Резистентный асцит при циррозе печени: сравнительный анализ патогенетически обоснованных подходов к лечению
Автор: Шабунин А.В., Павлов Ч.С., Левина О.Н., Дроздов П.А., Осипова С.В., Араблинский А.В., Матвеев Д.В., Лукин А.Ю., Лиджиева Э.А.
Журнал: Московский хирургический журнал @mossj
Рубрика: Абдоминальная хирургия
Статья в выпуске: 4 (94), 2025 года.
Бесплатный доступ
Введение. Асцит значительно влияет на прогноз цирроза печени (ЦП). Существующие методы лечения эффективны, но имеют побочные эффекты. Сравнение подходов поможет выбрать персонализированную тактику и улучшить исходы у пациентов с ЦП. Цель исследования. Сравнить эффективность и безопасность патогенетически обоснованных методов лечения резистентного асцита у больных циррозом печени. Материалы и методы. В исследование, на базе ММНКЦ им. С.П. Боткина ДЗМ включены 92 человека с ЦП и асцитом, разделенных на 3 протокола: в группе 1 (n=35) проводилась диуретическая терапия, в группе 2 (n=31) – трансъюгулярное портосистемное шунтирование (TIPS), в группе 3 (n=26) – комплексная терапия Терлипрессином в сочетании с Фуросемидом. Группы сопоставимы по полу и возрасту, средний уровень MELD в группе 1 составил 13±2,6 балла, в группе 2 – 14,13±3,51, в группе 3 – 15,15±3,4. Контроль проводился в день обращения, через 14 дней, 30 дней, затем каждые 2 месяца в течение года. Критериями компенсации являлись отсутствие нарастания асцита и признаков декомпенсациии цирроза печени. Летальность оценивали в течение года. Результаты. В группе 1 длительность компенсации составила 31,2±10,31 недель, летальность – 26 % (9 человек). В группе 2 длительность компенсации составила 41,5¬±13,17 недель и была достоверно выше, чем у больных группы 1 (р<0,05). Течение энцефалопатии в течение 1 месяца усугубилось у 17 человек (54,8 %). Летальность в 2 группе составила 10 % (3 случая). В группе 3 длительность компенсации составила 37,4 ±11,4 недели, что было достоверно выше, чем среди пациентов группы 1 (р=0,012), летальность в группе 3 составила 11 % (3 случая). Выводы. Результаты исследования демонстрируют, что применение патогенетически обоснованных методов коррекции асцитического синдрома позволяет достоверно продлить период компенсации у больных с циррозом печени.
Цирроз печени, резистентный асцит, гепаторенальный синдром, терлипрессин, трансъюгулярное портосистемное шунтирование
Короткий адрес: https://sciup.org/142246446
IDR: 142246446 | УДК: 616.36-008.5-036.1-08 | DOI: 10.17238/2072-3180-2025-4-70-78
Текст научной статьи Резистентный асцит при циррозе печени: сравнительный анализ патогенетически обоснованных подходов к лечению
Асцит – патологическое накопление жидкости в брюшной полости, которое встречается болеечему50 % больных с 10-летней историей заболевания печени, значительно ухудшает прогноз течения цирроза печени (ЦП) и продолжительность жизни [1]. В течение первого года от момента появления асцита выживаемость пациентов с ЦП составляет от 45 до 82 %, в течение пяти лет – менее 50 % [2], что делает данное осложнение абсолютным показанием к включению в лист ожидания трансплантации печени.
Согласно действующим клинических рекомендациям по лечению цирроза печени, опубликованным на сайте Министерства Здравоохранения РФ, асцит легкой степени не требует лечения, при умеренном увеличении живота показано ограничение потребления натрия и проведение диуретической терапии, при развитии выраженного асцита необходимо проведение объемного парацентеза с последующим ограничением потребления натрия и продолжение диуретической терапии [3]. Часть исследований приходят к заключению, что у пациентов с рецидивирующим асцитом сочетание антагониста альдостерона и петлевых диуретиков является предпочтительной схемой лечения, поскольку комбинированная терапия увеличивает натрийуретический эффект [2]. У пациентов с асцитом 3 степени или рефрактерным асцитом методом выбора является объемный парацентез, на протяжении многих десятилетий являющийся методом выбора, прежде всего из-за его доступности [4]. При эвакуации >5 л жидкости, необходимо восполнение уровня альбумина в связи с его потерями с асцитической жидкостью и восполнение объема циркулирующей крови для снижения риска развития постпарацентезной дисфункции [2]. Однако, несмотря на очевидные положительные эффекты парацентеза, он не влияет на патогенетические факторы развития асцита, и приводит к рецидиву патологических симптомов в 93 % случаев, а медиана выживаемости этих пациентов в 50 % не достигает 6 месяцев [5].
В патогенезе развития асцита основную роль играют портальная гипертензия, висцеральная и периферическая артериальная вазодилатация и нейрогуморальная активация [6, 7]. Пусковым механизмом цирротического асцита можно считать нарушения экскреции натрия почками, что приводит к положительному балансу натрия, задержке воды и увеличению объема внеклеточной жидкости. Снижение экскреции натрия, обусловленное расширением артериальных сосудов, в свою очередь запускает нейрогуморальные реакции, результатом которых становится сужение почечных сосудов и дальнейшей задержке натрия и, следовательно, развитию асцита и отеков [8].
Асцит развивается только при наличии портальной гипертензии, если постсинусоидальный градиент давления выше 12 мм рт. ст. [9], что является причиной повышения гидростатического давления внутри печеночных синусои-дов, приводящего к транссудации жидкости в брюшную полость [10]. Таким образом, объем вырабатываемой асцитической жидкости определяется величиной гидростатического давления, а онкотическая динамика (концентрация альбумина в плазме) играет в скорости накопления и тяжести асцита лишь вторичную роль [11]. Данная концепция является патогенетическим обоснованием для применения шунтирующих вмешательств, направленных на коррекцию портальной гипертензии для лечения резистентного асцита.
Большинство последних исследований [12, 13] демонстрируют, что трансъюгулярное портосистемное внутрипеченочное шунтирование (TIPS), представляющее собой минимально инвазивное рентгенологическое вмешательство, направленное на создание искусственного анастомоза между портальной и печеночной венами через яремный доступ, сопровождается более низкой смертностью, по сравнению с такими методами как установка постоянного брюшно-венозного шунта, постоянного перитонеального катетера и проведения повторных объемных лапароцентезов. Ограничением метода является риск нарастания печеночной энцефалопатии, обусловленной портосистемным шунтированием крови, что приводит к снижению печеночного клиренса токсинов, в частности аммиака, и их накоплению в системном кровотоке с последующим нейротоксическим воздействием [14].
Ряд авторов сообщают, что применение TIPS часто сопряжено с нарастанием уровня билирубина (>3 мг/дл) [15] и повышением баллов MELD [16] из-за снижения перфузии печени, что ухудшает течение цирроза печени. Согласно оценке различных метаанализов, смертность пациентов после TIPS через 12 месяцев составляет в среднем 20–44 % со значительной гетерогенностью среди исследований (I2=82,1, τ2 = 0,37, p<0,001) [16].
Вторым патогенетически обоснованным методом лечения резистентного асцита может считаться применение Терлипрессина, синтетического аналога вазопрессина, с избирательным действием на V1-рецепторы гладкомышечных клеток сосудов. Его использование при асците, особенно при развитии гепаторенального синдрома (ГРС), основано на таких эффектах, как вазоконстрикция сосудов брюшной полости (особенно брыжеечных артерий), уменьшение притока крови к портальной системе, снижение давления в воротной вене и уменьшение фильтрации жидкости в брюшную полость [17, 18]. При гепаторенальном синдроме Терлипрес-син корригирует системную вазодилатацию, повышая общее периферическое сопротивление, улучшает перфузию почек, увеличивая скорость клубочковой фильтрации [19], снижает активацию ренин-ангиотензин-альдостероновой системы (РААС), уменьшая задержку натрия и воды [20]. Кроме того, применение Терлипессина приводит к уменьшению активации симпатической нервной системы, снижению выброса вазодилататоров и стабилизации кровообращения [2]. Вместе с очевидными позитивными эффектами, имеется ряд серьезных ограничений, таких как спазм коронарных, мезентериальных или периферических сосудов, риск усугубления гипонатриемии, требующих строгого мониторинга.
Таким образом, учитывая неоднозначность литературных данных, отсутствие сравнительных исследований применения при резистентном асците методов, направленных на коррекцию портальной гипертензии и системной вазодилатации, на базе ГБУЗ ММНКЦ им. С.П. Боткина ДЗМ, мы провели собственное исследование, по оценке эффективности и безопасности различных подходов коррекции асцитического синдрома.
Цель исследования
Сравнить эффективность и безопасность патогенетически обоснованных методов лечения резистентного асцита у больных циррозом печени.
Материалы и методы
В проспективное исследование, проведенное на базе ММНКЦ им. С.П. Боткина ДЗМ, после оформления информированного согласия были включены 92 человека с циррозом печени и асцитическим синдромом госпитализированные в стационар с 2020 г. по 2023 г. Для сравнения различных подходов к лечению асцитического синдрома больные с циррозом печени были разделены на три клинических протокола: в группе 1 – проводилась диуретическая терапия возрастающими дозами петлевых диуретиков (Фуросемид до 200 мг в сутки) и Спиронолактона (до 300мг/сут), в группа 2 – трансъюгулярное портосистемное шунтирование (TIPS), в группе 3 – применялась комплексная терапия Терлипрессином 1000 мкг/сут внутривенно в сочетании с возрастающими дозами петлевых диуретиков (Фуросемид до 200 мг в сутки). Контроль состояния и лабораторных показателей проводился в день обращения, через 14 дней, 30 дней, затем каждые 2 месяца в течение года. Компенсацией считали отсуствие нарастания асцитического синдрома и потребности в повторной госпитализации в связи с декомпенсацией цирроза печени. Летальность оценивали в течение года.
Всем пациентам проводилась антибактериальная терапия, при наличии положительной культуры при исследовании асцитической жидкости – согласно спектру чувствительности, при отсутствии роста и наличии признаков гепаторенального синдрома – препаратом первой линии были цефалоспорины 3 поколения с β-лактамазной активностью. Во всех группах наблюдения при наличии показаний выполнялся лечебный пароцентез с постепенной (не более 6 литров в сутки) эвакуацией жидкости и коррекция дефицита сывороточного альбумина. Показаниями к дренированию являлись: напряженный асцит или резистентный асцит с олигоанурическим синдромом и повышением содержания сывороточного креатинина > 140 мкмоль/л; гипонатриемия <130 ммоль/л; гипокалиемией <3,0 ммоль/л; гиперкалиемией >5,5 ммоль/л.
Характеристика пациентов с асцитическим синдромом представлена в таблице 1.
Таблица 1 Характеристика пациентов с напряженным и/или резистентным асцитом (n=92)
Table 1
Characteristics of patients with refractory and/or tense ascites (n=92)
|
Характеристики групп/ Characteristics of groups |
Группа 1/ Group 1 |
Группа 2/ Group 2 |
Группа 3/ Group 3 |
|
Число пациентов/ Number of patients |
35 |
31 |
26 |
|
Пол, м/ж/ Gender, m/w |
25/10 |
21/10 |
12/14 |
|
Средний возраст, лет/ Average age, years |
49±7,53 |
49,52±7,46 |
49,5±7,46 |
|
Чайлд-Пью-Таркотт, баллы/ Child-Pugh-Tarcott, points |
11±3,2 |
9,39±0,91 |
9,62±0,75 |
|
MELD-Na, баллы/ MELD-Na, points |
13±2,6 |
14,13±3,51 |
15,15±3,4 |
|
Число пациентов с напряженным асцитом, чел (%) /Number of patients with severe ascites, people (%) |
24 (68) |
11(35) |
15 (58) |
|
Число пациентов с резистентным асцитом, чел (%) /Number of patients with resistant ascites, people (%) |
6 (17) |
20 (64) |
11 (42) |
|
Гепаторенальный синдром, чел (%)/Hepatorenal syndrome, people (%) |
6 (17) |
10 (32) |
24 (92) |
|
Спонтанный бактериальный перитонит, чел (%) / Spontaneous bacterial peritonitis, people (%) |
10 (28) |
24 (77) |
17 (65) |
|
Послеоперационные осложнения, количество больных (%) /Postoperative complications, number of patients (%) |
0 |
1 (3) |
0 |
|
Длительность периода компенсации, недели/ Duration of the compensation period, weeks |
31,2±10,31 |
41,5±13,17 |
37,4±11,4 |
|
Летальность в группе в течение 1 года / Mortality in the group within 1 year |
9 (25,7) |
3 (9,67 %) |
3 (11,5 %) |
Лабораторные исследования. Выполнялся общий анализ крови, общий анализ мочи, биохимический анализ крови, коагулограмма, группа крови и резус-фактор, анализ крови на онкомаркеры, анализ на RW, HBsAg, antiHCV, ВИЧ. Были установлены жесткие точки контроля лабораторных показателей у всех наблюдаемых проспективного исследования – в день обращения, через 14 дней, через 30, 60 и 90 дней, 1 год. При наличии клинических показаний дополнительный лабораторный контроль проводился с необходимой частотой. Всем пациентам выполнялось исследование уровня альфа-фетопротеина (АФП) для исключения гепатоцеллюлярной карциномы. Исследование крови на RW, HbsAg, antiHCV, ВИЧ было необходимо в рамках первичного обращения.
Инструментальные методы исследования включали рентгенографию органов грудной клетки, ультразвуковое исследование органов брюшной полости и почек, эзофагогастродуоденоскопию, ЭКГ. Обязательным диагностическим методом являлась компьютерная томография (КТ) органов брюшной полости и малого таза с внутривенным болюсным контрастированием. Исследование проводилось на аппарате Aquilion и GE Revolution 2 с толщиной слоя 1,0 мм нативно и после внутривенного болюсного введения 100 мл Омнипак-350.
Статистический анализ выполнен с применением IBM SPSS Statistics 26. Для сравнения групп количественные данные проверялись на нормальность распределения и в зависимости от результата использовались тесты Манна-Уитни или критерий Стьюдента; для сравнения малых групп использовались методы непараметрической статистики (метод Пирсона). Анализ выживаемости проведен с применением метода Каплана-Мейера с использованием тестов Бреслоу и Тарон-Уэр.
Результаты исследования. В группу пациентов, получавших диуретическую терапию включены 35 человек, 25 мужчин и 10 женщин, средний возраст составил 49±7,53 лет, средний уровень MELD-Na – 13±2,6 баллов, средний уровень по шкале Чайлд-Пью-Таркотт – 9,31±1,1. В группу были включены 5 пациентов (14 %) с умеренным, 24 человека (69 %) с напряженным, и 6 больных (17 %) с резистентным асцитом. У 10 пациентов (28 %) был диагностирован спонтанный бактериальный перитонит, в 7 случаях – микробиологически подтвержденный, с 3 случаях – диагноз был установлен на основании признаков бактериальной инфекции (лейкоцитоз, повышение уровня С-реактивного белка), при условии исключения иных очагов инфекции. У 6 пациентов (17,1 %) диагностирован гепаторенальный синдром, в последующем разрешившийся на фоне консервативной терапии и не потребовавший экстракорпоральных методов лечения. Дренирование брюшной полости проводилось в 16 случаях (45,7 %), клинический эффект от лечения достигнут на стационарном этапе во всех случаях, однако у 5 пациентов не отмечено полного регресса асцита, в последующем проводилось наблюдение в амбулаторном порядке с коррекцией терапии с учетом наличия электролитных нарушений, уровня альбумина, признаков инфицирования асцита. Минимально эффективная диуретическая терапия в данной группе включала Спиронолактон 150 мг однократно в сутки, максимальная – Таб. Спиронолактон 300мг/сут в сочетании с Фуросемидом от 40 до 200 мг в сутки. Рецидив асцита отмечался практически в половине случаев, у пациентов, которые ранее переносили дренирование брюшной полости. В 2 случаях (5,7 %) декомпенсация развивалась в течение 3х месяцев, у 18 больных (51,4 %) – в течение полугода, что значительно снижало качество жизни пациентов и требовало повторных госпитализаций. Длительность компенсации в группе 1 составила 31,2±10,31 недель, летальность составила 25,7 % (9 человек).
В группу 2 были включены 31 человек, преобладали мужчины (67,7 %), средний возраст составил 49,52±7,46 лет. Средний уровень MELD-Na был на уровне 14,13±3,51 баллов, средний уровень Чайлд-Пью-Таркотт – 9,39±0,91. В группу были включены 11 человека (35 %) с напряженным, и 20 больных (64 %) с резистентным асцитом. У 24 пациентов (77 %) был диагностирован спонтанный бактериальный перитонит, в 17 случаях – с подтвержденной гемокультурой. Гепаторенальный синдром верифицирован в 32 % случаев (10 больных).
Эффективность лечения в виде полного регресса асцита или уменьшения до степени минимального, достигнута в 90 % случаев, что позволило отказаться от диуретической терапии в течение месяца у 71 % пациентов. Отсуствие клинического эффекта отмечалось во всех случаях несостоятельности установленного шунта, зарегистрированным по данным УЗИ органов брюшной полости.
Длительность компенсации у пациентов, перенесших TIPS по поводу резистентного или рецидивирующего асцита составила 41,5±13,17 недель и была достоверно выше, чем среди пациентов, получавших консервативную терапию (р<0,05) (рис. 1).
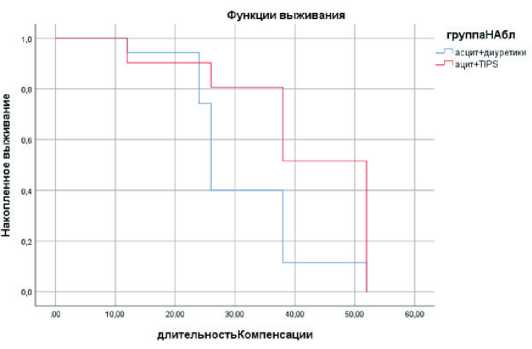
Рис. 1. Сравнительная длительность периода компенсации у больных с асцитом на фоне консервативной терапии и после проведения TIPS
Эффективность шунтирующих вмешательств для коррекция резистентного асцита не подлежит сомнению, однако в связи с высоким риском ассоциированных осложнений данная методика в настоящее время рассматривается в качестве промежуточного варианта в листе ожидания трансплантации печени. При анализе послеоперационного периода после проведения TIPS в 1 случае развилось послеоперационное осложнение – миграция стента под капсулу печени с развитием внутрибрюшного кровотечения, потребовавшее проведения лапаротомии, санации и гемостаза.
Не выявлено значимого влияния трансъюгулярного портосистемного шунтирования на проявления печеночной недостаточности, динамика уровня MELD-Na у пациентов после TIPS была сопоставима с аналогичными показателями у пациентов на фоне диуретической терапии (рис. 2).
Динамика уровня MELD-Na
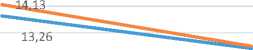
10,8
10,97
MELD-Na1
MELD-Na2
^mwb Асцит, TIPS ^^^^^^В Асцит, диуретическая терапия
Рис. 2. Сравнительная динамика уровня MELD-Na у больных с асцитом на фоне консервативной терапии, после проведения TIPS
Fig. 2. Comparative dynamics of MELD-Na scores in ascites patients: conservative therapy versus post-TIPS outcomes
Наиболее частым осложнением TIPS является печеночная энцефалопатия, частота развития которой, согласно литературным данным, достигает 50 %. Печеночная энцефалопатия у пациентов с асцитом перед проведением TIPS отмечалась у всех пациентов, в 14 случаях – ПЭ 1 степени (минимальных когнитивных нарушений), в 15 случаях – ПЭ 2 степени, у 2-х пациентов – ПЭ 3 степени. После вмешательства тяжесть энцефалопатии в течение 1 месяца усугубилось у 17 человек (55 %): у двух пациентов с ПЭ 2 степени развилась тяжелая ПЭ 4 степени, у 10 пациентов с ПЭ 1 степени ПЭ прогрессировала до 3 степени, у трех – до 2 степени, у 1 пациента с ПЭ 2 степени – до 3 степени. В итоге группа пациентов с ПЭ 3 степени, требующей стационарного лечения, возросла с 6,5 % до 35 % (рис. 3).
Fig. 1. Event-free survival in ascites patients managed conservatively or with TIPS
Динамика печеночной энцефалопатии после TIPS
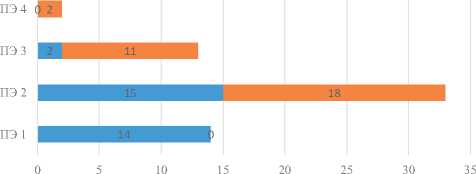
■ Перед TIPS ■ После TIPS
Рис. 3. Динамика печеночной энцефалопатии после проведения TIPS Fig. 3. Hepatic encephalopathy progression following TIPS placement
Диагностика сердечной недостаточности с сохранённой фрСогласно нашим наблюдениям, тяжесть печеночной энцефалопатии не была связана с исходным состоянием пациента, наличие энцефалопатии 3 степени не является противопоказанием к проведению TIPS, при условии проведения адекватной терапии, включающей применение Орнитина, Лактулозы и продленных курсов санации кишечника с использованием Метронидазола или Рифаксимина или Норфлоксацина.
Летальность в 2 группе составила 10 % (3 пациента), и в одном случае была ассоциирована с тяжелой печеночной энцефалопатией, а в двух – с декомпенсацией цирроза печени и отсутствием эффективности TIPS.
При сравнительном анализе выживаемости не выявлено достоверных различий между группой пациентов, получавших консервативную терапию и TIPS.
Несмотря на противоречивые литературные данные и возможные риски осложнений, применение TIPS продемонстрировало значительный положительный эффект, достоверное увеличение длительности периода компенсации в сравнении с группой консервативной терапии.
Показания к применению терлипрессина были выявлены у 26 человек, 12 мужчин и 14 женщин в возрасте от 34 до 64 лет, средний возраст составил 49,5±7,46 лет. Средний уровень MELD-Na составил 15,15±3,4 балла, средний уровень Чайлд-Пью-Таркотт – 9,62±0,75. В группу были включены 15 человек (58 %) с напряженным, и 11 (42 %) с резистентным асцитом. У 17 пациентов (65 %) был диагностирован спонтанный бактериальный перитонит, в 11 случаях – бактериологически подтвержденный. Гепаторенальный синдром верифицирован в 92 % случаев (24 больных).
У трех пациентов, включенных в группу наблюдения, был диагностирован тромбоз воротной вены, явившийся противопоказанием для проведения портосистемного шунтирования. На фоне первого введения терлипрессина в дозе 1000 мкг/сут внутривенно со скоростью 250 мкг/час у этих пациентов отмечался выраженный болевой абдоминальный синдром, не купировавшийся при снижении скорости введе- ния, и полностью регрессировавший при отмене препарата, что явилось показанием к прекращению лечения.
Дренирование брюшной полости потребовалось 15 пациентам (58 %). Среди оставшихся 23 пациентов болевой синдром отмечался в двух случаях и регрессировал на фоне снижения скорости введения препарата до 125 мкг/час. В 19 случаях (73 %) отмечалось увеличение темпа диуреза в течение первых двух суток терапии, лечение было продолжено до 5 суток, регресс асцита достигнут в течение 14 суток на фоне продолжающейся диуретической терапии. Таким образом, отсуствие эффекта от проведения терапии терлипрессином в сочетании с диуретиками отмечено в трех случаях (11 %). Регресс гепаторенального синдрома достигнут в 18 случаях (69 %), в 16 из них – с полной нормализацией креатинина (рис. 4).
Эффективность введения терлипрессина
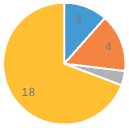
некупирующийся болевой синдром, отвод от лечения отсуствие эффекта от терапии регресс асцита регресс гепаторенального синдрома и асцита
Рис. 4. Эффективность лечения пациентов с напряженным или резистентным асцитом при использовании терлипрессина в комбинации с петлевыми диуретиками
Fig. 4. Therapeutic outcomes of terlipressin with diuretic therapy in management of refractory ascites
Длительность компенсации в группе 3, составила в среднем 37,4 ±11,4 недели, что было достоверно выше, чем среди пациентов на фоне консервативной терапии (р=0,012), однако уступало эффективности TIPS (рис. 5).
Длительность компенсации, нед
41,5
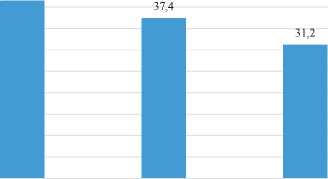
TIPS Терлипрессин + Диуретическая терапия диуретическая терапия
Рис. 5. Сравнительная длительность периода компенсации у больных с асцитом на фоне консервативной терапии, применения терлипрессина, после проведения TIPS
Fig. 5. Comparative duration of compensated phase in ascites patients: conservative therapy vs. terlipressin treatment vs. post-TIPS outcomes
Летальность, среди пациентов, получавших терапию терлипрессином, составила 11 % (3 случая), во всех случаях причиной ее стало нарастание печеночной недостаточности.
Таким образом, при наличии корректного отбора, адекватной терапии, коррекции послеоперационной энцефалопатии все исследуемые подходы к лечению были эффективны, позволили значительно снизить летальность и достоверно увеличить длительность компенсации у пациентов с циррозом печени и асцитическим синдромом.
Обсуждение
Асцитический синдром является одним из самых распространенных и сложных для коррекции проявлений цирроза печени. Подбор минимально эффективной диуретической терапии требует мастерства клинициста, высокая частота повторных госпитализаций и потребность в заместительной терапии альбумином создают существенную нагрузку на систему здравоохранения. Оптимизация тактики лечения позволит не только улучшить прогноз и продолжительность жизни больных, но и сократить экономические затраты за счет снижения числа осложнений и повторных госпитализаций.
На основе международных и отечественных рекоменда ций [2, 3, 4, 17] мы выбрали три направления терапии, с учетом различных аспектов патофизиологического процесса, приводящего к формированию асцитического синдрома. Часто препятствием для проведения инвазивных вмешательств, таких как портосистемное шунтирование, являются тяжесть состояния больных и опасения развития осложнений, однако наше исследование продемонстрировало, что при адекватной подготовке и послеоперационной коррекции лечения, применение портосистемного внутрипеченочного шунтирования позволило в 90 % случаев достичь полного регресса асцита или уменьшения его до минимального и отказаться от диуретической терапии в течение месяца у 71 % пациентов. Длительность компенсации у больных после TIPS составила 41,5±13,17 и была достоверно выше, чем на фоне консервативной терапии. Нарастание печеночной энцефалопатии является ожидаемым осложнением и требует мониторинга, своевременной коррекции терапии. В нашей работе, в большинстве случаев (14 больных – 82 %) удалось полностью купировать признаки энцефалопатии. Особого интереса заслуживает проведение терапии синтетическим аналогом вазопрессина – терлипрессином, который обладает такими позитивными эффектами как повышение системного артериального давления, улучшает гемодинамику, функцию почек, предупреждает парацентез-индуциро-ванную дисфункцию кровообращения при циррозе печени с асцитом с гепаторенальным синдромом и без него [17, 19]. Мы применяли Терлипрессин в виде продленной инфузии в течение 4–6 часов и не наблюдали таких осложнений как спазм коронарных, мезентериальных или периферических сосудов. При наличии тромбоза воротной вены отмечался выраженный болевой синдром, потребовавший прекращения терапии, в 73 % был получен положительный результат лечения, длительность компенсации после введения терли-прессина составила 37,4 ±11,4 и была достоверно выше, чем среди пациентов на фоне консервативной терапии (р=0,012).
Заключение
Результаты проведенного исследования продемонстрировало, что применение TIPS и терлипрессина при резистентном асците оправдано в случаях неэффективности диуретической терапии и потребности в повторных лапароцентезах, поскольку эти методы позволяют значительно снизить портальную гипертензию и улучшить контроль над накоплением жидкости. При адекватном отборе пациентов и своевременной коррекции лечения, применение TIPS и терлипрессина позволяет достоверно продлить период клинической компенсации, снизить объем диуретической терапии и улучшить качество жизни пациентов с циррозом печени.


