Результаты анализа прогнозирования печеночной недостаточности при выполнении обширных резекций печени
Автор: Краснов А.О., Краснов О.А., Павленко В.В., Краснов К.А.
Журнал: Хирургическая практика @spractice
Рубрика: Оригинальные исследования
Статья в выпуске: 2, 2015 года.
Бесплатный доступ
В статье представлены результаты анализа обследования и лечения 70 пациентов, после выполнения обширных резекций печени. Установлено, что показатель скорости плазменной элиминации индоцианина зеленого (ИЦЗ) имеет достоверную высокую чувствительность (100%) и специфичность (88%) в определении функционального потенциала печени. Данный метод рекомендован для включения в комплекс обследования в ходе подготовки пациента к обширной резекции печени.
Обширные резекции, послеоперационная печеночная недостаточность, резектабельность, функциональный резерв печени, индоцианиновый тест
Короткий адрес: https://sciup.org/142211623
IDR: 142211623 | УДК: 616-006.04
Текст научной статьи Результаты анализа прогнозирования печеночной недостаточности при выполнении обширных резекций печени
Заболеваемость первичным и метастатическим раком печени, паразитарными заболеваниями значительно увеличилась за последние годы [1]. У больных, перенесших резекцию печени, наиболее значима проблема прогноза, профилактики и лечения послеоперационной печеночной недостаточности. Низкий функциональный резерв оставшейся ткани печени – основной фактор развития печеночной недостаточности.
Развитие медицинских технологий, совершенствование техники выполнения оперативных вмешательств на печени, достижения современной анестезиологии и реаниматологии способствуют значительному снижению летальности после резекций печени [2]. В настоящее время она составляет 3–8%, при расширенных резекциях печени 15–18%. Остается высокой и частота послеоперационных осложнений, которая составляет 30–56% [3].
Важным сдерживающим фактором для выполнения обширных резекций печени является, нередко, небольшой объем паренхимы остающейся после резекции. За последнее время появилось много работ посвященных изучению, проблем реабилитации печеночных функций у пациентов, перенесших резекцию печени [2, 4]. Благодаря этим исследованиям было установлено, что функциональное состояние культи печени после резекции, зависит от ряда факторов, основными из ко- торых являются исходное состояние паренхимы печени перед операцией и степень ишемического повреждения печени как следствия выключения ее из кровообращения при выполнении операции или других факторов, обусловливающих гипоксию (кровопотеря, артериальная гипотония и т.д.). Именно эти факторы способствуют развитию в послеоперационном периоде самого грозного осложнения - печеночной недостаточности. Несмотря на бурный прогресс в области хирургии печени, проблема реабилитации культи печени после обширных резекций остается нерешенной [5, 6]. Угроза развития печеночной недостаточности после обширной резекции стимулировала разработку различных методов ее прогнозирования, особенно при компрометированной паренхиме [7, 8].
В клинической практике используется значительное количество показателей, позволяющих оценить функцию печени, которые можно подразделить на поисковые, диагностические и количественные тесты. Поисковые тесты позволяют выявить заболевание печени, диагностические тесты - этиологию заболевания, а количественные тесты позволяют определять величину функционального резерва [9]. Установлено, что рутинные исследования функции печени не всегда позволяют оценить регенеративную способность органа после операции [10]. Определение степени печеночной недостаточности, как по клиническим признакам, так и по отдельным лабораторным тестам до сих пор представляет крайне трудную и не решенную проблему [11]
Исследование основных биохимических показателей крови, таких как билирубин, щелочная фосфатаза, гамма-глутамилтранспептидаза, аспартатаминотрансфераза, аланинаминотрансфераза, лактатдегидрогеназа, альбумин, преаль-бумин, протеин С, фибриноген, мочевина, протромбиновый индекс, желчные кислоты, глюкоза, галактоза и в настоящее время считается актуальным и необходимым звеном в исследовании функционального состояния печени [4].
Динамические клиренс-тесты обеспечивают прямое измерение действительного, реального функционального состояния печени и позволяют оценить степень гепатоцеллюлярной недостаточности на момент исследования и более точно отразить прогноз заболевания [10-18].
Материалы и методы
Работа основана на анализе результатов обследования и лечения 70 больных (35 мужчин и 35 женщин) с объемными образованиями печени различной этиологии, находившихся на лечении в хирургическом отделении №2 МУЗ «Городская клиническая больница №3 им. М.А. Подгорбунского» с января 2005 года по июль 2012 года. Средний возраст больных – 50,4 + 2,8 лет.
В зависимости от примененного алгоритма обследования по критериям операбельности все исследуемые больные были распределены на две группы: контрольную и основную группы.
В контрольную группу вошли 37 больных с объемными образованиями печени различной этиологии. Мужчин было 20 (54,05%), женщин – 17 (45,95%). Возраст больных был от 26 лет до 69 лет, средний возраст составил – 48,32лет±3,1 лет.
В основной группе было 33 больных: 15 мужчин (45,45%) , 18 женщин (54,55%). Возраст больных был от 23 лет до 71 года, средний возраст составил - 52, 73±3,4 года.
Пациентам с объемными образованиями печени, которые вошли в программу исследования, были выполнены обширные резекции печени после комплексного обследования. К обширным резекциям печени мы относили гемигепатэктомии и расширенные гемигепатэктомии.
Оценка резектабельности объемных образований печени в каждом конкретном случае осуществлялась как до операции, так и интраоперационно и подразумевала наличие остающегося в виде культи печени участка непораженной опухолью паренхимы в объеме не менее двух сегментов. В исследуемых группах проводилась оценка по таким критериям, как: длительность оперативного вмешательства; продолжительность госпитализации; количество и структура послеоперационных осложнений; послеоперационная летальность.
Результаты исследования
При анализе интраоперационной кровопотери установлено, что у 53 (75,7%) больных она была менее 20% ОЦК, от 20% до 30% ОЦК – у 15 (21,4%) больных и в 2(2,9%) наблюдениях -превышала 30% ОЦК.
При изучении результатов средней длительности оперативных вмешательств в контрольной и основной группах при обширных резекциях печени не установлено достоверных различий по этому показателю. Она составила в контрольной группе – 398,1 мин (300 – 530), в основной группе – 348,3 мин (210 – 480) (р>0,05).
Различные послеоперационные осложнения развились в 32 (45,7%) случаях. У части больных наблюдалась пострезекционная печеночная недостаточность – 18 (25,7%) пациентов. Реже встречались: гнойно-септические осложнения – 9 (12,9%), прочие осложнения отмечены у 5 (7,1%) больных. В 7 (8,9%) случаях прогрессирующая некоррегируемая печеночная недостаточность послужила причиной летального исхода. Длительность лечения в контрольной и основной группах в среднем составила 18,1+1,8 и 21,3+2,5 койко-день, соответственно (р>0,05).
С целью определения функционального резерва печени 33 (47,1%) больным с объемными образованиями в предоперационном периоде выполнялся тест элиминации красителя индоцианина зеленого. Всем больным основной группы выполнены выполнены обширные резекции печени. Нормальным показателем скорости плазменной элиминации диагностического красителя (СПЭ), при котором функция печени считается не нарушенной, является 20%/мин и более, при этом остаточная концентрация красителя на 15 минуте исследования (ОК15) не должна превышать 10%. У обследованных пациентов СПЭ колебалась от 5,9%/мин до 30,1%/мин и в среднем составила – 19,9 %/мин, а ОК15 находилась в диапазоне от 3,5% до 35,1%, в среднем – 14,7%.
Для оценки диагностической ценности метода выполнен анализ связи параметров динамического клиренс-теста с традиционными биохимическими показателями и другими критериями.
С помощью регрессионного анализа выявлялись факторы, влияющие на исход госпитализации (Y). На первоначальном этапе исследования в качестве, факторов были выбраны (показатели, информация о которых известна до проведения оперативного вмешательства): пол и возраст пациента, показатели УЗИ, КТ, билирубина до операции, диагноз. Переменные пол и диагноз была включены в анализ в виде фиктивный переменных. В качестве метода построения прогнозной модели был выбран регрессионный анализ в виде бинарной логистической регрессии. Бинарная логистическая регрессия позволяет прогнозировать вероятность летального исхода (Y=0) по измеренным у него значениям факторов. Чем ближе значение вероятности к 1, тем более вероятен летальный исход госпитализации. Чем ближе к нулю это значение, тем более вероятен благоприятный исход оперативного вмешательства. За порог отсечения принята величина 0,5.
На первоначальном этапе построения модели использовался стандартный метод, оставляющий при построении модели всю заданную группу факторов.
Были получены следующие результаты. Статистика R – Nadelkerkes, определяющая ту долю дисперсии результативного признака, которую можно объяснить выделенной группой факторов, равна 0,305. Поэтому можно говорить о том, что модель не является адекватной. Основные результаты анализа представлены в таблице 1. Кодировка фиктивных переменных представлена в таблице 2.
Анализ результатов, представленных в таблице 1, показал, что все факторы, включенные в модель, незначимо влияют на исход госпитализации. Другим критерием качества модели является классификационная матрица (таблица 3).
Анализ классификационной матрицы показал, что процент правильной классификации для группы пациентов с летальным исходом является низким (20%).
На следующем этапе построения модели для выбора наиболее значимых факторов, влияющих на госпитализацию, применялся метод пошагового включения. По результатам работы этого метода все факторы были отброшены, как неинформативные для прогноза исхода госпитализации. Этот факт свидетельствует о том, что данной группы показателя недостаточно, чтобы перед проводимой операцией прогнозировать исход госпитализации.
На втором этапе исследования к данной группе факторов были добавлены показатели, характеризующие кровопотерю при операции и длительность операции, а также билирубин на
1 и 5 сутки. В таблице 4 приведены основные результаты регрессионного анализа, где в качестве метода использовался метод пошагового включения.
В качестве значимых факторов, влияющих на исход госпитализации, регрессионный анализ оставил показатели, характеризующие длительность операции и билирубин на 5 сутки. Оценка на значимость отличия от нуля коэффициентов регрессии В осуществляется с помощью статистики Вальда. Анализ данных, представленных в таблице 3, показал, что вся выделенная группа факторов оказывает значимое влияние на исследуемый показатель. Наибольшее влияние оказывает билирубин на 5 сутки. Чем больше длительность операции и выше билирубин на 5 сутки, тем вероятнее летальный исход госпитализации.
К основным результатам логистической регрессии относится значение статистики Nagelkerke R Square (R квадрат Най-джелкерка), являющуюся приближенным значением квадрата коэффициента множественной корреляции, оценивающей долю влияния всех исследуемых факторов на дисперсию зависимой переменной. В нашем случае Nagelkerke R Square=0,811. Таким образом, от рассматриваемой группы фактором вероятность летального исхода госпитализации зависит на 81,1%.
Таблица 1
Основные результаты бинарной логистической регрессии (стандартный метод)
|
Показатель |
B |
Станд. ошибка |
Вальд |
ст.св. |
Знч. |
Exp(B) |
|
пол(1) |
–0,056 |
0,406 |
0,019 |
1 |
0,891 |
0,946 |
|
возраст |
0,074 |
0,042 |
3,099 |
1 |
0,078 |
1,077 |
|
диагноз |
3,899 |
4 |
0,420 |
|||
|
диагноз(1) |
3,218 |
2440,706 |
0,000 |
1 |
0,999 |
24,972 |
|
диагноз(2) |
3,655 |
2440,706 |
0,000 |
1 |
0,999 |
38,677 |
|
диагноз(3) |
3,513 |
2440,706 |
0,000 |
1 |
0,999 |
33,542 |
|
диагноз(4) |
–15,741 |
9762,824 |
0,000 |
1 |
0,999 |
0,000 |
|
узи_кт |
0,017 |
0,010 |
2,900 |
1 |
0,089 |
1,017 |
|
билирубин_до |
0,023 |
0,061 |
0,140 |
1 |
0,708 |
1,023 |
|
Константа |
–11,216 |
2440,708 |
0,000 |
1 |
0,996 |
0,000 |
Кодировка фиктивных переменных
Таблица 2
|
Частота |
Кодирование параметра |
|||||
|
(1) |
(2) |
(3) |
(4) |
|||
|
диагноз |
1 |
25 |
1,000 |
0,000 |
0,000 |
0,000 |
|
2 |
27 |
0,000 |
1,000 |
0,000 |
0,000 |
|
|
3 |
5 |
0,000 |
0,000 |
1,000 |
0,000 |
|
|
4 |
10 |
0,000 |
0,000 |
0,000 |
1,000 |
|
|
5 |
7 |
–1,000 |
–1,000 |
–1,000 |
–1,000 |
|
|
пол |
0 |
36 |
1,000 |
|||
|
1 |
38 |
–1,000 |
||||
Таблица 3
Классификационная матрица
|
Наблюдаемые |
Предсказанные |
|||
|
исход госпитализации |
Процент корректных классифицированных пациентов |
|||
|
0 |
1 |
|||
|
Исход госпитализации |
0 |
58 |
2 |
96,7 |
|
1 |
8 |
2 |
20 |
|
|
Общий процент |
85,7 |
|||
Таблица 4
Результаты бинарной логистической регрессии (метод пошагового включения)
|
Показатель |
B |
Станд. ошибка |
Вальд |
Знач. |
Exp(B) |
|
Длительность операции (Х1) |
0,017 |
0,007 |
5,429 |
0,02 |
1,018 |
|
Билирубин на 5 сутки (Х2) |
0,059 |
0,017 |
14,499 |
0,0001 |
1,061 |
|
Константа |
–11,736 |
3,605 |
10,597 |
0,001 |
0,000 |
Используя данные таблицы 4, для каждого пациента по измеренным у него значениям факторов может быть вычислена прогнозная вероятность летального исхода госпитализации по формуле:
P ( У = 1/ X 1, X 2 ) =
1 + e -( - 11,736 + 0,017 . X 1 + 0,059 . X 2) .
В качестве порога отсечения на первоначальном этапе выбирается величина 0,5. Если рассчитанная вероятность больше 0,5, то это означает, что по модели больной должен быть отнесен к группе пациентов с летальным исходом госпитализации.
В таблице 5 представлена классификационная матрица. Классификационная матрица оценивает адекватность модели: чем больше процент правильной классификации, тем более работоспособной является модель.
Анализ результатов, представленных в таблице 5 показал, что из пациентов, с благоприятным исходом госпитализации
Таблица 5
Классификационная матрица
Изменяя порог классификации, можно повысить качество классификации. Эта процедура осуществляется с помощью ROC-анализа. Введем два понятия: чувствительность и специфичность. Под чувствительностью Se (Sensitivity) для нашего случая будем понимать долю верно классифицированных больных с летальным исходом госпитализации. Для нашей модели чувствительность равна Se=0,571. Специфичность Sp (Specificity) – это доля верно классифицированных больных с благоприятным исходом госпитализации. Для нашей модели Sp=0,95.
ROC-кривая показывает зависимость количества верно классифицированных больных с летальным исходом госпитализации, от верно классифицированных больных без летального исхода (рис. 1).
Одним из критериев качества модели является оценка площади под кривой (AUC), которая в идеальном случае должна равняться 1. Таким образом, считается, чем больше показатель AUC, тем большей прогностической силой обладаем модель.
Площадь под кривой равна 0,947, что говорит о высоком качестве модели. Используя данные ROC-анализа, изменим порог классификации. В качестве критерия изменения выберем такой порог отсечения, при котором значения чувствительности и специфичности были бы наибольшими.
Меняя порог отсечения с 0,5 на 0,13 можно значительно улучшить качество классификации. При новом пороге отсечения чувствительность модели будет равна 0,9; а специфичность 0,883 (см. таблицы 6 и 7).
Используя модель (1) и новый порог классификации (0,13), для каждого пациента может быть определен прогноз исхода госпитализации.
На третьем этапе исследование проводилось на основной группе больных. В качестве факторов, влияющих на исход гос-
Кривые ROC
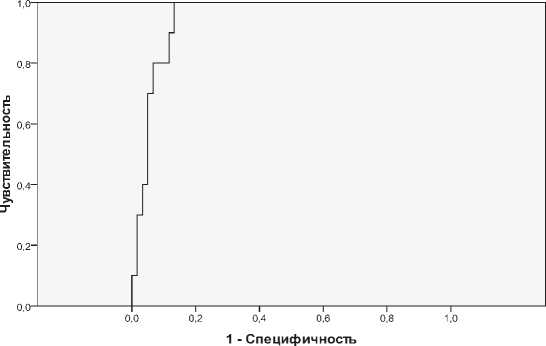
Рис. 1. График ROC-кривой
Таблица 6
Фрагмент таблицы «Чувствительность–специфичность»
|
Порог отсечения |
Чувствительность |
Специфичность |
|
0,0000000 |
1,000 |
0,000 |
|
0,1037101 |
1,000 |
0,833 |
|
0,1151360 |
1,000 |
0,850 |
|
0,1235646 |
1,000 |
0,867 |
|
0,1289743 |
0,900 |
0,867 |
|
0,1303962 |
0,900 |
0,883 |
|
0,1356365 |
0,800 |
0,883 |
|
0,1633170 |
0,800 |
0,900 |
|
0,1900011 |
0,800 |
0,917 |
|
0,2217675 |
0,800 |
0,933 |
|
0,2624278 |
0,700 |
0,933 |
|
0,3008277 |
0,700 |
0,950 |
|
0,3758912 |
0,600 |
0,950 |
|
0,5070483 |
0,500 |
0,950 |
|
0,5950678 |
0,400 |
0,950 |
|
0,6748767 |
0,400 |
0,967 |
|
0,7634670 |
0,300 |
0,967 |
Таблица 7
|
Наблюденные |
Предсказанные |
|||
|
исход госпитализации |
Процент корректных |
|||
|
0 |
1 |
|||
|
Исход |
0 |
53 |
7 |
88,3 |
|
госпитализации |
1 |
1 |
9 |
90 |
|
Общий процент |
88,6 |
|||
Классификационная матрица для модели с порогом отсечения равным 0,13
питализации, были выбраны: пол и возраст пациента, его диагноз, билирубин до операции, показатели УЗИ, КТ, показатели ОК15, СПЭ, показатели фиброскана.
Основные результаты регрессионного анализа представлены в таблице 8.
Регрессионный анализ в качестве фактора, с помощью которого можно прогнозировать исход госпитализации оставил показатель ОК15. Значение статистики Nagelkerke R Square равно 0,833. Таким образом, от данного фактора вероятность летального исхода госпитализации зависит на 83,3%.
Модель, по которой можно прогнозировать вероятность летального исхода госпитализации, имеет вид:
( ) 1 + e - ( - 20,499 + 1,471 . X 1) '
Классификационная матрица, соответствующая данной модели, представлена в таблице 9.
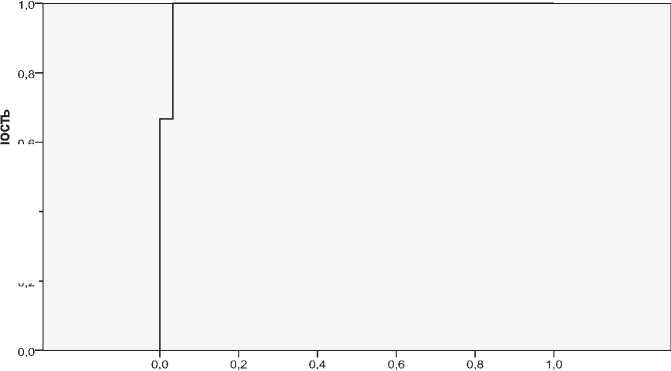
Для улучшения качества классификации был проведен ROC-анализ.
График ROC-кривой представлен на рис. 2.
Площадь под ROC-кривой равна 0,977, что говорит о том, что построенная модель обладает высокой прогностической способностью. В качестве нового порога отсечения предлагается выбрать порог, значение которого равно 0,26. В таблице 10 представлена классификационная матрица для нового порога отсечения.
Таким образом, используя построенную модель и новый порог отсечения, был верно, спрогнозирован исход госпитализации.
Выводы
Установлено, что показатель скорости плазменной элиминации индоцианина зеленого (ИЦЗ) имеет достоверную высокую чувствительность (100%) и специфичность (88%) в определении функционального потенциала печени.
Таблица 9
Классификационная матрица
|
Наблюденные |
Предсказанные |
|||
|
исход госпитализации |
Процент корректных |
|||
|
0 |
1 |
|||
|
Исход госпитализации |
0 |
29 |
1 |
96,7 |
|
1 |
1 |
2 |
66,7 |
|
|
Общий процент |
94,3 |
|||
Таблица 10
Классификационная матрица при пороге отсечения равном 0,26
Таблица 8
Результаты регрессионного анализа
|
Показатель |
B |
Станд. ошибка |
Вальд |
Знач. |
Exp(B) |
|
ОК15 (Х1) |
1,471 |
0,688 |
4,571 |
0,032 |
4,353 |
|
Константа |
–20,499 |
10,121 |
4,102 |
0,042 |
0,0001 |
|
Наблюденные |
Предсказанные |
|||
|
исход госпитализации |
Процент корректных |
|||
|
0 |
1 |
|||
|
Исход госпитализации |
0 |
29 |
1 |
96,7 |
|
1 |
0 |
3 |
100 |
|
|
Общий процент |
97 |
|||
Кривые ROC
0,4—
g.
0,2-
1 - Специфичность
Рис. 2. График ROC-кривой
Скорость плазменной элиминации ИЦЗ с высокой чувствительностью и специфичностью характеризует тяжесть печеночной дисфункции и по своей прогностической силе превосходит другие критерии, что позволяет рекомендовать использование клиренс-теста с индоцианином при комплексном обследовании в ходе подготовки к обширной резекции печени и при ее проведении.
Список литературы Результаты анализа прогнозирования печеночной недостаточности при выполнении обширных резекций печени
- Вишневский В.А., Кубышкин В.А., Чжао А.В., Икрамов Р.З. Операции на печени: Рук. для хирургов.-М.: Миклош, 2003г.-153с.
- Гальперин Э.И. Регенерация печени при массивных ее резекциях и повреждениях//Анналы хирургической гепатологии, 2002, Т.7, №1, С. 279.
- Патютко Ю.И. Хирургическое лечение злокачественных опухолей печени.//М.: Практическая медицина, 2005 -312 с.
- Mullin EJ, Metcalfe MS, Maddern GJ. How much liver resection is too much?//Am J Surg. 2005;190(1):87-97.
- Guglielmi A, Ruzzenente A, Conci S, Valdegamberi A, Iacono C. How much remnant is enough in liver resection?//dig Surg. 2012;29(1): P. 6-17.
- Eroglu A., Demirci S., Akbulut H. et al. Effect of granulocytemacrophage colony-stimulating factor on hepatic regeneration after 70% hepatectomy in normal and cirrhotic rats//HPB, 2002,v.4,n2, P. 67-73.
- Lalazar G, Adar T, Ilan Y. Point-of-care continuous (13) C-methacetin breath test improves decision making in acute liver disease: results of a pilot clinical trial.//World J Gastroenterol. 2009 Feb 28;15(8): P. 966-72.
- Hashimoto M., Watanabe G. Hepatic parenchymal cell volume and the indocyanine green tolerance test.//J Surg Res 2000;92: P. 222-7.
- Kamath PS, Wiesner RH, Malinchoc M, Kremers W, Therneau TM, Kosberg CL, D'Amico G, Dickson ER, Kim WR. A model to predict survival in patients with end-stage liver disease.//Hepatology. 2001 Feb;33(2): P. 464-70.
- Malinchoc M, Kamath PS, Gordon FD, Peine CJ, Rank J, ter Borg PC. A model to predict poor survival in patients undergoing transjugular intrahepatic portosystemic shunts.//Hepatology. 2000 Apr;31(4): P. 864-71.
- Giannini E.G., Fasoli A., Borro P. et al. 13C-galactose breath test and 13C-aminopyrine breath test for the study of liver function in chronic liver disease.//Clin Gastroenterol. Hepatol.2005;3: P. 279-85.
- Kobayashi T., Kubota K., Imamura H. et al. Hepatic phenylalanine metabolism measured by the phenylalanine breath test.//Eur J Clin Invest 2001;31: P. 356-61.
- Li Y.M., Lv F., Xu X. Evaluation of liver functional reserve by combining d-sorbitol clearance rate and CT measured liver volume.//World J Gastroenterol 2003;9: P. 2092-5.
- Rocco A, de Nucci G, Valente G, Compare D, D'Arienzo A, Cimino L, Perri F, Nardone G.; 13C-aminopyrine breath test accurately predicts longterm outcome of chronic hepatitis C.//J Hepatol. 2012 Apr;56(4): P. 782-7.
- Chalasani N, Kahi C, Francois F, Pinto A, Marathe A, Bini EJ, Pandya P, Sitaraman S, Shen J. Model for end-stage liver disease (MELd) for predicting mortality in patients with acute variceal bleeding.//Hepatology. 2002 May;35(5): P. 1282-4.
- Imamura H, Sano K, Sugawara Y, Kokudo N, Makuuchi M. Assessment of hepatic reserve for indication of hepatic resection: decision tree incorporating indocyanine green test.//J Hepatobiliary Pancreat Surg. 2005;12(1): P. 16-22.
- Lee SG, Hwang S. How I do it: assessment of hepatic functional reserve for indication of hepatic resection.//J Hepatobiliary Pancreat Surg. 2005;12(1): P. 38-43.
- Eguchi H, Umeshita K, Sakon M, Nagano H, Ito Y, Kishimoto SI, Dono K, Nakamori S, Takeda T, Gotoh M, Wakasa K, Matsuura N, Monden M. Presence of active hepatitis associated with liver cirrhosis is a risk factor for mortality caused by posthepatectomy liver failure.//dig dis Sci. 2000 Jul;45(7): P. 1383-8.


