Результаты чрескожного вмешательства при остром коронарном синдроме в зависимости от вида механической гемодинамической поддержки кровообращения
Автор: Верещагин Иван Евгеньевич, Ганюков В.И., Кочергин Н.А., Корнелюк Р.А., Барбараш О.Л.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Оригинальные исследования
Статья в выпуске: 1S т.23, 2019 года.
Бесплатный доступ
Цель Сравнить результаты чрескожного коронарного вмешательства высокого риска у пациентов с острым коронарным синдромом без подъема сегмента ST с многососудистым поражением коронарных артерий при поддержке экстракорпоральной мембранной оксигенации и внутриаортальной баллонной контра-пульсации. Методы В исследование включены 34 пациента в возрасте 68,2 ± 10,6 года, из них 18 пациентам выполнено чрескожное коронарное вмешательство в условиях экстракорпоральной мембранной оксигенации, 16 больным - чрескожное коронарное вмешательство при поддержке внутриаортальной баллонной контра-пульсации. Изучена комбинированная конечная точка крупных неблагоприятных кардиоваскулярных событий в госпитальном периоде и течение 12 мес. после индексного вмешательства. Через 12 мес. по данным телефонного опроса производился учет частоты и структуры неблагоприятных кардиоваскулярных событий. Результаты Через 12 мес. наблюдения комбинированная конечная точка крупных неблагоприятных кардиоваскулярных событий в группе чрескожного коронарного вмешательства и экстракорпоральной мембранной оксигенации составила 22,2% (4 пациента), в группе чрескожного коронарного вмешательства и внутриаортальной баллонной контрапульсации - 68,7% (11 пациентов), р = 0,002. Выводы Отдаленные (12 мес.) результаты лечения больных острым коронарным синдромом без подъема сегмента ST при многососудистом поражении коронарных артерий демонстрируют клинические преимущества стратегии чрескожного коронарного вмешательства при поддержке экстракорпоральной мембранной оксигенации по сравнению со стратегией чрескожного коронарного вмешательства с поддержкой внутриаортальной баллонной контрапульсации у пациентов, получивших отказ в традиционных методах реваскуляризации миокарда (коронарном шунтировании или чрескожном коронарном вмешательстве без поддержки).
Внутриаортальная баллонная контрапульсация, многососудистое поражение, острый коронарный синдром без подъема сегмента st, чрескожное коронарное вмешательство, экстракорпоральная мембранная оксигенация
Короткий адрес: https://sciup.org/142230688
IDR: 142230688 | DOI: 10.21688/1681-3472-2019-1S-S34-S43
Текст научной статьи Результаты чрескожного вмешательства при остром коронарном синдроме в зависимости от вида механической гемодинамической поддержки кровообращения
Острый коронарный синдром без подъема сегмента ST (ОКСбпST) — это наиболее распространенная форма острого коронарного синдрома, при которой заболеваемость сохраняется на высоком уровне, а смертность сопоставима с отдаленной смертностью при инфаркте миокарда с подъемом сегмента ST.
Данные регистров показали, что госпитальная смертность пациентов c острым коронарным синдромом с подъемом сегмента ST, по сравнению с ОКСбпST, значимо выше (7 и 3,5%, соответственно), но уже через 6 мес. эти данные сопоставимы (12 и 13%) [ 1 ].
Выбор оптимальной стратегии реваскуляризации у пациентов с ОКСбпST с многососудистым поражением

Статья доступна по лицензии Creative Commons Attribution 4.0.
(МП) коронарного русла представляет особую сложность. Это обусловлено отсутствием четких рекомендаций по данному вопросу [ 2 ].
Не вызывает сомнения, что ранняя реваскуляризация приводит не только к купированию симптомов, но и сокращению сроков госпитализации и улучшению прогноза. Показания, сроки реваскуляризации миокарда и выбор методов лечения, таких как чрескожное коронарное вмешательство (ЧКВ), коронарное шунтирование (КШ) или сочетание этих подходов, зависят от факторов риска и сопутствующих заболеваний у пациента, а также выраженности поражения коронарных артерий [ 3, 4 ].
Как коронарное шунтирование, так и чрескожное коронарное вмешательство имеют ограничения. Хирурги отказывают в выполнении КШ на основании высокого риска операции, отражаемого шкалой EuroSCORE II. Факторы, ассоциированные с хирургической смертностью после КШ: острый коронарный синдром, низкая сократительная функция левого желудочка, высокий риск геморрагических осложнений на фоне двойной антиагрегантной терапии, ожирение и сопутствующий коморбидный фон [ 5, 6 ]. Эндоваскулярные специалисты воздерживаются от ЧКВ, опираясь на повышающийся показатель SYNTAX Score, который отражает высокий риск неблагоприятного исхода на фоне технической сложности чрескожного вмешательства. Консервативное ведение пациентов ОКСбпST с МП, которым было отказано в реваскуляризации, сопровождается высокой госпитальной летальностью — 28% [ 7 ]. С учетом этих факторов нередко формируется группа тяжелых пациентов ОКСбпST с МП, которым специалисты кардиокоманды не решаются выставить показания для хирургической или эндоваскулярной реваскуляризации ввиду высокого риска интраоперационных осложнений.
Таким образом, неопределенным остается выбор оптимальной стратегии реваскуляризации у пациентов с ОКСбпST при МП, особенно у получивших отказ в традиционных способах реваскуляризации.
В связи с этим представляется целесообразным рассмотреть вопрос о сопровождении ЧКВ высокого риска при ОКСбпST с МП циркуляторной поддержкой.
Такой подход, возможно, уменьшит риск чрескожного вмешательства за счет снижения опасности гемодинамического коллапса во время лимитирующих коронарный кровоток внутрисосудистых манипуляций. В настоящее время сохраняется необходимость детального анализа непосредственных и отдаленных результатов ЧКВ в условиях экстракорпоральной мембранной оксигенации (ЭКМО), в сравнении с применением «общедоступного» подхода в реваскуляризации миокарда при многососудистом поражении, у пациентов высокого риска — ЧКВ в условиях внутриаортальной баллонной контрапульсации (ВАБК).
Гипотезой исследования является преимущество использования поддержки ЭКМО при ЧКВ высокого риска у пациентов с острым коронарным синдромом без подъема сегмента и многососудистым поражением КА, по сравнению с внутриаортальной баллонной контрапульсацией.
Методы
Мы представляем ретроспективный регистровый анализ. В исследование вошли 34 пациента с ОКСбпST с многососудистым поражением КА, которым выполнено чрескожное коронарное вмешательство высокого риска с гемодинамической поддержкой ЭКМО или ВАБК с 2012 г. по 2016 г.
Критерии включения: острый коронарный синдром без подъема сегмента ST, многососудистое поражение коронарных артерий (стенозы двух и более крупных эпикардиальных артерий и/или их ветвей диаметром не менее 2,5 мм со степенью стеноза не менее 70% и/или стеноз ствола левой коронарной артерии (СтЛКА) не менее 50%, отказ от КШ или ЧКВ без гемодинамической поддержки.
Критерии исключения: кардиогенный шок и выраженный коморбидный фон, лимитирующий продолжительность жизни.
Кардиокоманда направила пациентов на реваскуляризацию миокарда с гемодинамической поддержкой после отказа в традиционных методах реваскуляризации (КШ или ЧКВ без поддержки). Стратификация риска госпитальных осложнений выполнялась при помощи прогностической шкалы EuroSCORE II (выраженность сопутствующей патологии, тяжесть клинического статуса и риск хирургических осложнений) [ 8 ] и шкалы GRACE (Global Registry of Acute Coronary Events) [ 9 ].
Критерии чрескожного коронарного вмешательства высокого риска:
-
1) сниженная функция левого желудочка (фракция выброса менее 30% по эхокардиографии);
-
2) большой объем миокарда, кровоснабжаемый стенозированным сосудом (Jeopardy Score не менее 8), а именно стеноз СтЛКА или случаи, когда целевой
сосуд обеспечивал коллатеральный кровоток к окклюзированной коронарной артерии, питающей более 40% миокарда;
-
3) технически сложное ЧКВ, то есть вмешательство на бифуркации, и/или СтЛКА, и/или хронической окклюзии коронарной артерии [ 10 ].
Антиагрегантная терапия на дооперационном этапе в группе ЧКВ + ВАБК включала нагрузочные дозы 150–300 мг ацетилсалициловой кислоты, 180 мг ти-кагрелора либо 600 мг клопидогрела. Процедура сопровождалась внутривенным введением нефрак-ционированного гепарина в дозировке 70–100 ед./кг до достижения активированного времени свертывания 300–350 с.
Установка канюль для аппарата ЭКМО проводилась по стандартной методике — общие бедренные вена и артерия. Венозную канюлю устанавливали на уровне правого предсердия, а артериальную — на уровне инфраренального отдела аорты. Производительность аппарата ЭКМО достигала 70–100% от расчетной объемной скорости перфузии, перфузионный индекс — 2,0–2,5 л/мин/м2. Мониторинг центральной гемодинамики осуществлялся через проводниковый катетер и катетер Свана – Ганса.
Установка ВАБК выполнялась через общую бедренную артерию. Под полной реваскуляризацией подразумевалось ЧКВ с остаточным баллом по шкале SYNTAX Score не более 2.
Успешным считали ЧКВ, если финальный кровоток по коронарным артериям не менее третьей градации TIMI с резидуальным остаточным стенозом не более 10% в стентированном сегменте КА при отсутствии серьезных сердечно-сосудистых осложнений во время процедуры (смерть, инфаркт миокарда, острое нарушение мозгового кровообращения / транзиторная ишемическая атака).
У всех пациентов после ЧКВ высокого риска оценивались значимые кровотечения по шкале BARC (Bleeding Academic Research Consortium) [ 13 ]. Значимая кровопотеря по шкале BARC 3А — явное кровотечение и снижение гемоглобина на 30–40 г/л, любая гемотрансфузия, связанная с кровотечением [ 13 ].
Через 12 мес. по данным телефонного опроса производился учет частоты и структуры неблагоприятных кардиоваскулярных событий.
Первичной конечной точкой исследования является комбинированная конечная точка серьезных неблагоприятных кардиоваскулярных событий (англ. Major Adverse Cardiovascular Events, MACE), включающая инфаркт миокарда, инсульт, повторную реваскуляризацию, смерть. Вторичная конечная точка исследования оценивала значимые кровотечения по шкале BARC.
Статистический анализ
Статистическая обработка данных проводилась с помощью пакета программ Statistica 8.0. При анализе средних значений количественных показателей в группах оценивалось соответствие фактического распределения показателя нормальному распределению с помощью критерия Колмогорова – Смирнова, а также равенство дисперсий с помощью критерия Левина. Для выявления различий между группами использовались t-критерий Стьюдента (в случае нормального
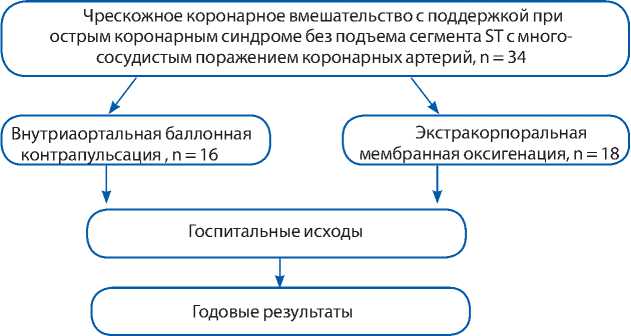
Рис. 1. Дизайн исследования
Таблица 1 Клинико-демографические и ангиографические характеристики пациентов
|
Показатель |
Чрескожное коронарное вмешательство + экстракорпоральная мембранная оксигенация, n = 18 |
Чрескожное коронарное вмешательство + внутриаортальная баллонная кон-трапульсация, n = 16 |
р |
|
Возраст, лет (M ± SD) Мужчины / женщины, n Артериальная гипертензия, n (%) Мультифокальный атеросклероз, n (%) Инфаркт миокарда в анамнезе, n (%) Сахарный диабет, n (%) Скорость клубочковой фильтрации по Кокрофту – Голту менее 60 мл/мин, n (%) |
68,3 ± 9,6 11 / 7 17 (94,5) 10 (55,5) 9 (50,0) 6 (33,3) 6 (33,3) |
68,1 ± 12,2 8 / 8 16 (100) 1 (6,25) 13(81,25) 5 (31,25) 6 (37,5) |
0,95 0,4 0,89 0,002 0,06 0,9 0,9 |
|
Острое нарушение мозгового кровообращения в анамнезе, n (%) |
4 (22,2) |
1 (6,25) |
0,1 |
|
Хроническая обструктивная болезнь легких в анамнезе, n (%) |
2 (11) |
2 (12,5) |
0,9 |
|
Острая сердечная недостаточность по классификации Киллипа, III–IV класс, n (%) |
0 |
2 (12,5) |
0,46 |
|
Фракция выброса левого желудочка, % (M ± SD) Фракция выброса левого желудочка менее 40%, n (%) |
49,3 ± 19,4 6 (33,3) |
47,1 ± 15,8 8 (50) |
0,72 0,3 |
|
Острый коронарный синдром высокого риска, n (%) |
13 (72,1) |
14 (87,5) |
0,71 |
|
EuroSCORE II, баллы (M ± SD) |
6,3 ± 6,3 |
6,4 ± 5,6 |
0,96 |
|
GRACE, баллы (M ± SD) |
119,7 ± 67,6 |
147,0 ± 39,7 |
0,16 |
|
Ангиографические показатели |
|||
|
Многососудистое поражение коронарных артерий, n (%) |
18 (100) |
16 (100) |
– |
|
Значимый стеноз ствола левой коронарной артерии (не менее 50%), n (%) |
11 (61,0) |
11 (68,7) |
0,6 |
|
Шкала Jeopardy, баллы (M ± SD) |
11 ± 2 |
12 ± 0 |
0,08 |
|
Шкала SYNTAX, баллы (M ± SD) |
33,5 ± 8,1 |
34,5 ± 4,8 |
0,66 |
распределения признаков и равенства дисперсий), U-критерий Манна – Уитни (в случае распределения, отличного от нормального). Критическим уровнем статистической значимости считалось p = 0,05.
Результаты
-
В исследование включено 34 пациента. Дизайн исследования представлен на рис. 1 .
Средний возраст пациентов в группах составил 68,2 ± 10,6 года, из них 19 (55,8%) мужчин и 15 (44,2%) женщин. В группу ЧКВ при поддержке ЭКМО вошли 18 пациентов, в группу ЧКВ при поддержке ВАБК — 16 человек. Представленные группы пациентов были сопоставимы по основным клинико-демографическим параметрам ( табл. 1 ) .
Несмотря на то что абсолютные цифры, оценивающие степень риска ОКСбпST, по шкале GRACE были выше в группе ЧКВ + ВАБК — 13 (72,1%) против 4 (87,5%)в группе ЧКВ + ВАБК, — статистический анализ различий не выявил, р = 0,71.
Успешное вмешательство в группе ЧКВ + ЭКМО выполнено у всех пациентов, в группе ЧКВ + ВАБК — у 14 (87,5%) пациентов, р = 0,86. У двоих пациентов в группе ЧКВ + ВАБК реваскуляризация осложнилась развитием острой сердечной недостаточности и, как следствие, летальным исходом.
В 10 (55,5%) случаях при поддержке ЭКМО и у 10 (62,5%) пациентов при поддержке ВАБК чрескожное коронарное вмешательство выполнялось трансрадиальным доступом. В группе ЧКВ + ЭКМО у 15 (83,3%) пациентов установка канюль производилась хирургическим способом. У 3 (16,7%) пациентов канюли устанавливались пункционно, с последующим ушиванием устройством ProStar XL (Abbott). Среднее время поддержки ЭКМО составило 125 ± 55 мин. При основном этапе значимых отклонений центральной гемодинамики, нарушений ритма и газообмена не выявлено.
Во второй группе внутриаортальный баллонный контрапульсатор 8 Fr Arrow International 30 или 40 СС
Таблица 2 Результаты чрескожного коронарного вмешательства в госпитальный период наблюдения
|
Показатель |
Чрескожное коронарное вмешательство + экстракорпоральная мембранная оксигенация, n = 18 |
Чрескожное коронарное вмешательство + внутриаортальная баллонная кон-трапульсация, n = 16 |
р |
|
|
Трансрадиальный доступ, n (%) |
10 (55,5) |
10 (62,5) |
0,32 |
|
|
Чрескожный способ установки устройства поддержки, n (%) |
7 (38,8) |
16 (100) |
0,95 |
|
|
Средний диаметр стентов, мм |
3,2 |
3,5 ± 0,3 |
0,25 |
|
|
Среднее количество стентов с лекарственным покрытием (M ± SD) |
2,3 ± 0,5 |
0,6 ± 0,8 |
0,002 |
|
|
Среднее количество стентов без лекарственного покрытия (M ± SD) |
0,27 ± 0,75 |
1,0 ± 0,8 |
0,009 |
|
|
Длительность основного этапа, мин (M ± SD) |
90,2 ± 79,8 |
40 ± 27,8 |
0,02 |
|
|
Коронарогенные осложнения, n (%) |
5 (27,75) |
2 (11,1) |
0,02 |
|
|
Прочие осложнения (диссекция корня аорты), n (%) |
1 (5,5) |
0 |
0,93 |
|
|
Полная реваскуляризация, n (%) |
4 (22,2) |
1 (6,25) |
0,01 |
|
|
Резидуальный SYNTAX Score, баллы (M ± SD) |
10,2 ± 9,8 |
19,4 ± 9,1 |
0,008 |
|
|
Госпитальные осложнения |
||||
|
Кровотечения по шкале BARC 3а и более, n (%) |
9 (50) |
3 (18,7) |
0,06 |
|
|
Заместительная терапия компонентами крови, n (%) |
7 (38,5) |
2 (11,1) |
0,07 |
|
|
Средний объем перелитой эритроцитарной массы, мл (M ± SD) |
491,5 ± 858,9 |
96,6 ± 282,2 |
0,08 |
|
|
Длительность госпитализации, дней (M ± SD) |
12,1 ± 4,7 |
10,1 ± 7,3 |
0,34 |
|
устанавливался пункционным способом по методике Сельдингера через общую бедренную артерию. Использовался режим поддержки 1 : 1. Среднее время поддержки ВАБК составило 128,8 ± 116,4 мин. У двоих (12,5%) пациентов поддержка ВАБК продолжалась в отделении интенсивной терапии, в остальных случаях поддержка прекращалась после чрескожного коронарного вмешательства.
Доля пациентов с полной реваскуляризацией составила 22,2% (4 пациента) в группе ЧКВ + ЭКМО и 6,25% (1 пациент) в группе ЧКВ + ВАБК. Ввиду сложности и протяженности поражения не у всех больных возможно выполнить полную реваскуляризацию миокарда.
Коронарогенные осложнения отмечались у 5 (27,75%) пациентов в группе ЧКВ + ЭКМО. Диссекции КА типа A и B, по классификации Национального института кардиологии, пульмонологии и гематологии (англ. National Heart, Lung and Blood Institute) [ 11 ], на контрольной коронарографии отмечены у 3 (16,6%) пациентов в группе ЧКВ + ЭКМО и не сопровождались электрокардиографическими признаками острой ишемии миокарда. Перфорация КА отмечена у 2 (11,1%) пациентов (тип 1 по классификации Эллис) [ 12 ].
В группе ЧКВ + ВАБК отмечено две диссекции коронарных артерий A и Е. Всем коронарогенным осложнениям предшествовала реваскуляризация хронической окклюзии КА или выполнение технически сложного стентирования.
Конечные точки госпитального периода представлены в табл. 3 . Летальные исходы в группах значимо различались, р = 0,05.
В раннем послеоперационном периоде один (5,5%) летальный исход у пациента с низкой фракцией выброса левого желудочка (34% по Симпсону) в группе ЧКВ + ЭКМО. Выполнение ЧКВ осложнилось диссекцией корня аорты типа II по Дебейки, без лимитации кровотока по КА. Пациенту выполнена полная реваскуляризация миокарда с имплантацией четырех стентов, но в раннем послеоперационном периоде возникла фибрилляция желудочков, рефрактерная к электро-импульсной терапии.
У одной женщины на вторые сутки после ЧКВ + ЭКМО выявлен инсульт в бассейне левой средней мозговой артерии, сопровождающийся нарушением сознания. Пациентка выписана из стационара на 10-е сут. после вмешательства.
В группе ЧКВ + ВАБК отмечается 5 (31,2%) летальных исходов в период госпитализации. У одного пациента ЧКВ высокого риска (SYNTAX Score 33,5 балла,
Таблица 3 Конечные точки госпитального периода
|
Показатель |
Чрескожное коронарное вмешательство + экстракорпоральная мембранная оксигенация, n = 18 |
Чрескожное коронарное вмешательство + внутриаортальная баллонная контрапульсация, n = 16 |
р |
|
MACE, n (%) |
2 (11) |
5 (31,2) |
0,15 |
|
Смерть, n (%) |
1 (5,5) |
5 (31,2) |
0,05 |
|
Инфаркт миокарда, n (%) |
0 |
0 |
– |
|
Инсульт (ОНМК / ТИА), n (%) |
1 (5,5) |
0 |
0,93 |
|
Повторная незапланированная реваскуляризация, n (%) |
0 |
0 |
– |
Примечание. MACE — неблагоприятные кардиоваскулярные события; ОНМК — острое нарушение мозгового кровообращения; ТИА — транзиторная ишемическая атака
EuroSCORE II 1,39%) осложнилось фибрилляцией желудочков в момент проведения стента через извитой кальцинированный сегмент огибающей артерии. Еще один летальный исход отмечен после ЧКВ высокого риска у пациента (SYNTAX Score 38 балла, EuroSCORE II 21,5%) после имплантации стента в СтЛКА с переходом на переднюю нисходящую артерию. У пациента через 15 мин после ЧКВ развивался кардиогенный шок с последующей остановкой сердечной деятельности с безуспешными реанимационными мероприятиями. Три (18,7%) летальных исхода в раннем послеоперационном периоде на фоне кардиогенного шока после ЧКВ у пациентов с SYNTAX Score более 33 баллов без полной реваскуляризации миокарда. У одного из них ЧКВ выполнялось на фоне острой сердечной недостаточности III класса по Киллипу.
Значимые кровотечения по шкале BARC [ 13 ] 3А степени отмечены у 9 (50%) пациентов в группе ЧКВ + ЭКМО, и у 3 (18,7%) в группе ЧКВ + ВАБК, р = 0,06.
Средний объем кровопотери в группе ЧКВ + ЭКМО к выезду пациента из операционной составил 252,1 ± 84,5 мл. Заместительная терапия компонентами крови проводилась у 7 (38,5%) пациентов в группе ЧКВ + ЭКМО и у 2 (12,5%) в группе ЧКВ + ВАБК, р = 0,07. Средний объем перелитой эритроцитарной массы составил 491,5 ± 858,9 мл в группе ЧКВ + ЭКМО и 96,6 ± 282,2 мл в группе ЧКВ + ВАБК, р = 0,08. При этом не прослеживается четкая связь гемотрансфузии и осложнения в месте доступа к магистральным сосудам. Основная кровопотеря в течение ЧКВ происходила во время постановки и удаления канюль аппарата ЭКМО или наложении сосудистого шва.
В группе ЧКВ + ЭКМО полная реваскуляризация миокарда выполнена у 4 (22,2%) пациентов, в группе ЧКВ + ВАБК — у 1 (6,25%) пациента, p = 0,01. Резидуальный SYNTAX Score в группе ЧКВ + ЭКМО составил 10,2 ± 9,8 балла, в группе ЧКВ + ВАБК — 19,4 ± 9,1 балла, р = 0,008.
Таблица 4 Конечные точки отдаленного периода наблюдения (12 мес.)
|
Показатель |
Чрескожное коронарное вмешательство + экстракорпоральная мембранная оксигенация, n = 18 |
Чрескожное коронарное вмешательство + внутриаортальная баллонная контрапульсация, n = 16 |
р |
|
MACE, n (%) |
4 (22,2) |
11 (68,7) |
0,002 |
|
Смерть, n (%) |
2 (11,1) |
6 (37,5) |
0,07 |
|
Инфаркт миокарда, n (%) |
1 (5,5) |
3 (18,7) |
0,24 |
|
Инсульт (ОНМК / ТИА), n (%) |
1 (5,5) |
0 |
0,93 |
|
Повторная незапланированная реваскуляризация, n (%) |
0 |
2 (12,5) |
0,46 |
Примечание. MACE — неблагоприятные кардиоваскулярные события; ОНМК — острое нарушение мозгового кровообращения; ТИА — транзиторная ишемическая атака
Результаты ЧКВ и особенности госпитального периода в группах представлены в табл. 2 . Конечные точки госпитального периода по группам представлены в табл. 3 . В госпитальном периоде комбинированная конечная точка (MACE) в 2 случаях(11%) в группах ЧКВ + ЭКМО и 5 (31,2%) случаях в ЧКВ + ВАБК значимо не различалась, р = 0,15.
Анализ результатов 12-месячного периода наблюдения в группах представлен в табл. 4 . В отдаленном периоде комбинированная конечная точка (MACE) в группах различалась, р = 0,002.
В группе ЧКВ + ЭКМО отмечен дополнительный один (5,5%) летальный исход в отдаленном периоде у пациента на фоне инфаркта миокарда через 3 дня после выписки из стационара. Общая летальность в группе в отдаленном периоде составила 2 (11,1%). В группе ЧКВ + ВАБК отмечается 6 (37,5%) летальных исходов. Три (18,7%) инфаркта миокарда в отдаленном периоде в группе ЧКВ + ВАБК. У одного пациента (5,5%) повторная реваскуляризация на целевом сосуде в связи с рестенозом стента. У одного пациента (5,5%) повторная реваскуляризация нецелевого сосуда через 11 мес.
Обсуждение
Результаты ретроспективного анализа показали, что гемодинамическая поддержка ЭКМО при ЧКВ высокого риска у пациентов с ОКСбпST с многососудистым поражением КА способствует полной реваскуляризации миокарда, что тем самым улучшает госпитальные и отдаленные результаты. Все пациенты, включенные в исследование, имели диагноз «острый коронарный синдром» и показания к реваскуляризации миокарда, и кардиокоманда принимала решение о способе реваскуляризации у каждого больного. Всем пациентам отказано в КШ и ЧКВ без гемодинамической поддержки. Основная причина — высокий риск реваскуляризации (как хирургической, так и эндоваскулярной), обусловленный большой вероятностью неблагоприятных кардиоваскулярных событий на фоне тяжести основного заболевания, распространенности и степени выраженности коронарного атеросклероза.
По данным литературы, около 40% пациентов с ОКСбпST имеют многососудистое поражение коронарных артерий [ 14 ]. Кроме того, зачастую пациенты данной группы имеют пожилой возраст с сочетанным коморбидным фоном.
Ранее опубликованные данные нашего одноцентрового регистра демонстрируют крайне неблагоприятный прогноз для пациентов с ОКСбпST высокого риска при многососудистом поражении КА, если больным отказали в реваскуляризации [ 15 ].
К сожалению, на данный момент нет крупных рандомизированных исследований с большой выборкой пациентов, где показывались бы преимущества и недостатки определенных стратегий реваскуляризации, в том числе использование аппаратов гемодинамической поддержки при выполнении ЧКВ высокого риска у пациентов с ОКСбпST с многососудистым поражением коронарных артерий. На данный момент не определен выбор методов гемодинамической поддержки у пациентов с ОКСбпST с многососудистым поражением. В рекомендациях по реваскуляризации миокарда упоминается лишь об объемах вмешательства. Так, европейские рекомендации по реваскуляризации миокарда ОКСбпST 2015 г. представляют выбор стратегии реваскуляризации на усмотрение кардиокоманды [ 2 ].
На основании результатов исследований поменялась тактика в отношении данной группы пациентов [ 16, 17 ] . В рекомендациях по реваскуляризации миокарда Европейского общества кардиологов за 2018 г. указывается, что полная реваскуляризация значимых поражений КА предпочтительней стентирования только артерии, связанной с инфарктом при многососудистом поражении у пациентов с ОКСбпST, ввиду лучших отдаленных результатов.
Довольно часто пациенты остаются без реваскуляризации из-за высокого риска интраоперационных осложнений. Летальность может достигать 28%, если методом лечения данной группы пациентов выбирается только медикаментозная терапия, в сравнении с 5,5% для группы ЧКВ и 8% для группы коронарного шунтирования [ 15 ].
Выходом из сложившейся ситуации может быть стратегия ЧКВ + ЭКМО пациентам, которым отказано в КШ и ЧКВ без гемодинамической поддержки. Наши первые исследования показали возможность и перспективность данной методики реваскуляризации при ЧКВ высокого риска. На протяжении 30 дней наблюдения в группе ЧКВ + ЭКМО отмечено 2 (9,1%) летальных исхода [7]. Изначально возник ряд вопросов о жизнеспособности и выполнимости технологии ЧКВ при поддержке ЭКМО и ее актуальности. Далее интерес представлял уровень основных кардиоваскулярных осложнений. Могут ли быть сопоставимы наши результаты с числом МАСЕ при ЧКВ без гемодинамической поддержки у больных ОКСбпST? Особое внимание мы уделили анализу геморрагических осложнений, учитывая, что установка и удаление канюль сопряжены с высоким риском кровопотери.
По данным G.J. Magovern, ЧКВ с поддержкой ЭКМО можно с успехом применить в группе пациентов высокого риска с нестабильной стенокардией. Госпитальная летальность у этих пациентов достигает 15%. Среди осложнений, встретившихся при использовании методики, авторы отмечают высокую частоту осложнений, связанных с артериальным доступом, — 50% всей группы пациентов [ 18 ].
При сопоставлении литературных данных с госпитальными и отдаленными результатами наших пациентов, которым выполнено ЧКВ в сочетании с ЭКМО (смерть 5,5% и 11%, МАСЕ 11% и 22%, соответственно), можно отметить допустимый характер, принимая во внимание тяжесть больных ОКСбпST. Полученные результаты в группе ЧКВ + ЭКМО подтверждают жизнеспособность предлагаемого подхода в качестве альтернативного метода реваскуляризации в крайне тяжелой группе пациентов.
При анализе результатов в группе ЧКВ + ВАБК возникает ряд вопросов. Чем можно объяснить высокую летальность в группе ЧКВ + ВАБК? Во-первых, пациенты имели крайне тяжелое поражение КА (по шкале SYNTAX Score более 32 баллов), постинфарктный кардиосклероз в анамнезе, значимый СтЛКА или эквивалент стеноза СтЛКА; у троих из пяти пациентов левожелудочковая недостаточность по классификации Киллипа II–III ст. Во-вторых, при выполнении ЧКВ высокого риска использование ВАБК не снижает риск ишемии миокарда при стентировании, особенно при технически сложных поражениях КА с длительной интервенцией на коронарной артерии.
Известно, что ВАБК не влияет на вентрикулярную разгрузку и увеличение сердечного выброса, повышает среднее артериальное давление и коронарную перфузию. В рандомизированном исследовании BSIC-1 оценивалась эффективность поддержки ВАБК при ЧКВ. Исследователи доказали, что рутинное применение ВАБК у всех пациентов нецелесообразно при ЧКВ высокого риска [ 19 ].
Эффективность и безопасность применения поддержки ЭКМО при ЧКВ, по сравнению с ВАБК, объясняется тем, что дополнительно к оксигенации крови веноартериальная ЭКМО может обеспечить циркуля- торную поддержку, позволяя выполнить более длительные вмешательства с низким риском гемодинамических нарушений на фоне ишемии миокарда.
Ограничения
Основными ограничениями исследования является ретроспективный характер анализа и малая выборка (34 пациента). Средний показатель по шкале SYNTAX составил 34 балла, что соответствует высокому риску неблагоприятного исхода на фоне технической сложности ЧКВ. С одной стороны, это является ограничением проводимого исследования, с другой — позволяет определить целесообразность различных методов гемодинамической поддержки при ЧКВ высокого риска у пациентов с ОКСбпST и многососудистым поражением коронарных артерий.
Заключение
Отдаленные (12 мес.) результаты лечения больных ОКСбпST при многососудистом поражении коронарных артерий демонстрируют клинические преимущества ЧКВ при поддержке ЭКМО, по сравнению с ВАБК, у пациентов, получивших отказ в традиционных методах реваскуляризации миокарда (коронарное шунтирование или ЧКВ без поддержки).
Финансирование
Исследование не имело финансовой поддержки.
Список литературы Результаты чрескожного вмешательства при остром коронарном синдроме в зависимости от вида механической гемодинамической поддержки кровообращения
- Yeh R. W., Sidney S., Chandra M., Sorel M., Selby J.V., Go A.S. Population trends in the incidence and outcomes of acute myocardial infarction. N. Engl J. Med. 2010;362(23):2155-65. PMID: 20558366. DOI: 10.1056/NEJMoa0908610
- Roffi M., Patrono C., Collet J.-Ph., Mueller Ch., Valgimigli M., Andreotti F., Bax J.J., Borger M.A., Brotons C., Chew D.P., Gencer B., Hasenfuss G., Kjeldsen K., Lancellotti P., Landmesser U., Mehilli J., Mukherjee D., Storey R.F., Windecker S.; ESC Scientific Document Group. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC). Eur Heart J. 2016;37(3):267-315. PMID: 26320110. https://doi. org/ DOI: 10.1093/eurheartj/ehv320
- Fukui T., Tabata M., Tobaru T., Asano R., Takanashi S., Sumiyoshi T. Early and long-term outcomes of coronary artery bypass grafting and percutaneous coronary intervention in patients with left main disease: single-center results of multidisciplinary decision making. Gen Thorac Cardiovasc Surg. 2014;62(5):301-7. PMID: 24317798. DOI: 10.1007/s11748-013-0357-7
- Ганюков В.И. Доказательная база приоритетной роли первичного чрескожного коронарного вмешательства в реваскуляризации больных с инфарктом миокарда с подъемом сегмента ST. Комплексные проблемы сердечно-сосудистых заболеваний. 2013;(1):24-34. DOI: 10.17802/2306-1278-2013-1-24-34
- Chalmers J., Pullan M., Fabri B., McShane J., Shaw M., Mediratta N., Poullis M. Validation of EuroSCORE II in a modern cohort of patients undergoing cardiac surgery. Eur J. Cardiothorac Surg. 2013;43(4):688-94. PMID: 22833541. 10.1093/ ejcts/ezs406 DOI: 10.1093/ejcts/ezs406


