Результаты длительной терапии риоцигуатом, включая стратегию переключения с силденафила, у пациентов с легочной гипертензией различного генеза
Автор: Мусашайхова С.А., Валиева З.С., Мартынюк Т.В.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 4, 2023 года.
Бесплатный доступ
Цель исследования: изучить влияние риоцигуата на функциональный и гемодинамический статус, ремоделирование правых камер сердца, а также безопасность терапии как у ранее нелеченных пациентов с идиопатической легочной гипертензией (ИЛГ) и неоперабельной хронической тромбоэмболической ЛГ (ХТЭЛГ), так и у пациентов c переключением на риоцигуат при недостижении целей лечения при приеме силденафила.Материал и методы. Всего в исследование включен 161 пациент с прекапиллярной ЛГ, трехлетний период наблюдения завершили 137 больных. Из 55 пациентов с ИЛГ терапия риоцигуатом начата после верификации диагноза - у 39 (подгруппа 1); 16 больным, ранее принимавшим силденафил, не достигших целей лечения, составили подгруппу 2 переключения на риоцигуат. Из 82 пациентов с неоперабельной ХТЭЛГ риоцигуат назначался впервые 45 пациентам, у 37 больных реализована стратегия переключения после 24-часовой отмены силденафила. Титрация дозы риоцигуата с 1 мг 3 раза/сут. проводилась согласно стандартному алгоритму до 7,5 мг/сут. К 36-му мес. в группах ИЛГ и ХТЭЛГ 92,4% и 94,8% пациентов соответственно получали 7,5 мг/сут. Исходно, через 12, 24 и 36 мес. всем пациентам проводились тест 6-минутной ходьбы (Т6МХ) с оценкой индекса одышки по шкале Борга и SpO2, эхокардиография (ЭхоКГ), катетеризация правых отделов сердца (КПОС), оценивался профиль безопасности терапии.Результаты. Исходно в группе ХТЭЛГ по сравнению с ИЛГ была достоверно выше доля пациентов ФК III-IV (70,7% против 41,8%); дистанция в Т6МХ (ДТ6МХ) составила 291 [232;385] м против 379 [300;448] м (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Идиопатическая легочная гипертензия, хроническая тромбоэмболическая легочная гипертензия, силденафил, риоцигуат, стратегия переключения
Короткий адрес: https://sciup.org/143181068
IDR: 143181068 | УДК: 615.036.8 | DOI: 10.38109/2225-1685-2023-4-42-55
Текст научной статьи Результаты длительной терапии риоцигуатом, включая стратегию переключения с силденафила, у пациентов с легочной гипертензией различного генеза
Данная статья распространяется на условиях «открытого доступа», в соответствии с лицензией CC BY-NC-SA 4.0 («Attribution-NonCommercial-ShareAlike» / «Атрибуция-Не-коммерчески-Сохранение Условий» 4.0), которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. Чтобы ознакомиться с полными условиями данной лицензии на русском языке, посетите сайт: by-nc-sa/4.0/
This is an open access article distributed under the terms of the Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International (CC BY-NC-SA 4.0) License , which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited.
Ключевым морфологическим субстратом прекапиллярной легочной гипертензии (ЛГ) является ремоделирование мелких артерий и артериол малого круга кровообращения, что приводит к повышению легочного сосудистого сопротивления и давления в легочной артерии с развитием правожелудочковой сердечной недостаточности [1,2]. Классическими вариантами прекапилярной ЛГ являются легочная артериальная гипертензия (ЛАГ) с эталонной идиопатической формой патологии (ИЛГ) и хроническая тромбоэмболическая легочная гипертензия (ХТЭЛГ). До 60% больных ХТЭЛГ являются операбельными: в результате проведения легочной тромбэндартерэктомии можно достичь регресса ЛГ вплоть до нормализации гемодинамики [2,3]. При неоперабельной форме ХТЭЛГ в дистальном сосудистом русле легких, как и при ЛАГ, возникают сходные изменения – гипертрофия и фиброз интимы, гипертрофия ме-дии, плексиформные повреждения [4]. Основой морфологических изменений является повреждение эндотелия, дисбаланс между вазоконстрикторными и вазодилатирующими факторами, с преобладанием тромботических, провоспалительных и митогенных эффектов, что способствует вазоконстрикции и тромбозам, пролиферативным и воспалительным изменениям в микроциркуляторном русле легких [1,2].
В патогенезе ЛАГ и неоперабельной ХТЭЛГ доказано снижение биодоступности оксида азота (NO) и уровня циклического гуанозинмонофосфата (цГМФ), как его вторичного мессенджера, в качестве важнейшей мишени современной лекарственной терапии, воздействующей на вазоконстрикцию и ремоделирование мелких легочных артерий и артериол, перегрузку правого желудочка [4-7].
Ингибиторы фосфодиэстеразы типа 5 (ИФДЭ-5) – силденафил и тадалафил – являются наиболее часто назначаемыми препаратами для лечения ЛАГ [7,8]. Однако значительная часть пациентов не достигала удовлетворительного результата на фоне терапии ИФДЭ-5, что послужило основой для изучения стратегии переключения на риоцигуат, как первый представитель класса стимуляторов рГЦ с двойным механизмом действия [9,10]. Препарат сенсибилизирует растворимую гуанилатциклазу (рГЦ) к эндогенному NO путем стабилизации связи NO-рГЦ, а также напрямую стимулирует фермент через другой участок связи, независимо от NO [11,12].
В отличие от других препаратов специфической терапии стимулятор растворимой гуанилатциклазы риоцигуат рекомендован для лечения пациентов ЛАГ, так и с ХТЭЛГ при неоперабельных или резидуальных формах [1,2]. Высокая эффективность замены ИФДЭ-5 на риоцигуат показана в ряде исследований, в частности 24-недельном многоцентровом открытом рандомизированном контролируемом исследовании
REPLACE [13]. Однако имеется очевидный дефицит данных в пользу долгосрочности результатов терапии.
Целью исследования явилось изучить влияние риоцигуата на функциональный и гемодинамический статус, ремоделирование правых камер сердца, а также оценить безопасность терапии как у ранее нелеченных пациентов с ИЛГ и неоперабельной ХТЭЛГ, так и у пациентов c переключением на риоцигуат при недостижении целей лечения при приеме силденафила.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
В проспективное открытое одноцентровое исследование в НИИ клинической кардиологии им. А.Л. Мясникова ФГБУ «Национальный медицинский исследовательский центр кардиологии им. академика Е.И. Чазова» Минздрава России в соответствии с рекомендациями надлежащей клинической практики и Хельсинкской декларацией за период 2016-2019 гг. включен 161 пациент с подтвержденной прекапиллярной ЛГ.
Критериями включения были возраст >18 лет; верифицированный диагноз ИЛГ или неоперабельной ХТЭЛГ (дистальный тип тромботического поражения легочных артерий, не подлежащий хирургическому и интервенционному лечению); функциональный класс (ФК) II-III (ВОЗ); дистанция в тесте 6-минутной ходьбы (ДТ6МХ) 165–440 м; сердечный индекс (СИ) <3,0 л/мин/м2; среднее давление в легочной артерии (срДЛА) >25 мм рт. ст.; давление заклинивания в лёгочной артерии (ДЗЛА) ≤ 15 мм рт. ст. и легочное сосудистое сопротивление (ЛСС) >400 дин 2 сек 2 см-5; отрицательный тест на вазореактивность при КПОС у пациентов с впервые выявленной ИЛГ; отсутствие ЛАГ-специфической терапии (подгруппа 1) или прием стабильной терапии силденафилом и антагонистами рецепторов эндотелина (АРЭ) или ингаляционным илопростом в течение не менее 3 мес.
Критериями исключения явились возраст <18 лет; ЛГ, обусловленная заболеваниями легких и/или гипоксией (группа 3), патологией левых отделов сердца (группа 2), другой патологией (группа 5); ХТЭЛГ с возможностью проведения хирургического и/или интервенционного вмешательства, беременность, лактация; гипотония (систолическое артериальное давление <95 мм рт. ст.); индивидуальная непереносимость риоцигуата.
Критериями недостаточного клинического ответа на терапию силденафилом для групп переключения было наличие как минимум одного из перечисленных факторов: сохранение ФК III (ВОЗ), несмотря на прием терапии силденафилом (монотерапия или сочетание с АРЭ или ингаляционным илопростом) в стабильных дозах на протяжении не менее трех месяцев; ДТ6МХ 165-440 м; среднее давление в правом предсердии (срДПП) 8-14 мм рт. ст. и СИ 2,0-2,5 л/мин/м2 согласно данным катетеризации правых отделов сердца (КПОС).
Клинико-демографические показатели в группах ЛГ представлены в таблице 1.
Таблица 1. Исходные клинико-демографические показатели пациентов
Table 1. Baseline clinical and demographic parameters of patients
|
Показатели |
Группа ИЛГ n=55 |
Группа ХТЭЛГ n=82 |
P-value |
|
Возраст на момент постановки диагноза, годы |
37,0 [29,0; 50,0] |
55,0 [45,0; 63,0] |
0,000002 |
|
Мужчины, n (%) |
5 (9,1%) |
34 (41,5%) |
0,000001 |
|
Длительность периода до установления диагноза, мес. |
15,0 [7,0; 31,0] |
10,5 [45,0; 29,0] |
0,030 |
|
Длительность терапии силденафилом, мес. |
5,0 [0; 25,0] |
14,0 [3,0;36,0] |
0,021 |
|
Длительность заболевания до начала терапии риоцигуатом, мес. |
37,0 [14,0; 77,0] |
42,0 [23,0; 91,0] |
0,008 |
|
ИМТ, кг/м2 |
26,0 [22,0;30,0] |
27,5 [24,0;32,0] |
0,120 |
Примечание/Note: ИМТ – индекс массы тела (BMI – body mass index) 44 ЕВРАЗИЙСКИЙ КАРДИОЛОГИЧЕСКИЙ ЖУРНАЛ, 4, 2023
Трехлетний период наблюдения завершили 137 больных. Из 55 пациентов с ИЛГ 39 пациентам риоцигуат назначался после верификации диагноза; 16 больных, ранее принимавших силденафил и не достигших целей лечения, составили группу переключения. Из 82 пациентов с неоперабельной ХТЭЛГ рио-цигуат назначался впервые 45 пациентам, а у 37 больных реализована стратегия переключения. Титрация дозы риоцигуата, начиная с 1 мг 3 раза в день, проводилась согласно стандартному алгоритму до максимальной 7,5 мг/сутки при отсутствии гипотонии и НЯ.
Пациентам из подгруппы переключения (подгруппа 2), которые не достигли целей лечения на фоне терапии силденафилом, через 24 часа после последнего приема силденафила была инициирована терапия риоцигуатом в начальной дозе 1 мг 3 раза в сутки.
В подгруппе переключения с ИЛГ (n=16) замена на риоцигуат проводилась с силденафила (n=13), ИФДЭ-5 + бозентан (n=2), ИФДЭ-5 + илопрост (n=1). В подгруппе переключения с ХТЭЛГ (n=37) предшествующая терапия включала силденафил (n=31) или ИФДЭ-5 + илопрост (n=6).
Оценка риска проводилась по шкале стратификации, предложенной в Европейских рекомендациях 2015 г. и Евразийских рекомендациях по ЛГ 2019 г. В этой модели учитывается панель параметров клинического, функционального, гемодинамического статуса, ЭхоКГ, уровня биомаркеров для установления риска летальности у пациентов с ЛАГ в течение одного года. Критерии низкого риска летальности (<5% в течение года) включают ФК I или II (ВОЗ) и ДТ6МХ 380-440 м; пиковое потребление кислорода >15 мл/мин/кг и вентиляционный эквивалент СО2 <45 по данным кардиореспираторного нагрузочного теста; нормальные значения натрийуретического пептида; нормализация размеров и функции правого желудочка (ПЖ) по данным
ЭхоКГ или магнитно-резонансной томографии сердца; срДПП <8 мм рт. ст. и повышение СИ более 2,5 л/мин/м2 по данным КПОС. Промежуточный или высокий риск устанавливается при наличии, по меньшей мере, единственного критерия соответствующего профиля.
Исходно и далее ежегодно в ходе динамического наблюдения на фоне приема терапии риоцигуатом всем пациентам проводились: Т6МХ по стандартной методике с оценкой выраженности одышки по шкале Борга, включающей 10 баллов от отсутствия до максимальной выраженности, у всех пациентов определялись SpO2, частота сердечных сокращений (ЧСС), АД до и после Т6МХ, проводились ЭхоКГ и КПОС, фиксировались события клинического ухудшения и профиль безопасности с учетом НЯ.
Трансторакальная ЭхоКГ проводилась на ультразвуковом приборе экспертного класса Vivid E9 (GE Healthcare, США) с использованием датчика M5S-D для регистрации изображений в 2D режиме. Для определения фаз сердечного цикла во время исследования выполнялась синхронная запись ЭКГ. Исследование проводилось с использованием стандартных эхокардиографических доступов и режимов. Расчет систолического давления в легочной артерии (СДЛА) проводился по формуле: СДЛА = мГДсТК + PПП, где мГДсТК – максимальный систолический градиент на трикуспидальном клапане, PПП – давление в правом предсердии [14]. Расчет срДЛА проводился по формуле: срДЛА = срГДсТК + PПП, где срГДсТК – средний систолический градиент на ТК. Для определения ДПП оценивался диаметр нижней полой вены и ее коллабирование на вдохе. Для проведения КПОС использовался аппарат Allura Xper FD10 (Philips, Нидерланды). Во время процедуры проводилась прямая манометрия с определением давления в легочной артерии, правых камерах сердца и ДЗЛА с применением катетера Сван-Ганца.
Дизайн исследования n=5 – НЯ n=6 – НЯ
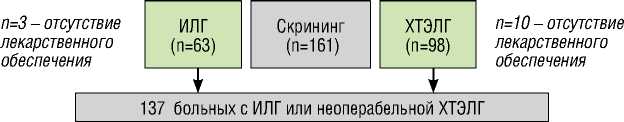
ХТЭЛГ ( n=82)
ИЛГ (n=55)
Подгруппа 1 (n=39) Ранее не леченные пациенты
Подгруппа 2 (n =16) Переключение с силденафила (n=13), ИФДЭ-5 + бозентан (n=2), ИФДЭ-5 + илопрост (n=1)
Подгруппа 1 (n=45) Ранее не леченные пациенты
Подгруппа 2 (n=37) Переключение с силденафила (n=31), ИФДЭ-5 + илопрост (n=6)
-
• ФК III (ВОЗ)
-
• Д6МХ 165-440 м
-
• NT-proBNP 300-1400 пг/мл
-
• Данные КПОС:
-
-ДПП 8-14 мм рт.ст.;
-
-СИ 2.0-2.5 л/мин/м2
Неадекватный клинический ответ: прием силденафила в стабильной дозе ≥ 3 мес. + наличие ≥ 1 критерия!
о
о о
Нед. 1 Нед. 12 Нед. 24
о
12 мес.
о
24 мес.
о
36 мес.

Рисунок 1. Дизайн исследования
-
Figure 1. Study design
ОРИГИНАЛЬНАЯ СТАТЬЯ
ТЕРАПИЯ РИОЦИГУАТОМ, СТРАТЕГИЯ ПЕРЕКЛЮЧЕНИЯ С СИЛДЕНАФИЛА У ПАЦИЕНТОВ С ЛГ
Статистическая обработка данных проводилась с использованием компьютерной программы Statistica v. 10.0 for Windows (StatSoftlnc, USA), предусматривающей возможность параметрического и непараметрического анализа. Оценка различий между группами и подгруппами проводилась с использованием критерия Манна-Уитни (U-критерий). Статистически значимые различия считались при достигнутом уровне р<0,005. Оценка динамики показателей на фоне терапии проводилась с применением непараметрического анализа по Вилкоксону. Результаты исследований представлены в виде медианы и межквартильного размаха (25-й и 75-й процентиль). Использовали парный и непарный критерии Стьюдента. Проверяли соответствие количественных показателей нормальному закону распределения. Сравнение качественных показателей проводили с помощью критерия Пирсона хи-квадрат.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
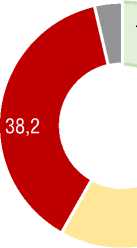
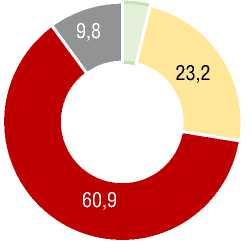
При оценке исходного функционального статуса в группе ХТЭЛГ доля наиболее тяжелых пациентов с ФК III-IV (ВОЗ) была достоверно выше (70,7% против 41,8%) при средней ДТ6МХ 291 [232;385] м по сравнению с 379 [300;448] м в группе ИЛГ (p<0,001) (табл. 2, рис. 2). У больных с ХТЭЛГ при выполнении Т6МХ отмечалась б о льшая выраженность одышки при более низком значении SрO2 после Т6МХ; при этом SрO2 до Т6МХ в среднем в группах ИЛГ и ХТЭЛГ не различались. В подгруппах лечения исходно различий по среднему ФК, ДТ6МХ, индексу одышки по Боргу, SрO2 не отмечалось (табл. 2).
По данным трансторакальной ЭхоКГ у пациентов с ИЛГ и ХТЭЛГ на момент включения выявлялись типичные признаки ремоделирования правых отделов сердца и снижение систолической функции ПЖ (табл. 3). При сравнительном анализе срДЛА в группе ИЛГ было достоверно выше по сравнению с группой ХТЭЛГ, при этом параметры оценки правых отделов сердца и ствола ЛА не различались. У пациентов ХТЭЛГ выявлены достоверно большие значения ЛП, КДР ЛЖ, ММЛЖ, корня аорты, которые находились в пределах нормальных значений.
При сопоставлении показателей в подгруппах лечения по всему спектру параметров достоверных различий выявлено не было. У пациентов с ХТЭЛГ в подгруппе переключения исходно была меньше SПП (p<0,05) по сравнению с группой стартовой терапии риоцигуатом.
При КПОС у пациентов ИЛГ и ХТЭЛГ выявлена типичная картина прекапиллярной ЛГ. При сопоставлении исходных параметров в группе ХТЭЛГ отмечались более низкие значения срДЛА, ЛСС, SаО2 и SvО2, другие показатели достоверно не различались. В подгруппах переключения у пациентов с ИЛГ и ХТЭЛГ исходные значения срДЛА (p=0,01), срДПП (p=0,001) и ЛСС (p=0,01) (по данным КПОС) были достоверно ниже, чем в подгруппе 1. Значения CИ и УО были достоверно выше в подгруппах 2 (p<0,05).
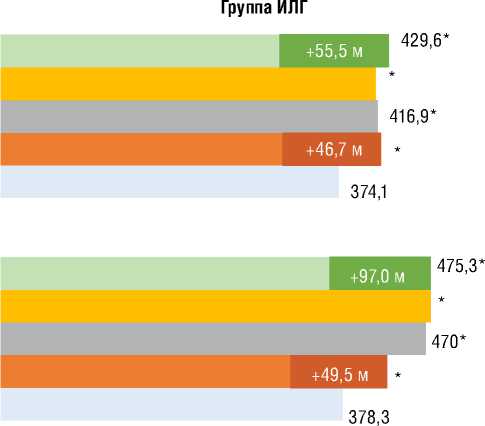
В обеих подгруппах ИЛГ достоверный прирост ДТ6МХ достигался уже к 6 мес. лечения риоцигуатом при достижении ФК I-II (ВОЗ) у 75% и 70% больных соответственно (рис. 3 и 4). В подгруппе 1 к 36 мес. лечения наблюдался наибольший прирост +97 м; в подгруппе переключения достигнутый к 6 мес. прирост ДТ6МХ сохранялся к 36 мес.
У пациентов из общей группы ХТЭЛГ с исходно более низкой ДТ6МХ к 6 мес. лечения также отмечалось значимое улуч-
Таблица 2. Исходная функциональная характеристика пациентов
Table 2. Baseline functional characteristics of patients
|
Исходные параметры |
Группа ИЛГ (n=55) |
Пациенты с ИЛГ |
Группа ХТЭЛГ (n=82) |
Пациенты с ХТЭЛГ |
||
|
Подгруппа 1 (n=39) |
Подгруппа 2 (n=16) |
Подгруппа 1 (n=45) |
Подгруппа 2 (n=37) |
|||
|
ФК I/II/III/IV (ВОЗ) |
5/26/22/2 |
5/18/14/2 |
0/8/8/0 |
3/21/50/8 |
2/10/32/7 |
1/11/18/1 |
|
ДТ6МХ, м |
379 [300;448] *** |
385,3 [304; 415] |
372 [327; 425] |
291 [232;385] |
296 [235;378] |
306 [241;387] |
|
Индекс одышки по Боргу, баллы |
4,0 [2,0;5,0] *** |
3,5 [1,8; 4,5] |
4,2 [2,0;5,3] |
5,5 [1,5;6,0] |
5,8 [1,8;6,5] |
5,2 [2,0;5,7] |
|
SрO2 до Т6МХ, % |
95 [92;97] |
94,2 [92,0; 97,2] |
95,5 [93,5; 98] |
94 [91,0; 96,5] |
93,6 [90,7; 96,0] |
95 [90; 96,5] |
|
SрO2 после Т6МХ, % |
96 [91;97] * |
93,6 [91,5;98,0] |
92,7 [91,0; 97,0] |
92,3 [89,2;95,0] |
91,8 [86,5;94,3] |
93,0 [89,5;95,5] |
Примечание: *p<0,05; ***p<0,001 – по сравнению с группой ХТЭЛГ
Note: *p<0,05; ***p<0,001 – as compared with CTEPH group
I
II
III
IV
3,6
48,2
I
II
III
IV
3,7
Группа ХТЭЛГ
Группа ИЛГ
Рисунок 2. Исходный ФК (ВОЗ) у пациентов с ИЛГ и ХТЭЛГFigure 2. Baseline FC (WHO) in patients with IPAH and CTEPH
46 ЕВРАЗИЙСКИЙ КАРДИОЛОГИЧЕСКИЙ ЖУРНАЛ, 4, 2023
Таблица 3. Исходные параметры трансторакальной эхокардиографии и КПОС
Table 3. Baseline parameters of transthoracic echocardiography and RHC
|
Параметры |
Группа ИЛГ (n=55) |
Пациенты с ИЛГ |
Группа ХТЭЛГ (n=82) |
Пациенты с ХТЭЛГ |
||
|
Подгруппа 1 (n=39) |
Подгруппа 2 (n=16) |
Подгруппа 1 (n=45) |
Подгруппа 2 (n=37) |
|||
ЭхоКГ:
|
SПП, cм2 |
23,0 [18,0; 28,3] |
23,7 [18,2;28,0] |
22,4 [17,8;27,2] |
25,3 [22; 30,5] |
28,0 [25,2;30,8] # |
24,6 [18,4; 27,8] |
|
БРПЖ, см |
4,7 [ 4,2; 5,2] |
4,5 [4,1; 5,0] |
4,7 [3,9; 4,9] |
4,7 [4,3; 5,1] |
4,6 [4,1; 4,9] |
4,8 [4,2; 5,2] |
|
ТПСПЖ, см |
0,70 [0,61;0,79] |
0,68 [0,60;0,76] |
0,71 [0,63;0,78] |
0,68 [0,63;0,80] |
0,67 [0,61;0,77] |
0,69 [0,60;0,72] |
|
TAPSE, см |
1,57 [1,20; 1,85] |
1,61 [1,48; 1,85] |
1,52 [1,24; 1,65] |
1,64 [1,31; 1,90] |
1,74 [1,41; 1,82] |
1,52 [1,24; 1,74] |
|
дИЭ |
1,58 [1,43; 1,82] |
1,67 [1,41; 1,90] |
1,55 [1,42; 1,58] |
1,62 [1,46; 1,85] |
1,64 [1,45; 1,89] |
1,53 [1,41; 1,69] |
|
FAC ПЖ,% |
26,5 [22,8; 35,6] |
25,3 [21,5; 35,5] |
26,8 [24,9; 34,5] |
25,5 [23,2; 35,3] |
24,3 [21,5; 35,5] |
26,7 [24,8; 35,1] |
|
Ствол ЛА, см |
3,3 [2,9; 3,6] |
3,2 [2,9; 3,6] |
3,4 [2,9; 3,7] |
3,1 [2,9; 3,4] |
3,2 [3,0; 3,6] |
3,3 [2,9; 3,5] |
|
СДЛА, мм рт. ст. |
91 [75; 105,5] |
88,1 [71; 100,5] |
92,2 [74; 107,5] |
85 [75; 108] |
84,7 [71; 100,5] |
85,5 [68; 103,5] |
|
СрДЛА, мм рт. ст. |
63 [47,3; 74,1] ** |
62,4 [48,8; 73,5] |
64,5 [50; 68] |
49,1 [40,5; 67] |
48,1 [37,7; 63,7] |
50,9 [41; 62] |
|
ДЗЛА, мм рт. ст. |
8,5 [7; 10] |
8,7 [7; 9] |
8,6 [6; 10] |
9 [7; 9,3] |
8,6 [7; 9,3] |
9,2 [7; 9,3] |
|
АО корень, см |
3,0 [2,8;3,2] *** |
2,9 [2,7; 3,0] |
3,2 [2,8; 3,3] |
3,35 [3,1;3,6] |
3,45 [2,8; 3,7] |
3,25 [2,7; 3,5] |
|
ЛП, см |
3,2[3,0;3,6] *** |
3,0 [2,8; 3,4] |
3,2 [2,9; 3,5] |
3,65 [3,4;4,0] |
3,6 [2,9; 3,8] |
3,86 [3,0; 3,98] |
|
КДР ЛЖ, см |
3,9 [3,5;4,6] *** |
4,0 [3,6; 4,4] |
3,8 [3,7; 4,6] |
4,4 [4,0;4,7] |
4,6 [3,9; 4,8] |
4,3 [3,8; 4,7] |
|
ММЛЖ, г |
128,9 [89,7;153,0]** |
127,2 [88,1;152,5] |
129,0 [90,2;153,5] |
142,5 [127,7;164,5] |
143,5 [128,7;165,5] |
140,8 [125,8;162,8] |
|
КПОС: |
||||||
|
СрДЛА, мм рт. ст. |
58,2 [50,0; 75,0] * |
63,5 [51; 78,5] |
50,8 [46,5; 68,0] ## |
53,0 [47,2; 62,5] |
61,5 [41,0; 78,5] |
51 [47,5; 73,0] ## |
|
СрДПП, мм рт. ст. |
6,2 [3,4; 10,8] |
10,0 [5,1; 14,0] |
4,0 [2,8; 6,2] ### |
6,5 [3,7; 11,8] |
10,2 [5,0; 13,4] |
4,5 [2,2; 7,6] ### |
|
ДЗЛА, мм рт. ст. |
8,4 [4,5; 11,0] |
8,3 [4,2; 10,1] |
7,4 [4,5; 11,0] |
9,3 [6,0; 12,2] |
10,1 [4,7; 11,2] |
8,8 [4; 11] |
|
УО, мл |
46,9 [35,5; 55] |
45,6 [32,5; 50,5] # |
55,7 [40,5; 66,5] |
47 [42; 57] |
49,5 [35,5; 55,3] |
57,9 [39,5; 65,0] |
|
СИ, л/мин/м2 |
2,0 [1,56; 2,30] |
1,79 [1,57; 2,0] |
2,15 [2,10; 2,35] # |
2,10 [1,46; 2,21] |
1,85 [1,42; 1,90] |
2,20 [2,0; 2,35] # |
|
SаО2,% |
96,0 [91,2; 98,5] * |
95,3 [91,5; 98,3] |
96,3 [92,1; 98,8] |
92,5 [90,4; 94,2] |
92,4 [91,4; 98,2] |
90,6 [91,5; 98,0] |
|
SvО2,% |
63,2 [58; 67,5] * |
61,8 [53; 63] |
60,5 [57; 66,5] |
58,0 [54; 61] |
58,3 59,5 [53; 63] |
60,9 61 [57; 66,5] |
|
ЛСС, дин 2 с 2 cм-5 |
1142,0 [900;1544] * |
1019,9 [956;1520] |
1278, 8 [1059;1456] ## |
989 [800;1189] |
940,9 [856,2;1110,0] |
1044,1 [959;1556] ## |
Примечание/Note: * – p<0,05; ** – p<0,01; *** – p<0,001 – по сравнению с группой ХТЭЛГ (as compared with t CTEPH group);
# – p<0,05; ## – p<0,01; ### – p<0,001 – по сравнению с подгруппой переключения (подгруппа 2) (as compared to the switching subgroup (subgroup 2)) ЭхоКГ – эхокардиография (echocardiography); SПП – площадь правого предсердия (area of the right atrium); БР ПЖ – базальный размер правого желудочка (basal size of the right ventricle); ТПСПЖ – толщина передней стенки правого желудочка (thickness of the anterior wall of the right ventricle); TAPSE – систолическая экскурсия кольца трикуспидального клапана (tricuspid annulus systolic excursion); дИЭ – диастолический индекс эксцентричности (diastolic eccentricity index); FAC ПЖ – фракционное изменение площади правого желудочка (fractional change in the area of the right ventricle); ЛА – легочная артерия (pulmonary artery); СДЛА – систолическое давление в легочной артерии (systolic pulmonary artery pressure); срДЛА – среднее давление в легочной артерии (mean pulmonary artery pressure); ДЗЛА – давление заклинивания в легочной артерии (wedge pressure in the pulmonary artery); АО – аорта (aorta); ЛП – левое предсердие (left atrium); КДРЛЖ – конечно-диастолический размер левого желудочка (end-diastolic size of the left ventricle); ММЛЖ – масса миокарда левого желудочка (left ventricular myocardial mass); КПОС – катетеризация правых отделов сердца (right heart catheterization); срДПП – среднее давление в правом предсердии (mean right atrium pressure); СИ – сердечный индекс (cardiac index); SаО2 – сатурация артериальной крови кислородом (oxygen saturation of arterial blood);
SvO2 – сатурация смешанной венозной крови кислородом (oxygen saturation of mixed venous blood); ЛСС – легочное сосудистое сопротивление (pulmonary vascular resistance)
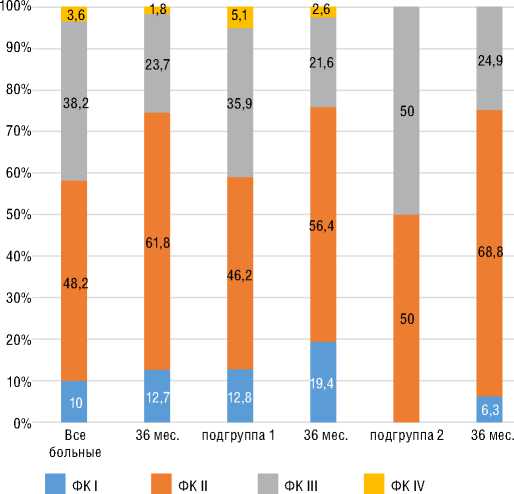
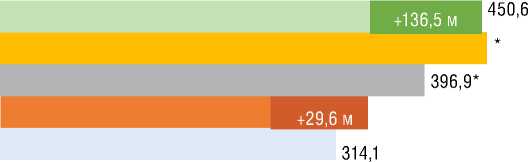
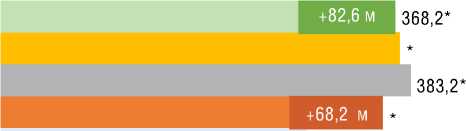
шение ФК (ВОЗ) (p=0,001) со средней дельтой ∆ДТ6МХ +48 м (p=0,001) без существенной динамики индекса одышки по Боргу. У пациентов с ХТЭЛГ подгруппы 1 прирост ДТ6МХ составил 68,2 м (p=0,001) с достижением 82,6 м к 36 мес. лечения. В подгруппе 2 достоверная динамика ДТ6МХ отмечена к 1-му году наблюдения с достижением +136,6 м к 36 мес. Примечательно, что у пациентов с ИЛГ и ХТЭЛГ достигнутая Д6МХ к 36 мес. наблюдения достоверно не различалась. При анализе SpO2 в покое в подгруппах стартовой терапии риоци-гуатом улучшение достигалось у больных с ИЛГ, начиная с 12 мес. лечения, и сохранялось к 36 мес. У пациентов с ХТЭЛГ из подгруппы 1 существенное улучшение показателя достигалось к 36 мес. В подгруппах 1 при анализе SpO2 после Т6МХ наблюдалась аналогичная динамика: у больных с ИЛГ улучшение сохранялось с 12 мес. до 36 мес.; у пациентов с ХТЭЛГ – отмечалось к 36 мес. В подгруппах переключения показатели SpO2 в
Группа ИЛГ
Группа ХТЭЛГ
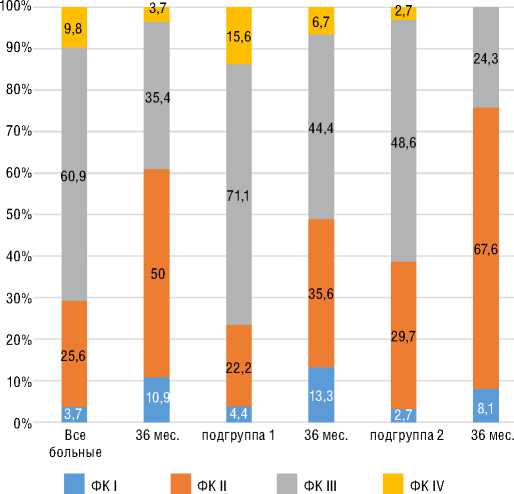
Рисунок 4. Динамика ФК (ВОЗ) на фоне специфической терапии, включающей риоцигуат, у пациентов с ХТЭЛГ к 36 мес. наблюдения
Рисунок 3. Динамика ФК (ВОЗ) на фоне специфической терапии, включающей риоцигуат, у пациентов с ИЛГ к 36 мес. наблюдения
Figure 4. FC (WHO) change on the specific therapy, including riociguat, in patients with CTEPH by 36 months of FU
Figure 3. FC (WHO) change on the specific therapy, including riociguat, in patients with IPAH by 36 months of FU
Группа ХТЭЛГ
285,6
исх.

36 мес.

24 мес.

12 мес.

6 мес.
Примечание/Note: *p<0,05 – по сравнению с исходным (compared to baseline)
Рисунок 5. Динамика дистанции в тесте 6-минутной ходьбы в подгруппах ИЛГ и ХТЭЛГ за период 36- месячного лечения риоцигуатом
Figure 5. Dynamics of the distance in 6MWT in IPAH and CTEPH subgroups over the period of 36 months of riociguat treatment
48 ЕВРАЗИЙСКИЙ КАРДИОЛОГИЧЕСКИЙ ЖУРНАЛ, 4, 2023
ORIGINAL ARTICLE
RIOCIGUAT THERAPY, A SWITCHING STRATEGY FROM SILDENAFIL IN PATIENTS WITH PH покое и после Т6МХ оставались на прежних уровнях.
У пациентов с ИЛГ и ХТЭЛГ к 36 мес. лечения риоцигуатом по данным ЭхоКГ было выявлено снижение СДЛА (p=0,02 и p=0,03, соответственно); срДЛА (p=0,03 и p=0,01, соответственно); уменьшение БРПЖ (p=0,04) по сравнению с исходными данными, наблюдалось достоверное увеличение FAC ПЖ (p=0,04 и p=0,03, соответственно) (табл. 4).
При сравнении средних дельт между двумя подгруппами пациентов к 36 мес. были выявлены достоверные различия па- раметров ∆БРПЖ (p=0,02) у пациентов подгруппы 1 с ХТЭЛГ в сравнении с соответствующей подгруппой ИЛГ, ∆FAC ПЖ у пациентов обеих групп (p= 0,04 и p=0,03, соответственно) с более высокими значениями средних дельт в подгруппе 1 с ХТЭЛГ. ∆СДЛА и ∆срДЛА к 36 мес. лечения были наибольшими у пациентов с ХТЭЛГ из подгруппы 1. Динамика СДЛА и срДЛА подтверждалась данными КПОС (табл. 5). В подгруппах 1 ∆SvO2у больных с ИЛГ и ХТЭЛГ были существенно больше в сравнении с подгруппами 2.
Таблица 4. Средние дельты показателей ЭхоКГ к 36 мес. по сравнению с исходными значениями
Table 4. Mean delta of Echo parameters at 36 months as compared to baseline
|
Параметры |
Группа ИЛГ |
Группа ХТЭЛГ |
||
|
Подгруппа 1 (n=36) |
Подгруппа 2 (n=16) |
Подгруппа 1 (n=40) |
Подгруппа 2 (n=37) |
|
|
∆ SПП, cм2 |
–2,46 [–3,98; 0,11] |
–1,84 [–2,70; –0,21] |
–3,61 [–5,98; –0,61] |
–2,07 [–3,18; –0,61] |
|
∆ БРПЖ, см |
0,15 [0,02; 0,28] |
0,03 [0,0; 0,35] |
–0,48 [–0,91; –0,23] *# |
0,02 [0,02; 0,25] |
|
∆ TAPSE, см |
0,10 [0,05; 0,64] |
0,13 [0,07; 0,79] |
0,06 [0,02; 0,35] |
0,09 [0,02; 0,35] |
|
∆ дИЭ |
0,14 [0,05; 0,34] |
0,12 [0,03; 0,37] |
0,13 [0,01; 0,28] |
0,12 [0,02; 0,31] |
|
∆ FAC ПЖ,% |
4,6 [2,2; 8,4] * |
3,7 [1,1; 5,6] |
8,2 [5,0; 12,6] *# |
1,0 [0,5; 2,4] |
|
∆ СДЛА, мм рт. ст. |
–8,0 [–14,5; –3,2] |
–6,8 [–9,0; –1,0] |
–15,6 [–21,3; –4,6] *# |
–7,5 [–10,0; 0,6] |
|
∆ срДЛА, мм рт. ст. |
–6,3 [–10,8; –1,2] |
–5,8 [–12,3; –3,6] |
–13,2 [–17,5; –6,6] *# |
–4,5 [–6,5; –1,6] |
Примечание: *p<0,05 – по сравнению с подгруппой переключения (подгруппа 2); # p<0,05 – по сравнению с группой ИЛГ Note: *p<0.05 – compared with the switching subgroup (subgroup 2); # p<0.05 – compared to IPAH group
Группа ИЛГ
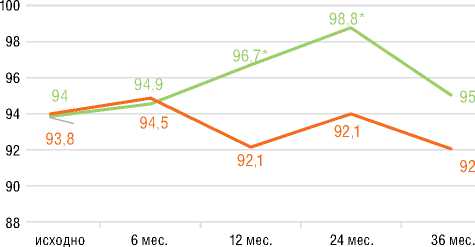
Группа ХТЭЛГ
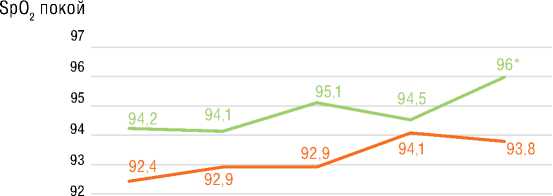
исходно 6 мес. 12 мес. 24 мес. 36 мес.
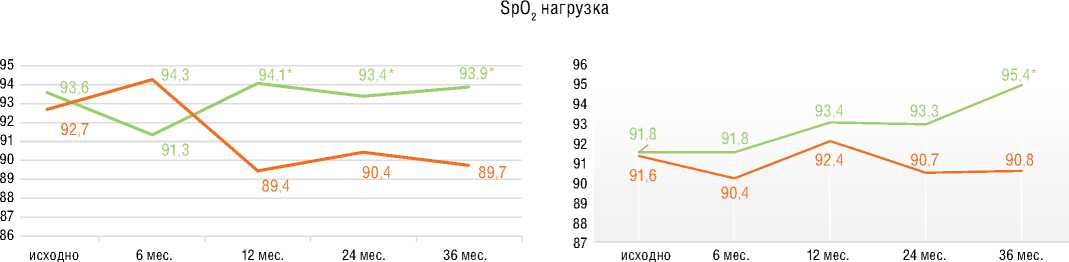
Стартовая терапия
Переключение с ИФДЭ-5
Рисунок 6. Результаты оценки теста 6-минутной ходьбы в подгруппах ИЛГ и ХТЭЛГ за период 36 месячного лечения риоцигуатом
Figure 6. Results of the 6MWT in IPAH and CTEPH subgroups over the period of 36 months of riociguat treatment
EURASIAN HEART JOURNAL, 4, 2023 49
По результатам комплексного анализа показателей клинического, функционального и гемодинамического статуса пациентов было выявлено, что 30% (общая группа ИЛГ): 36% (подгруппа 1) и 24% пациентов (подгруппа 2) находились в зоне высокого риска; 46,7% больных (общая группа ИЛГ): 39,2% (подгруппа 1) и 52% пациентов (подгруппа 2) имели факторы промежуточного риска (рис. 7). 28,2% пациентов с ХТЭЛГ в общей группе (36% (подгруппа 1) и 24% пациентов (подгруппа 2)) при начальной оценке имели высокий риск годичной летальности; 60,9% (общая группа ХТЭЛГ): 39,2% (подгруппа 1) и 52% пациентов (подгруппа 2) – промежуточный риск. Доля пациентов исходно низкого риска оказалась вдвое ниже в группе ХТЭЛГ. Наиболее часто на высокий риск развития летального исхода у пациентов ИЛГ и ХТЭЛГ указывали значения SПП (76,7% и 89,1%, соответственно), СИ (83,5% и 72,5%, соответственно) и SvО2 (73,7% и 79,3%, соответственно).
Доля пациентов низкого риска увеличивалась к 6-, 12- и 24-месячной точкам наблюдения, достигнув 26,7% в группе
ИЛГ и 44,8% в группе ХТЭЛГ к 36 мес. терапии риоцигуатом (рис. 7). Для реализации целей лечения доля пациентов ИЛГ в подгруппе 1 с потребностью в назначении двойной терапии удвоилась к 6 мес. (16,3%) и, в дальнейшем, возрастала до 51,2% и 56% к 24 и 36 мес. соответственно (рис. 8). К 6 мес. 1,8% больных в подгруппе 2 назначалась тройная специфическая терапия, эта доля постепенно возрастала и достигла 16,3% к 36 мес. В подгруппе переключения замена силденафила на риоцигуат приводила к сохранению режимов терапии на протяжении года. Только 6,2% больных к 24-му и 36-му мес. лечения потребовалось назначение 3-го препарата.
Доля пациентов с ХТЭЛГ в подгруппе 1 с потребностью в назначении двойной терапии увеличилась с 6,1% до 20% к 24 мес. наблюдения (рис. 9). Следует подчеркнуть, что в подгруппе 2 переключение с силденафила на риоцигуат в виде монотерапии способствовало реализации целей лечения, что позволило продолжить лечение без изменения схемы на протяжении 36 мес.
Таблица 5. Динамика гемодинамических параметров и SvO 2 на фоне терапии риоцигуатом подгруппах лечения Table 5. Dynamics of hemodynamic parameters and SvO2 with riociguat in the treatment subgroups
|
Данные КПОС |
Стартовая терапия риоцигуатом |
Переключение с ИФДЭ-5 (n=16) |
||
|
6 мес. (n=39) |
36 мес. (n=36) |
6 мес. (n=16) |
36 мес. (n=16) |
|
Группа ИЛГ:
|
∆ СДЛА, мм рт. ст. |
-7,0 [-14,0; -3,0] |
-4,7 [-14,0; -3,0] |
-6,0 [-12,0; 0,0] |
-2,8 [-11,0; 1,0] |
|
∆ срДЛА, мм рт. ст. |
-4,0 [-6,0; 0,0] |
-4,2 [-8,4; -2,0] |
-5,0 [-7,0; -0,5] |
-6,8[-14,0; -3,0] |
|
∆ СИ, л/мин/м2 |
0,3 [0,0; 1,0] |
0,5 [0,2; 0,7] * |
0,4 [0,1; 0,8] |
0,2 [0,0;0,6] |
|
∆ ЛСС, дин 2 с 2 см-5 |
-278,0 [-641,0; 8,0] |
-198,7 [-389,0; 0,0] * |
-170,0 [-605,0; 7,2] |
-75,5 [-245,0; 58,0] |
|
∆ SvO2,% |
4,0 [2,0; 15,0] |
6,4 [1,0; 11,0] * |
2,4 [2,0; 11,0] |
1,7 [-1,0; 6,0] |
|
Группа ХТЭЛГ: |
||||
|
∆ СДЛА, мм рт. ст. |
-11,0 [-17,5; -2,5] |
-18,5 [-24,0; -4,5] *# |
-8,5 [-11,0; -4,5] |
-6,4 [-13,0; -2,6] |
|
∆ срДЛА, мм рт. ст. |
-8,5 [-11,0; -4,5] |
-14,5 [-19,0; -5,2] *# |
-6,8 [-10,5; -2,5] |
-8,0 [-6,5; -2,9] |
|
∆ СИ, л/мин/м2 |
0,4 [0,0; 0,7] |
0,6 [0,3; 1,1] * |
0,3 [0,0; 0,5] |
0,2 [0,0; 0,4] |
|
∆ ЛСС, дин 2 с 2 см-5 |
-311,0 [-608,5; -10,0] |
-460,5 [-615,5; -25,0] *# |
-190,0 [-675,5; 5,0] |
-215,5 [-708,5; -32,5] |
|
∆ SvO2,% |
4,5 [3,0; 11,5] |
8,0 [0,0; 12,5] * |
4,0 [2,0; 15,0] |
3,2 [1,0;9,5] |
Список литературы Результаты длительной терапии риоцигуатом, включая стратегию переключения с силденафила, у пациентов с легочной гипертензией различного генеза
- Чазова И.Е., Мартынюк Т.В., Валиева З.С. и соавт. Евразийские клинические рекомендации по диагностике и лечению легочной гипертензии (2019). Евразийский Кардиологический Журнал. 2020;1:78-122. [Chazova I.E., Martynyuk T.V., Valieva Z.S., et al. Eurasian clinical guidelines on diagnosis and treatment of pulmonary hypertension. Eurasian heart journal. 2020;(1):78-122. (In Russ.)]. https://doi.org/10.38109/2225-1685-2020-1-78-122
- Авдеев С.Н., Барбараш О.Л., Баутин А.Е. и соавт. Легочная гипертензия, в том числе хроническая тромбоэмболическая легочная гипертензия. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(12):4683. [Avdeev S.N., Barbarash O.L., Bautin A.E., et al. 2020 Clinical practice guidelines for Pulmonary hypertension, including chronic thromboembolic pulmonary hypertension. Russian Journal of Cardiology. 2021;26(12):4683. (In Russ.)]. https://doi.org/10.15829/1560-4071-2021-4683
- Чазова И.Е., Мартынюк Т.В., Валиева З.С., др. Евразийские рекомендации по диагностике и лечению хронической тромбоэмболической легочной гипертензии (2020). Евразийский Кардиологический Журнал. 2021;1:6-43. [Chazova I.E., Martynyuk T.V., Valieva Z.S., et al. Eurasian Association of Cardiology (EAC) guidelines for the diagnosis and treatment of chronic thromboembolic pulmonary hypertension (2020). Eurasian heart journal. 2021;(1):6-43. (In Russ.)]. https://doi.org/10.38109/2225-1685-2021-1-6-43
- Хроническая тромбоэмболическая легочная гипертензия: Руководство для врачей/ Под ред. Т.В. Мартынюк, акад. РАН И.Е. Чазовой. — Москва: ООО «Медицинское информационное агентство», 2023. 416 с. [Chronic thromboembolic pulmonary hypertension: A guide for doctors/ Ed. T.V. Martynyuk, acad. RAS I.E. Chazova. — Moscow: Medical Information Agency LLC, 2023. 416 p. (in Russ.)]. ISBN 978-5-907098-61-9
- Schermuly RT, Stasch JP, Pullamsetti SS et al. Expression and function of soluble guanylate cyclase in pulmonary arterial hypertension. Eur Respir J 2008;32:881-891. https://doi.org/10.1183/09031936.00114407
- Giaid A, Saleh D. Reduced expression of endothelial nitric oxide synthase in the lungs of patients with pulmonary hypertension. N Engl J Med 1995;333:214-221. https://doi.org/10.1056/NEJM199507273330403
- Galie N., Humbert M., Vachiery J.L, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS). Eur Respir J. 2015;46(4):903-975. https://doi.org/10.1183/13993003.01032-2015
- Мартынюк Т.В. Легочная гипертензия: диагностика и лечение. Москва, 2018. Серия Библиотека ФГБУ «НМИЦ кардиологии» Минздрава России. [Martynyuk T.V. Pulmonary hypertension: diagnosis and treatment. Moscow, 2018. Series Library of the National Medical Research Center of Cardiology (in Russ.)].
- Hoeper MM, Simonneau G, Corris PA, et al. RESPITE: switching to riociguat in pulmonary arterial hypertension patients with inadequate response to phosphodiesterase-5 inhibitors. Eur Respir J. 2017;50(3):1602425. https://doi.org/10.1183/13993003.02425-2016
- Taran IN, Belevskaya AA, Saidova MA, et al. Initial Riociguat Monotherapy and Transition from Sildenafil to Riociguat in Patients with Idiopathic Pulmonary Arterial Hypertension: Influence on Right Heart Remodeling and Right Ventricular-Pulmonary Arterial Coupling. Lung. 2018;196(6):745-753. https://doi.org/10.1007/s00408-018-0160-4
- Ghofrani HA, Galiè N, Grimminger F, et al. Riociguat for the treatment of pulmonary arterial hypertension. N Engl J Med. 2013;369(4):330-40. https://doi.org/10.1056/NEJMoa1209655
- Ghofrani HA, D’Armini A.M., Grimminger F, et al. Riociguat for the Treatment of Chronic Thromboembolic Pulmonary Hypertension. N Engl J Med. 2013;369:319-329. https://doi.org/10.1056/NEJMoa1209657
- Hoeper MM, Al-Hiti H, Benza RL, et al. Switching to riociguat versus maintenance therapy with phosphodiesterase-5 inhibitors in patients with pulmonary arterial hypertension (REPLACE): a multicentre, openlabel, randomised controlled trial. Lancet Respir Med. 2021;9(6):573-584. https://doi.org/10.1016/S2213-2600(20)30532-4
- Nagueh SF, Middleton KJ, Kopelen HA, et al. Doppler tissue imaging: a noninvasive technique for evaluation of left ventricular relaxation and estimation of filling pressures. J Am Coll Cardiol 1997;30(6):1527-1533. https://doi.org/10.1016/s0735-1097(97)00344-6
- Мартынюк Т.В., Шмальц А.А., Горбачевский С.В., Чазова И.Е. Оптимизация специфической терапии легочной гипертензии: возможности риоцигуата. Терапевтический архив. 2021;93(9):1117-1124. [Martynyuk T.V., Shmalts A.A., Gorbachevsky S.V., Chazova I.E. Optimization of specific therapy for pulmonary hypertension: the possibilities of riociguat. Terapevticheskii arkhiv. 2021;93(9):1117- 1124. (in Russ.)]. https://doi.org/10.26442/00403660.2021.09.201014
- Simonneau G., D’Armini A.M., Ghofrani H.A., et al. Riociguat for the treatment of chronic thromboembolic pulmonary hypertension: a longterm extension study (CHEST-2). Eur Respir J 2015;45(5):1293-1302. https://doi.org/10.1183/09031936.00087114
- Rubin LJ, Galiè N, Grimminger F, et al. Riociguat for the treatment of pul monary arterial hypertension: a long-term extension study (PATENT-2). Eur Respir J. 2015;45(5):1303-1313. https://doi.org/10.1183/09031936.00090614
- Delcroix M, Staehler G, Gall H, et al. Risk assessment in medically treated chronic thromboembolic pulmonary hypertension patients. Eur Respir J. 2018;521800248. https://doi.org/10.1183/13993003.00248-2018
- Ghofrani HA, Grimminger F, Grünig E, et al. Predictors of long-term outcomes in patients treated with riociguat for pulmonary arterial hypertension: data from the PATENT-2 open-label, randomised, longterm extension trial. Lancet Respir Med. 2016;4:361-371. https://doi.org/10.1016/S2213-2600(16)30019-4
- Hoeper MM, Gomez Sanchez M-А, Humbert M, et al. Riociguat treatment in patients with pulmonary arterial hypertension: Final safety data from the EXPERT registry. Respir Med. 2021;177:106241. https://doi.org/10.1016/j.rmed.2020.106241
- Sood N, Aranda A, Platt D, et al. Riociguat improves health-related quality of life for patients with pulmonary arterial hypertension: results from the phase 4 MOTION study. Pulm Circ. 2019;9(1):2045894018823715. https://doi.org/10.1177/2045894018823715
- Yang S., Yang Y., Zhang Y. et al. Haemodynamic effects of riociguat in CTEPH and PAH: a 10-year observational study. ERJ Open Res. 2021;7:00082. https://doi.org/10.1183/23120541.000822021
- Kambakamba A., Tello K., Axmann J., et al. Acute hemodynamic effects of riociguat in pulmonary arterial hypertension and chronic thromboembolic pulmonary hypertension. Eur Respir J. 2018;52:PA3049. https://doi.org/10.1183/13993003.congress-2018.PA3049
- C-H. Tsai, C-Kю Wu, P-H. Kuo, et al. Riociguat Improves Pulmonary Hemodynamics in Patients with Inoperable Chronic Thromboembolic Pulmonary Hypertension. Acta Cardiol Sin. 2020 Jan;36(1):64–71. https://doi.org/10.6515/ACS.202001_36(1).20190612A
- Halank M., Hoeper MM, Ghofrani H-A, et al. Riociguat for pulmonary arterial hypertension and chronic thromboembolic pulmonary hypertension: Results from a phase II long-term extension study. Respir Med. 2017;128:50-56. https://doi.org/10.1016/j.rmed.2017.05.008


