Результаты хирургического лечения пациентов с ИБС и диффузным поражением коронарного русла
Автор: Шевченко Ю.Л., Катков А.А., Ермаков Д.Ю., Ульбашев Д.С., Вахрамеева А.Ю.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Редакционные статьи
Статья в выпуске: 3 т.19, 2024 года.
Бесплатный доступ
За последние десятилетия увеличилось количество пациентов с ИБС и диффузным поражением венечного русла, результаты реваскуляризации которых остаются неудовлетворительными, а риск повторных вмешательств и послеоперационных осложнений - высоким. В некоторых случаях таких больных относят к группе неоперабельных, а медикаментозная терапия для них неэффективна. Именно для таких пациентов разработан и внедрен в клиническую практику метод стимуляции экстракардиального неоангиогенеза, позволяющий повысить эффективность хирургического лечения. Проведена сравнительная оценка результатов различных методов реваскуляризации миокарда у пациентов с диффузным поражением коронарного русла.Цель: сравнение эффективности и безопасности стандартной хирургической и эндоваскулярной коррекции поражений коронарных артерий, а также комплексной реваскуляризации миокарда (шунтирования и чрескожного коронарного вмешательства, дополненных методикой «ЮрЛеон») у пациентов с диффузным венечным атеросклерозом.Материалы и методы. В исследование включено 133 пациента с ИБС и диффузным поражением коронарного русла, которым проведено лечение в Клинике грудной и сердечно-сосудистой хирургии им. Св. Георгия НМХЦ им. Н.И. Пирогова с 2011 по 2024 гг. I - больные, которым выполнялось коронарное шунтирование (n = 35); II - эндоваскулярная коррекция нарушений коронарного кровотока (n = 33); III - больные, которым коронарное шунтирование дополнялось методикой стимуляции экстракардиального неоангиогенеза (n = 37); IV - пациенты, которым чрескожное коронарное вмешательство дополнялось миниинвазивной процедурой «ЮрЛеон» (n = 28). По клинической и ангиографической характеристике больные между собой статистически значимо не отличались. Оценивались клинические данные, показатели эхокардиографии, степень поражения венечного русла, осложнения после операции, случаи больших неблагоприятных сердечно-сосудистых и цереброваскулярных событий (MACCE), общая выживаемость.Результаты. Средний период наблюдения составил 41,8±25,9 месяцев. Группы отличались по частоте повторной эндоваскулярной реваскуляризации (повторное коронарное шунтирование не проводилось) (p = 0,013): в I группе (34,3%) отмечалась чаще, чем в III (13,5%) (p = 0,04); была самой высокой во II группе (42,4%) пациентов, что статистически значимо выше, чем в IV (17,9%) (p = 0,041). Исследование показало, что число случаев MACCE статистически значимо отличалось в разных группах пациентов. После комплексной реваскуляризации количество таких наблюдений уменьшилось по сравнению с изолированным выполнением КШ или ЧКВ (p = 0,0004), во II группе показатель был самый высокий (84,8%). При этом отмечалась тенденция к более высокой выживаемости больных в III и IV группах.Заключение. Комплексная реваскуляризация миокарда у пациентов с ИБС и диффузным поражением коронарного русла является эффективной и безопасной процедурой. Новый гибридный подход, сочетающий в себе чрескожное коронарное вмешательство под контролем внутрисосудистых методов исследования и миниинвазивное выполнение методики «ЮрЛеон», позволяет расширить возможности лечения пациентов, которые ранее считались неоперабельными
ID: 140307880 Короткий адрес: https://sciup.org/140307880
Текст ред. заметки Результаты хирургического лечения пациентов с ИБС и диффузным поражением коронарного русла
В последние десятилетия увеличилось количество больных ИБС с диффузным поражением венечного русла [1; 2]. Как правило, это пожилые, полиморбидные пациенты, с высоким функциональным классом (ФК) стенокардии, рефрактерной к медикаментозной терапии [3]. В настоящее время выбор наилучшей стратегии лечения таких больных представляет собой серьезную проблему, так как тяжелое диффузное поражение коронарного русла является независимым предиктором как ранних, так и отдаленных послеоперационных осложнений [3–6]
Анатомические и функциональные особенности состояния венечных артерий, выраженный кальциноз, малый диаметр сосудов, их тандемное и диффузное поражение, локализация стенозов в дистальных отделах венечного русла ограничивают возможности эндоваскулярной реваскуляризации миокарда, полный объем шунтирования становится крайне маловероятным, а медикаментозное лечение неэффективным [7–9]. При определении наилучшей стратегии лечения необходимо учитывать адекватное соотношение риска и пользы, однако безопасность и эффективность различных методов реваскуляризации у таких больных остаются до конца неизученными [2].
С целью улучшения результатов лечения пациентов с диффузным поражением коронарного русла академиком РАН Ю.Л. Шевченко в дополнение к прямой реваскуляризации разработана и внедрена в клиническую практику методика хирургической стимуляции экстракардиально-го неоангиогенеза – «ЮрЛеон» ( Патент на изобретение RU №2758024С1. Заявка № 2021105731 ).
Продемонстрированы сравнительные результаты изолированного выполнения шунтирования и чрескожного коронарного вмешательства (ЧКВ), а также комплексной реваскуляризации миокарда у пациентов с диффузным поражением венечного русла.
Материал и методы
В проспективное, рандомизированное исследование включены данные 133 пациентов с ИБС, которые находились на лечении в Клинике грудной и сердечно-сосудистой хирургии имени Святого Георгия ФГБУ «НМХЦ им. Н.И. Пирогова» с 2011 по 2024 гг.
Критерии включения:
-
• клинические проявления ИБС III–IV ФК;
-
• резистентность к оптимальной медикаментозной терапии;
-
• отсутствие гемодинамически значимой патологии клапанного аппарата сердца;
-
• диффузное атеросклеротическое поражение коронарных артерий (задействовано два и более сегмента одной магистральной артерии, общей протяженностью поражения более 50% всей длины сосуда при наличии гемодинамически значимого сужения просвета и малым диаметром дистального русла – менее 2 мм);
-
• фракция выброса левого желудочка (ФВ ЛЖ) менее 50%.
Критерии невключения:
-
• аневризма ЛЖ;
-
• необходимость кардиальной ресинхронизирующей терапии;
-
• почечная и печеночная недостаточность;
-
• наличие тромбоза ЛЖ или предсердия;
-
• гемодинамически значимая патология клапанного аппарата сердца;
-
• наличие онкозаболеваний.
Пациенты разделены на группы изолированной прямой реваскуляризации: I – больные, которым выполнялось коронарное шунтирование (КШ) (n = 35); II – эндоваскулярная коррекция нарушений коронарного кровотока (n = 33); группы комплексной реваскуляризации: III – больные, которым КШ дополнялось методикой стимуляции экстракардиального неоангиогенеза (n = 37); IV – пациенты, которым ЧКВ дополнялось миниинвазив-ной процедурой «ЮрЛеон» (n = 28). Отбор больных для комплексной реваскуляризации происходил с помощью рандомизации (генератор случайных чисел) при поступлении. По клинической и ангиографической характеристике пациенты всех групп между собой статистически значимо не отличались (p>0,05) (Табл. 1, 2).
Средний возраст пациентов составил 61,35±7,4 лет; среди всех больных преобладал мужской пол (73,7%), III ФК стенокардии напряжения (78,9%) и II ФК ХСН по NYHA (57,9%).
При первичной коронарографии у пациентов было выявлено 120±10 значимых стенозов в I–IV группах. Большинство больных имели трехсосудистое поражение венечного русла – в 61% наблюдений. У всех пациентов было отмечено значимое поражение передней нисходящей артерии или ствола левой коронарной артерии. Преобладал правый тип коронарного кровоснабжения – в 77,4% случаях (Табл. 2).
Все пациенты дали согласие на включение в исследование, которое проведено в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации. Проведение исследования одобрено этическим комитетом ФГБУ «НМХЦ им. Н.И. Пирогова» Минздрава России.
На дооперационном этапе оценивались клинические данные, показатели эхокардиографии, выполнялась селективная многопроекционная коронароангиография по стандартному протоколу с оценкой полученных результатов двумя независимыми специалистами.
КШ проводилось по стандартной методике через стернотомный доступ с использованием аппарата искусственного кровообращения или на работающем сердце. У большинства больных для шунтирования ПНА использовалась внутренняя грудная артерия, для шунтирования других коронарных магистралей – большая или малая подкожные вены.
При проведении ЧКВ применяли инвазивные визуализирующие методы (внутрисосудистое УЗИ) для оценки
Табл. 1. Клиническая характеристика больных
|
Критерий |
I группа (n = 35) |
II группа (n = 33) |
III группа (n = 37) |
IV группа (n = 28) |
p |
|
|
Возраст, годы (M±SD) |
60,5±9,5 |
63,4±8,0 |
59,8±7,6 |
61,7±4,5 |
>0,05 |
|
|
Мужской пол, n (%) |
26 (74,3) |
24 (72,7) |
28 (75,7) |
20 (71,4) |
>0,05 |
|
|
Хроническая обструктивная болезнь легких (ХОБЛ), n (%) |
8 (22,9) |
7 (21,2) |
9 (24,3) |
7 (25,0) |
>0,05 |
|
|
Курение, n (%) |
21 (60,0) |
19 (57,6) |
22 (59,4) |
17 (60,7) |
>0,05 |
|
|
Сахарный диабет 2 типа, n (%) |
21 (60,0) |
23 (69,7) |
24 (64,9) |
19 (67,8) |
>0,05 |
|
|
ФВ ЛЖ (M±SD, %) |
45,1±4,7 |
42,8±5,6 |
43,5±4,8 |
44,2±6,0 |
>0,05 |
|
|
Артериальная гипертензия, n (%) |
24 (68,6) |
26 (78,8) |
22 (70,3) |
20 (71,4) |
>0,05 |
|
|
Острое нарушение мозгового кровообращения (ОНМК) в анамнезе, n (%) |
2 (5,7) |
3 (9,1) |
3 (8,1) |
2 (7,1) |
>0,05 |
|
|
Острый инфаркт миокарда (ОИМ) в анамнезе, n (%) |
29 (82,9) |
28 (84,8) |
31 (83,7) |
25 (89,3) |
>0,05 |
|
|
ФК стенокардии напряжения |
III, n (%) |
28 (80,0) |
24 (72,7) |
28 (75,7) |
22 (78,6) |
>0,05 |
|
IV, n (%) |
7 (20,0) |
9 (27,3) |
9 (24,3) |
6 (24,4) |
>0,05 |
|
|
ФК ХСН по NYHA |
I, n (%) |
3 (8,6) |
4 (12,1) |
2 (5,4) |
3 (10,7) |
>0,05 |
|
II, n (%) |
22 (62,8) |
18 (54,5) |
22 (59,5) |
15 (53,6) |
>0,05 |
|
|
III, n (%) |
9 (25,7) |
10 (30,3) |
11 (29,7) |
9 (32,1) |
>0,05 |
|
|
IV, n (%) |
1 (2,9) |
1 (3,1) |
2 (5,4) |
1 (3,6) |
>0,05 |
|
Табл. 2. Ангиографическая характеристика больных
|
Критерий |
I группа (n = 35) |
II группа (n = 33) |
III группа (n = 37) |
IV группа (n = 28) |
p |
|
|
Поражений КА, всего, n |
115 |
122 |
138 |
105 |
>0,05 |
|
|
Кол-во бассейнов коронарного русла со значимым стенозированием |
1, n (%) |
1 (2,9) |
3 (9,1) |
1 (2,7) |
3 (10,7) |
>0,05 |
|
2, n (%) |
12 (34,3) |
11 (33,3) |
13 (35,1) |
8 (28,6) |
>0,05 |
|
|
3, n (%) |
22 (62,8) |
19 (57,6) |
23 (62,2) |
17 (60,7) |
>0,05 |
|
|
Локализация поражения венечного русла |
||||||
|
Ствол левой коронарной артерии (ЛКА), n (%) |
5 (14,3) |
4 (12,1) |
6 (16,2) |
4 (14,3) |
>0,05 |
|
|
Система передней нисходящей артерии (ПНА), n (%) |
35 (100) |
33 (100) |
37 (100) |
28 (100) |
>0,05 |
|
|
Система огибающей артерии (ОА), n (%) |
24 (68,6) |
23 (69,7) |
27 (72,9) |
21 (75,0) |
>0,05 |
|
|
Система правой коронарной артерии (ПКА), n (%) |
26 (74,3) |
22 (66,7) |
26 (70,3) |
19 (67,9) |
>0,05 |
|
|
Правый тип коронарного кровоснабжения, n (%) |
28 (80,0) |
25 (75,8) |
29 (78,4) |
21 (75,0) |
>0,05 |
|
протяженности поражения, выбора зоны имплантации стента, их размеров и контроля результатов операции. Эндоваскулярное лечение проводилось пациентам при официальном коллегиальном отказе в выполнении КШ, либо при отказе больного от открытой хирургической реваскуляризации.
Комплексная реваскуляризация миокарада у пациентов III группы предполагала проведение КШ по стандартному протоколу и дополнение его методикой стимуляции экстракардиальной васкуляризации миокарда «ЮрЛеон», которая включала абразивную обработку перикарда и эпикарда специальной перчаткой с целью их десквамации; формирование медиастинального жирового лоскута с субтотальной перикардэктомией и фиксацией его на поверхности сердца; а также введение через дополнительный перикардиальный дренаж в послеоперационном периоде дренажного стерильного аспирата (50–80 мл), содержащего факторы стимуляции неоангиогенеза.
В IV группе пациентам первым этапом выполняли ЧКВ в бассейне пораженного коронарного русла. Вторым этапом – методику «ЮрЛеон» из левосторонней миниторакотомии, которую проводили через разрез кожи длиной
7–10 см, на 6–8 см латеральнее средней линии, как правило, в 5 межреберье; затем, тупым и острым путем, без использования электрокоагулятора формировали медиастинальный жировой лоскут с субтотальной перикардэк-томией, после чего выполнялись абразивная обработка перикарда и эпикарда, фиксация жирового лоскута на поверхности сердца с установкой в оставшуюся заднюю часть перикардиальной полости дренажа, дренирование плевральной полости и закрытие раны. На 2–3 сутки удаляли плевральный дренаж и вводили в оставшуюся перикардиальную полость через специальный дренаж стерильный аспират, подготовленный по оригинальной методике, с большим количеством факторов стимуляции неоангиогенеза.
В отдаленном послеоперационном периоде оценивалось клиническое состояние пациентов, случаи больших неблагоприятных сердечно-сосудистых и цереброваскулярных событий (Major adverse cardiovascular and cerebrovascular events – MACCE), общая выживаемость.
Статистический анализ
Статистические расчеты проведены в программе Statistica 12 (StatSoft, США). Оценено соответствие данных
нормальному распределению (критерии Шапиро-Уилка, Колмогорова-Смирнова). Показатели описательной статистики включали: число наблюдений (n), среднее значение (М), стандартное отклонение (SD), медиану (Ме). При распределении, близком к нормальному, для нескольких групп использован однофакторный дисперсионный анализ. В случаях, когда распределение отличалось от нормального, анализ выполнялся с помощью непараметрических критериев: U-критерия Краскела-Уоллиса для независимых нескольких выборок, U-критерия Манна-Уитни для сравнения между двумя выборками. Различия считали статистически значимыми при p<0,05. Результаты выявления больших неблагоприятных сердечно-сосудистых и цереброваскулярных событий (MACСE), выживаемость пациентов были проанализированы с использованием метода Каплана-Мейера, график оценки представлял ступенчатую линию, значения функции между точками наблюдений считались константами.
Результаты исследования
Всем пациентам I и III групп выполнено шунтирование ПНА, из них 33 (94,3%) пациентам I группы и 36 (97,3%) больным III группы проведено маммарокоронарное шунтирование. Всего аутовенозных шунтов было создано: 56 из 89 (62,9%) в I группе и 58 из 94 (61,7%) в III группе (p>0,05). У большинства пациентов было сформировано 3 дистальных анастомоза: 21 (60,0%) в I группе и 23 (62,2%) в III группе (p>0,05). По основным параметрам оперативного вмешательства пациенты обеих групп между собой статистически значимо не отличались. У 1 (2,9%) больного в I группе после операции развилось послеоперационное кровотечение, потребовавшее экстренной операции в объеме рестернотомии и остановки кровотечения, у 1 (2,7%) пациента в III группе развился послеоперационный инфаркт миокарда (Табл. 3).
При ЧКВ было скорректировано 105 из 122 (86,1%) поражений КА во II группе и 90 из 105 (85,7%) – в IV группе, имплантировано 155 стентов во II группе и 141 – в IV группе (p>0,05). Длина стентированного участка и средний диаметр стентов статистически значимо не различались. 1 (3,0%) больной во II группе перенес ЧКВ-ассоциированный ОИМ (Табл. 4).
Средний период наблюдения после оперативного вмешательства составил 41,8±25,9 месяцев. Частота повторной эндоваскулярной реваскуляризации (повторное КШ не проводилось) была самой высокой во II группе – 42,4% пациентов, что статистически значимо выше, чем в IV группе – 17,9% (p = 0,041). Повторная реваскуляризация в I группе (34,3%) отмечалась чаще, чем в III группе (13,5%) (p = 0,04).
Статистически значимых отличий в частоте регистрации ОИМ, ОНМК, смерти от сердечно-сосудистых причин выявлено не было, однако пациенты III и IV группы демонстрировали меньший удельный вес данных осложнений. Группы комплексной реваскуляризации показали статистически значимо меньшее
Табл. 3. Периоперационная характеристика групп пациентов, которым выполнялось КШ
|
Критерий |
I группа (n = 35) |
III группа (n = 37) |
p |
|
Всего шунтов |
89 |
94 |
>0,05 |
|
Аутоартериальных шунтов, n (%) |
33 из 89 (37,1) |
36 из 94 (38,3) |
>0,05 |
|
Аутовенозных шунтов, n (%) |
56 из 89 (62,9) |
58 из 94 (61,7) |
>0,05 |
|
Продолжительность оперативного вмешательства, мин. (M±SD) |
269,5±64,9 |
280,1±57,6 |
>0,05 |
|
Использование аппарата искусственного кровообращения, n (%) |
9 (25,7) |
11 (29,7) |
>0,05 |
|
Инотропная поддержка, n (%) |
6 (17,1) |
5 (13,5) |
>0,05 |
|
Интраоперационная кровопотеря, мл (M±SD) |
360,5±51,4 |
357,2±58,1 |
>0,05 |
|
Осложнения |
|||
|
Послеоперационное кровотечение, n (%) |
1 (2,9) |
0 |
>0,05 |
|
Периоперационный ОИМ, n (%) |
0 |
1 (2,7) |
>0,05 |
|
ОНМК, n (%) |
0 |
0 |
>0,05 |
|
Послеоперационная летальность, n (%) |
0 |
0 |
>0,05 |
|
Послеоперационный койко-день, (M±SD) |
9,8±4,52 |
9,2±4,31 |
>0,05 |
Табл. 4. Периоперационная характеристика групп пациентов, которым выполнялось ЧКВ
Обсуждение
Проблема выбора оптимальной тактики реваскуляризации миокарда у пациентов с ИБС и диффузным
Табл. 5. 5-летние результаты лечения пациентов
|
Критерий |
I группа (n = 35) |
II группа (n = 33) |
III группа (n = 37) |
IV группа (n = 28) |
p |
|
Повторная реваскуляризация, n (%) |
12 (34,3)* |
14(42,4)** |
5 (13,5)* |
5 (17,9)** |
0,013 |
|
ОИМ, n (%) |
5 (14,3) |
4 (12,1) |
3 (8,1) |
5 (17,9) |
0,69 |
|
ОНМК, n (%) |
1 (2,9) |
2 (6,1) |
1 (2,7) |
1 (3,6) |
0,87 |
|
Сердечнососудистая смерть, n (%) |
7 (20,0) |
8 (24,2) |
5 (13,5) |
5 (17,9) |
0,72 |
|
MACСE, n (%) |
25 (71,4)* |
28 (84,8)** |
14 (37,8)* |
16 (57,1)** |
0,0004 |
|
Смерть от всех причин, n (%) |
10 (28,6) |
12 (36,4) |
7 (18,9) |
6 (21,4) |
0,36 |
Примечание : *, ** – статистически значимые различия, критерий Манна-Уитни при p<0,05.
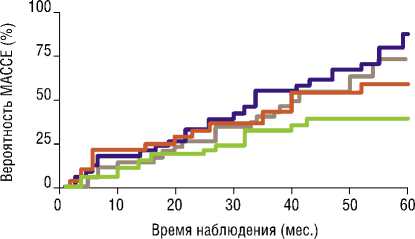
— Группа! — Группа!! — Группа III ^—Группа IV
Рис. 1. Неблагоприятные сердечно-сосудистые и цереброваскулярные события (кривые Каплана-Майера).
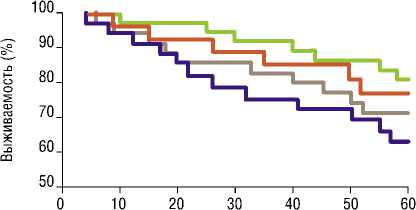
Время наблюдения (мес.)
^— Группа I ^— Группа II — Группа III ^— Группа IV
Рис. 2. Выживаемость пациентов (кривые Каплана-Майера).
поражением коронарного русла остается все еще актуальной [10]. Существуют различные методы лечения таких больных, каждый из которых имеет свои преимущества и недостатки. Так, коронарная эндартероэктомия в некоторых случаях позволяет получить удовлетворительные результаты там, где невозможно проведение полной реваскуляризации [11], однако эта методика связана с высоким риском развития инфаркта миокарда в периоперационном периоде, поэтому не может быть рекомендована повсеместно [12]. До сих пор нет единого мнения о результатах использования трансмиокардиальной лазерной реваскуляризации (ТМЛР), а качество доказательств ее эффективности считается невысоким [13–15]. Использование миниинвазивного КШ для выполнения неполного объема реваскуляризации у пациентов с диффузным и многососудистым поражением коронарного русла помогает избежать серьезного хирургического вмешательства, но связано с частыми повторными операциями и серьезными сердечно-сосудистыми осложнениями [16]. Так же и эндоваскулярное лечение у этой группы пациентов ассоциировано с высокой частотой повторных ЧКВ, выполняемых по поводу рецидивирующей ишемии миокарда, возникающей в отдаленные сроки наблюдения [17].
Мета-анализ, проведенный Meier P. и его коллегами, включал 12 исследований с участием 6529 пациентов. Они пришли к выводу, что развитые коллатерали играют важную защитную роль, снижая риск летального исхода. У пациентов с хорошо развитой внутрисердечной и экс-тракардиальной коллатеральной сетью риск смерти был меньше на 36% по сравнению с контрольной группой [18].
Внедрение в клиническую практику методов хирургической стимуляции экстракардиальной васкуляризации миокарда позволило значительно расширить возможности лечения пациентов с ИБС и диффузным многососудистым поражением коронарного русла [19; 20].
В нашем исследовании КШ и ЧКВ, дополненные методикой «ЮрЛеон», демонстрировали лучшие отдаленные результаты: улучшение клинического состояния больных, значимое уменьшение количества основных сердечно-сосудистых, цереброваскулярных осложнений (MACСE) и увеличение уровня выживаемости в отдаленном периоде после операции по сравнению с контрольными группами. При этом отмечалось, что снижался риск повторных реваскуляризаций в группе ЧКВ+ЮрЛеон по сравнению с группой изолированного эндоваскулярного лечения. Все это демонстрировало эффективность состоявшегося экстракардиальной васкуляризации миокарда.
Ограничением данного исследования является небольшое количество больных с оценкой результатов в разные отдаленные сроки после операции.
Заключение
Накопленный опыт проведения комплексной реваскуляризации миокарда у пациентов с ИБС и диффузным поражением коронарного русла позволяет сделать вывод об эффективности и безопасности данной процедуры. В настоящее время отсутствуют какие-либо сложности, которые могли бы ограничить возможности хирурга в дополнении КШ методикой стимуляции экстракар-диальной васкуляризации сердца, а представленный новый гибридный подход к лечению пациентов с ИБС, объединяющий ЧКВ под контролем внутрисосудистых методов исследования и миниинвазивного выполнения
методики ЮрЛеон, расширяет возможности лечения пациентов, которые до недавнего времени признавались инкурабельными.
Список литературы Результаты хирургического лечения пациентов с ИБС и диффузным поражением коронарного русла
- Brown RA, Shantsila E, Varma C, Lip GY. Epidemiology and pathogenesis of diffuse obstructive coronary artery disease: the role of arterial stiffness, shear stress, monocyte subsets and circulating mircoparticles. Ann Med. 2016; 48(6): 444-455. doi: 10.1080/07853890.2016.1190861.
- Курбанов С.К., Власова Э.Е., Акчурин Р.С. и др. Госпитальные и годичные результаты коронарного шунтирования при диффузном поражении коронарных артерий // Кардиологический вестник. – 2019. – №14(1). – С.60-66.
- Шевченко Ю.Л., Борщев Г.Г. Экстракардиальная реваскуляризация миокарда у больных ИБС с диффузным поражением коронарного русла. – М.: Издательство НМХЦ им. Н.И. Пирогова, 2022.
- McNeil M, Buth K, Brydie A, et al. The impact of diffuseness of coronary artery disease on the outcomes of patients undergoing primary and reoperative coronary artery bypass grafting. Eur J Cardiothorac Surg. 2007; 31(5): 827-33. doi: 10.1016/j.ejcts.2006.12.033.
- Lozano I, Capin E, de la Hera JM, et al. Diffuse Coronary Artery Disease Not Amenable to Revascularization: Long-term Prognosis. Rev Esp Cardiol (Engl Ed). 2015; 68(7): 631-3. doi:10.1016/j.rec.2015.02.013.
- Dourado LOC, Pereira AC, Poppi NT, et al. The Role of the Heart Team in Patients with Diffuse Coronary Artery Disease Undergoing Coronary Artery Bypass Grafting. Thorac Cardiovasc Surg. 2021; 69(7): 584-591. doi: 10.1055/s-0040-1718936.
- Dourado LOC, Bittencourt MS, Pereira AC, et al. Coronary Artery Bypass Surgery in Diffuse Advanced Coronary Artery Disease: 1-Year Clinical and Angiographic Results. Thorac Cardiovasc Surg. 2018; 66(6): 477-482. doi: 10.1055/s-0037-1601306.
- Mizukami T, Sonck J, Sakai K, et al. Procedural Outcomes After Percutaneous Coronary Interventions in Focal and Diffuse Coronary Artery Disease. J Am Heart Assoc. 2022; 11(23): e026960. doi: 10.1161/JAHA.122.026960.
- Акчурин Р.С., Ширяев А.А., Васильев В.П. и др. Современные тенденции в коронарной хирургии // Патология кровообращения и кардиохирургия. – 2017. – №21(3S). – С.34-44.
- Боливоги Ж.М., Максимкин Д.А., Файбушевич А.Г. и др. Возможности повышения эффективности чрескожных коронарных вмешательств у больных ишемической болезнью сердца с диффузным многососудистым поражением коронарного русла // Креативная кардиология. – 2021. – №15(4). – С.482-95. doi: 10.24022/1997-3187-2021-15-4-482-495.
- Ширяев А.А., Акчурин Р.С., Васильев В.П. и др. Годовые результаты коронарного шунтирования у пациентов с диффузным поражением коронарных артерий // Кардиология и сердечно-сосудистая хирургия. – 2021. – №14(5). – С.413 419. doi: 10.17116/kardio202114051413.
- Heo W, Min HK, Kang DK, et al. Long Segmental Reconstruction of Diffusely Diseased Left Anterior Descending Coronary Artery Using Left Internal Thoracic Artery with Extensive Endarterectomy. Korean J Thorac Cardiovasc Surg. 2015; 48(4): 285-288. doi: 10.5090/kjtcs.2015.48.4.285.
- Briones E, Lacalle JR, Marin-Leon I, et al. Transmyocardial laser revascularization versus medical therapy for refractory angina. Cochrane Database Syst Rev. 2015; 2015(2): CD003712. doi: 10.1002/14651858.CD003712.pub3.
- Iwanski J, Knapp SM, Avery R, et al. Clinical outcomes meta-analysis: measuring subendocardial perfusion and efficacy of transmyocardial laser revascularization with nuclear imaging. J Cardiothorac Surg. 2017; 12(1): 37. doi: 10.1186/s13019-017-0602-8.
- Tasse J, Arora R. Transmyocardial revascularization: peril and potential. J Cardiovasc Pharmacol Ther. 2007; 12(1): 44-53. doi: 10.1177/1074248406297640.
- Рыжман Н.Н., Кравчук В.Н., Князев Е.А., Хубулава Г.Г. и др. Опыт применения минимально инвазивной прямой реваскуляризации миокарда при коронарном шунтировании // Вестник Российской военно-медицинской академии. – 2014. – №1. – С.7-12.
- Бабунашвили А.М., Карташов Д.С., Бабокин В.Е. и др. Эффективность применения стентов, покрытых сиролимусом, при лечении диффузных (длинных и очень длинных) атеросклеротических поражений коронарных артерий // Российский кардиологический журнал. – 2017. – №8(148). – С.42-50. doi: 10.15829/1560-4071-2017-8-42-50.
- Meier P, Hemingway H, Lansky AJ, et al. The impact of the coronary collateral circulation on mortality: a meta-analysis. Eur Heart J. 2012; 33(5): 614-621. doi: 10.1093/eurheartj/ehr308.
- Шевченко Ю.Л., Борщев Г.Г., Ульбашев Д.С. Отдаленные результаты коронарного шунтирования, дополненного хирургической стимуляцией экстракардиальной васкуляризации миокарда, у пациентов с диффузным поражением коронарного русла // Комплексные проблемы сердечно-сосудистых заболеваний. – 2023. – №12(1). – С.160-171. doi: 10.17802/2306-1278-2023-12-1-160-171.
- Shevchenko YuL, Borshchev GG, Ulbashev DS. Surgical technique of angiogenesis stimulation (extracardial myocardial revascularization) in patients with coronary artery disease. Cardiology and Cardiovascular Medicine. 2022; 6: 529-535. doi: 10.26502/fccm.92920295.


