Результаты хирургического лечения первичных сарком сердца
Автор: Бабешко Степан Сергеевич, Самурганов Ю.П., Барбухатти К.О., Порханов В.А.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Онкология
Статья в выпуске: 2 т.25, 2021 года.
Бесплатный доступ
Цель. Оценить непосредственные и отдаленные результаты хирургического лечения пациентов с первичными саркомами сердца. Методы. В ГБУЗ «НИИ - ККБ № 1 им. проф. С.В. Очаповского» (г. Краснодар) с 2013 по 2020 г. прооперировали 5 пациентов (2 мужчины и 3 женщины) разных возрастных групп (от 10 до 54 лет) с первичными саркомами сердца различных локализаций. Выполняли все операции из срединного стерно-томного доступа в условиях искусственного кровообращения, нормотермии и кристаллоидной кардиоплегии. Результаты. Средний возраст пациентов составил 32 ± 12 лет. Двум диагностировали лейомиосаркому (правого предсердия и легочной артерии), двум - ангиосаркому правого предсердия и одному - плеоморфную саркому левого предсердия. У двух больных поражение ограничивалось одной камерой, у трех опухоль имела запущенный, агрессивный инфильтративный рост и прорастала в нижнюю полую вену, миокард левого желудочка, контралатеральные камеры сердца, перикард и париетальную плевру. Трем пациентам выполнили радикальную операцию с краем резекции R0, двум - циторедуктивную операцию с краем резекции R2 ввиду распространенности процесса в местные ткани и технической невозможности радикальной резекции. Летальных случаев в госпитальном периоде не было. Четыре пациента получали адъювантную полихимиотерапию. В отдаленном периоде (средний срок наблюдения 18,8 ± 11,7 мес.) выжил один пациент (срок наблюдения 35 мес.), который проходил курс химиотерапии в связи с локальным рецидивом. Пациент с лейомиосаркомой легочной артерии перенес повторную операцию ввиду локального рецидива через год после первичной. Причина всех летальных исходов - прогрессирование онкологического заболевания. Средняя продолжительность жизни после операции среди умерших пациентов - 14,8 ± 8,1 мес. Выводы. Несмотря на положительные ранние результаты хирургического лечения первичных сарком сердца, показатели отдаленной выживаемости и безрецидивного течения крайне неблагоприятные. Тем не менее мультимодальный подход к лечению данной патологии, включающий радикальную хирургическую резекцию опухоли R0 в сочетании с современными схемами неоадъювантной и адъювантной химиотерапии, лучевой терапии, позволяет в ряде случаев улучшить выживаемость у этой тяжелой когорты пациентов.
Злокачественное новообразование сердца, первичная опухоль сердца, саркома сердца, хирургическая резекция опухоли
Короткий адрес: https://sciup.org/142230819
IDR: 142230819 | DOI: 10.21688/1681-3472-2021-2-69-79
Текст научной статьи Результаты хирургического лечения первичных сарком сердца
Результаты хирургического лечения первичных сарком сердца. Патология кровообращения и кардиохирургия. 2021;25(2):69-79. http://
С.С. Бабешко, Ю.П. Самурганов, К.О. Барбухатти, В.А. Порханов,
Первичные опухоли сердца встречаются крайне редко: от 0,001 до 0,03 % [1–3]. Около 25 % первичных опухолей сердца у взрослых пациентов являются злокачественными, и большая часть из них — саркомы [4]. Среди локализованных в сердце сарком наиболее распространены опухоли эндотелиального происхождения — ангиосаркомы. В то же время de novo в сердце могут возникать костные, нейрогенные и другие гистологические типы сарком [4].
Саркомы сердца часто протекают бессимптомно. Кроме того, на пике клинических проявлений для них характерны неспецифические симптомы, имитирующие другую патологию, что усложняет постановку диагноза. Прогноз крайне неблагоприятный ввиду поздней диагностики, агрессивного роста опухолей с обширной локальной инвазией, склонностью к метастазированию, частых рецидивов и прогрессирования заболевания, несмотря на своевременные хирургическое лечение и системную лекарственную и лучевую терапию.
Принципиальное значение имеют ранняя диагностика и гистологическая верификация опухоли [5]. Хотя в лечении первичных злокачественных новообразований сердца доминирует мультимодальный подход, эффективность химиотерапии при различных гистологических подтипах сарком вариабельна, а в ряде случаев отсутствует, поэтому методом выбора является хирургическая резекция опухоли [6].
Совершенствование инструментальных методов исследования: чреспищеводной эхокардиографии, компьютерной, магнитно-резонансной и позитронно-эмиссионной томографии сердца, трансвенозной эндокардиальной биопсии и трансторакальной пункционной биопсии под компьютерной навигацией — увеличило точность предоперационной диагностики. Однако из-за анатомо-морфологических особенностей сарком, маскирующих новообразование под доброкачественное, подозрение на злокачественную природу опухоли может возникнуть только во время операции [7].
В настоящей статье представлен опыт хирургического лечения первичных сарком сердца.
Методы
В НИИ – ККБ № 1 с 2013 по 2020 г. прооперированы 5 пациентов (2 мужчины и 3 женщины) разных
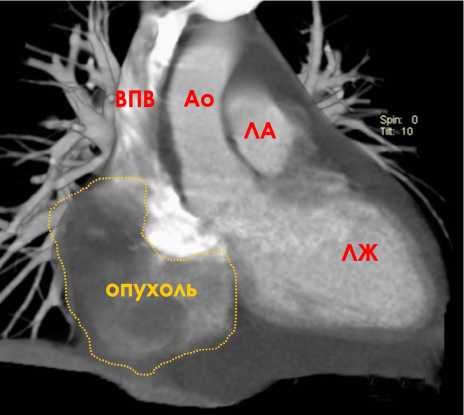
Рис. 1. Компьютерная томография органов грудной клетки с контрастным усилением пациента № 3 с ангиосаркомой правого предсердия
Примечание. ВПВ — верхняя полая вена; Ао — аорта;
ЛА — легочная артерия; ЛЖ — левый желудочек.
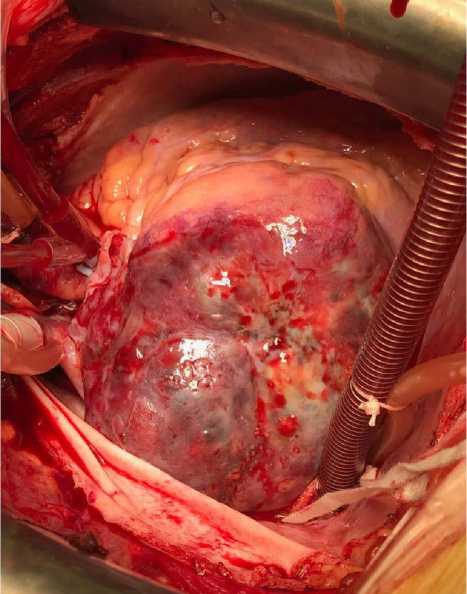
Рис. 2. Интраоперационный вид сердца пациента № 3: инфильтративный рост опухоли в стенку правого предсердия
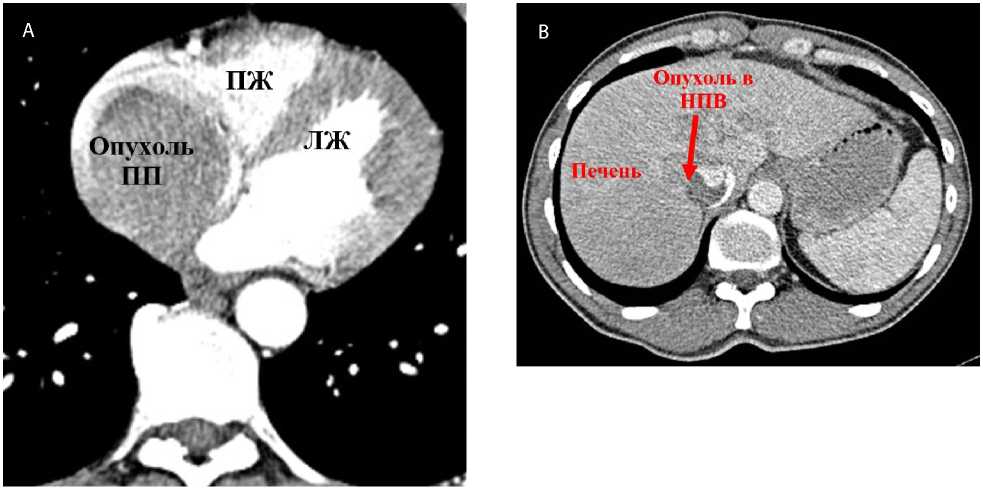
Рис. 3. Компьютерная томография органов грудной клетки с контрастным усилением пациента № 1 с лейомиосаркомой правого предсердия (А), прорастающей в нижнюю полую вену (B)
Примечание. ПП — правое предсердие; ПЖ — правый желудочек; ЛЖ — левый желудочек; НПВ — нижняя полая вена.
возрастных групп (от 10 до 54 лет) с первичными саркомами сердца различных локализаций. Данные о непосредственных результатах лечения собирали путем ретроспективного изучения медицинских карт пациентов, а отдаленные результаты оценивали посредством сбора анамнеза по телефону и изучения копий медицинской документации, высланной родственниками больных на электронную почту, а также путем анализа медицинских карт пациентов, повторно госпитализированных в НИИ – ККБ № 1.
Все пациенты прошли стандартное предоперационное обследование: 2D-трансторакальную допплер-эхокардиографию, компьютерную томографию органов грудной клетки с контрастным усилением. Дополнительно проводили ультразвуковое исследование органов брюшной полости, компьютерную томографию головного мозга, органов брюшной полости, конечностей с целью исключения отдаленных метастазов. Предоперационную трансвенозную биопсию опухоли выполнили только одному пациенту, однако гистологическое исследование дало ложное заключение — миксома.
Все операции осуществляли из срединного стер-нотомного доступа в условиях искусственного кровообращения, нормотермии и кардиоплегии раствором «Кустодиол» (Dr. F. Koehler Сhemie GmbH, Бенсхайм, Германия). Удаленные препараты отправляли на плановое гистологическое исследование в патоморфологическую лабораторию. По результа- там гистологической картины пациенты наблюдались и получали системную лекарственную терапию у онкологов НИИ – ККБ № 1 либо по месту жительства.
Результаты
Исходная характеристика пациентов и анатомоморфологические особенности опухолей представлены в табл. 1. Средний возраст — 32 ± 12 лет. Ведущий симптом — одышка разной степени выраженности, у трех наблюдалась потеря веса в течение 3 мес., у четырех — периферические отеки, у одного — перикардиальный выпот. Два больных поступили в экстренном порядке с клиникой острой сердечной недостаточности, отеком легких.
У пациентов с ангиосаркомой правого предсердия (№ 3) и лейомиосаркомой легочной артерии (№ 2) распространенность опухолевого процесса ограничивалась одной камерой сердца (рис. 1, 2). У трех других саркомы были местнораспространенными и прорастали из правого либо левого предсердия в нижнюю полую вену, миокард левого желудочка, контрлатеральные камеры сердца, перикард и париетальную плевру (табл. 1, рис. 3). Однако ни у кого не обнаружено отдаленных метастазов. Одного пациента (№ 4) экстренно прооперировали ввиду прогрессирующей острой сердечной недостаточности на фоне выраженной обструкции митрального клапана опухолевыми массами.
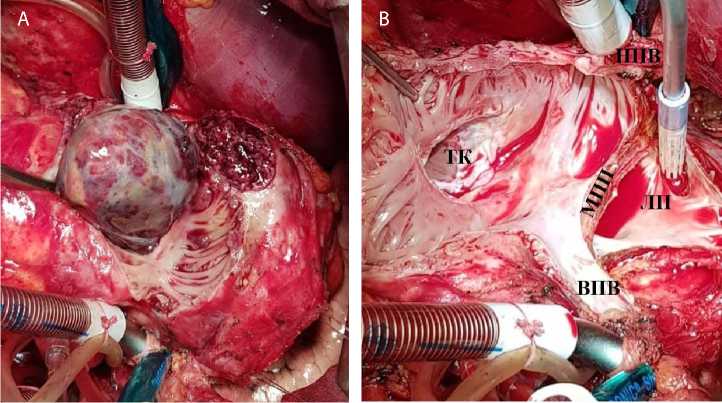
Рис. 4. Интраоперационный вид сердца пациента № 5 после правой атрио-томии (А) и удаления опухоли единым блоком со стенкой правого предсердия, верхней полой вены, париетальной плевры, коллектором правых легочных вен и фрагментом межпредсердной перегородки (B)
Примечание. НПВ — нижняя полая вена; ТК — трехстворчатый клапан; МПП — межпредсердная перегородка; ЛП — левое предсердие; ВПВ — верхняя полая вена.
Пациентам из-за распространения опухолевых масс в стенку абдоминальной части нижней полой вены (№ 1) и стенку левого желудочка (№ 4) не смогли произвести радикальное удаление опухоли и выполнили циторедуктивную резекцию R2. У остальных новообразования удалили в пределах здоровых тканей (R0) единым блоком со стенкой пораженного предсердия (легочного ствола – у пациента № 2) и окружающими структурами и тканями, во- влеченными в процесс (стенка верхней полой вены, коллектор легочных вен, листок медиастинальной плевры, бифуркация легочной артерии и так далее) (рис. 4). Сформировавшиеся дефекты камер сердца и магистральных сосудов во всех случаях, кроме одного пациента (№ 3), закрыли одной или несколькими заплатами из ксеноперикарда, выкроенными интраоперационно по размерам и форме дефектов (рис. 5). У одного пациента (№ 3) стенку правого
Табл. 1. Характеристика пациентов с первичными саркомами сердца
|
Показатель |
Пациент № 1 |
Пациент № 2 |
Пациент № 3 |
Пациент № 4 |
Пациент № 5 |
|
Пол |
Мужской |
Женский |
Мужской |
Женский |
Женский |
|
Возраст, лет (32 ± 12 лет) |
48 |
29 |
10 |
40 |
54 |
|
Одышка |
++ |
+ |
+ |
+++ |
+++ |
|
Снижение веса за последние 3 мес. |
+ |
– |
– |
+++ |
+++ |
|
Периферические отеки |
++ |
– |
+ |
+++ |
++ |
|
ФК НК по классификации NYHA |
III |
II |
II |
IV |
III |
|
Класс ОСН по классификации Киллипа |
III |
I |
I |
IV |
III |
|
Гистологический подтип саркомы |
Лейомиосаркома |
Лейомиосаркома |
Ангиосаркома |
Плеоморфная саркома |
Ангиосаркома |
|
Локализация опухоли |
ПП |
ЛА |
ПП |
ЛП |
ПП |
|
Инвазия |
Нижняя полая вена, МПП, ЛП |
– |
– |
Миокард левого желудочка |
МПП, устья правых легочных вен, перикард, медиастинальная плевра |
Примечание. ФК НК — функциональный класс недостаточности кровообращения; NYHA — Нью-Йоркская ассоциация кардиологов (англ. New York Heart Association); ОСН — острая сердечная недостаточность; ПП — правое предсердие; ЛА — легочная артерия; ЛП — левое предсердие; МПП — межпредсердная перегородка.
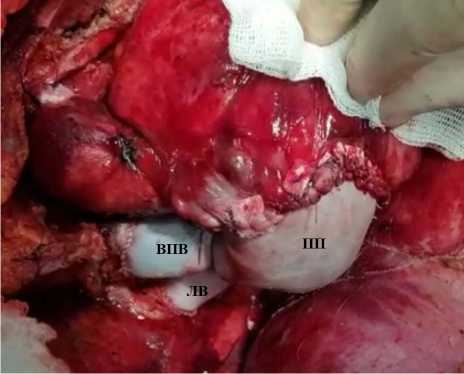
Рис. 5. Конечный вид операционной раны пациента № 5: восстановленные заплатами из ксеноперикарда верхняя полая вена, правые легочные вены, свободная стенка правого предсердия
Примечание. ВПВ — верхняя полая вена;
ЛВ — легочная вена; ПП — правое предсердие.
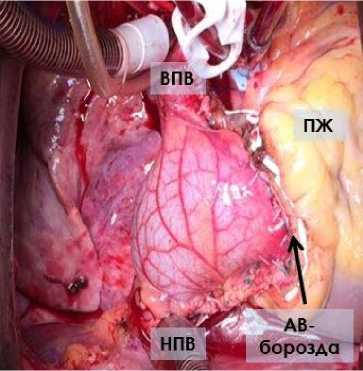
Рис. 6. Окончательный вид операционной раны пациента № 3 после пластики правого предсердия аутоперикардиальным лоскутом in situ
Примечание. ВПВ — верхняя полая вена; НПВ — нижняя полая вена; ПЖ — правый желудочек; АВ-борозда — атриовентрикулярная борозда.
предсердия после ее субтотальной резекции единым блоком вместе с опухолью восстановили лоскутом из аутоперикарда на ножке in situ (рис. 6).
Среднее время искусственного кровообращения составило 150,6 ± 22,0 мин, среднее время пережатия аорты — 94,4 ± 20,0 мин. Летальных исходов в госпитальном периоде не было, однако выявлены нелетальные ранние осложнения. У пациента, у которого не удалили полностью опухоль левого предсердия из-за прорастания в толщу миокарда левого желудочка, в послеоперационном периоде развилась левожелудочковая миокардиальная слабость, что потребовало более длительной инфузии кардиотонических препаратов (адреналин до 0,15 мкг/кг/мин с постепенным снижением дозы на протяжении 5 сут.). У одного пациента (№ 3) в раннем послеоперационном периоде возникла преходящая атриовентрикулярная блокада II ст. с последующим стойким восстановлением нормальной проводимости. У пациента (№ 5) ввиду обширной резекции медиастинального листка париетальной плевры вместе с правым диафрагмальным нервом развился стойкий парез правого купола диафрагмы без клинических признаков дыхательной недостаточности. Продления искусственной вентиляции легких и хирургической коррекции не потребовалось из-за отсутствия клинической значимости пареза.
По данным патоморфологического и иммуногистохимического исследований установили гистологические подтипы сарком: лейомиосаркома (№ 1 и 2), ангиосаркома (№ 3 и 5) и плеоморфная (№ 4). В среднем больные проводили в стационаре 15,4 ± 7,0 койко-дня. После выписки 4 пациента проходили курс адъювантной химиотерапии (циклофосфан, доксорубицин, дакарбазин) (табл. 2).
На момент написания статьи среднее время наблюдения составляло 18,8 ± 11,7 мес., из всей серии наблюдений выжил только один пациент (№ 3) — с ангиосаркомой правого предсердия (срок наблюдения 35 мес.). По данным эхокардиографии в августе 2020 г. ему диагностировали локальный рецидив опухоли в виде опухолевых масс в правом предсердии, произрастающих из межпредсердной перегородки. Больной проходил курс химиотерапии. Из двух пациентов с резекцией R2 один скончался от прогрессирования заболевания через 16 мес. после операции и прохождения 6 курсов адъювантной полихимиотерапии. Другой пациент умер через 3 мес. после операции от полиорганной недостаточности на фоне прогрессирования основного заболевания. У пациента (№ 2) с лейомиосаркомой легочной артерии через 12 мес. после операции возник локальный рецидив, оперировали повторно в объеме резекции опухоли R0 единым блоком со стволом и бифуркацией легочной артерии и последующим
Табл. 2. Интраоперационные данные, непосредственные и отдаленные результаты лечения
|
Показатель |
Пациент № 1 |
Пациент № 2 |
Пациент № 3 |
Пациент № 4 |
Пациент № 5 |
|
Экстренная операция Радикальность операции Время искусственного кровообращения, мин (в среднем 150,6 ± 22,0 мин) |
– R2 147 |
– R0 125 |
– R0 142 |
+ R2 146 |
– R0 193 |
|
Время пережатия аорты, мин (в среднем 94,4 ± 20,0 мин) |
97 |
54 |
94 |
91 |
136 |
|
Ранние послеоперационные осложнения |
– |
– |
Преходящая атриовентрикулярная блокада II ст. |
Левожелудочковая миокардиальная слабость |
Парез правого купола диафрагмы |
|
Нахождение в стационаре, койко-дни (в среднем 15,4 ± 7,0 дня) |
11 |
10 |
20 |
20 |
14 |
|
Количество курсов адъювантной химиотерапии |
6 |
8 |
5 |
– |
6 |
|
Отдаленные результаты |
|||||
|
Локальный рецидив опухоли |
– |
Через 12 мес. после первой операции и через 11 мес. после второй |
Через 33 мес. после операции |
– |
– |
|
Повторная операция Исход заболевания Срок наблюдения, мес. (в среднем 18,8 ± 11,7 мес.) |
– Умер 16 |
+ (R0) Умер 24 |
– Жив 35 |
– Умер 3 |
– Умер 16 |
протезированием сосудов ксеноперикардом. После второй операции пациент прошел 4 курса адъювантной полихимиотерапии, однако еще через 12 мес. (через 24 мес. от первичной операции) умер от прогрессирования онкологического заболевания. Безре-цидивный период у пациента (№ 5) с ангиосаркомой правого предсердия длился 13 мес., после чего по данным контрольной компьютерной томографии органов грудной клетки диагностирована прогрессия в виде опухолевых масс и множества увеличенных лимфатических узлов в заднем и среднем средостении. Еще через 3 мес. пациент умер. Средняя продолжительность жизни после операции среди умерших пациентов составила 14,8 ± 8,1 мес.
Обсуждение
Примерно 25 % первичных опухолей сердца являются злокачественными, из них около 75 % — опухоли мезенхимального происхождения (саркомы). Наиболее распространенным гистологическим типом первичных сарком сердечной локализации является ангиосаркома (37 %) — опухоль, производная эндотелиальных клеток, за ней следуют злокачественная фиброзная гистиоцитома (24 %), лейомиосаркома (9 %), рабдомиосаркома (7 %), неклассифицированные саркомы (7 %) и другие (16 %) [7]. Самая распространенная локализация ангиосарком — правые отделы сердца, а злокачественных фиброзных гистиоцитом — левые. Опухоли крайне злокачественны: имеют агрессивный рост, быстро проникают во все слои сердечной стенки и дают обширные метастазы в различные системы органов. По данным N.A. Silverman и соавт., до 80 % пациентов на момент обращения имеют отдаленные метастазы [4]. Средний возраст обращения к специалистам — около 40 лет [8]. Редко, но встречаются саркомы сердца в младенческом и детском возрасте [9], что подтверждает представленный случай лечения пациента 10 лет с ангиосаркомой правого предсердия. Однако у детей чаще всего (более 50 % случаев) встречаются рабдомио- и фибросаркома [10].
Как правило, пациенты обращаются к врачу после эпизодически возникающих симптомов, которые зачастую неспецифичны и длятся от нескольких недель до нескольких месяцев. Клиническая картина зависит от локализации и размера опухоли. Манифестируют болезнь по одному из четырех механизмов:
-
1) обструкция атриовентрикулярного отверстия и клапанная дисфункция;
-
2) местная инвазия, вызывающая жизнеугрожающие аритмии с нарушением гемодинамики или перикардиальный выпот с тампонадой сердца;
-
3) материальная эмболия в малом или большом кругах кровообращения участками опухоли с соответствующими симптомами;
-
4) системные проявления в виде астении, лихорадки и потери веса [5].
Наиболее частые симптомы на фоне общего недомогания: одышка (60 % случаев), боль в груди (28 %), симптомы застойной сердечной недостаточности (28 %), учащенное сердцебиение (24 %), лихорадка (14 %), миалгия (10 %), эмболия (5 %) [7]. В представленной серии наблюдений ведущим симптомом, заставившим пациентов обратиться к врачу, была одышка, которая, как правило, свидетельствует о запущенной стадии заболевания и значительном размере опухоли, так как сопровождает нарушения внутрисердечной гемодинамики, пролабирование опухолевых масс в атриовентрикулярные отверстия, заполнение полости пораженной камеры более чем на 50–70 %, перикардиальный выпот и другие неблагоприятные события.
Для дифференциальной диагностики сарком сердца с доброкачественными новообразованиями и тромбами используют инструментальные методы: эхокардиографию, компьютерную томографию с контрастным усилением, магнитно-резонансную томографию сердца и позитронно-эмиссионную томографию. Каждый из них имеет преимущества и недостатки, поэтому при подозрении на злокачественную опухоль сердца рекомендуется использовать все четыре [11]. Эхокардиография наиболее доступна, в том числе по стоимости, и позволяет оценить расположение опухоли, ее подвижность и взаимодействие с внутрисердечными структурами в движении, влияние на гемодинамику. Недостатками метода являются неоптимальное качество изображения; невозможность точно оценить распространен- ность процесса; узость окна, не позволяющая оценить масштаб опухоли, если последняя выходит за пределы пораженной камеры сердца. С помощью компьютерной и магнитно-резонансной томографии грудной клетки определяют степень инвазии опухоли в миокард и экстракардиальные структуры, оценивают ее размер, положение в полостях сердца и вовлечение клапанного аппарата, наличие отдаленных метастазов, морфологию (питающие сосуды, полости некроза и так далее). Магнитно-резонансная томография дает возможность дифференцировать мягкотканный компонент новообразования, отличить его от жировой ткани и тромба. Компьютерная томография позволяет оценить кальцификацию, выявить отдаленные метастазы в легкие и лимфоузлы средостения. С помощью позитронно-эмиссионной томографии в сочетании с компьютерной томографией возможно дифференцировать доброкачественный и злокачественный процессы, стадировать злокачественные новообразования, оптимизировать место биопсии и спланировать лучевую терапию [11].
По данным J.-T. Kim и соавт., от миксомы — самой распространенной доброкачественной опухоли сердца — саркомы левых камер отличаются следующими признаками:
-
1) несептальное происхождение;
-
2) инвазия в легочные вены;
-
3) множественный характер;
-
4) широкое прикрепление к стенке левого предсердия;
-
5) полутвердая консистенция [12].
Однако «золотым стандартом» диагностики является гистологическое изучение биопсийного материала, полученного путем трансвенозной эндомиокардиальной биопсии либо (при подходящей анатомии) трансторакальной тонкоигольной биопсии опухоли с помощью компьютерной навигации. Тонкоигольная аспирационная биопсия при инфильтрации перикарда и цитологическое исследование перикардиального выпота не показали эффективности [13]. Установка гистологического подтипа саркомы до операции, во-первых, позволяет сформировать индивидуальную схему и этапность лечения, подобрать системную терапию и, главное, неоадъювантную химиотерапию, которая может значительно уменьшить размеры опухоли и повысить вероятность получить негативный край резекции во время операции, а во-вторых, дает возможность прогнозировать, так как разные гистологические подтипы отличаются скоростью роста, склонностью к метастазированию и ответом на химиотерапевтическое воздействие [7; 14].
Несмотря на широкие диагностические возможности, иногда трудно отличить саркому от миксомы больших размеров, и происходят ошибки, одна из которых описана в серии наблюдений. Такие случаи не единичны, причем часто малоопытные хирурги не соблюдают онкологические принципы удаления новообразования с фокусом на негативный край резекции, ошибочно принимая опухоль за доброкачественную, что приводит к ранним локальным рецидивам [15–21].
Прогноз первичных сарком сердца крайне неблагоприятен, в том числе по сравнению с саркомами мягких тканей другой локализации. M. Hamidi и соавт. в ретроспективном многоцентровом исследовании на выборке из 210 пациентов с первичными саркомами сердца в сравнении с 24 404 больными саркомами мягких тканей внесердечной локализации показали, что медиана выживаемости в первой группе в 15 раз ниже, чем во второй (6 против 93 мес., р < 0,001) [22]. При этом хирургическая резекция опухоли обеспечивает лучший прогноз: медиана выживаемости пациентов с саркомами сердца, перенесших резекцию, составила 12 мес., без операции — 1 мес. (р < 0,001). Радикальная резекция опухоли R0 в пределах здоровых тканей — важнейший предиктор увеличения отдаленной выживаемости пациентов с первичными саркомами сердца [7; 8; 23–25]. Таким образом, хирургическое лечение является методом выбора. Однако распространенность процесса и вовлечение различных сердечных структур и окружающих тканей снижают резектабельность опухоли. При ее локализации в правом предсердии с местной инвазией технически возможно выполнить субтотальную резекцию стенки предсердия, верхней полой вены, межпредсердной перегородки с последующим замещением дефектов заплатами из ксеноперикарда. При распространении опухоли на атриовентрикулярную борозду с вовлечением правой коронарной артерии радикальное удаление также возможно с последующей реконструкцией или шунтированием последней. В случае прорастания опухоли в нижнюю полую вену следует использовать нестандартные техники венозной канюляции, гипотермию и циркуляторный арест [14]. При локализации саркомы в легочной артерии целесообраз- но выполнять резекцию ствола легочной артерии с бифуркацией. Для дальнейшего восстановления кровотока возможно использовать ксено- и алло-графты, ксеноперикард, синтетические сосудистые протезы.
Наибольшие технические трудности для хирурга вызывают новообразования, располагающиеся в левых камерах сердца, а также поражающие миокард желудочков, нижнюю полую вену и центральный фиброзный скелет сердца. В подобных случаях наибольшую визуализацию дает аутотрансплантация сердца, которая позволяет радикально удалить опухоль под контролем зрения, быстро выполнить протезирование или реконструкцию атриовентрикулярных клапанов и в случае необходимости восстановить анатомию сердца при помощи ксеноперикардиальных или иных заплат. M.J. Reardon и соавт. представили опыт 12 радикальных резекций первичных сарком левых камер с применением аутотрансплантации сердца и сообщили об отсутствии госпитальной летальности и медиане выживаемости 18,5 мес., что можно считать положительным результатом с учетом труднодоступной локализации опухолей, сомнительной операбельности и крайне низкой ожидаемой продолжительности жизни [26].
Еще один метод лечения нерезектабель-ных сарком сердца — трансплантация сердца. A. Gowdamarajan и соавт. изучили результаты трансплантации сердца по поводу неоперабельного злокачественного новообразования у 21 пациента. Через 1–36 мес. (в среднем через 12 мес.) после операции 14 наблюдаемых (67 %) умерли. Причина смерти 13 из них — рецидив болезни или метастазы. Один больной умер по неизвестным причинам. Семь выживших пациентов наблюдались в течение 6–66 мес. (в среднем 27 мес.), и только у одного из них обнаружили признаки рецидива [27]. Тем не менее трансплантация сердца может рассматриваться лишь как резервный метод, так как наилучшие результаты и прогноз дает именно резекция опухоли R0. N. Isambert и соавт. установили, что медиана выживаемости после резекции опухоли R0 у пациентов с первичными саркомами сердца выше, чем после трансплантации сердца (38,8 против 27,5 мес.) [28]. При этом операция может носить паллиативный характер, если необходимо провести экстренное вмешательство для облегчения симптомов серьезных нарушений внутрисердечной гемодинамики, несмотря на ис- ходную нерезектабельность опухоли и отдаленные метастазы. По данным A. Miralles и соавт., до 78 % пациентов с первичными злокачественными новообразованиями сердца поступают в клинику с обструкцией левого или правого атриовентрикулярных отверстий и требуют резекции опухоли для спасения жизни [29]. В исследуемой серии 2 пациента перенесли циторедуктивную резекцию по этим причинам, одного из них экстренно прооперировали с клиникой отека легких.
Роль химиотерапии или лучевой терапии в лечении первичных сарком сердца противоречива. Ввиду редкости заболевания нет больших проспективных исследований, доказывающих эффективность этих методов в дополнение к хирургическому вмешательству. По-видимому, адъювантная химиотерапия не увеличивает выживаемость пациентов, перенесших неполные резекции [7; 8; 15]. Комбинация нескольких химиотерапевтических агентов (ифосфамид, доксорубицин, циклофосфамид и паклитаксел) с подтверждением ответа эффективнее терапии одним агентом [7; 30; 31]. G.V. Poole и соавт. в обзоре на небольшой выборке пациентов предположили, что послеоперационное облучение может увеличить выживаемость [15]. A.P. Burke и соавт., N. Isambert и соавт. сообщили о положительном эффекте комбинации адъювантной химиотерапии и лучевой терапии [8; 28].
В рассмотренной когорте пациентов, несмотря на положительные ранние результаты, показатели отдаленной выживаемости и безрецидивного течения неутешительные, что отражает исходную распространенность опухолевого процесса, сложность хирургических процедур и невозможность радикальной резекции в двух случаях. Эту информацию важно доносить до пациента и его родственников при обсуждении плана лечения наряду со сведениями о побочных эффектах системной терапии и возможных осложнениях. Больные первичными саркомами сердца, как правило, достаточно молоды, но имеют негативный прогноз.
Ограничения
Исследование включает небольшое количество пациентов в силу редкости обсуждаемой патологии, поэтому описанные схемы лечения не носят рекомендательного характера, а результаты могут лишь послужить вкладом в изучение первичных сарком сердца. Некоторые пациенты были направлены из других клиник и после операции в НИИ – ККБ № 1 получали лечение, включая адъювантную химиотерапию, в медицинских учреждениях по месту жительства, в результате чего детали ухода и лечения упущены.
Заключение
Первичные саркомы сердца встречаются крайне редко, имеют множество гистологических подтипов, могут локализоваться в любой из камер сердца и поражают пациентов разных возрастных групп. В силу анатомо-морфологических особенностей опухолей и невозможности в ряде случаев провести их предоперационное гистологическое исследование следует иметь онконастороженность в диагностике пациентов с новообразованиями сердца и использовать для этого все доступные инструментальные методы. Несмотря на неблагоприятный прогноз, агрессивная хирургическая тактика, направленная на радикальное удаление опухоли с негативным краем резекции, является основным методом местного контроля и улучшения выживаемости. Схему и этапность лечения каждого пациента следует планировать индивидуально исходя из локализации и размеров опухоли, гистологического подтипа саркомы, распространенности процесса, наличия отдаленных метастазов и отдавать предпочтение мультимодальному подходу с применением современных схем неоадъювантной и адъювантной химиотерапии, лучевой терапии, что позволит улучшить прогноз у этой тяжелой когорты пациентов.
Список литературы Результаты хирургического лечения первичных сарком сердца
- Abraham K.P., Reddy V., Gattuso P. Neoplasms metastatic to the heart: review of 3314 consecutive autopsies. Am J Cardiovasc Pathol. 1990;3(3):195-198. PMID: 2095826.
- Lam K.Y., Dickens P., Chan A.C. Tumors of the heart. A 20-year experience with a review of 12,485 consecutive autopsies. Arch Pathol Lab Med. 1993;117(10):1027-1031. PMID: 8215825.
- Reynen K. Frequency of primary tumors of the heart. Am J Cardiol. 1996;77(1):107. PMID: 8540447. https://doi. org/10.1016/s0002-9149(97)89149-7
- Silverman N.A. Primary cardiac tumors. Ann Surg. 1980;191 (2):127-138. PMID: 7362282; PMCID: PMC1345598. https://doi.org/10.1097/00000658-198002000-00001
- Shanmugam G. Primary cardiac sarcoma. Eur J of Cardiothorac Surg. 2006;29(6):925-932. PMID: 16675225. https://doi. org/10.1016/j.ejcts.2006.03.034
- Shapiro L.M. Cardiac tumours: diagnosis and management. Heart. 2001 ;85(2):218-222. PMID: 11156679; PMCID: PMC1729629. https://doi.org/10.1136/heart.85.2.218
- Putnam J.B. Jr, Sweeny M.S., Colon R., Lanza L.A., Frazier O.H., Cooley D.A. Primary cardiac sarcoma. Ann Thorac Surg. 1991;51(6):906-910. PMID: 2039319. https://doi. orq/10.1016/0003-4975(91)91003-e
- Burke A.P., Cowan D., Virmani R. Primary sarcomas of the heart. Cancer. 1992;69(2):387-395. PMID: 1728367. https:// doi.org/10.1002/1097-0142(199201 15)69:2-387::aid-cncr2820690219-3.0.co;2-n
- Llombart-Cussac A., Pivot X., Contesso G., Rhor-Alvarado A., Delord J.P., Spielmann M., Tursz T., Le Cesne A. Adjuvant chemotherapy for primary cardiac sarcomas: the IGR experience. Br J Cancer. 1998;78(12):1624-1628. PMID: 9862574; PMCID: PMC2063231. https://doi.org/10.1038/bjc.1998.733
- Zipes D.P., Libby P., Bonow R.O., Braunwald E. Braunwald's heart disease: A textbook of cardiovascular medicine. 7th ed. Vol. 1. Philadelphia: Elsevier Saunders; 2005. 1102 p.
- Tyebally S., Chen D., Bhattacharyya S., Mughrabi A., Hussain Z., Manisty C., Westwood M., Ghosh A.K., Guha A. Cardiac tumors: JACC CardioOncology state-of-the-art review. JACC: CardioOncology. 2020;2(2):293-311. https://doi.org/10.1016/i. ¡accao.2020.05.009
- Kim J.-T., Baek W.-K., Kim K.-H., Yoon Y.-H., Kim D.-H., Lim H.-K. A primary cardiac sarcoma preoperatively presented as a benign left atrial myxoma. Yonsei Med J. 2003;44(3):530-533. PMID: 12833594. https://doi.org/10.3349/ymi.2003.44.3.530
- Basso C., Valente M., Poletti A., Casarotto D., Thiene G. Surgical pathology of primary cardiac and pericardial tumours. Eur J Cardiothorac Surg. 1997;12(5):730-737. PMID: 9458144. https://doi.org/10.1016/s1010-7940(97)00246-7
- Bakaeen F.G., Jaroszewski D.E., Rice D.C., Walsh G.L., Vaporciyan A.A., Swisher S.S., Benjamin R., Blackmon Sh., Reardon M.J. Outcomes after surgical resection of cardiac sarcoma in the multimodality treatment era. J Thorac Cardiovasc Surg. 2009;137(6):1454-1460. PMID: 19464464. https://doi.org/10.1016/jj.jtcvs.2008.11.026
- Poole G.V., Meredith J.W., Breyer R.H., Mills S.A. Surgical implication in malignant cardiac disease. Ann Thorac Surg. 1983;36(4):484-491. PMID: 6354118. https://doi.org/10.1016/ s0003-4975(10)60494-8
- Molina J.E., Edwards J.E., Ward H.B. Primary cardiac tumors: experience at the University of Minnesota. Thorac Cardiovasc Surg. 1990;38(Suppl 2):183-191. PMID: 2237900. https://doi. org/10.1055/s-2007-1014064
- Murphy M.C., Sweeney M.S., Putnam J.B. Jr, Walker W.E., Frazier O.H., Ott D.A., Cooley D.A. Surgical treatment of cardiac tumors: a 25-year experience. Ann Thorac Surg. 1990;49(4):612-617. PMID: 2322057. https://doi.org/10.1016/0003-4975(90)90310-3
- Hattori Y., Iriyama T., Watanabe K., Negi K., Takeda I., Sugimura S. Primary cardiac sarcoma: two case reports. Jpn Circ J. 2000;64(3):222-224. PMID: 10732857. https://doi. org/10.1253/ici.64.222
- Centofanti P., Di Rosa E., Deorsola L., Dato G.M., Patane F., La TorreM.,BarbatoL.,VerziniA.,FortunatoG.,diSummaM.Primary cardiac tumors: early and late results of surgical treatment in 91 patients. Ann Thorac Surg. 1999;68(4):1236-1241. PMID: 10543485. https://doi.orq/10.1016/s0003-4975(99)00700-6
- Bakaeen F.G., Reardon M.J., Coselli J.S., Miller C.C., Howell J.F., Lawrie G.M., Espada R., Ramchandani M.K., Noon G.P., Weilbaecher D.G., DeBakey M.E. Surgical outcome in 85 patients with primary cardiac tumors. Am J Surg. 2003;186(6):641-647. PMID: 14672772. https://doi.org/10.1016/ii.amisurg.2003.08.004
- Segesser L.V., Cox J., Gross J., Lerch R., Gabathuler J., Glassey F., Gisselbaek A., Faidutti B. Surgery in primary leiomyosarcoma of the heart. Thorac Cardiovasc Surg. 1986;34(6):391-394. PMID: 2433803. https://doi.org/10.1055/s-2007-1022181
- Hamidi M., Moody J.S., Weigel T.L., Kozak K.R. Primary cardiac sarcoma. Ann Thorac Surg. 2010;90(1):176-181. PMID: 20609770; PMCID: PMC4201046. https://doi.org/10.1016/!. athoracsur.2010.03.065
- Agarwal V., Agarwal S.K., Srivastava A.K., Kaoor S. Primary cardiac tumors: surgical experience and follow-up. Indian Heart J. 2003;55(6):632-636. PMID: 14989515.
- Evans B.J., Haw M.P. Surgical clearance of invasive cardiac leiomyosarcoma with concomitant pneumonectomy. Eur J Cardiothorac Surg. 2003;24(5):843-846. PMID: 14583324. https://doi.org/10.1016/s1010-7940(03)00437-8
- Conner W.C., Fink G.W., McGinnis K.M., Alfieris G.M. Surgical management of leiomyosarcoma of the mediastinum. Ann Thorac Surg. 2004;77(1):334-336. PMID: 14726097. https://doi. org/10.1016/s0003-4975(03)00520-4
- Reardon M.J., Malaisrie S.C., Walkes J.-C., Vaporciyan A.A., Rice D.C., Smythe W.R., DeFelice C.A., Wojciechowski Z.J. Cardiac autotransplantation for primary cardiac tumors. Ann Thorac Surg. 2006;82(2):645-650. PMID: 16863779. https://doi. org/10.1016/j.athoracsur.2006.02.086
- Gowdamarajan A., Michler R.E. Therapy for primary cardiac tumors: is there a role for heart transplantation? Curr Opin Cardiol. 2000;15(2):121-125. PMID: 10963150. https://doi. org/10.1097/00001573-200003000-00010
- Isambert N., Ray-Coquard I., Italiano A., Rios M., Kerbrat P., Gauthier M., Blouet A., Chaigneau L., Duffaud F., Piperno-Neumann S., Kurtz J.-E., Girard N., Collard O., Bompas E., Penel N., Bay J.-O., Guillemet C., Collin F., Blay J.-Y., Le Cesne A., Thariat J. Primary cardiac sarcomas: a retrospective study of the French Sarcoma Group. Eur J Cancer. 2014;50(1):128-136. PMID: 24135684. https://doi.org/10.1016/i.eica.2013.09.012
- Miralles A., Bracamonte L., Soncul H., Diaz del Castillo R., Akhtar R., Bors V., Pavie A., Gandjbackhch I., Cabrol C. Cardiac tumors: clinical experience and surgical results in 74 patients. Ann Thorac Surg. 1991;52(4):886-895. PMID: 1929651. https:// doi.org/10.1016/0003-4975(91)91241-m
- Loffler H., Grille W. Classification of malignant cardiac tumors with respect to oncological treatment. Thorac Cardiovasc Surg. 1990;38(Suppl 2):173-175. PMID: 2237898. https://doi. org/10.1055/s-2007-1014062
- Park B.J., Bacchetta M., Bains M.S., Downey R.J., Flores R., Rusch V.W., Girardi L.N. Surgical management of thoracic malignancies invading the heart or great vessels. Ann Thorac Surg. 2004;78(3):1024-1030. PMID: 15337042. https://doi. org/10.1016/i.athoracsur.2004.02.043


