Результаты хроматографического и электрофоретического разделения гликозаминогликанов сыворотки крови, суставного хряща и костной ткани
Автор: Матвеева Е.Л., Лунева С.Н., Талашова И.А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4, 2003 года.
Бесплатный доступ
В работе представлены результаты хроматографического и электрофоретического разделения гликозаминогликанов сыворотки крови здоровых доноров, костной ткани сельхозживотных и суставного хряща интактных собак. Поскольку химические свойства гликозаминогликанов, являющихся тканеспецифичными, но видонеспецифичными соединениями, определяют функциональные потенции тканей, естественно полагать, что первые реактивные изменения, а в дальнейшем развитие патологического процесса, локализуются в системе протеин-полисахаридных комплексов.
Ионообменная хроматография, электрофорез, гликозаминогликаны, костная ткань, суставной хрящ
Короткий адрес: https://sciup.org/142120665
IDR: 142120665
Текст научной статьи Результаты хроматографического и электрофоретического разделения гликозаминогликанов сыворотки крови, суставного хряща и костной ткани
Исследование спектра гликозаминогликанов (ГАГ) соединительной ткани представляет большой интерес как в теоретическом, так и в практическом плане. В ряде литературных источников подтверждено предположение о том, что продукты деградации протеогликанов (ПГ) соединительной ткани поступают в кровоток и увеличивают содержание ГАГ в сыворотке крови при некоторых патологиях опорнодвигательной системы [1, 2] пропорционально тяжести заболевания и распространенности патологического процесса. Качественный анализ
ГАГ сыворотки крови показал увеличение концентрации кератансульфата и гиалуроновой кислоты [3]. Однако нам представляется интересным сравнение пула ГАГ сыворотки крови, суставного хряща и костной ткани в норме для получения сравнительных характеристик при исследовании патологического процесса. Целью проведенного нами исследования являлось выделение и хроматографическое разделение ГАГ сыворотки крови, суставного хряща и костной ткани интактных собак в возрасте 1,5-3 года.
МАТЕРИАЛЫ И МЕТОДЫ
Для выделения ГАГ из костной ткани животных мы использовали диссоциативно экстрагированный костный матрикс, оставшийся после выделения неколлагеновых белков, полу- ченный так, как было описано ранее [4]. Надосадочную жидкость, оставшуюся после осаждения коллагена, диализовали и лиофильно высушивали. Высушенные ГАГ подвергали легкому гидролизу HCl в течение 8 часов в соотношении 10 г : 300 мл 0,1 М HCl, нагревая под вакуумом. Гидролизат нейтрализовали 6 N NaOH до рН 7,0. Затем определяли уроновые кислоты (УК), гексозы и общий азот, по соотношению УК/гексозы рассчитывали концентрацию ГАГ в растворе. Кроме того, нами оформлена заявка на изобретение (получена приоритетная справка № 2002 129 089 от 5.11.02) “Способ выделения гликозаминогликанов из неминерализованной соединительной ткани”.
Выделение гликозаминогликанов из суставного хряща интактных собак для исследования их качественного состава проводили в соответствии с описанным модифицированным методом [1,2]. Суставной хрящ подвергали папаиновому протеолизу в присутствии фермента в 0,1 М ацетатном буфере рН 5,5 с 0,005М ЭДТА и 0,001М цистеина. Папаин брался из расчета 2-3 мг на 100 мг ткани. За 5 часов инкубации при 65°С ткань разрушалась полностью, в частности, происходила деструкция протеогликанов до ГАГ. Последнее подтвердили контрольные исследования надосадочной жидкости, полученной после осаждения ГАГ, показавшие отсутствие в ней уроновых кислот. Белки, РНК, гликопротеины осаждали из раствора протеолизата добавлением хлорной кислоты до 0,5N конечной концентрации. Осадок формировался в течение 30 мин при 0°С, после чего его отделяли центрифугированием (10мин,40.000 хg). Полученный супернатант медленно нейтрализовали 1М NаОН на холоду, затем проводили осаждение ГАГ 4%-ным ацетатом калия в 96% этаноле. Осадок ГАГ, собранный центрифугированием, переосаждали этанолом, снова собирали, высу- шивали и растворяли в 0,5 мл воды, из которых отбирали аликвоту для количественной оценки ГАГ и электрофореза. Фракционирование ГАГ проводили методом горизонтального электрофореза в пластинах (9x12см) в 0,9% агарозном геле толщиной 1мм. Электрофорез вели на холоду в 0,1 М Ва(СН3СООН)2, рН 8,0 (30 мА; 1,5 часа), в 0,1 М LiCl-HСl, рН 4,1 (20 мА, 40мин). После электрофореза гели окрашивали 0,1% толуидиновым синим в 1% уксусной кислоте в течение 30 мин, затем отмывали от избытка красителя в 1 % уксусной кислоте до прозрачного фона и сушили на стекле.
Выделение ГАГ из сыворотки крови собак производили по описанной в литературе [5] схеме, включающей в себя последовательные этапы ферментативного протеолиза, депротеинизации и осаждения гликозаминогликанов специфическими осадителями – четвертичными аммониевыми основаниями.
Для хроматографического разделения препаратов ГАГ их растворяли в 5 мл 0,02 М трис-НСl буфере (рН 7,2), наносили на колонку 2,5 x 2,0 см (был использован комплект оборудования для хроматографии низкого и среднего давления фирмы “LKB”, Швеция), содержащую ДЕАЕ-сефадекс А-25 (ионообменная емкость 3,5+0,5 meg/g, размер гранул 40-120 мкм). Линейный градиент концентрации элюирующего раствора создавали использованием 0,00-2,5 М хлористого натрия в 0,02 М трис-HCl буфере (рН 7,0). Фракции денситометрировали при длине волны 226 нм и отбирали по 3 мл, объединяли в пределах одного пика и определяли в них количество УК, гексоз, общего азота и сульфатов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ионообменная хроматография препарата ГАГ костной ткани показала, что он содержит один тип ГАГ, выходящих одним пиком и относящихся к хондроитинсульфату (рис. 1).
Гели, полученные при электорофорезе ГАГ суставного хряща и окрашенные метахромати-ческим красителем толуидиновым синим, который позволяет получить дифференцированное окрашивание полианионов разной структуры, имели следующие тона: синий цвет, что соответствует гиалуроновой кислоте, и фиолетовые тона различных оттенков, что характерно для сульфатированных ГАГ. Использованный метод показал, что препараты ГАГ хряща содержат 3 фракции (рис. 3), обозначенные А, В, С начиная от старта. Фракция А окрашивалась в синий цвет и имела вид, характерный для гиалуроновой кислоты, т.е. поперечную исчерченность. Фракции В и С окрашивались в фиолетовые тона. По полученным нами данным, фракция А представляет собой гиалуроновую кислоту, фракции В и С, идентифицированные по пробегу стандартов, соответственно – кератансульфат и хондроитинсульфат.
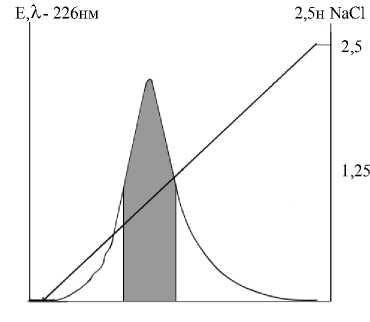
Рис. 1. Хроматографический профиль протеолизата ГАГ внеклеточного матрикса костной ткани на анионообменнике
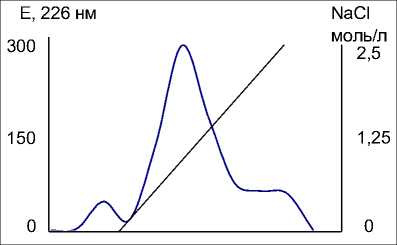
Рис. 2. Хроматографический профиль протеолизата ГАГ сыворотки крови на анионообменнике
На основании полученных результатов был сделан вывод о том, что в препарате ГАГ из матрикса суставного хряща коленных суставов собак присутствуют гиалуроновая кислота, хондроитинсульфат и кератансульфат.
При проведении ионообменной хроматографии ГАГ сыворотки крови (рис. 1) мы получили три пика, которые идентифицировали, определяя показатели обмена ГАГ (табл. 1). Принимая во внимание отсутствие сульфатных групп в первом пике, этот пик был идентифицирован нами как гиалуроновая кислота, что согласуется с данными литературы. Второй и третий пик были идентифицированы нами как хондроитинсульфат и кератансульфат соответственно.
Поскольку химические свойства гликозаминогликанов (являющихся тканеспецифичными, но видонеспецифичными соединениями [6]) определяют функциональные потенции тканей, естественно полагать, что первые реактивные изменения, а в дальнейшем развитие патологического процесса, локализуются в лабильной, но в целом устойчивой системе протеин-полисахаридных комплексов.
Таблица 1 Состав фракций ГАГ сыворотки крови здоровых людей
|
Показатель |
Фракции ПГ |
||
|
I |
II |
III |
|
|
УК мМ/л |
0,82 |
1,51 |
1,33 |
|
Сульфаты мМ/л |
0,13 |
2,48 |
1,46 |
|
ГА мМ/л |
0,58 |
0,31 |
0,33 |
|
Сульфаты/УК |
0,16 |
1,64 |
1,10 |
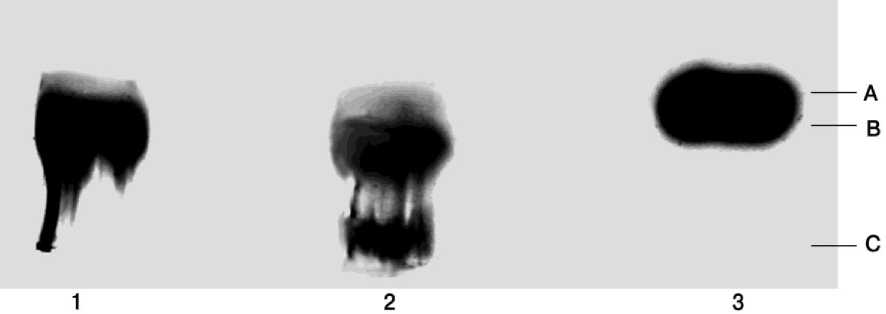
Р ис. 3. Электрофореграмма ГАГ суставного хряща коленных суставов интактных собак в 1% агарозном геле, 0,1 М Ba(Ac) 2 буфер, pH 8,0: А - ХС, B - КС, С - ГК. 1, 2 - экстракт ГАГ суставного хряща, 3 - ХС


