Результаты испытания набора реагентов для определения статуса мутаций гена EGFR методом ПЦР-РВ (тест-EGFR) для диагностики in vitro в клинической практике
Автор: Тороповский Андрей Николаевич, Мухаметханова Лейсан Мударисовна, Никитин Алексей Георгиевич, Гордиев Марат Гордиевич, Еникеев Рафаэль Фаридович, Техтелева Ирина Сергеевна, Павлова Ольга Николаевна
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 4 (28), 2017 года.
Бесплатный доступ
В настоящее время актуально определение мутаций методом ПЦР-РВ. Целью работы является анализ результатов испытания набора реагентов для определения статуса мутаций гена EGFR методом ПЦР-РВ (Тест-EGFR) для внедрения его в клинико-лабораторную практику. На базе ГАУЗ «Республиканского клинического онкологического диспансера МЗ РТ» были проведены клинические испытания медицинского изделия для диагностики in vitro «Набор реагентов для определения статуса мутаций гена EGFR методом ПЦР-РВ (Тест-EGFR) в исполнениях: 1) «Тест-EGFR-12» на 12 определений, 2) «Тест-EGFR-24» на 24 определения» производства ООО «ТестГен». В качестве субъектов клинического испытания было использовано 50 образцов свободно циркулирующей ДНК, выделенной из плазмы крови от пациентов с диагнозом метастатический немелкоклеточный рак легкого (НМРЛ) III-IV стадии, полученных из банка остаточных аликвот цельной плазмы крови в процессе лечебно-диагностической практики. В 28 предоставленных образцах мутантная ДНК гена EGFR не была обнаружена и в 22 образцах - обнаружена. В ходе проведения клинических испытаний было проанализировано 50 образцов плазмы крови и был выявлен один ложноотрицательный результат. Анализ и оценка результатов проведенных клинико-лабораторных испытаний медицинского изделия подтвердили соответствие качества медицинского изделия, эффективности и безопасности его применения. По результатам статистической обработки полученных характеристик эффективности диагностическая чувствительность исследуемого медицинского изделия составила 90,1 %, диагностическая специфичность - 95,9 %, доля ложноотрицательных результатов - 9,9 %. Воспроизводимость результатов - 100 %. В процессе испытаний наборы продемонстрировали высокую надежность.
Ген egfr, метод пцр-рв, тест-egfr, немелкоклеточный рак легкого
Короткий адрес: https://sciup.org/14344326
IDR: 14344326 | УДК: 575.2
Текст научной статьи Результаты испытания набора реагентов для определения статуса мутаций гена EGFR методом ПЦР-РВ (тест-EGFR) для диагностики in vitro в клинической практике
В последнее десятилетие второй по распространенности причиной смертности, после сердечно-сосудистых заболеваний, стали онкологические болезни. Это связано с несколькими факторами, во-первых – с увеличением продолжительности жизни, во-вторых – с изменением доступности и качества методов диагностики. Однако наиболее доступные методы диагностики дают неоднозначные результаты [1, 3, 5].
В настоящее время выходят на первый план детекции мутаций методом ПЦР-РВ. Методы молекулярных тестов позволяют выявить наследственно обусловленные формы рака, вызванные мутациями, передающимися из поколения в поколение, обеспечить эффективное применение таргетных препаратов, увеличить эффективность и снизить себестоимость лечения [1, 2, 4, 5].
Компанией ООО «ТестГен» разработан набор реагентов, который предназначен для профессионального применения в медицинских организациях и клинико-диагностических лабораториях онкологического профиля для обследовании пациентов с диагнозом метастатический немелкоклеточный рак легкого (НМРЛ) III-IV стадии с целью качественного определения статуса мутаций L858R, T790M и делеции (del) в 19 экзоне гена EGFR методом ал-лель-специфической ПЦР в режиме реального времени в пробе свободно циркулирующей ДНК, содержащей опухолевую ДНК, выделенной из плазмы крови, для определения показаний к таргетной терапии низкомолекулярными ингибиторами тирозинкиназы EGFR и мониторинга ответа на них.
Одним из первых методов определения соматических мутаций в гене EGFR было секвенирование по Сэнгеру, которое предполагало анализ всей кодирующей области. Однако этот метод имеет низкую чувствительность, поэтому были разработаны более чувствительные способы, основанные на прямом анализе мутаций и делеций гена EGFR. Современные методы анализа соматических мутаций представляют собой либо таргетноесеквенирование генов, либо полногеномное/полноэкзомноесеквенирование. Однако это дорогостоящие методы. Также следует отметить, что в молекулярно-генетических исследованиях используют преимущественно ДНК, выделенную непосредственно из опухолевой ткани, но при прогрессировании заболевания существуют трудности с получением материала для проведения ПЦР, поскольку опухоль часто является гетерогенной и имеет различные молекулярногенетические профили. Поэтому наиболее перспективным представляется определение содержания маркеров циркулирующей в плазме крови опухолевой ДНК (цДНК). За счёт лизиса опухолевых клеток количество цДНК в плазме увеличивается, особенно существенно это происходит на поздних стадиях заболевания.
Таким образом целью нашей работыявляется анализ результатов испытания набора реагентов для определения статуса мутаций гена EGFR методом ПЦР-РВ (Тест-EGFR) для внедрения его в клинико-лабораторную практику.
Для реализации поставленной цели предстояло решить следующие задачи:
-
- изучить соответствие набора реагентов своему назначению;
-
- определить эффективность медицинского изделия для диагностики invitro в соответствии с предназначенным производителем применением медицинского изделия по назначению;
-
- определить качество набора реагентов, эффективность и безопасность его применения.
Материалы и методы. На базе ГАУЗ «Республиканского клинического онкологического диспансера МЗ РТ» в период с «05» июня 2017 г. по «10» июля 2017 были проведены клинические испытаниямедицинского изделиядля диагностики invitro«Набор реагентов для определения статуса мутаций гена EGFR методом ПЦР-РВ (Тест-EGFR) по ТУ 9398-00497638376-2015 в исполнениях: 1) «Тест-EGFR-12» на 12 определений, 2) «Тест-EGFR-24» на 24 определения» производства ООО «ТестГен», в соответствии с Приказом Министерства Здравоохранения РФ от 9 января 2014 г. N 2н.
Набор реагентов «Тест-EGFR» рекомендуется пациентам с диагнозом метастатический немелкоклеточный рак легкого (НМРЛ) III-IV стадиидля определения показаний к таргетной терапии низкомолекулярными ингибиторами тирозинкиназы EGFR и мониторинга ответа на них.
Общее время проведения анализа составляет 2–2,5 ч.
Аналитические характеристики набора представлены таблице 1.
Таблица 1
Аналитические характеристики набора реагентов «Тест-EGFR»
|
Аналитическая специфичность |
Специфичен по отношению к мутациям L858R, T790M и делеции (del) в 19 экзоне гена EGFR |
|
Аналитическая чувствительность |
1 копия гена EGFR в 1 мкл раствора ДНК |
|
Диапазон определяемых концентраций ДНК |
От 1 до 1000 копий гена EGFR в 1 мкл раствора ДНК |
|
Результат теста, соответствующий норме |
Отсутствие мутаций L858R, T790M и делеции (del) в 19 экзоне гена EGFR |
В качестве субъектов клинического испытания было использовано 50 образцов свободно циркулирующей ДНК, выделенной из плазмы крови от пациентов с диагнозом метастатический немелкоклеточный рак легкого (НМРЛ) III-IV стадии, полученных из банка остаточных аликвот цельной плазмы крови в процессе рутинной лечебно-диагностической практики ГАУЗ «Республиканский клинический онкологический диспансер МЗ РТ», достаточных по объемам и удовлетворяющие параметрам программы клинического испытания.
В 28 предоставленных образцах мутантная ДНК гена EGFR не была обнаружена и в 22 образцах – обнаружена. Статус мутаций гена EGFR был известен и установлен до проведения клинических испытаний регистрируемого набора реагентов в ходе лечебнодиагностического процесса с помощью зарегистрированного Набора реагентов для определения соматических мутаций в гене EGFR «Therascreen® EGFR RGQ PCR Kit (24)» на 24 образца, производства «Киаген Манчестер Лимитед», Великобритания, регистрационное удостоверение № ФСЗ 2012/12826 от 05.09.2012.
Каждый из 50 образцов подвергался анализу для установления статуса мутаций L858R, T790M и делеций (del) в 19 экзоне гена EGFR методом аллель-специфической ПЦР в режиме реального времени.
Статус мутаций L858R, T790M и делеций (del) в 19 экзоне гена EGFR в образцах под номерами 1-12 был установлен с помощью исследуемых образцов наборов реагентов «Тест-EGFR-12» (LOT: 1704-350) и «Тест-EGFR-24» (LOT: 1704-355), в образцах под номерами 13–24 с помощью наборов реагентов «Тест-EGFR-12» (LOT: 1704-351) и «Тест-EGFR-24» (LOT: 1704-355), в образцах под номерами 25–36 с помощью наборов реагентов «Тест-EGFR-12» (LOT: 1704-352) и «Тест-EGFR-24» (LOT: 1704-356), в образцах под номерами 37–48 с помощью наборов реагентов «Тест-EGFR-12» (LOT: 1704-353) и «Тест-EGFR-24» (LOT: 1704-356), в образцах под номерами 49–50 с помощью наборов реагентов «Тест-EGFR-12» (LOT: 1704-354) и «Тест-EGFR-24» (LOT: 1704-357).
Для экстракции ДНК из плазмы крови использовали комплект реагентов для экстракции РНК/ДНК из клинического материала «АмплиПрайм МАГНО-сорб» по ТУ 9398-00409286667-2012, вариант 100–1000 для выделения ДНК из 100 проб (НекстБио, Россия), регистрационное удостоверение № ФСР 2012/13824 от 18.09.2013.
Полученная ДНК должна храниться при температуре +4 °С и использоваться для анализа в течение 12 часов.
Определение статуса мутаций L858R, T790M и делеции (del) в 19 экзоне гена EGFR исследуемым набором реагентов «Тест-EGFR» в препарате нуклеиновых кислот (НК), полученном из клинического образца, методом полимеразной цепной реакции с гибридизационно-флуоресцентной детекцией включало в себя три этапа:
-
1) ПЦР-амплификацию ДНК;
-
2) гибридизационно-флуоресцентную детекцию, которая производится во время прохождения ПЦР;
-
3) интерпретацию результатов.
С пробами ДНК были проведены реакции амплификации участков гена EGFR в реакционном буфере при помощи специфичных к этим участкам ДНК праймеров и фермента Taq-полимеразы. В составе реакционной смеси для амплификации присутствуют аллель-специфичные праймеры и флуоресцентно-меченые олиго-нуклеотидные зонды, которые гиб-ридизуются с комплементарным участком амплифицируемой ДНК-мишени и разрушаются Taq-полимеразой, в результате чего происходит нарастание интенсивности флуоресценции. Это позволяет регистрировать накопление специфического продукта амплификации путем измерения интенсивности флуоресцентного сигнала. Детекция флуоресцентного сигнала осуществляется непосредственно в ходе ПЦР с помощью амплификатора с системой детекции флуоресцентного сигнала в режиме «реального времени».
Для проведения ПЦР с детекцией в режиме «реального времени» использовали ампли-фикатор планшетного типа «ДТпрайм» («ДНК – Технология», Россия).
Далее провели анализ кривых накопления флуоресцентного сигнала по одному каналу:
-
– по каналу FAM/Green в реакционной смеси Норма регистрируется сигнал, свидетельствующий о накоплении продуктов амплификации ДНК нормального варианта гена EGFR ;
-
– по каналу FAM/Green в реакционных смесях del , L858R , T790M регистрируется сигнал, свидетельствующий о накоплении продуктов амплификации ДНК мутантных вариантов гена EGFR иделеций в экзоне 19.
Полученные результаты интерпретировали на основании данных об уровне флуоресцентного сигнала относительно фона по соответствующим каналам для контрольных образцов и проб ДНК, выделенных из исследуемых образцов. Интерпретация производилась с помощью программного обеспечения используемого амплификатора «ДТпрайм» («ДНК – Технология», Россия).
После проведения анализа предоставленными образцами набора реагентов «Тест-EGFR» и интерпретации результатов, полученные данные сравнивались с результатами ПЦР, проведённых в ходе лечебно-диагностического процесса с помощью Набора реагентов для определения соматических мутаций в гене EGFR «Therascreen® EGFR RGQ PCR Kit (24)» на 24 образца, производства «Киаген Манчестер Лимитед», Великобритания, регистрационное удостоверение № ФСЗ 2012/12826 от 05.09.2012, по стандартной методике производителя. Свидетельством правильности работы исследуемых медицинских изделий было совпадение результатов.
Также проведен статистический анализ результатов исследования.
Результаты исследований. В 28 предоставленных образцах мутантная ДНК гена EGFR не была обнаружена и в 22 образцах – обнаружена. Статус мутаций гена EGFR был известен и установлен до проведения клинических испытаний регистрируемого медицинского изделия в ходе лечебно-диагностического процесса с помощью зарегистрированного Набора реагентов для определения соматических мутаций в гене EGFR «Therascreen® EGFR RGQ PCR Kit (24)» на 24 образца, производства «Киаген Манчестер Лимитед», Великобритания, регистрационное удостоверение № ФСЗ 2012/12826 от 05.09.2012.
Сводные результаты клинических испытаний представленных образцов медицинского изделия в сравнении с результатами ПЦР, проведенных с помощью зарегистрированного медицинского изделия, Набора реагентов для определения соматических мутаций в гене EGFR «Therascreen® EGFR RGQ PCR Kit (24)» на 24 образца («Киаген Манчестер Лимитед», Великобритания, № ФСЗ 2012/12826 от 05.09.2012), приведены в таблице 2.
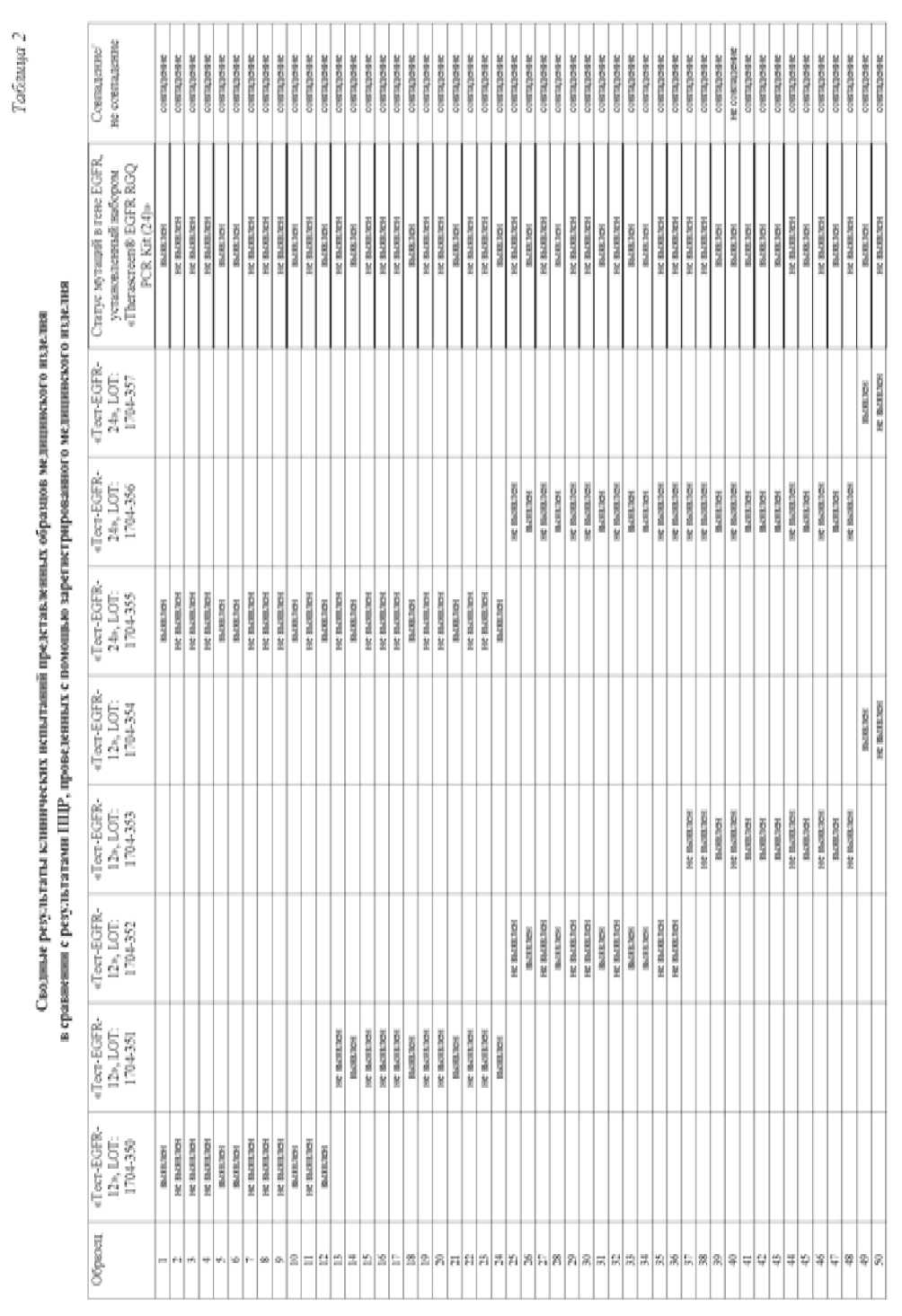
В ходе проведения клинических испытаний было проанализировано 50 образцов плазмы крови и был выявлен 1 ложноотрицательный результат. Это может быть связано с неверной пробоподготовкой на этапе выделения или хранения ДНК, неустойчивостью продуктов ПЦР и другими факторами.
Анализ и оценка результатов проведенных клинико-лабораторных испытаний медицинского изделия подтвердили соответствие качества медицинского изделия, эффективности и безопасности его применения. По результатам статистической обработки полученных характеристик эффективности диагностическая чувствительность исследуемого медицинского изделия составила 90,1 %, диагностическая специфичность 95,9 %, доля ложноотрицательных результатов 9,9 %.
Воспроизводимость результатов 100 %. В процессе испытаний наборы продемонстрировали высокую надежность.
Выводы. В результате проведенных клинических испытаний в форме клиниколабораторных испытаний установлено: «Набор реагентов для определения статуса мутаций гена EGFR методом ПЦР-РВ (Тест-EGFR) по ТУ 9398-004-97638376-2015 в исполнениях: 1) «Тест-EGFR-12» на 12 определений, 2) «Тест-EGFR-24» на 24 определения», производства ООО «ТестГен» безопасен и клинически эффективен при использовании по назначению, установленному производителем.
-
1. Результаты проведенных испытаний подтверждают эффективность и безопасность применения медицинского изделия «Набор реагентов для определения статуса мутаций гена EGFR методом ПЦР-РВ (Тест-EGFR) по ТУ 9398-004-97638376-2015 в исполнениях: 1) «Тест-EGFR-12» на 12 определений, 2) «Тест-EGFR-24» на 24 определения», производства ООО «ТестГен».
-
2. Изделие может применяться в медицинских учреждениях и клинико-диагностических лабораториях онкологического профиля. Область применения набора реагентов – клиническая лабораторная диагностика, онкология.
-
3. Отклонения от алгоритма выполнения клинических испытаний отсутствовали.
В ходе клинических испытаний медицинского изделия были выявлены следующие достоинства:
-
1) удобство при использовании: изделие представляет собой набор реагентов готовых к использованию;
-
2) медицинское изделие позволяет проводить качественное определение статуса мутаций L858R, T790M и делеций (del) в 19 экзоне гена EGFR методом аллель-специфической ПЦР в режиме реального времени в пробе свободно циркулирующей ДНК, содержащей опухолевую ДНК, выделенной из плазмы крови, с высокими показателями диагностической чувствительности (90,1 %) и диагностической специфичности (95,9 %). Доля ложноотрицательных результатов 9,9 %. Воспроизводимость результатов 100 %. В процессе испытаний наборы продемонстрировали высокую надежность.
Список литературы Результаты испытания набора реагентов для определения статуса мутаций гена EGFR методом ПЦР-РВ (тест-EGFR) для диагностики in vitro в клинической практике
- Бровкина О.И., Гордиев М.Г., Тороповский А.Н. и др. Определение соматических мутаций в гене EGFR в тканях и плазме больных немелкоклеточным раком легкого//Биомедицинская химия. -2016. -Т. 62, № 6. -С. 638-644.
- Емельянова М.А., Мазуренко Н.Н., Гагарин И.М. и др. Определение мутаций в гене EGFR при немелкоклеточном раке легкого с помощью биологических микрочипов//Вестник РОНЦ им. Н.Н. Блохина РАМН. -2012. -Т. 23, № 3. -С. 15-23.
- Цветкова Л.А. Исследование различных видов рака на наличие мутаций в гене EGFR с помощью HRM-анализа//Студенческая наука -2015. В рамках юбилейных мероприятий, посвященных 110-летию со дня основания клиники и 90-летию основания университета -СПб.: Санкт-Петербургский государственный педиатрический медицинский университет, 2015. -С. 62.
- Шикеева А.А., Кекеева Т.В., Завалишина Л.Э. и др. Анализ молекулярно-генетических изменений в гене EGFR у пациентов с НМРЛ//Онкохирургия. -2011. -Т. 3, № 2. -С. 87-88.
- Якунина Е.Ю., Мошев А.В., Модестов А.А. Определение мутации гена EGFR у пациентов с немелкоклеточным раком легкого//Сибирское медицинское обозрение. -2016. -Т. 101, № 5. -С. 112-113.


