Результаты исследования безопасности радиофармацевтического лекарственного препарата на основе микросфер альбумина диаметром 5-10 мкм, меченных рением-188
Автор: Петросян К.М., Крылов В.В., Луговая А.В., Власова О.П., Сигов М.А., Степаненко В.Ф., Богачева В.В., Тищенко В.К., Спиченкова О.Н., Иванов С.А., Каприн А.Д.
Рубрика: Научные статьи
Статья в выпуске: 4 т.34, 2025 года.
Бесплатный доступ
Хронические воспалительные заболевания суставов, такие как ревматоидный, псориатический, реактивный артрит, анкилозирующий спондилоартрит и ряд других болезней приводят к значительным потерям качества жизни и нередко становятся причиной инвалидности. Одним из проявлений этих заболеваний являются рецидивирующие синовиты, которые прогрессируют, несмотря на проводимую терапию. В зарубежной клинической практике в лечении таких пациентов хорошо себя зарекомендовал метод радиосиновэктомии (РСЭ), основанный на внутрисуставном введении препаратов, содержащих радиоактивные частицы, которые подвергают синовиальную оболочку контактному лучевому воздействию. В МРНЦ им. А.Ф. Цыба (г. Обнинск) для проведения РСЭ коленных суставов был разработан радиофармацевтический лекарственный препарат (РФЛП) на основе микросфер альбумина крови человека диаметром 510 мкм, меченных рением188 («МСА 510 мкм, 188Re», «АртроренМРНЦ»). Представлены результаты клинических исследований 1й фазы, цель которых – изучить переносимость, безопасность и фармакокинетику препарата при проведении РСЭ коленного сустава (однократное внутрисуставное введение для лечения хронического рецидивирующего синовита); исследовать эффективность препарата при возрастающей активности (370, 555, 740 и 925 МБк), оценить влияние РСЭ с использованием исследуемого РФЛП на качество жизни пациентов, изучить радиационное воздействие на медицинский персонал. 20 пациентам (1875 лет) с рецидивирующими хроническими синовитами коленного сустава была проведена РСЭ с введением «МСА 510 мкм, 188Re» активностью от 370 до 925 МБк. После введения были выполнены планарная сцинтиграфия и ОФЭКТ/КТ коленного сустава через 24, 48 и 72 ч после введения, радиометрия мочи в течение 48 ч после РСЭ и оценка поглощённых доз внутреннего облучения синовиальной оболочки и органов риска. Поглощённые дозы, сформированные после РСЭ в коленном суставе у пациентов, находились в пределах от 17,5 до 74 Гр, а дозы в органах риска оказались многократно ниже общепринятых дозовых ограничений. Продемонстрирована высокая безопасность и хорошая переносимость РФЛП («МСА 510 мкм,188Re»). Активность препарата 740 МБк оказалась оптимальной с точки зрения безопасности и эффективности при проведении РСЭ коленного сустава.
Ядерная медицина, лучевая терапия, радиосиновэктомия, синовит, коленный сустав, микросферы альбумина, 188Re, радиофармпрепарат, «Артрорен-МРНЦ», клинические испытания, поглощённая доза
Короткий адрес: https://sciup.org/170211347
IDR: 170211347 | УДК: 616.728.3-018.36-002:615.846.2:[615.362.124+546.719.02.188 | DOI: 10.21870/0131-3878-2025-34-4-160-172
Текст научной статьи Результаты исследования безопасности радиофармацевтического лекарственного препарата на основе микросфер альбумина диаметром 5-10 мкм, меченных рением-188
Воспалительная патология суставов является очень распространённой и значимой медикосоциальной проблемой, весьма негативно влияющей на физическую активность и трудоспособность [1]. Для лечения больных с артритами применяется широкий спектр методов системного воздействия (противовоспалительная терапия нестероидными препаратами и стероидами, различные виды базисной терапии и др.), а также методы локальной терапии (внутрисуставные введения стероидов и других препаратов), хирургическое лечение.
Петросян К.М. * – врач-радиолог; Крылов В.В. – зав. отд., д.м.н.; Луговая А.В. – врач-радиолог; Власова О.П. – вед. науч. сотр, к.б.н.; Сигов М.А. – и.о. зав. отд.; Степаненко В.Ф. – зав. лаб., д.б.н.; Богачева В.В. – ст. науч. сотр., к.б.н.; Тищенко В.К. – и.о. зав. лаб., д.б.н.; Спиченкова О.Н. – вед. Инженер; Иванов С.А. – директор, чл.-корр. РАН, д.м.н., проф. каф. РУДН. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России. Каприн А.Д. – ген. директор, директор МНИОИ им. П.А. Герцена, зав. каф. РУДН, акад. РАН, д.м.н., проф. ФГБУ «НМИЦ радиологии» Минздрава России.
Радиосиновэктомия (РСЭ) – метод локальной терапии артритов, сопровождающихся синовитами, направленный на стойкое подавление воспаления в синовиальной сумке сустава. Метод может применяться при различных нозологических формах, но показанием к выполнению РСЭ во всех случаях является синовит, резистентный к стандартным методам лечения [2-4]. Частота встречаемости синовитов растёт, составляя по данным разных авторов от 9 до 33% патологии суставов [3, 5].
Синовит без своевременного лечения имеет тенденцию к прогрессированию, которое приводит к деструкции тканей сустава. Воспалительный процесс, как правило, реализуется через усиленную выработку провоспалительных цитокинов, патологическую активацию лимфоцитов и усиленную выработку протеолитических ферментов, усиливающих резорбцию хряща и кости [6].
РСЭ является достаточно эффективным и надёжным методом локальной терапии: малотравматичным, простым в использовании и не требующим длительной реабилитации [3, 7-9].
Как описано в исследовании Р. М. Балабановой и соавт. [3], «принцип терапевтического действия бета-излучающего радионуклида основан на воздействии β -частиц на синовиальную оболочку сустава. Введённый препарат захватывается путём фагоцитоза клетками поверхностного эпителия синовиальной оболочки, оказывая тем самым повреждающее действие. За счёт локального облучения ткани воспалённой синовиальной оболочки сустава в ней вызывается процесс абляции, т.е. гибели функционально активных клеток, ответственных за поддержание воспаления. В исходе такого воздействия обычно возникает поверхностный фиброз синовии. Клинически в случаях положительного результата определяется снижение болей и проявлений активного воспаления» [3, 9].
Положительный мировой опыт использования РСЭ диктует необходимость внедрения этого метода в отечественную клиническую практику, что определяет актуальность данного исследования [10]. Для проведения РСЭ используются внутрисуставно вводимые радиофармацевтические лекарственные препараты (РФЛП), содержащие различные бета-излучающие радионуклиды (198Аu, 90Y, 32Р, 169Er, 166Но, 186Re, 188Re и др.) [11].
Особое место в этом ряду занимает 188Re, получаемый посредством генератора вольфрам-188/рений-188 (188W/188Re), «который может располагаться непосредственно в лечебном учреждении. Достаточно длительный период полураспада материнского радиоизотопа 188W (Т 1/2 =64,9 сут) обеспечивает возможность работы генератора в течение нескольких месяцев. Энергия бета( β ¯)-излучения (максимальная энергия бета-частиц 2,12 МэВ, средняя энергия – 0,763 МэВ) и период полураспада дочернего радионуклида 188Re (Т 1/2 =16,9 ч)» позволяют достигать высоких локальных поглощённых доз. За счёт наличия низкоэнергетического γ -излучения (155 кэВ) можно визуализировать распределение РФЛП в организме пациента [12].
Логистические преимущества радионуклида и ядерно-физические свойства 188Re позволяют предположить возможность организации «рениевой платформы» в радионуклидной терапии, подобной той, что сформирована в радионуклидной диагностике на основе технеция-99m (99мТс) [13].
В настоящем клиническом исследовании был использован РФЛП, произведённый заводом «Медрадиопрепарат» с использованием элюата стационарного 188W/188Re генератора. Однако для более удобной пользовательской логистики следует рассмотреть генератор ГРЕН-1, производства АО «ГНЦ РФ – ФЭИ» (Обнинск), который можно размещать непосредственно в лечебном учреждении (при наличии у него соответствующих разрешительных документов) [14].
Генератор ГРЕН-1 (ТУ 26.60.11-031-08624390-2006) предназначен для применения в специализированных (лицензия Ростехнадзора и санэпидемзаключение на работу с радионуклидом 188Re) медицинских организациях для многократного получения стерильного раствора перрената натрия с 188Re, применяемого для изготовления РФЛП с помощью специальных наборов реагентов (приказ Минздрава России от 27.04.2015 г. № 211н «Об утверждении Порядка изготовления радиофармацевтических лекарственных препаратов непосредственно в медицинских организациях»). Полученные таким образом РФЛП сразу после изготовления и проведения контроля качества используют в медицинских организациях для проведения радионуклидной терапии пациентов с различными онкологическими и неонкологическими заболеваниями.
Генератор сорбционный двухигольчатый изготовлен из радиационно-стойких материалов, обеспечивающих и сохраняющих механическую прочность и способность ослабления ионизирующего излучения. Материалом сорбционной колонки генератора служит оксид алюминия (Al 2 O 3 ). Мощность излучения на поверхности генератора составляет 80 мкЗв/(ч х ГБк) (ГигоБеккерели). Масса генератора составляет 16 кг. Генератор поставляется в медицинские организации в виде целостной конструкции и не подлежит разбору (рис. 1).

Рис. 1. Генератор 188Re ГРЕН-1 с принадлежностями.
Оптимальное время, необходимое для накопления максимально возможной активности радионуклида 188Re в генераторе, составляет 3 сут (рис. 2). Устройство генератора представлено на рис. 3. Срок службы генератора (в зависимости от начальной активности и интенсивности использования) составляет от 40 до 200 сут.
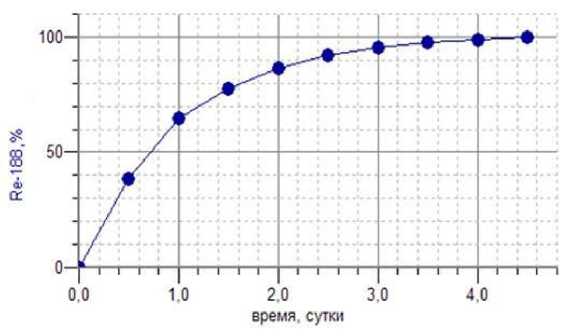
Рис. 2. Накопление 188Re в системе генератора.
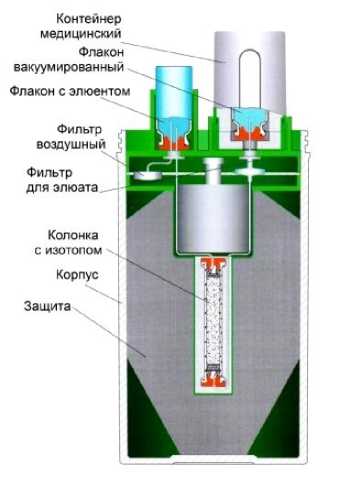
Рис. 3. Устройство генератора 188Re ГРЕН-1.
На основании выполненных в 2015-2017 гг. «в рамках ФЦП Фарма-2020 (Государственный контракт № 14.N08.11.0055 от 20.10.2015 г.) доклинических исследований РФЛП «Микросферы альбумина 5-10 мкм, 188Re» в МРНЦ им. А.Ф. Цыба – филиале ФГБУ «НМИЦ радиологии» Минздрава России, а также разработанной заводом «Медрадиопрепарат» нормативной документации и опытно-промышленного регламента на производство РФЛП «Микросферы альбумина 5-10 мкм, 188Re», в 2021-2023 гг. было получено разрешение на проведение клинического исследования 1-й и 2-й фаз этого РФЛП по протоколу № МСА 5-10 мкм, 188Re «Открытое несравнительное клиническое исследование. Проведение исследований безопасности и терапевтической эффективности разработанного радиофармпрепарата (РФЛП) на основе микросфер альбумина 5-10 мкм, меченных 188Re для процедуры радиосиновэктомии при местном лечении хронических воспалительных заболеваний суставов», версия 2 от 22.02.2022 г. (РКИ № 198 от 28.03.2022 г.)» [15]. Таким образом, цель данной работы – изучить переносимость, безопасность и фармакокинетику препарата при проведении РСЭ коленного сустава (однократное внутрисуставное введение для лечения хронического рецидивирующего синовита); исследовать эффективность препарата при возрастающей активности (370, 555, 740 и 925 МБк), оценить влияние РСЭ с использованием исследуемого РФЛП на качество жизни пациентов, изучить радиационное воздействие на медицинский персонал.
Материалы и методы
РФЛП «Микросферы альбумина 5-10 мкм, 188Re» (коммерческое название «Артрорен-МРНЦ») для данного исследования производился на заводе «Медрадиопрепарат» ФМБА России и доставлялся в медицинскую организацию в готовой для использования форме в день введения пациенту.
РФЛП представляет собой суспензию желтовато-бежевого цвета. Состав представлен активными (188Re в виде натрия перрената и альбумин человека в виде микросфер 5-10 мкм) и вспомогательными веществами (аскорбиновая кислота, олова дихлорид 2 водный, полисорбат-80, калий-натрий тартрат тетрагидарт, раствор натрия хлорида 0,9%).
В исследовании 1-й фазы приняли участие 20 пациентов (10 мужчин и 10 женщин) 1949-1994 г.р. с воспалительными заболеваниями суставов, сопровождающимися синовитами, устойчивыми к стандартной терапии (включая внутрисуставные введения глюкокортикоидов).
Критериями включения пациентов являлись:
– возраст от 18 до 75 лет;
– наличие рецидивирующего синовита, устойчивого к стандартной противовоспалительной и базисной терапии, включая внутрисуставное введение глюкокортикоидов (прогрессирование после 1 и более введений).
Для женщин репродуктивного возраста перед процедурой введения РФЛП и в течение 1 мес. после неё было рекомендовано соблюдение контрацепции. Для мужчин репродуктивного возраста соблюдение контрацепции рекомендовано в течение 1 мес. после процедуры РСЭ.
Критериями невключения пациентов являлись:
– возраст моложе 18 лет или старше 75;
– беременность, грудное вскармливание;
– сопутствующие заболевания и состояния, препятствующие проведению лечебных и/или диагностических мероприятий и/или затрудняющих их интерпретацию.
Критериями исключения пациентов являлись:
– отказ пациента на любом из этапов исследования;
– необходимость назначения лечения, исключающего возможность объективной оценки результатов клинического исследования.
Пациенты были последовательно набраны в 4 группы по 5 человек. Было выполнено исследование возрастающих активностей РФЛП. Первая группа получила по 370 МБк. После 4-недельного наблюдения пациентам 2 группы было введено по 555 МБк, затем через такой же период наблюдения пациенты 3 группы получили по 740 МБк, и в завершении исследования 4-я группа получила по 925 МБк.
После введения РФЛП пациенты в течение 72 ч находились в стационаре под наблюдением медицинского персонала, где им проводили плановые лабораторные исследования, УЗИ коленного сустава, планарную сцинтиграфию и ОФЭКТ/КТ коленного сустава через 24, 48 и 72 ч после процедуры.
Cцинтиграфическое исследование пациентов выполнялось на гибридной системе Discovery NM/CT 670 (GE Healthcare) в режиме «whole body» с утверждёнными ранее параметрами: скорость движения деки стола - 18 см/мин, матрица 256 x 1024 пикселей. ОФЭКТ/КТ выполнялось с параметрами сканирования: 20 с/проекция, 60 проекций, матрица 128 x 128 пикселей. При получении посттерапевтических изображений на ОФЭКТ/КТ в обязательном порядке производилась коррекция рассеивания и поглощения с применением рентгеновской компьютерной томографии, выполненной в режиме «low dose» (120 кВ и 80 мА). В работе были использованы следующие параметры: коллиматор для высоких энергий общего назначения (high energy general purpose, HEGP), центр фотопика для изотопа 188Re установлен на 155 кэВ с шириной окна дискриминации ± 10%. Для обработки посттерапевтических изображений и проведения количественного анализа, для оценки уровня накопления РФЛП в полости коленного сустава и органах-мишенях применялась специализированная программа «Q.Metrix» из официального программного обеспечения Xeleris 3.2 (GE Healthcare). Определение чувствительности ОФЭКТ/КТ системы и получение количественных параметров выполнялось согласно инструкциям производителя.
Также была выполнена радиометрия мочи испытуемых в течение двух суток после РСЭ и дозиметрическое сопровождение медицинских специалистов, задействованных во введении РФЛП. Так же, как в исследовании Е.Д. Степченковой и соавт. [16], «для радиометрии применяли метод, общепринятый при проведении клинических исследований РФЛП. Активность (МБк) образцов измеряли на дозкалибраторе РИС-А1 (OOO «НТЦ Амплитуда»). Скорость счёта (имп./мин) образцов измеряли на автоматическом гамма-счётчике 2480 Wizard2 (PerkinElmer, Inc). У пациентов, которым вводили РФЛП, в контейнеры для биопроб (ООО «ГЕМ») собирали мочу в течение 48 ч после проведения РСЭ, начиная с момента времени после введения РФЛП. Для минимизации контакта персонала с пациентами и для снижения рисков радиоактивного загрязнения помещений, мочеиспускание пациентов осуществлялось в свободном режиме, однако фиксировался объём собранной мочи за каждое мочеиспускание и время мочеиспускания. Образцы проб мочи пациентов передавали в лабораторию экспериментальной ядерной медицины МРНЦ им. А.Ф. Цыба, помещали в шкафы вытяжные радиохимические ШВ-2РА (АО «В/О Изотоп»). Измерения радиоактивности проб мочи проводили с учётом времени распада радионуклида 188Re, отсчитываемого от даты и времени введения РФЛП» [16].
Аналогично методам исследования В.Ф. Степаненко и соавт. [17], «оценка величин доз внутреннего облучения очагов и органов риска пациентов, включённых в фазу 1 клинического исследования, проводилась в соответствии с общей схемой Medical Internal Radiation Dose Committee (MIRD), с применением разработанного в ФГБУ «НМИЦ радиологии» комплекса программ для расчётов поглощённых доз внутреннего облучения, включающего специализированные базы данных с информацией о величинах поглощённых долей энергии бета- и гамма-излучения в органах и тканях людей различных возрастных и весовых категорий» и с использованием полученных при проводимых клинических исследованиях индивидуальных данных об анатомических и топометрических характеристиках очагов и органов риска пациентов, величин и динамики активности РФЛП в них [18]. Проведена оценка величин доз локального облучения пальцев кистей рук и глаз специалистов, проводящих введение радиофармацевтических лекарственных препаратов пациентам, c применением разработанной в ФГБУ «НМИЦ радиологии» методики локальной дозиметрии [18, 19].
Результаты
Нежелательные реакции/явления. У всех пациентов 4-й группы, которым вводили максимальную активность РФЛП (925 МБк), было зарегистрировано нежелательное явление в виде временного радиосиновита, который выражался в отёке коленного сустава, болях при активном движении. Для лечения применялись нестероидные противовоспалительные средства местно (мази и гели). Симптомы были купированы в течение 2-3 недель. В связи с развитием радиосиновита после введения 925 МБк было принято решение отказаться от использования этой активности при проведении 2-й фазы клинического исследования.
На протяжении всего клинического исследования 1-й фазы серьёзные нежелательные явления зарегистрированы не были.
Оценка клинико-лабораторных показателей. Гематологические показатели после проведения РСЭ не продемонстрировали заметных отклонений. Уровни СОЭ и СРБ за время наблюдения клинически значимо не менялись через 24, 48, 72 ч и 4 недели после введения. Следует отметить, что метод РСЭ является видом локальной терапии, чем следует объяснить отсутствие заметного системного воздействия.
Результаты радиометрических исследований. Выведение 188Re с мочой в течение 48 ч варьировали от 0,15 до 2,91%.
Индивидуальные поглощённые дозы внутреннего облучения очагов (коленный сустав) и органов риска пациентов. В табл. 1 указаны показатели индивидуальных поглощённых доз внутреннего облучения очагов и органов риска пациентов 1-й фазы клинического исследования (20 человек).
Таблица 1
Поглощённые дозы внутреннего облучения визуализированных очагов и органов риска пациентов
|
Номер пациента |
Поглощённая доза, Гр |
|||
|
Очаг (коленный сустав) |
Правая почка |
Левая почка |
Мочевой пузырь |
|
|
001 |
28,6 |
0,11 |
0,093 |
0,054 |
|
002 |
23,1 |
0,071 |
0,062 |
0,075 |
|
003 |
71 |
0,13 |
0,12 |
0,052 |
|
004 |
29,4 |
0,034 |
0,2 |
0,019 |
|
005 |
36,1 |
0,,14 |
0,13 |
0,031 |
|
006 |
19,4 |
0,19 |
0,17 |
0,21 |
|
007 |
42,8 |
0,33 |
0,36 |
0,16 |
|
008 |
33,7 |
0,14 |
0,11 |
0,089 |
|
009 |
17,5 |
0,42 |
0,36 |
0,6 |
|
010 |
26,8 |
0,26 |
0,18 |
0,28 |
|
011 |
56,9 |
0,46 |
0,37 |
0,11 |
|
012 |
64,7 |
0,39 |
0,47 |
0,18 |
|
013 |
63,6 |
0,35 |
0,32 |
0,068 |
|
014 |
65,9 |
0,44 |
0,44 |
0,25 |
|
015 |
64,8 |
0,42 |
0,44 |
0,091 |
|
016 |
28,1 |
0,18 |
0,17 |
0,15 |
|
017 |
25 |
0,27 |
0,23 |
0,11 |
|
018 |
49,5 |
0,27 |
0,26 |
0,27 |
|
019 |
65,8 |
0,13 |
0,14 |
0,3 |
|
020 |
73,7 |
0,2 |
0,18 |
0,12 |
У 20 пациентов 1-й фазы клинического исследования показатель индивидуальных поглощённых доз внутреннего облучения очагов и органов риска оказался различным и зависел от объёма очагов и органов риска, а также от величин введённых активностей.
Более высокие вводимые активности формируют более высокие дозы внутреннего облучения. Вместе с тем, в больших по объёму очагах (в суставах с более крупными суставными сумками, с более массивными выпотами и с большей площадью поверхности синовиальной оболочки) при той же самой величине введённой активности формируются меньшие дозы внутреннего облучения. В исследованной группе пациентов величины доз в пролеченных коленных суставах составляют от 17,5 до 74 Гр. Индивидуальные лучевые нагрузки на органы риска (мочевой пузырь, почки) – от 0,02 до 0,6 Гр, это значительно ниже принятых при проведении радионуклидной терапии дозовых ограничений [17].
На рис. 4 показаны изображения ОФЭКТ/КТ, проведённой спустя сутки после введения в коленный сустав 740 МБк РФЛП «МСА 5-10 мкм, 188Re». Визуализируется интенсивное равномерное распределение РФЛП в полости коленного сустава на фоне отображения костных структур. Процент включения РФЛП в коленный сустав на первые сутки составил 96,7% от введённой активности.
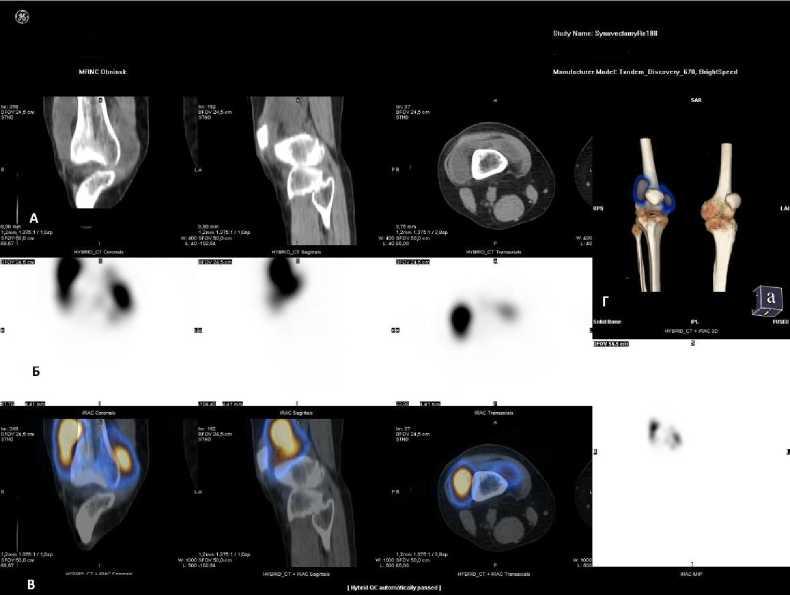
Рис. 4. А – КТ изображение исследуемого коленного сустава; Б – ОФЭКТ изображение после введения РФЛП «МСА 5-10 мкм, 188Re»; В – совмещённое ОФЭКТ/КТ после введения РФЛП «МСА 5-10 мкм, 188Re»; Г – 3D-реконструкция (MIP).
Определение локальных доз облучения медицинского персонала. Аналогично результатам, представленным в работе В.В. Крылова и соавт. [20], данное исследование показало, что «проведение работ, связанных с фасовкой, введением испытываемого РФЛП и последующим общением с пациентом, является безопасным с радиационной точки зрения. Величины индивидуальных локальных поглощённых доз облучения персонала, участвующего в фазе 1, составили для глаз – от 0,03 мГр до 3,9 мГр, для кистей рук – от 0,07 мГр до 11,3 мГр (за один лечебный цикл). При этом пределы доз облучения для персонала в соответствии с действующими нормами радиационной безопасности (НРБ-99/2009) составляют для кистей рук 500 мЗв/год, для хрусталика глаза – 150 мЗв/год» [20].
Заключение
Переносимость РСЭ с применением «МСА 5-10 мкм, 188Re» оказалась высокой у всех испытуемых, введение РФЛП не сопровождалось осложнениями, ни у одного пациента не отмечена гематологическая токсичность.
Однако, у всех 5 пациентов 4 группы через 4 недели после внутрисуставного введения 925 МБк «МСА 5-10 мкм, 188Re» были зарегистрированы жалобы на усиление отёчности и болей при активных движениях в исследуемом коленном суставе, что было расценено как нежелательное явление «радиосиновит», из-за чего было принято решение отказаться от данной активности при проведении 2 фазы исследования.
У всех пациентов при проведении сцинтиграфии всего тела и ОФЭКТ/КТ коленного сустава через 24, 48 и 72 ч наблюдалось накопление РФЛП только в полости коленного сустава.
Результаты исследования подтвердили выводы Е.Д. Степченковой и соавт. [16]: «В первые 48 ч после внутрисуставной инъекции РФЛП у всех пациентов выводится не более 3% от введённой активности препарата с постоянной скоростью выведения. Полученные данные косвенно свидетельствуют о высокой стабильности РФЛП «МСА 5-10 мкм, 188Re» in vivo » [16].
Величины накопленных поглощённых доз внутреннего облучения пораженных суставов составили от 17,5 до 74 Гр, а индивидуальные лучевые нагрузки на органы риска (почки, мочевой пузырь, кишечник) – от 0,02 до 0,6 Гр. Это значительно ниже принятых при проведении радионуклидной терапии дозовых ограничений.
Результаты представляемого клинического исследования согласуются с данными В.В. Крылова и соавт. [16] – проведение работ, связанных с фасовкой, введением испытываемого РФЛП и последующим общением с пациентом, является безопасным в соответствии с действующими нормами радиационной безопасности (НРБ-99/2009). Величины индивидуальных локальных поглощённых доз облучения персонала, участвующего в фазе 1 клинического исследования, составили для глаз – от 0,03 до 3,9 мГр, для кистей рук – от 0,07 до 11,3 мГр (за один лечебный цикл) [20].
Таким образом, проведённые клинические исследования 1-й фазы доказали высокую безопасность и хорошую переносимость РФЛП «МСА 5-10 мкм, 188Re» активностью 370-740 МБк при проведении радиосиновэктомии пациентам с рецидивирующими синовитами коленных суставов.


