Результаты клинических наблюдений пациентов с ВИЧ-инфекцией с некротическими процессами головки бедренной кости
Автор: Перецманас Е.О., Веселова Е.И., Герасимов И.А., Зубиков В.С., Рукин Я.А.
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Оригинальное исследование
Статья в выпуске: 3 (57), 2024 года.
Бесплатный доступ
Введение: заболевание ВИЧ-инфекцией часто сопровождается развитием аваскулярного некроза головки бедренной кости, однако патогенез этого процесса до сих пор не до конца изучен. В литературе встречаются единичные исследования, указывающие на прямое действие вируса иммунодефицита человека на остеоциты и остеобласты. В опубликованных ранее клинических наблюдениях нами приводились данные об обнаружении РНК вируса иммунодефицита человека непосредственно в очагах остеонекроза головки бедренной кости, в том числе и при неопределяемой вирусной нагрузке в крови [12].Цель исследования: представить первые результаты клинических наблюдений у пациентов с ВИЧ-инфекцией с некротическими процессами головки бедренной кости, у которых выявлена РНК ВИЧ в очаге костного некроза.Материалы и методы: в исследование были включены пациенты с ВИЧ-инфекцией и некрозами головки бедра с неопределяемой вирусной нагрузкой в плазме крови, у которых с помощью ПЦР определялась вирусная нагрузка в очагах деструкции кости (n=16).По результатам исследования биопсийного материала пациенты разделены на две группы по признаку наличия бактериального агента (коксит) и его отсутствия (асептический некроз). Группу коксит составили пациенты с деструкцией головки бедренной кости на фоне верифицированного инфекционного коксита (n=7), из них у двоих туберкулезный коксит и у пятерых неспецифический. Группу с асептическим некрозом головки бедренной кости составили пациенты без выявленной бактериальной нагрузки (n=9).Результаты: несмотря на отсутствие значимой разницы в группах по уровню CD4 Т-лимфоцитов, число пациентов с выраженным иммунодефицитом (CD4 Т-лимфоциты менее 350 кл/мкл) в группе с кокситом составило 42,9% (3/7), в группе с асептическим некрозом головки бедренной кости 22,2% (2/9), что предполагает при увеличении размеров выборки большую выраженность иммунодефицита у пациентов с кокситом. Вирусная нагрузка в очагах некроза у пациентов обеих групп была значительно выше неопределяемого уровня. Пациентам с кокситом на данном временном этапе осуществлялась установка цементного спейсера, насыщенного антимикробными препаратами в зависимости от индивидуальной чувствительности возбудителя. В группе пациентов с асептическим некрозом выполнялось одноэтапное эндопротезирование. В сроки наблюдения от 4-х до 16 месяцев в группе пациентов с кокситом средний балл по шкале Харриса после проведения первого этапа операции составил 61,2±2,4 (при поступлении 23,4±5,1), причем у обоих пациентов с туберкулезным кокситом отмечено прогрессирование местного специфического процесса. В группе с асептическим некрозом после лечения средний показатель по шкале Харриса составил 87,2±4,5 против 26,7±7,6 при поступлении, послеоперационных осложнений в наблюдаемый период не отмечено.
Вич, вирус иммунодефицита человека, артрит, некроз головки бедренной кости
Короткий адрес: https://sciup.org/142243244
IDR: 142243244 | УДК: 617.3 | DOI: 10.17238/2226-2016-2024-3-32-40
Текст научной статьи Результаты клинических наблюдений пациентов с ВИЧ-инфекцией с некротическими процессами головки бедренной кости
THE DEPARTMENT OF TRAUMATOLOGY AND ORTHOPEDICS
Распространенность воспалительных заболеваний суставов среди пациентов с ВИЧ-инфекцией варьирует от 3 до 71 % [1, 2]. Исследователями отмечается частое выявление остеонекротических процессов головки бедренной кости у данной категории пациентов [3, 4, 5, 6]. Результаты систематического обзора и их мета-анализ демонстрируют повышенный риск инфекционных осложнений и соответственно ревизизионных вмешательств у пациентов с ВИЧ-инфекцией, перенесших тотальное эндопротезирование тазобедренного сустава по поводу неинфекционной артропатии тазобедренного сустава [7, 8, 9, 10]. В литературе встречается немного публикаций, посвященных результатам лечения инфекционных кокситов у пациентов с ВИЧ-инфекцией с небольшим количеством наблюдений. Так у 1 из двух пациентов с туберкулезным кокситом и ВИЧ-инфекцией через 3,5 года после двухэтапного эндопротезирования отмечена реактивация специфической инфекции [11]. Ранее мы публиковали данные о наличии РНК ВИЧ непосредственно в очагах некроза головки бедренной кости даже при неопределяемой вирусной нагрузке в крови [12]. Учитывая приводимые в литературе данные о прямом разрушающем действии ВИЧ на структуру, функцию остеокластов, а также активации дифференцировки остеокла- стов с опосредованным действием на механизм остеогенеза [13, 14, 15, 16], результаты лечения такой когорты пациентов привлекают повышенный интерес, что и послужило стимулом проведения нашего исследования.
Цель исследования: представить первые результаты клинических наблюдений у пациентов с ВИЧ-инфекцией с некротическими процессами головки бедренной кости, у которых выявлена РНК ВИЧ в очаге костного некроза.
Материалы и методы. В исследование были включены пациенты с ВИЧ-инфекцией и некрозами головки бедра с неопределяемой вирусной нагрузкой в плазме крови, у которых с помощью ПЦР определялась вирусная нагрузка в очагах деструкции кости (n=16). (таблица 1). У 7 пациентов при микробиологическом исследовании в биоптате суставных образований обнаружены патогенные микроорганизмы – у двоих M. Tuberculosis, четверых- St.aureus и одного пациента- Klebs.pneumonia. В 9 случаях бактериальной нагрузки в суставных образованиях не выявлено, установлен диагноз асептического некроза.
Статистический анализ. Статистическую обработку данных проводили с помощью программы StattTeh v2.8.0, используя непараметрические критерии Пирсона, U-критерий Манна – Уитни, χ2. Значимыми считали различия при доверительном интервале, равном 95 %, не включавшем в себя единицу (p = 0,05).
Таблица 1
Иммунологические и вирусологические показатели у пациентов, включенных в исследование
|
Па-ци-ент |
Диагноз |
CD4 Т-лимфоциты при включении в исследование, кл/мкл |
ВН в крови, при включении в исследование, копий/мл |
ВН в очаге, копий/ мл |
|
1 |
Асептический некроз головки бедренной кости |
1269 |
Менее 50 |
6800 |
|
2 |
Асептический некроз головки бедренной кости |
434 |
Менее 50 |
57000 |
|
3 |
Асептический некроз головки бедренной кости |
442 |
Менее 50 |
7900 |
|
4 |
Асептический некроз головки бедренной кости |
234 |
Менее 50 |
340 |
|
5 |
Асептический некроз мголовки бедренной кости |
387 |
Менее 50 |
370 |
|
6 |
Асептический некроз головки бедренной кости |
921 |
Менее 50 |
47000 |
|
7 |
Асептический некроз головки бедренной кости |
242 |
Менее 50 |
21000 |
|
8 |
Асептический некроз головки бедренной кости |
533 |
Менее 50 |
58000 |
|
9 |
Асептический некроз головки бедренной кости |
627 |
Менее 50 |
22000 |
|
10 |
Коксит |
500 |
Менее 50 |
3100 |
|
11 |
Коксит |
422 |
Менее 50 |
4200 |
|
12 |
Коксит |
318 |
Менее 50 |
100000 |
|
13 |
Коксит |
635 |
Менее 50 |
17000 |
|
14 |
Коксит |
215 |
Менее 50 |
3900 |
|
15 |
Коксит |
551 |
Менее 50 |
48000 |
|
16 |
Коксит |
140 |
Менее 50 |
20000 |
В очагах деструкции головки бедренной кости и синовиальной оболочке проводили микробиологическую, гистологическую и ПЦР диагностику.
Микробиологическое исследование на микобактерии туберкулеза, неспецифическую флору и грибы выполняли по стандартным методикам. Также проводили гистоморфо- логическое исследование образцов из тех же очагов костной деструкции.
РНК ВИЧ из полученного биоматериала определяли с применением коммерческого набора «Экстракция 100» (Вектор-Бест, Россия) в соответствии с инструкцией производителя. Количественное определение РНК ВИЧ, проводили методом ПЦР-РВ, коммерческим набором «Реалбест РНК ВИЧ количественный» (Вектор-Бест, Россия).
При поступлении в стационар изучали данные анамнеза, проводили клинический осмотр с описанием локального статуса, лучевые и лабораторные исследования. Исследование проведено в соответствии с этическими принципами Хельсинкской декларации (World Medical Association Declaration of Helsinki — Ethical Principles for Medical Research Involving Human Subjects, 2013) и «Правилами клинической практики в Российской Федерации» (Приказ Минздрава РФ № 266 от 19.06.2003) с получением письменного согласия пациентов на участие в исследовании и одобрено комитетом по этике ФГБУ НМИЦ ФПИ Минздрава России, протокол № 17 от 25.08.2022.
Результаты исследования. По результатам бактериологического и гистоморфологического исследования биопсийного материала пациенты разделены на две группы- с инфекционным кокситом (n=7) (43%), из них у двоих определена туберкулезная этиология возбудителя (28,5%) четверых- St.aureus (57,1%) и одного пациента- Klebs.pneumonia.(14,2%) и асептическим некрозом головки бедренной кости (n=9) (53%). Группы были сопоставимы по возрасту (р=0,568), полу (р=0, 772), количеству CD4 Т-лимфоцитов (р=0,408) и уровню ВН в крови (р=0,918). Сроки наблюдения составили от 4-х месяцев до 16 месяцев. Забор костного материала для определения вирусной нагрузки осуществлялся в очаге деструкции головки бедренной кости и для сравнения в области подвздошной кости и большого вертела (рис1.)
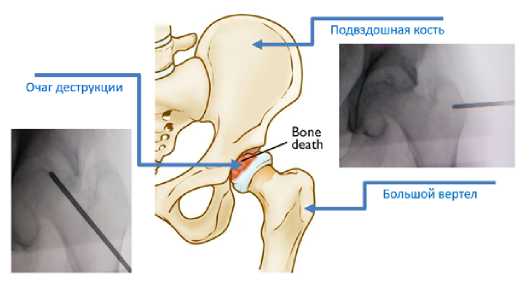
Рисунок 1 - Схема проведения трепанобиопсии в очагах деструкции головки бедренной кости и контрольных участках.
Средний уровень вирусной нагрузки в очаге деструкции головки бедренной кости при коксите составил 28 тыс. копий/ мл, при асептическом некрозе 24,5 тыс. копий/мл (р=0,918). По данным лабораторных исследований статистически досто- верная разница выявлена при определении показателей СРБ и общего белка. Средний уровень СРБ у пациентов с кокситом составил 31 мг/л, средний уровень общего белка- 78,9 г/л. В группе с асептическим некрозом соответственно средний уровень СРБ составил 2,8 мг/л, средний уровень общего белка 70,9 г/л (оба р <0,05). Изучение результатов клинических наблюдений в группах с кокситом и асептическим некрозом выявило отсутствие значимой разницы по уровню CD4 Т-лимфоцитов, в то же время разница в числе пациентов с выраженным иммунодефицитом (CD4 Т-лимфоциты менее 350 кл/мкл) в группе с кокситом – 42,9% (3/7) и в группе с аваскулярным некрозом головки бедренной кости – 22,2% (2/9) предполагает при увеличении размеров выборки большую выраженность иммунодефицита у пациентов с кокситом.
Тактика хирургического лечения в исследуемых группах различалась. В группе с инфекционным кокситом и определяемой вирусной нагрузкой в суставе выполнялся первый этап планируемого двухэтапного лечения- устанавливался цементный антимикробный спейсер собственной конструкции (патент №212287 от 14.07.2022), насыщенный антимикробными препаратами согласно определенной микробиологическим исследованием индивидуальной чувствительности возбудителя. В группе с асептическим некрозом выполнялось одноэтапное тотальное эндопротезирование. Время наблюдения составило от 4-х до 16 месяцев. Результаты лечения с учетом состояния сустава по балльной шкале Харриса и наличию осложнений представлены в таблице 2.
Таблица 2
Состояние сустава и осложнения у пациентов с кокситом и асептическим некрозом головки бедренной кости
|
Группа наблюдения |
Вид операции |
Оценка состояния сустава по шкале Харриса (Harris Hip Score) при поступлении (баллы) |
Оценка состояния сустава по шкале Харриса (Harris Hip Score) через 3-16 месяцев после операции (баллы) |
Осложнения (про-гресси-рование местного инфекционного процесса) Абс. цифры, % |
|
коксит |
установка антимикробного спейсера |
23,4±5,1 |
61,2±2,4 |
2 (28,8%) |
|
асептический некроз |
тотальное эндо-протезирование |
26,7±7,6 |
87,2±4,5 |
0 (0%) |
Осложнения в виде прогрессирования специфического процесса получены у двоих пациентов в группе с кокситами (клинические наблюдения 1 и 2).
Клиническое наблюдение 1
Пациент Ч. 46 лет. В течение 10 лет состоял на диспансерном учете у фтизиатра по поводу туберкулёмы с распадом в левом легком. 21.09.2015 г. был снят с учета. В сентябре 2020 г., после физической нагрузки появилась резкая боль в правом тазобедренном суставе, повышение температуры тела до 39 градусов. В противотуберкулезном стационаре по месту жительства установлен диагноз правостороннего туберкулезного коксита, проводилось консервативное лечение - левофлоксацин 1,0 в/в, капреомицин 1,0 в/м, циклосерин 0,75, протионамид 0,75, ПАСК 10,0 (рис.5). В связи с увеличением лимфоузла в правой паховой области 04.12.2020 г. выполнена пункционная биопсия. Цитологически - на фоне элементов крови отмечаются единичные мелкие участки лимфоидной ткани, представленные лимфоцитами, отмечаются клетки гистиоци-тарного ряда, нити фибрина. 09.06.2021 г. выполнена резекция правого тазобедренного сустава, установка артикулирующего спейсера (рис.6). Послеоперационный период протекал гладко. 09.12.2021 г. выполнено ревизионное эндопротезирование правого тазобедренного сустава (удаление артикулирующего спейсера, бесцементное тотальное эндопротезирование правого тазобедренного сустава) (рис.7). Послеоперационный период протекал гладко. После выписки из стационара больной самостоятельно прекратил прием АРТ. ВН в крови определялась как 8,5 х 104 копий мл. На фоне отказа от АРТ 02.08.2022 г. в результате травмы, полученной в быту (падение в помещении), сформировалась гематома области правого бедра, которая осложнилась нагноением. Госпитализирован в ФГБУ НМИЦ ФПИ, где 12.08.2022 г. выполнено вскрытие, дренирование гематомы. 26.03.2023 г. открылся свищевой ход в области правого бедра. 12.04.2023 г. операция: фистулотомия правого бедра. Микробиологическое исследование операционного материала: Staph. aureus. В ходе данной госпитализации установлен диа-гноз-перипротезная инфекция с расшатыванием ацетабулярного компонента и вывихом его головки (рис.8). Был повторно обследован на ВИЧ. Выявлено, что, несмотря на значительное снижение вирусная нагрузка в крови оставалась достаточно высокой (3100 копий /мл). На фоне проведения антивирусной терапии достигнуто радикальное снижение вирусной нагрузки до неопределяемого уровня, однако у пациента сохранялся свищ с гнойным отделяемым. 29.08.2023 произведено оперативное вмешательство в объеме удаления вертлужного компонента эндопротеза и установки цементного спейсера (рис.9). Учитывая отсутствие нестабильности феморальный компонент (ножка Вагнера) сохранен, головка спейсера установлена непосредственно на шейку бедренного компонента. В удаленном ацетабулярном компоненте была выявлена бактериальная нагрузка МБТ и ВН -3,9 х 103 копий мл. Роста неспецифической флоры не получено. Пациент был выписан под наблюдение специалистов по месту жительства, наблюдается дистанционно при помощи чат-бота. В декабре 2023 года местно без признаков воспаления, передвигается при помощи костылей. Состояние сустава по шкале Харриса оценивается на 62 балла.
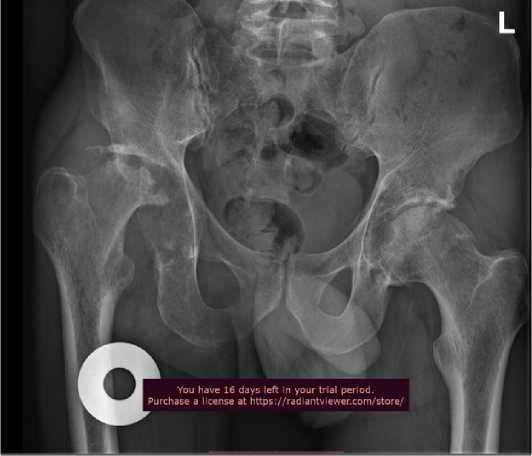
Рисунок 2 - Рентгенограмма тазобедренных суставов пациента Ч.
Туберкулезная деструкция с лизисом головки правой бедренной кости.
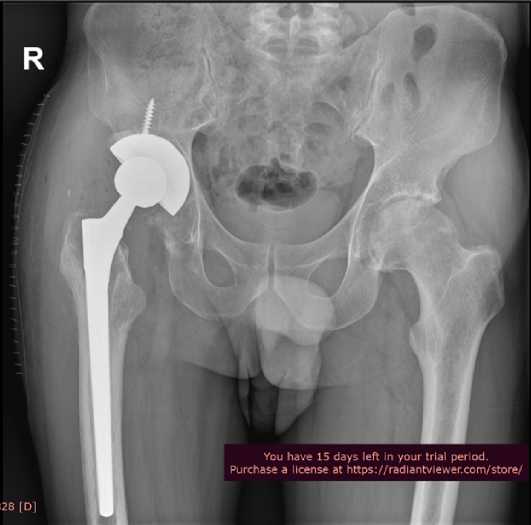
Рисунок 4 - Рентгенограмма правого тазобедренного сустава пациента Ч. Состояние после эндопротезирования.
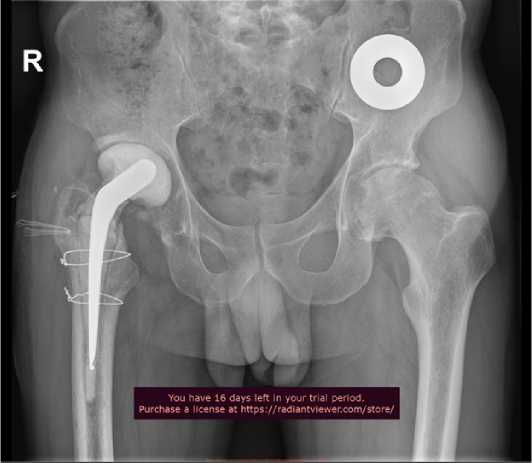
Рисунок 3 - Пациент Ч. Рентгенограмма после установки артикулирующего цементного спейсера правого тазобедренного сустава.
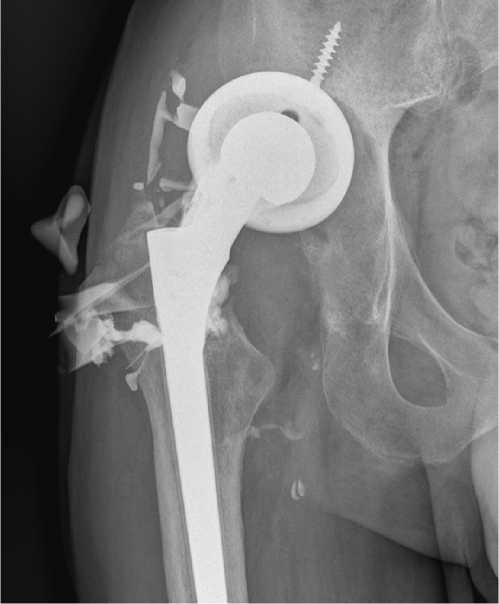
Рисунок 5 - Пациент Ч. Фистулограмма правого тазобедренного сустава. Перипротезная инфекция с расшатыванием ацетабулярного компонента и вывихом его головки.
Таким образом, у обоих пациентов с туберкулезным кокситом в послеоперационном периоде наблюдалось прогрессирование специфического процесса.
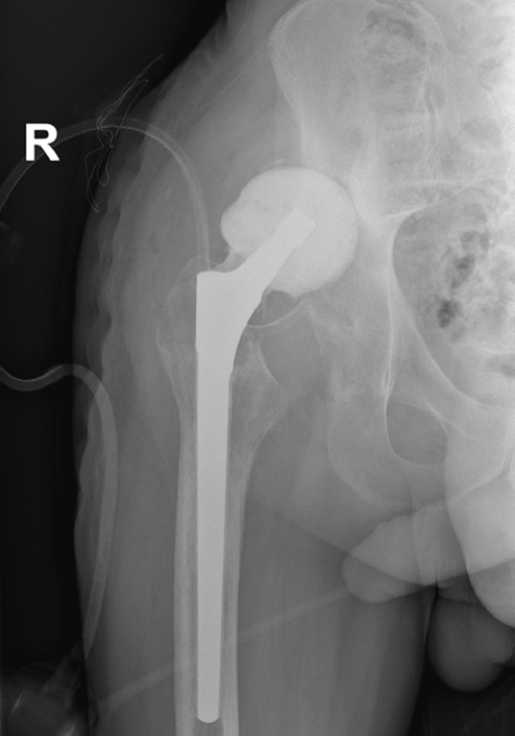
Рисунок 6 - Рентгенограмма правого тазобедренного сустава пациента Ч. Состояние после повторной установки цементного спейсера.
Клиническое наблюдение 2
Пациент А, 31 года. ВИЧ инфекция выявлена в 2013 году, проводимая АРТ с 2015 года- долутегравир, лами-вудин, тенофовир. CD4 Т-лимфоциты - 434 кл/мкл, РНК ВИЧ в крови-не определяется. Боли и ограничение движений в правом тазобедренном суставе беспокоят в течении 2-х лет. Обследован у травматолога по месту жительства, установлен диагноз асептического некроза правого тазобедренного сустава, направлен в наш центр на стационарное лечение. При поступлении выраженный болевой синдром и ограничение движений в правом тазобедренном суставе, боли по шкале ВАШ до 6 баллов. На рентгенограмме правого тазобедренного сустава выраженное сужение суставной щели, признаки фрагментация и некроза головки бедренной кости.
В биоптате из очага некроза головки бедренной кости ВН -5,7 х 10 4 копий/мл, в большом вертеле ВН не определена. 15.11.22 пациенту выполнено эндопротезирование правого тазобедренного сустава.
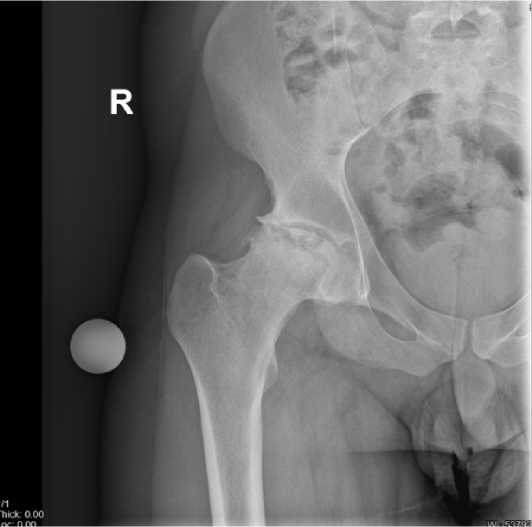
Рисунок 7 - Рентгенограмма правого тазобедренного сустава пациента А.
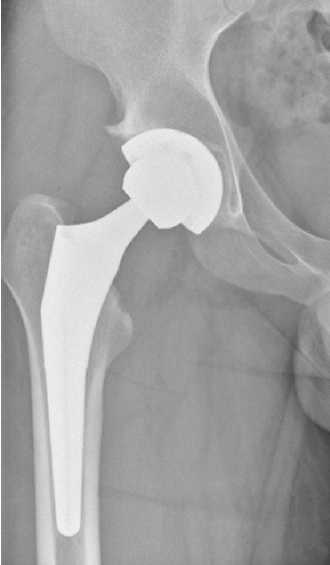
Рисунок 8 - Рентгенограмма правого тазобедренного сустава пациента А. Состояние после эндопротезирования.
В резецированной головке бедренной кости бактериальная нагрузка не выявлена. Роста неспецифической флоры не по- лучено. Пациент был выписан под наблюдение специалистов по месту жительства, наблюдается дистанционно при помощи чат-бота. В апреле 2024 года жалобы на незначительные болевые ощущения в оперированном суставе после длительной ходьбы. Состояние сустава по шкале Харриса оценивается на 87 баллов. Гистологическое заключение- костные балки с признаками резорбции, в межбалочных пространствах волокнистая соединительная ткань, инфильтрированная лимфоцитами, плазматическими клетками, очаговым ангиоматозом. В отдельных полях зрения в межбалочных пространствах очаги некроза.
Обсуждение. Частота встречаемости гнойных осложнений и необходимость повторных операций по замене суставов у пациентов с ВИЧ-инфекцией, особенно при поражении тазобедренного сустава, выше, чем в общей популяции. Проведенные наблюдения показали наличие РНК ВИЧ в очагах деструкции кости при некротических процессах в головке бедренной кости у пациентов ВИЧ-инфекцией в том числе и с неопределяемой вирусной нагрузкой в крови, причем ВН в очагах некроза была значительно выше неопределяемого уровня [17]. Выявление РНК ВИЧ (вирусной нагрузки) в очагах некроза головки бедренной кости может свидетельствовать о том, что развитие осложнений в послеоперационном периоде связано не только с рисками присоединения вторичной микрофлоры на фоне иммунодефицита, но и с непосредственным действием вируса на костную ткань. Подобные предположения выдвигались и в ранее проведенных исследованиях [4,7]. Косвенным фактором, подтверждающим эту гипотезу, является сопоставимый уровень вирусной нагрузки как при коксите, так и при асептическом некрозе, несмотря на значимые различия в уровне воспалительных факторов (СРБ и общего белка).
В нашем исследовании тактика ведения пациентов с кокситом и асептическим некрозом отличалась: пациентам с кокситом после установления диагноза осуществлялась установка цементного спейсера, насыщенного антимикробными препаратами в зависимости от индивидуальной чувствительности возбудителя, затем наблюдение и только в случае стихания воспалительного процесса, вызванного вторичной микрофлорой, проводилось эндопротезирование. У пациентов с асептическим некрозом выполнялось одноэтапное эндопротезирование, что имеет на наш взгляд определенные риски, учитывая возможную вирусную этиологию некротического процесса у этой категории пациентов. У пациентов с кокситом после установки цементного спейсера средний балл по шкале Харриса вырос и составил 61,2±2,4 (при поступлении 23,4±5,1), причем у обоих пациентов с туберкулезным кокситом отмечено прогрессирование местного специфического процесса. При этом у пациентов с асептическим некрозом после лечения средний показатель по шкале Харриса увеличивался более значительно 87,2±4,5 против 26,7±7,6 при поступлении, послеоперационных осложнений в наблюдаемый период не отмечено. Несмотря на больший прирост по шкале Харриса у пациентов с асептическим некрозом и отсутствие ранних послеоперационных осложнений, окончательные выводы о результатах лечения будут сделаны после более длительных сроков наблюдения.
Ограничением данного исследования является малое количество наблюдений, что не позволяет достоверно судить о частоте обнаружения вируса внутри суставных образований в случае его отсутствия в крови, но свидетельствует в пользу необходимости дальнейшего изучения спектра инфекционных агентов при помощи предоперационных инвазивных методик у пациентов с ВИЧ-инфекцией.
Заключение. При отсутствии вирусной нагрузки в крови, РНК ВИЧ может обнаруживаться в очаге костной деструкции головки бедренной кости как при инфекционных бактериальных кокситах, так и при асептическом некрозе. Наличие вируса в очагах некроза в головке бедренной кости указывает на возможное прямое воздействие инфекционного агента на костную ткань. Продолжение исследования с анализом окончательных данных результатов лечения позволит сформировать конкретные рекомендации по диагностике и лечению патологии тазобедренного сустава при ВИЧ-инфекции.
Список литературы Результаты клинических наблюдений пациентов с ВИЧ-инфекцией с некротическими процессами головки бедренной кости
- Biviji A.A., Paiement G.D., Steinbach L.S. Musculoskeletal manifestations of human immunodeficiency virus infection. Journal of the American Academy of Orthopaedic Surgeons. 2002;10(5):312-320. doi: 10.5435/00124635-200209000-00003
- Буханова Д.В., Белов Б.С. Поражение суставов при ВИЧ-инфекции. Медицинский совет. 2018; (9):82-87 https://doi.org/10.21518/2079-701X-2018-9-82-87 Bukhanova D.V., Belov B.S. Joint damage in HIV positive patients. Meditsinskiy Sovet. 2018; (9):82-87 (In Russian) doi: 10.21518/2079-701X-2018-9-82-87
- Zhao C. S., Li X., Zhang Q., Sun S., Zhao R. G., Cai J. Early outcomes of primary total hip arthroplasty for osteonecrosis of the femoral head in patients with human immunodeficiency virus in China. Chinese Medical Journal. 2015;128(15):2059-2064. doi: 10.4103/0366-6999.161364
- Issa K, Naziri Q, Rasquinha V, Maheshwari A.V., Delanois R.E., Mont M.A. Outcomes of cementless primary THA for osteonecrosis in HIV-infected patients. The Journal of bone and joint surgery. American volume. 2013;95(20),1845-1850. doi: 10.2106/JBJS.L.01583
- Lee S.O., Lee J.E., Lee S., Lee S.H., Kang J.S., Lee I.S. et al. Osteonecrosis of the femoral head in Korean patients with human immunodeficiency virus infection. Infection & Chemotherapy. 2020;52(4):592. doi: 10.3947/ic.2020.52.4.592
- Zhao R., Ma R., Zhao C., Zhang Q. Risk Factors for Osteonecrosis of the Femoral Head in Human Immunodeficiency Virus-Positive Patients: A Retrospective Case–Control Study. AIDS Research and Human Retroviruses. 2022;38(11):869-874. doi: 10.1089/aid.2021.0224
- O’Neill, S.C., Queally, J.M., Hickey A., Mulhall K.J. Outcome of total hip and knee arthroplasty in HIV-infected patients: a systematic review. Orthopedic reviews. 2019;11(1):8020. doi: 10.4081/or.2019.8020
- Youngman T.R., Riepen D.W., Rinehart D.B., Thota D.R., Sun J.J., Telford C.L., Huo M.H. Complications of primary total hip arthroplasty in human immunodeficiency virus-positive patients with femoral head osteonecrosis. Hip International, 2023;33(1):62-66. doi: 10.1177/11207000211005750
- Lutz A.B., Patel D.V., Bibbo C., Hong I.S., Hameed D., Dubin J., Mont M.A. Total Hip Arthroplasty in Human Immunodeficiency Virus Positive Patients: A Systematic Review of Outcomes. The Journal of Arthroplasty. 2024. doi: 10.1016/j.arth.2024.02.043
- Falakassa J., Diaz A., Schneiderbauer M. Outcomes of total joint arthroplasty in HIV patients. The Iowa orthopaedic journal. 2014;34:102.
- Зубиков В.С. , Перецманас Е.О., Герасимов И.А. Опыт хирургического лечения туберкулезного и неспецифического артрита методом двухэтапной артропластики с использованием артикулирующих цементных спейсеров, насыщенных антибиотиками. Туберкулез и болезни легких. 2019;97(11):25-32. doi: 10.21292/2075-1230-2019-97-11-25-32 Zubikov V.S., Peretsmanas E.O., Gerasimov I.А. The experience of surgical treatment of tuberculosis and non-specific arthritis with two-stage arthroplasty using articulating cement spacers saturated with antibiotics. Tuberculosis and Lung Diseases. 2019;97(11):25-32. (In Russian) doi: 10.21292/2075-1230-2019-97-11-25-32
- Перецманас Е.О., Тюлькова Т.Е., Зубиков В.С., Герасимов И.А., Каминский Г.Д. Вирус иммунодефицита человека в очаге деструкции костной ткани при асептическом некрозе головки бедренной кости: клинические наблюдения. Травматология и ортопедия России. 2023;29(3):94-101. doi: 10.17816/2311-2905-7989 Peretsmanas E.O., Tyulkova T.E., Zubikov V.S., Gerasimov I.A., Kaminsky G.D. Human Immunodeficiency Virus in the Focus of Bone Tissue Destruction in Patients With Aseptic Osteonecrosis of the Femoral Head: Two Case Reports. Traumatology and Orthopedics of Russia. 2023;29(3):94-101. (In Russian). doi: 10.17816/2311-2905-7989.
- Raynaud-Messina B., Bracq L., Dupont M., Souriant S., Usmani S. M., Proag A. Bone degradation machinery of osteoclasts: An HIV-1 target that contributes to bone loss. Proceedings of the National Academy of Sciences. 2018;115(11): E2556-E2565. doi: 10.1073/pnas.1713370115
- Sviercz F.A., Jarmoluk P., Cevallos C.G., López C.A., Freiberger R.N., Guano A. et al. Massively HIV-1-infected macrophages exhibit a severely hampered ability to differentiate into osteoclasts. Frontiers in Immunology.2023;14:1206099. doi: 0.3389/fimmu.2023.1206099
- Cotter A.G., Mallon P.W. The effects of untreated and treated HIV infection on bone disease. Current opinion in HIV and AIDS. 2014;9(1):17-26. doi: 10.1097/COH.0000000000000028
- Delpino, M. V., & Quarleri, J. Influence of HIV infection and antiretroviral therapy on bone homeostasis. Frontiers in endocrinology. 2020;11:549865 doi:10.3389/fendo.2020.00502
- Перецманас Е.О., Орлова-Морозова Е.А., Есин И.В., Каминский Г.Д., Тюлькова Т.Е., Панова А.Е., Ловачева О.В. Вирус иммунодефицита человека - один из факторов воспаления костной ткани при туберкулезном спондилите, ассоциированным с ВИЧ-инфекцией. Гипотеза или реальность? // Туберкулез и болезни легких. 2023;2(101):47-53. DOI 10.58838/2075-1230-2023-101-2-47-53 [Peretsmanas E.O., Orlova-Morozova E.A., Esin I.V., Kaminsky G.D., Tyulkova T.E., Panova A.E., Lovacheva O. V. O.V. Human Immunodeficiency Virus is One of the Factors Promoting Bone Tissue Inflammation in Tuberculous Spondylitis Associated with HIV Infection. Hypothesis or Reality? Tuberculosis and Lung Diseases. 2023;101(2):47-53. (In Russ.) DOI 10.58838/2075-1230-2023-101-2-47-53].


