Результаты клинического исследования безопасности радиофармацевтического лекарственного препарата с 188Re при проведении внутриартериальной радиоэмболизации
Автор: Кучеров В.В., Петросян А.П., Власова О.П., Сигов М.А., Тищенко В.К., Спиченкова О.Н., Степаненко В.Ф., Шегай П.В., Иванов С.А., Каприн А.Д.
Рубрика: Научные статьи
Статья в выпуске: 3 т.33, 2024 года.
Бесплатный доступ
В России и мире порядка 10% всех злокачественных новообразований печени являются неоперабельными. Наиболее эффективным лечением таких пациентов является химио- и радиоэмболизация. Разработан отечественный радиофармацевтический лекарственный препарат (РФЛП) на основе микросфер альбумина диаметром 20-40 мкм, меченных радиоизотопом 188Re (РФЛП «Гепаторен-МРНЦ»), для лечения неоперабельного первичного и вторичного рака печени методом внутриартериальной радиоэмболизации. Проведены доклинические исследования и 1 фаза клинических исследований. Цель работы - изучить безопасность РФЛП «Гепаторен-МРНЦ» при проведении радиоэмболизации пациентам с неоперабельным первичным и вторичным раком печени; подбор безопасной и максимально переносимой активности радиофармпрепарата. Была проведена внутриартериальная радиоэмболизация РФЛП «Гепаторен-МРНЦ» активностью 3-6 ГБк для 20 пациентов с диагнозом: первичный рак печени (С22.0, С22.1), метастатический рак печени (С19.0, С22.1, С18.7, С18.0, С20.0). Всем пациентам была выполнена сцинтиграфия и ОФЭКТ всего тела через 2, 24, 48 и 72 ч после операции. Также была выполнена радиометрия мочи пациентов, взятой в течение 48 ч после проведения операции. За пациентами велось наблюдение на протяжении 3-х мес. Выведение препарата из организма с мочой в первые 48 ч составило в среднем 23% [12-40%]. Не наблюдалось накопление свободного 188Re в щитовидной железе. У всех пациентов наблюдался небольшой (5,5-13,2%) лёгочный шунт. Диагностическое изображение ОФЭКТ/КТ с РФЛП «99mТс-МАА» у всех пациентов совпадало с посттерапевтическим изображением ОФЭКТ/КТ с РФЛП «МСА 20-40 мкм, 188Re». Дозы внутреннего облучения опухолевых очагов находились в пределах от 9,2 до 68,5 Гр. Величины индивидуальных лучевых нагрузок на критические органы оказались многократно меньше общепринятых дозовых ограничений при радиотерапии. Гематологическую токсичность I степени наблюдали у 15 (75%), II степени - у 3 (15%), III степени - у 2 (10%) пациентов. У всех исследуемых наблюдали гепатологическую токсичность II степени. Хорошую переносимость РФЛП наблюдали у 10 (50%), удовлетворительную - у 7 (35%), а неудовлетворительную - у 3 (15%) пациентов. Выраженных осложнений в период наблюдения за больными выявлено не было. Один пациент умер спустя 2 мес. после операции от прогрессирования основного заболевания. По результатам проведения первой фазы клинического исследования можно сделать вывод о безопасности и переносимости РФЛП «Гепаторен-МРНЦ» активностью 3-6 ГБк для проведения радиоэмболизации пациентам с неоперабельным раком печени.
Онкология, лучевая терапия, радиоэмболизация, рак печени, микросферы альбумина, 188re, радиофармпрепарат, клинические исследования, радионуклид, бета-излучение, гепатоцеллюлярная карцинома, ядерная медицина и визуализация
Короткий адрес: https://sciup.org/170206291
IDR: 170206291 | УДК: 615.849.2:546.719.02.188:616.36-006.6 | DOI: 10.21870/0131-3878-2024-33-3-18-29
Текст научной статьи Результаты клинического исследования безопасности радиофармацевтического лекарственного препарата с 188Re при проведении внутриартериальной радиоэмболизации
Лечение первичных и метастатических злокачественных новообразований печени – актуальная проблема современной онкологии. Данные канцеррегистра МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России свидетельствуют о том, что количество заболевших первичным раком печени в России с каждым годом увеличивается: если в 2010 г. было зарегистрировано 6626 человек с диагнозом «Первичный рак печени», то к 2020 г.
Кучеров В.В. – зав. отд., к.м.н.; Петросян А.П. – врач, к.м.н.; Власова О.П.* – в.н.с., к.б.н.; Сигов М.А. – и.о. зав. отд.; Тищенко В.К. – и.о. зав. лаб., д.б.н.; Спиченкова О.Н. – вед. инж.; Степаненко В.Ф. – зав. лаб., д.б.н., проф.; Иванов С.А. – директор, чл.-корр. РАН, д.м.н., проф. каф. РУДН. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России. Шегай П.В. – зам. ген. директора, к.м.н.; Каприн А.Д. – ген. директор, директор МНИОИ им. П.А. Герцена, зав. каф. РУДН, акад. РАН, д.м.н., проф. ФГБУ «НМИЦ радиологии» Минздрава России.
В настоящее время основным методом лечения первичного рака печени остаётся хирургическое лечение. Однако, на момент обнаружения, опухоль можно радикально удалить не более чем у 15-20% пациентов. Таким образом, терапия нерезектабельного рака печени нужна порядка 80% больных [4, 5]. При невозможности хирургического лечения в связи с выраженными сопутствующими заболеваниями или распространённостью опухолевого процесса применяются локальные методы лечения, такие как химиоэмболизация печёночных артерий, радиочастотная абляция; чрескожное введение этанола; криотерапия; микроволновая коагуляция и др. [5, 6].
В последние годы в России в практику активно начал внедряться такой метод лечения неоперабельного рака печени, как трансартериальная радиоэмболизация печени. Радиоэмболизация (РЭ) – метод внутрисосудистой терапии, заключающийся во внутриартериальном селективном введении микрочастиц (микросфер), содержащих в основном радионуклид 90Y. Микросферы локализуются в пределах сосудистой сети опухолей и, вдобавок к эмболизации, обеспечивают облучение окружающей ткани новообразований [7, 8].
РЭ при опухолях печени – это безопасный и высокоэффективный метод локального лечения, что подтверждают многочисленные исследования. Ряд крупных международных организаций, таких как ESMO (European Society for Medical Oncology), ESDO (European Society of Digestive Oncology), NCCN (National Comprehensive Cancer Network), рекомендуют использовать РЭ с микросферами, содержащими 90Y, в качестве основного метода лечения пациентов с распространёнными опухолями печени или как альтернативу химиоэмболизации, а также в качестве первого этапа лечения перед резекцией или трансплантацией печени [9-11].
В последние годы идёт активный поиск новых радионуклидов для использования при РЭ печени [12, 13]. Одним из таких радионуклидов является 188Rе. Физические характеристики 188Re сравнимы с характеристиками 90Y по максимальной энергии бета-излучения (2,1 МэВ), однако 188Re обладает меньшим периодом полураспада (16,9 ч против 64,1 ч у 90Y), а, соответственно, и большей мощностью дозы, что должно улучшить терапевтический эффект препарата. Преимуществом 188Rе является также то, что он излучает гамма-кванты с энергией 155 кэВ, близкой к энергии диагностического нуклида 99mТс (140 кэВ), что позволяет регистрировать процесс распределения микросфер после РЭ в организме пациентов на гамма-камере. Еще одним достоинством 188Re является то, что этот радионуклид можно получать генераторным способом из терапевтических генераторов, устанавливаемых в лечебных учреждениях, подобно диагностическим генераторам 99Mo/99mТс, и изготавливать радиофармацевтический лекарственный препарат (РФЛП) на местах непосредственно перед операцией [14, 15].
В МРНЦ им. А.Ф. Цыба – филиале ФГБУ «НМИЦ радиологии» Минздрава России совместно с заводом «Медрадиопрепарат» ФМБА России разработали оригинальный РФЛП на ос- нове микросфер альбумина 20-40 мкм, меченный 188Re, для проведения процедуры внутриартериальной РЭ [16]. Микросферы альбумина крови человека (микросферы альбумина, МСА) имеют диапазон размеров 20-40 мкм (до 90% от общего количества), а также являются биодеградируемыми субстанциями.
На основании выполненных в 2015-2017 гг. в рамках ФЦП Фарма-2020 (государственный контракт № 14.N08.11.0055 от 20.10.2015 г.) доклинических исследований РФЛП «Микросферы альбумина 20-40 мкм, 188Re» в МРНЦ им. А.Ф. Цыба – филиале ФГБУ «НМИЦ радиологии» Минздрава России, а также разработанной заводом «Медрадиопрепарат» нормативной документации и опытно-промышленного регламента на производство РФЛП «Микросферы альбумина 20-40 мкм, 188Re», в 2022 г. было получено разрешение на проведение клинических исследований (КИ) 1 и 2 Фазы этого РФЛП: «Проведение исследований безопасности и терапевтической эффективности разработанного РФЛП» (РКИ № 199 от 28.03.2022 г.).
Материалы и методы
В исследовании 1 Фазы приняло участие 20 добровольцев (14 мужчин и 6 женщин) в возрасте 41-77 лет с диагнозом «Первичный и вторичный неоперабельный рак печени». Критерии включения добровольцев в КИ 1 Фазы были следующими:
-
- наличие подтверждённого метастатического поражения печени при колоректальном раке (гистологическим и/или лучевыми методами исследования – КТ, МРТ, ПЭТ) у пациентов с изолированным или преобладающим метастатическим поражением печени при исчерпании возможностей системной терапии;
-
- наличие первичного рака печени: 1) гепатоцеллюлярный рак в стадии B-C по Барселонской системе стадирования; 2) холангиоцеллюлярный рак (ХЦР) при поздних стадиях и неоперабельном внутрипечёночном ХЦР (стадии IIIa-IVa, T3-4N0-1M0);
-
- шунтирование РФЛП «Макротех 99тТс» (99тТс-МАА) в лёгкие <15% и отсутствие
шунтирования в кишечник по данным сцинтиграфии в режиме «всё тело» и ОФЭКТ;
-
- индекс Карновского >60% или ECOG 0-2 при циррозе в стадии субкомпенсации (Ch-P A-B);
-
- объём поражённой ткани печени не более 70% по данным КТ/МР-волюметрии;
-
- уровень сывороточного билирубина <30 ммоль/л;
-
- уровень гемоглобина крови Hb >80 г/л;
-
- уровень лейкоцитов в периферической крови >3 х 109/л;
-
- уровень тромбоцитов в периферической крови >90 х 109/л.
Основной целью 1 Фазы КИ было проведение исследования безопасности и переносимости отечественного РФЛП «Микросферы альбумина 20-40 мкм, 188Re» для лечения пациентов с нерезектабельным раком печени после однократного внутриартериального введения РФЛП. Второстепенной целью исследования была оценка влияния РФЛП на качество жизни пациентов по критериям облегчения клинической симптоматики, качество и количество неблагоприятных явлений и серьёзных неблагоприятных явлений.
Пациентам была выполнена трансартериальная РЭ РФЛП «МСА 20-40 мкм, 188Re», который представляет собой микросферы альбумина крови человека (МСА), диаметром 20-40 мкм, меченные радионуклидом 188Re (табл. 1).
Добровольцам вводили РФЛП с повышающей активностью, которая варьировала от 3,1-3,5 ГБк (первые 8 добровольцев) до 5,0-5,7 ГБк (последние 4 добровольца). РФЛП
«МСА 20-40 мкм, 188Re» нарабатывался на производственной площадке завода «Медрадиопре-парат» ФМБА России и в готовом виде привозился в клинику МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России в день операции.
Таблица 1
Характеристики добровольцев, принимающих участие в 1 Фазе клинических исследований
|
№ п/п |
Номер добровольца |
Год рожде-ния/масса тела, кг |
Диагноз |
Введённая активность РФЛП, МБк |
|
1 |
ОАВ 001 |
1981/66 |
C19 Рак ректосигмоидного отдела ободочной кишки pT4N0M1a IVa ст. |
3303 |
|
2 |
ЧВВ 002 |
1963/83 |
C22.1 Холангиоцеллюлярный рак cT3N1M0 IIIB ст. |
3298 |
|
3 |
ЯВН 003 |
1959/69 |
C18.7 Рак сигмовидной кишки, pT4aN1aM0 IIIB ст. |
3076 |
|
4 |
МЕН 004 |
1953/77 |
C19 Рак ректосигмоидного отдела толстой кишки pT4N1M1a (hep) IVA ст. |
3195 |
|
5 |
ПСА 005 |
1964/90 |
C20 Рак прямой кишки pT2N0M0 I ст. |
3469 |
|
6 |
ГНВ 006 |
1955/80 |
C22.0 Гепатоцеллюлярный рак pT2N0M0 II ст. |
3440 |
|
7 |
ЕВА 007 |
1959/74 |
C22.0 Гепатоцеллюлярный рак сT3N1M0 IVA ст. |
3066 |
|
8 |
ДЗА 008 |
1952/81 |
C22.0 Гепатоцеллюлярный рак сT2N0M0 II ст. |
3234 |
|
9 |
БВА 009 |
1957/85 |
C22.0 Гепатоцеллюлярный рак cT3N0M0 IIIA ст. |
4452 |
|
10 |
КСМ 010 |
1960/52 |
C22.2 Гепатоцеллюлярный рак сT4N0M0 IIIB ст. |
4430 |
|
11 |
ВДА 011 |
1963/98 |
C22.0 Гепатоцеллюлярный рак cT2N0M0 II ст. |
4590 |
|
12 |
ДВК 012 |
1942/66 |
C22.0 Гепатоцеллюлярный рак cT3N0M0 IIIA ст. |
4630 |
|
13 |
КАМ 013 |
1956/59 |
C22.0 Гепатоцеллюлярный рак cT3N0M0 IIIA ст. |
4337 |
|
14 |
ПЛА 014 |
1955/59 |
C22.0 Гепатоцеллюлярный рак cT3N1M1 (hep) IVB ст. |
4156 |
|
15 |
МАН 015 |
1949/59 |
C22.0 Гепатоцеллюлярный рак cT3N0M1 IVB ст. |
4192 |
|
16 |
СНВ 016 |
1953/84 |
C22.0 Гепатоцеллюлярный рак cT2N0M1 IV ст. |
4127 |
|
17 |
АДА 017 |
1949/69 |
C18.0 Рак слепой кишки pT4aN1aM0 IIIB ст. |
5000 |
|
18 |
КНА 018 |
1953/89 |
C22.0 Гепатоцеллюлярный рак cT4N0M0 IIIB ст. |
5240 |
|
19 |
КВЕ 019 |
1972/76 |
C22.0 Гепатоцеллюлярный рак cT3N0M0 IIIA ст. |
5643 |
|
20 |
ФАВ 020 |
1977/70 |
C20 Рак прямой кишки pT3N0M0 IIA ст. |
5700 |
После проведения операции добровольцы 3 дня наблюдались в стационаре клиники. Всем добровольцам были проведены плановые лабораторные анализы; ультразвуковое исследование печени, брюшной полости и малого таза; компьютерная томография органов брюшной полости; повременная планарная сцинтиграфия и ОФЭКТ/КТ всего тела через 1, 24, 48 и 72 ч после операции.
Сцинтиграфическое исследование добровольцев выполнялось на гибридной системе Discovery NM/CT 670 (GE Healthcare) в режиме «whole body» со стандартными параметрами: скорость движения деки стола - 18 см/мин, матрица 256 x 1024 пк. ОФЭКТ/КТ выполнялось с параметрами сканирования: 20 с/проекция, 60 проекций, матрица 128 x 128 пк. При получении изображений на ОФЭКТ/КТ в обязательном порядке производилась коррекция рассеивания и поглощения с применением рентгеновской компьютерной томографии, выполненной в режиме «low dose» (120 kV и 80 mA).
Для получения изображений применялись параметры для работы с 188Re: коллиматор high energy general purpose (HEGP), фотопик 155 кэВ с шириной окна дискриминации ± 10%.
Все полученные посттерапевтические изображения сравнивались с изображениями, полученными на этапе проведения диагностики с РФЛП «99mТс-МАА» с теми же параметрами, что и посттерапевтическое сканирование. Для получения диагностических изображений применялись стандартные параметры для работы с 99mTc: коллиматор low energy high resolution (LEHR), фотопик 140,5 кэВ с шириной окна дискриминации ± 10%.
Также, в рамках КИ, выполнялась радиометрия мочи пациентов в течение 48 ч после РЭ и дозиметрическое сопровождение добровольцев и медицинского персонала, контактирующего с
РФЛП. Для добровольцев были рассчитаны поглощённые дозы на очаг поражения и критические органы. Для персонала рассчитывалась лучевая нагрузка на кисти рук и глаза.
Результаты
Результаты повременной сцинтиграфии всего тела показали наличие небольшого шунта у всех добровольцев (табл. 2) как на стадии скрининга с РФЛП «99mТс-МАА» (0,9-13,6%), так и при посттерапевтическом сканировании с РФЛП «МСА 20-40 мкм, 188Re» (5,5-13,2%). Причём, можно было видеть статистически значимое увеличение шунта на посттерапевтическом сканировании. У 16 добровольцев из 20 шунт с РФЛП «МСА 20-40 мкм, 188Re» был больше шунта с РФЛП «99mТс-МАА», оставаясь, однако, в пределах допустимого значения.
Таблица 2
Показатели лёгочного шунта у пациентов после введения РФЛП «99mТс-МАА» и РФЛП «МСА 20-40, 188Re»
|
Номер добровольца |
Шунт c 99mТс-МАА, (%) |
Шунт с МСА20-40 мкм, 188Re, (%) |
Δ – изменение шунта, % |
|
ОАВ 001 |
11,7 |
7,9 |
-3,8 |
|
ЧВВ 002 |
4,4 |
6,8 |
2,4 |
|
ЯВН 003 |
3,4 |
9,7 |
6,3 |
|
МЕН 004 |
2,6 |
7,8 |
5,2 |
|
ПСА 005 |
12,3 |
7,3 |
- 5,0 |
|
ГНВ 006 |
13,6 |
13,2 |
- 0,4 |
|
ЕВА 007 |
5,8 |
8,7 |
2,9 |
|
ДЗА 008 |
1,3 |
11,7 |
10,4 |
|
БВА 009 |
2,2 |
5,5 |
3,3 |
|
КСМ 010 |
4,3 |
9,2 |
4,9 |
|
ВДА 011 |
0,9 |
5,9 |
5,0 |
|
ДВК 012 |
1,1 |
6,3 |
5,2 |
|
КАМ 013 |
4,8 |
10,8 |
6,0 |
|
ПЛА 014 |
4,1 |
7,8 |
3,7 |
|
МАН 015 |
3,1 |
6,5 |
3,4 |
|
СНВ 016 |
1,2 |
7,4 |
6,2 |
|
АДА 017 |
1,3 |
5,5 |
4,2 |
|
КНА 018 |
1,5 |
8,9 |
7,4 |
|
КВЕ 019 |
4,5 |
9,4 |
4,9 |
|
ФАВ 020 |
12,5 |
9,5 |
-3,0 |
Наблюдалась хорошая сходимость между ОФЭКТ/КТ изображениями распределения РФЛП «99mТс-МАА» и «МСА 20-40 мкм, 188Re» в организме добровольцев (рис. 1). Не наблюдалось на ОФЭКТ/КТ существенного поглощения свободного 188Re в щитовидной железе на протяжении 72 ч после РЭ, что косвенно подтверждает хорошую связываемость радионуклида с микросферами.
Результаты радиометрии мочи в первые 48 ч после РЭ показали 23% [12-40%] выведение активности макроагрегатов 188Re, образующихся при биологическом распаде части микросфер, из организма. Это говорит о высоком удержании препарата в опухолевом очаге.
Результаты расчётов поглощённых доз, выполненных в соответствии с публикацией [17] в визуализированных на ОФЭКТ/КТ очагов и органов риска добровольцев, представлены в табл. 3. Поглощённые дозы зависят как от массы органа, так и от кинетики накопления-выведения активности РФЛП в органе. Можно видеть, что поглощённые дозы в поражённой доле печени (9,2-68,5 Гр) существенно выше доз, полученных здоровой долей печени (1,3-8,2 Гр) и критичес- кими органами (0,25-5,8 Гр). Лучевая нагрузка на органы риска всех пациентов оказалась многократно ниже общепринятых дозовых ограничений («commonly applied dose constraints») [18].
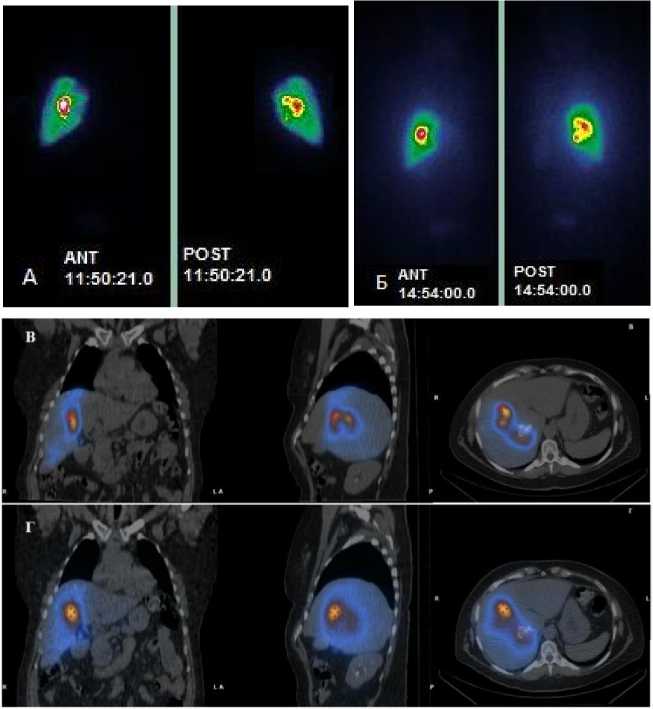
Рис. 1. А – планарное изображение передней и задней прямой проекции после введения РФЛП «99mТс-МАА»; Б – планарное изображение передней и задней прямой проекции после введения РФЛП «МСА 20-40 мкм, 188Re»; В – ОФЭКТ/КТ после введения РФЛП «99mТс-МАА»; Г – ОФЭКТ/КТ после введения РФЛП «МСА 20-40 мкм, 188Re».
Результаты измерений индивидуальных локальных доз облучения медицинского персонала, проводившего лечебные процедуры с РФЛП «МСА 20-40 мкм, 188Re» в первой фазе КИ, показали, что локальные дозы облучения медицинского персонала, контактирующего с РФЛП, находились в пределах от 0,01 до 6,2 мГр (глаза) и от 0,04 до 66 мГр (кисти рук). Отмеченные в ряде случаев локальные дозы облучения кожи отдельных пальцев рук в диапазоне от 10 до 120 мГр связаны со случайным попаданием капель РФЛП из шприца на поверхность защитной перчатки. Тем не менее, не было установлено превышений пределов доз для персонала. В соответствии с НРБ основные годовые пределы доз для персонала равны: для кожи (включая кожу кистей рук) – 500 мЗв, для хрусталика глаза – 150 мЗв. Следовательно, проведение работ, связанных с фасовкой, введением испытываемого РФЛП и последующим общением с пациентом, являлось безопасным с радиационной точки зрения.
Результаты неблагоприятных явлений и серьёзных неблагоприятных явлений у добровольцев 1 Фазы КИ представлены в табл. 4. Как можно видеть, у всех пациентов наблюдалась гепатотоксичность 2 степени, купируемая, и гематологическая токсичность 1 степени (15 добровольцев), 2 степени (3 добровольца) и 3 степени (3 добровольца). За время проведения КИ наблюдалось всего 1 серьёзное неблагоприятное явление (смерть) от прогрессирования основного заболевания с сомнительной связью на проведение РЭ.
Таблица 3
Поглощённые дозы внутреннего облучения визуализированных очагов и органов риска добровольцев
|
Номер добровольца |
Поглощённые дозы, Гр |
||||||
|
Печень с опухолью |
Печень без опухоли |
Селезёнка |
Лёгкие |
Правая почка |
Левая почка |
Мочевой пузырь |
|
|
ОАВ 001 |
10,8±1,6 |
1,9±0,2 |
0,8±0,1 |
0,6±0,1 |
1,9±0,3 |
1,9±0,3 |
1,9±0,3 |
|
ЧВВ 002 |
23,7±2,5 |
1,9±0,2 |
1,1±0,14 |
0,6±0,1 |
3,3±0,4 |
2,3±0,3 |
2,1±0,2 |
|
ЯВН 003 |
19,0±2,4 |
- |
2,8±0,4 |
0,3±0,1 |
2,5±0,3 |
2,3±0,3 |
2,0±0,3 |
|
МЕН 004 |
18,0±1,7 |
3,1±0,40 |
1,7±0,3 |
0,5±0,1 |
3,6±0,5 |
1,8±0,2 |
2,7±0,4 |
|
ПСА 005 |
12,9±1,7 |
4,4±0,7 |
1,3±0,2 |
0,9±0,1 |
3,3±0,5 |
1,4±0,2 |
2,5±0,3 |
|
ГНВ 006 |
39,5±5,1 |
4,7±0,7 |
1,7±0,2 |
1,7±0,3 |
2,8±0,4 |
2,4±0,4 |
2,6±0,4 |
|
ЕВА 007 |
21,3±2,7 |
1,3±0,2 |
1,1±0,2 |
0,3±0,1 |
2,1±0,3 |
1,2±0,2 |
3,3±0,5 |
|
ДЗА 008 |
41,2±4,2 |
8,2±1,1 |
1,1±0,2 |
0,7±0,1 |
3,9±0,6 |
2,3±0,4 |
1,3±0,2 |
|
БВА 009 |
27,1±3,8 |
3,2±0,5 |
1,4±0,2 |
0,5±0,1 |
2,6±0,4 |
3,1±0,5 |
3,9±0,6 |
|
КСМ 010 |
16,0±2,2 |
2,9±0,4 |
2,2±0,4 |
0,5±0,1 |
4,8±0,7 |
2,7±0,5 |
0,8±0,1 |
|
ВДА 011 |
68,5±9,6 |
4,4±0,7 |
1,7±0,3 |
0,5±0,1 |
1,3±0,2 |
1,9±0,3 |
5,8±0,9 |
|
ДВК 012 |
44,9±5,8 |
5,1±0,2 |
1,3±0,1 |
0,4±0,1 |
4,5±0,8 |
4,3±0,8 |
0,5±0,1 |
|
КАМ 013 |
16,1±2,6 |
2,1±0,3 |
1,4±0,2 |
0,1±0,1 |
2,9±0,5 |
2,2±0,4 |
2,7±0,4 |
|
ПЛА 014 |
22,8±3,6 |
1,4±0,2 |
0,6±0,1 |
3,4±0,5 |
2,2±0,3 |
1,2±0,2 |
1,3±0,2 |
|
МАН 015 |
22,0±3,7 |
2,9±0,4 |
1,5±0,2 |
0,7±0,1 |
3,7±0,6 |
2,9±0,4 |
2,1±0,3 |
|
СНВ 016 |
25,2±4,1 |
5,9±0,9 |
1,4±0,2 |
0,6±0,1 |
3,5±0,5 |
2,2±0,3 |
0,8±0,1 |
|
АДА 017 |
24,0±3,5 |
1,9±0,3 |
0,6±0,1 |
0,2±0,1 |
0,2±0,1 |
0,2±0,1 |
0,1±0,1 |
|
КНА 018 |
9,2±1,3 |
3,6±0,6 |
2,7±0,4 |
0,6±0,1 |
1,9±0,3 |
2,0±0,3 |
2,5±0,4 |
|
КВЕ 019 |
19,0±3,1 |
4,3±0,7 |
1,8±0,3 |
0,4±0,1 |
2,6±0,3 |
1,9±0,3 |
0,1±0,1 |
|
ФАВ 020 |
14,9±1,7 |
3,0±0,5 |
2,1±0,3 |
0,5±0,1 |
1,8±0,3 |
1,6±0,2 |
1,5±0,3 |
Таблица 4
Список неблагоприятных явлений по 1 Фазе клинических исследований у добровольцев
|
Номер пациента |
Неблагоприятные явления |
Дата регистра-ции |
Исход |
Дата окончания |
Связь с исследуемым препаратом |
Медикаментозная терапия |
|
ОАВ 001 |
Гематологическая токсичность, 1 ст. |
72 ч |
Разрешилось |
2 нед. |
Вероятная |
- |
|
Гепатотоксичность, 2 ст. |
72 ч |
Разрешилось |
4 нед. |
Вероятная |
Гепатопротекторы |
|
|
ЧВВ 002 |
Гематологическая токсичность, 1 ст. |
72 ч |
Разрешилось |
2 нед. |
Вероятная |
- |
|
Гепатотоксичность, 2 ст. |
72 ч |
Разрешилось |
4 нед. |
Возможная |
Гепатопротекторы |
|
|
ЯВН 003 |
Гематологическая токсичность, 2 ст. |
72 ч |
Разрешилось |
1 нед. |
Вероятная |
- |
|
Гепатотоксичность, 2 ст. |
72 ч |
Разрешилось |
4 нед. |
Вероятная |
Гепатопротекторы |
|
|
МЕН 004 |
Гематологическая токсичность, 2 ст. |
72 ч |
Разрешилось |
1 нед. |
Вероятная |
- |
|
Гепатотоксичность, 2 ст. |
72 ч |
Разрешилось |
4 нед. |
Вероятная |
Гепатопротекторы |
|
|
ПСА 005 |
Гематологическая токсичность, 2 ст. |
72 ч |
Разрешилось |
2 нед. |
Возможная |
- |
|
Гепатотоксичность, 2 ст. |
72 ч |
Разрешилось |
4 нед. |
Вероятная |
Гепатопротекторы |
|
|
ГНВ 006 |
Гематологическая токсичность, 1 ст. |
72 ч |
Разрешилось |
3 нед. |
Возможная |
- |
|
Гепатотоксичность, 2 ст. |
72 ч |
Разрешилось |
4 нед. |
Возможная |
Гепатопротекторы |
|
|
ЕВА 007 |
Гематологическая токсичность, 1 ст. |
72 ч |
Разрешилось |
3 нед. |
Возможная |
- |
|
Гепатотоксичность, 2 ст. |
72 ч |
Разрешилось |
4 нед. |
Возможная |
Гепатопротекторы |
|
|
ДЗА 008 |
Гематологическая токсичность, 3 ст. |
72 ч |
Разрешилось |
3 нед. |
Возможная |
Стимуляторы гемопоэза |
|
Гепатотоксичность, 2 ст. |
72 ч |
Разрешилось |
4 нед. |
Возможная |
Гепатопротекторы |
|
|
БВА 009 |
Гематологическая токсичность, 1 ст. |
72 ч |
Разрешилось |
2 нед. |
Возможная |
- |
|
Гепатотоксичность, 2 ст. |
72 ч |
Разрешилось |
4 нед. |
Возможная |
Гепатопротекторы |
|
|
КСМ 010 |
Гематологическая токсичность, 1 ст. |
72 ч |
Разрешилось |
3 нед. |
Возможная |
- |
|
Гепатотоксичность, 2 ст. |
72 ч |
Разрешилось |
4 нед. |
Возможная |
Гепатопротекторы |
|
|
ВДА 011 |
Гематологическая токсичность, 3 ст. |
72 ч |
Разрешилось |
3 нед. |
Возможная |
Стимуляторы гемопоэза |
|
Гепатотоксичность, 2 ст. |
72 ч |
Разрешилось |
4 нед. |
Возможная |
Гепатопротекторы |
|
|
ДВК 012 |
Гематологическая токсичность, 1 ст. |
72 ч |
Разрешилось |
2 нед. |
Возможная |
- |
|
Гепатотоксичность, 2 ст. |
72 ч |
Разрешилось |
4 нед. |
Возможная |
Гепатопротекторы |
|
|
КАМ 013 |
Гематологическая токсичность, 1 ст. |
72 ч |
Разрешилось |
2 нед. |
Возможная |
- |
|
Гепатотоксичность, 2 ст. |
72 ч |
Разрешилось |
4 нед. |
Возможная |
Гепатопротекторы |
|
|
ПЛА 014 |
Гематологическая токсичность, 1 ст. |
72 ч |
Разрешилось |
2 нед. |
Возможная |
- |
|
Гепатотоксичность, 2 ст. |
72 ч |
Разрешилось |
4 нед. |
Возможная |
Гепатопротекторы |
Продолжение таблицы 4
|
Номер пациента |
Неблагоприятные явления |
Дата регистра-ции |
Исход |
Дата окончания |
Связь с исследуемым препаратом |
Медикаментозная терапия |
|
|
МАН 015 |
Гематологическая токсичность, Гепатотоксичность, 2 ст. |
1 ст. |
72 ч 72 ч |
Разрешилось Разрешилось |
2 нед. 4 нед. |
Возможная Возможная |
- Гепатопротекторы |
|
СНВ 016 |
Гематологическая токсичность, Гепатотоксичность, 2 ст. |
1 ст. |
72 ч 72 ч |
Разрешилось Разрешилось |
2 нед. 4 нед. |
Возможная Возможная |
- Гепатопротекторы |
|
АДА 017 |
Гематологическая токсичность, Гепатотоксичность, 2 ст. |
1 ст. |
72 ч 72 ч |
Разрешилось Разрешилось |
3 нед. 4 нед. |
Возможная Вероятная |
- Гепатопротекторы |
|
КНА 018 |
Гематологическая токсичность, Гепатотоксичность, 2 ст. |
1 ст. |
72 ч 72 ч |
Разрешилось Разрешилось |
2 нед. 4 нед. |
Возможная Возможная |
- Гепатопротекторы |
|
КВЕ 019 |
Гематологическая токсичность, Гепатотоксичность, 2 ст. |
1 ст. |
72 ч 72 ч |
Разрешилось Разрешилось |
3 нед. 4 нед. |
Возможная Вероятная |
- Гепатопротекторы |
|
ФАВ 020 |
Гематологическая токсичность, Гепатотоксичность, 2 ст. |
1 ст. |
72 ч 72 ч |
Разрешилось Разрешилось |
2 нед. 4 нед. |
Возможная Вероятная |
- Гепатопротекторы |
Заключение
В результате проведённых исследований было установлено следующее: поведение терапевтического РФЛП «МСА 20-40 мкм, 188Re» в организме добровольцев не отличалось от распределения диагностического РФЛП «99mТс-МАА».
Выраженных осложнений в период наблюдения за добровольцами с диагнозом «неоперабельный первичный и вторичный рак печени» в 1 Фазе КИ не выявлено. Полный период наблюдения завершён у 19 добровольцев. 1 доброволец умер спустя 2 мес. после операции от прогрессирования основного заболевания.
Были определены лучевые нагрузки на критические органы добровольцев, которые оказались многократно меньше общепринятых дозовых ограничений при радиотерапии. Дозы внутреннего облучения на долю печени с опухолью, в зависимости от введённых активностей РФЛП и объёмов опухолевых очагов, находились в пределах от 9,2 до 68,5 Гр.
Также не было установлено превышений пределов доз для персонала в соответствии с НРБ-99/2009.
Гематологическую токсичность I степени наблюдали у 15 (75%) добровольцев, II степени – у 3 (15%) добровольцев, III степени – у 2 (10%) добровольцев. У всех исследуемых добровольцев наблюдали гепатологическую токсичность II степени.
Хорошую переносимость РЭ наблюдали у 10 (50%) добровольцев, удовлетворительную – у 7 (35%), неудовлетворительную – у 3 (15%).
По результатам проведённых КИ 1 Фазы можно сделать вывод о безопасности и переносимости РФЛП «МСА 20-40 мкм, 188Re» активностью 3,0-6,0 ГБк при проведении РЭ пациентам с неоперабельным первичным и вторичным раком печени.
Список литературы Результаты клинического исследования безопасности радиофармацевтического лекарственного препарата с 188Re при проведении внутриартериальной радиоэмболизации
- Петрова Г.В., Каприн А.Д., Грецова О.П., Старинский В.В. Злокачественные новообразования в России (обзор статистической информации за 1993-2013 гг.). М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИРЦ» Минздрава России, 2015. 511 с.
- Злокачественные новообразования в России в 2020 году /под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2021. 252 с.
- Рак печени (гепатоцеллюлярный). Клинические рекомендации. Утв. Общероссийским национальным союзом «Ассоциация онкологов России». М., 2020. 57 с.
- Vogel A., Cervantes A., Chau I., Daniele B., Llovet J., Meyer T., Nault J.C., Neumann U., Ricke J., Sangro B., Schirmacher P., Verslype C., Zech C.J., Arnold D., Martinelli E., ESMO Guidelines Committee. Hepatocellular carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up //Ann. Oncol. 2018. V. 29, N 4 (Suppl.). P. iv238-iv255.
- Таразов П.Г. Артериальная радиоэмболизация злокачественных опухолей печени микросферами иттрия-90 //Вопросы онкологии. 2013. Т. 59, № 4. С. 428-434.
- Van Cutsem E., Cervantes A., Adam R., Sobrero A., van Krieken J.H., Aderka D., Aguilar A.A., Bardelli A., Benson A., Bodoky G., Ciardiello F., D'Hoore F., Diaz-Rubio E., Douillard D-Y., Ducreux M., Falcone A., Grothey A., Gruenberger T., Haustermans K., Heinemann V., Hoff P., Köhne C-H., Labianca R., Laurent- Puig P., Ma B., Maughan T., Muro K., Normanno N., Österlund P., Oyen W.J.G., Papamichael D., Pentheroudakis G., Pfeiffer P., Price T.J., Punt C., Ricke J., Roth A., Salazar R., Scheithauer W., Schmoll H.J., Tabernero J., Taïeb J., Tejpar S., Wasan H., Yoshino T., Zaanan A., Arnold D. ESMO consensus guidelines for the management of patients with metastatic colorectal cancer //Ann. Oncol. 2016. V. 27, N 8. P. 1386-1422.
- Каприн А.Д., Иванов С.А., Кучеров В.В., Петросян А.П., Майоров К.В., Марков Н.В., Петров Л.О., Давыдов Г.А., Сигов М.А., Силантьева Н.К., Березовская Т.П., Усачева А.Ю., Санин Д.Б. Радиоэм-болизация печени: новая глава в отечественной онкологии //Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2019. Т. 29, № 5. С. 7-12.
- NCCN Guidelines® Recommend SIR-Spheres® Y-90 Resin microspheres for the Treatment of Metastatic Colorectal Cancer. [Электронный ресурс]. URL: https://www.sirtex.com/media/r3rbtofj/english-20161212.pdf (дата обращения 15.05.2023).
- Hickey R., Lewandowski R.J., Prudhomme T., Ehrenwald E., Baigorri B., Critchfield J., Kallini J., Gabr A., Gorodetski B., Geschwind J.-F., Abbott A., Shridhar R., White S.B., Rilling W.S., Boyer B., Kauffman Sh., Kwan Sh., Padia S.A., Gates V.L., Mulcahy M., Kircher Sh., Nimeiri H., Benson A.B., Salem R. 90Y radioembolization of colorectal hepatic metastases using glass microspheres: safety and survival outcomes from a 531-patient multicenter study //J. Nucl. Med. 2016. V. 57, N 5. P. 665-671.
- Petriev V.M., Vlasova O.P., Postnov A.A., Epstein N.B. Radiopharmaceutical development based on human blood albumin microspheres and 90Y //J. Phys.: Conf. Ser. 2017. V. 784. P. 012046. DOI: 10.1088/1742-6596/784/1/012046.
- Власова О.П., Степченкова Е.Д., Петриев В.М., Клементьева О.Е., Степченков Д.В., Красноперова А.С., Кузнецов А.А., Нерозин Н.А., Иванов С.А., Каприн А.Д. Результаты доклинических испытаний эффективности радиофармпрепарата «ДТПА-микросферы альбумина, 90Y» //Медицинская радиология и радиационная безопасность. 2020. Т. 65, № 5. С. 60-67.
- Banka V.K., Moon S.H., Jeong J.M., Seelam S.R., Lee Y.S, Kim Y.J., Lee D.S., Chung J.K. Development of 4-hexadecyl-4,7-diaza-1,10-decanedithiol (HDD) kit for the preparation of the liver cancer therapeutic agent Re-188-HDD/lipiodol //Nucl. Med. Biol. 2015. V. 42, N 3. P. 317-322.
- Bevelacqua J.J. 210Po microsphere radiological design for tumor vascular disruption radionuclides //PeerJ. 2015. V. 3. P. e1143. DOI: 10.7717/peerj.1143.
- Yttrium-90 and Rhenium-188 radiopharmaceuticals for radionuclide therapy. Vienna: IAEA, 2015. 301 p.
- Knapp F.F., Dash A. Radiopharmaceuticals for therapy. New Delhi, India: Springer (India) Pvt. Ltd., 2016. 357 p.
- РФЛП для терапии первичной гепатоцеллюлярной карциномы и метастатических образований в печень, а также состав и способ его получения //Патент RU2698111, 09.10.2017.
- Степаненко В.Ф., Петриев В.М., Каприн А.Д., Иванов С.А., Шегай П.В., Богачева В.В., Колыженков Т.В., Петухов А.Д., Крылов В.В., Кучеров В.В., Сигов М.А., Власова О.П., Петросян А.П., Петросян К.М., Спиченкова О.Н., Иванников А.И., Хайлов А.М., Коротков В.А., Жарова Е.П., Еремеев М.Р. Персонализированная дозиметрия внутреннего облучения опухолевых образований и органов риска пациентов: разработка и реализация методического базиса для дозиметрического обеспечения клинических исследований терапевтических радиофармпрепаратов //Радиация и риск. 2023. Т. 32. № 1. С.156-167.
- Gerhard S.G., Palma D.A., Arifin A.J., Louie A.V., Li G.J., Al-Shafa F., Cheung P., Rodrigues G.B., Bassim C.W., Corkum M.T. Organ at risk dose constraints in SABR: a systematic review of active clinical trials//Pract. Radiat. Oncol. 2021, V. 11, N 4, P. e355-e365.


