Результаты количественной оценки иммунопреципитата при определении противопоказаний к введению хондропротекторов
Автор: Матвеева Е.Л., Кармацких О.Л., Карасева Т.Ю.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 1, 2003 года.
Бесплатный доступ
В работе сравниваются ряд биохимических и иммунологических показателей в двух группах больных, исследования синовиальной жидкости которых рандомизированны по принципу наличия или отсутствия колец преципитата при определении противопоказаний к внутрисуставному введению хондропротекторов на основе гликозаминогликанов суставного хряща для дифференциальной оценки преобладания деструктивных или воспалительных процессов в суставе.
Синовиальная жидкость, иммунодиффузия
Короткий адрес: https://sciup.org/142120567
IDR: 142120567
Текст научной статьи Результаты количественной оценки иммунопреципитата при определении противопоказаний к введению хондропротекторов
Фактор аутоиммунного процесса остается неизученным моментом в этиологии заболеваний суставов. Нами был предложен «Способ определения показаний к внутрисуставному введению хондропротекторов на основе гидролизата гликозаминогликанов хряща» (приоритетная справка № 2000116050/14 от 19.06.00), сущность которого заключается в следующем: готовят пластину со слоем геля, в который вносят либо гидролизат гликозаминогликанов суставного хряща, либо хондропротектор на основе гидролизата гликозаминогликанов хряща, а за- тем, используя метод радиальной иммунодиффузии, проводят реакцию преципитации, внося в лунки агара синовиальную жидкость больного. Наличие колец преципитации определяет противопоказания к внутрисуставному применению хондропротекторов на основе гидролизата гликозаминогликанов. Однако с целью уточнения и стандартизации данного исследования возникла необходимость количественной оценки иммунопреципитата и получения аналогичных данных в сыворотке крови.
МАТЕРИАЛЫ И МЕТОДЫ
Предложенным способом исследовали 12 образцов иммунопреципитата от 6 больных с заболеваниями суставов (6 синовиальных жидкостей и 6 сывороток крови). Агаровый гель готовили на стандартных предметных стеклах (для каждого образца на отдельном стекле), выполняя по 4 параллели для отдельного исследования. Денситометрию полученных высушен- ных стекол осуществляли на денситометре прибора для электрофореза “Paragon” фирмы “Bec-man”. В качестве эталона нами было принято максимально темное окрашивание преципитата. Количественная оценка иммунопреципитата проводилась гравиметрическим (весовым) методом на электронных весах «Tecator». Математическая обработка полученных результатов проводилась методом вариационной статистики с расчетом значений средней и ошибки средней. Достоверность различий оценена с помощью критерия Фишера с принятием вероятности Р равной 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 показан денситометрический профиль иммунопреципитата. Два пика в опытном образце и в эталоне соответствуют радиусам кольца преципитата. На рис. 2 показаны значения количеств преципитата для синовиальной жидкости и сыворотки крови. Следует отметить, что они различаются с достоверно более высоким уровнем в сыворотке крови.
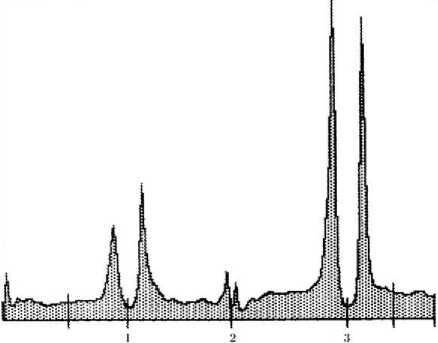
Рис. 1. Денситометрический профиль иммунопреципитата: 1 - опытный образец, 2 - стык двух предметных стекол, 3 - эталонный образец.
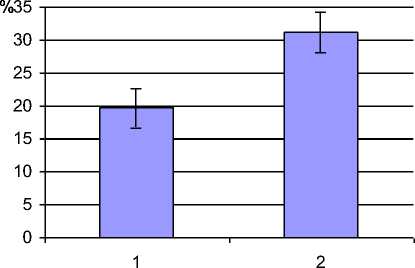
Рис. 2. Значения количеств иммунопреципитата в синовиальной жидкости (1) и в сыворотке крови (2) в % от условно принятого эталона.
При наличии в опциях прибора электрофореза гликозаминогликанов можно было бы автоматически количественно оценить преципитат, вводя концентрацию уроновых кислот. Следует заметить, что количественное определение иммунопреципитата в сыворотке крови и синовиальной жидкости позволит рекомендовать или не рекомендовать назначение хондропротекторов на основе гликозаминогликанов. Также возможно определить способ их введения и применения: при высоких значениях количества преципитата в синовиальной жидкости, очевидно, не следует назначать внутриартикуляного или аппликационного применения такого рода пре- паратов. При высоких количествах иммунопреципитата в сыворотке крови, по всей видимости, не рекомендовано инъекционное введение хондропротекторов.
Таблица.
Состав синовиальной жидкости в группах больных с положительным и отрицательным результатом тестирования на определение противопоказаний к введению хондропротекторов
|
Показатели синовиальной жидкости |
С отрицательным результатом |
С положительным результатом |
|
Общий белок г/л |
25,7 ± 1,9 |
33,8 ± 1,8* |
|
Белковые фракции (%): альбумины α1 α2 β γ А/G |
63,65 ± 1,14 2,79±0,19 6,43±0,87 12,89±0,69 14,23±0,68 1,78±0,29 |
64,10±1,41 2,96±0,27 7,32±0,72 11,46±0,76 14,13±0,77 1,84±0,10 |
|
Ig G |
7,17±1,44 |
7,34±0,97 |
|
Ig A |
1,21±0,26 |
0,93±0,14 |
|
Ig M |
0,80±0,36 |
1,48±0,21* |
|
Уроновые кислоты г/л |
4,27±0,85 |
5,80±0,85* |
|
Сиаловые кислоты мМ/л |
0,88±0,17 |
1,27±0,20* |
*– различия достоверны с уровнем вероятности р U <0,05 по критерию U Вилкоксона–Манна–Уитни.
Полученные нами результаты показали достоверные различия в этих группах по ряду биохимических показателей: общему белку, уроновым и сиаловым кислотам. Не отмечено достоверных изменений в обеих группах в распределении белковых фракций и иммуноглобулинов классов G и A.
Концентрация УК синовии, представленных гиалуроновой кислотой, по референтным [7] и по полученным нами данным [1], снижается при всех видах патологии суставов. Однако при остеоартрозах, в отличие от ревматоидного артрита, снижается достоверно и в гораздо большей степени. Это происходит несмотря на то, что в синовию поступают продукты деструкции суставного хряща – главным образом белки и углеводные компоненты протеогликанов. Снижение количества УК отражает гораздо большее поступление в синовию белковых маркеров метаболизма протеогликанов, т.к. в сыворотке крови больных с заболеваниями суставов количество УК возрастает прямо пропорционально тяжести деструктивного процесса [8], а количество белка остается без достоверных изменений. Вдвое большая концентрация сиаловых кислот у боль- ных с положительным тестом на противопоказания к введению хондропротекторов объясняется, по–видимому, большей выраженностью у данной группы больных явлений воспаления, возможно, аутоиммунной природы.
Артикулярный хрящ, как аваскуляризиро-ванная ткань, в норме не является объектом, задействованным в иммунной системе, но, возможно, потенциально способен образовывать антитела. Локальный воспалительный процесс в суставе, который реализуется факторами моно-нуклеарных клеток и стимулирует активность внеклеточных протеиназ, приводит к деградации хряща и делает компоненты хрящевого матрикса аутоантигенами [4]. Таким образом, специфические макромолекулы хряща, такие как коллаген II типа и протеогликаны, деструк-турирующиеся при активном синовите, травма-тизации или микротравматизации могут восприниматься как чужеродный материал и провоцировать воспалительный процесс у пациентов с ДДИ. При наличии высокой активности лизосомальных ферментов и деградации хрящевого матрикса, сопровождающейся продукцией антител, формируется порочный замкнутый круг воспалительного процесса.
Таким образом, достоверность различий биохимических тестов наглядно демонстрирует преобладание в патогенезе либо воспалительного, либо дистрофического компонента, поскольку дегенеративно-дистрофические заболевания суставов зачастую сопровождаются явлениями воспаления. Следует отметить, что специфичность метода определения аутоантител к гликозаминогликанам суставного хряща способом радиальной иммунодиффузии ниже, чем при определении концентрации тех же антител им-муноферментным методом, но вместе с тем этот способ позволяет получить достоверный результат даже в условиях лабораторий низкой технической оснащенности и вследствие этого может быть широко использован в ортопедотравматологической практике.


