Результаты комбинированного и химиолучевого лечения больных раком грудного отдела пищевода по данным регионального онкологического центра
Автор: Тонеев Е.А., Пикин О.В., Деньгина Н.В., Рябов А.Б., Мартынов А.А., Гальчин А.В., Исаев Д.Н., Фирстов А.А., Прохоров Д.Д.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 5 т.22, 2023 года.
Бесплатный доступ
Актуальность. Рак пищевода (РП) - одно из самых агрессивных онкологических заболеваний желудочно-кишечного тракта. Химиолучевая терапия является стандартом лечения местнораспространенного РП. Цель исследования - изучить эффективность химиолучевой терапии как в самостоятельном варианте, так и в качестве предоперационного воздействия в лечении больных раком грудного отдела пищевода. материал и методы. В период с 01.01.12 по 31.12.21 в регионарном канцер-регистре взято на учет 940 больных раком грудного отдела пищевода, из них отобрано 178 пациентов, которым проведена одновременная ХЛТ по поводу РП I-III клинической стадии. Данные пациентов (n=37), у которых на фоне ХЛТ возникли осложнения, требующие прерывания лечения, не учитывались при оценке непосредственных и отдаленных результатов. В окончательный анализ включены данные о 141 больном.
Рак пищевода, химиолучевое лечение, торакальная хирургия
Короткий адрес: https://sciup.org/140303545
IDR: 140303545 | УДК: 616.329-08-059:615.28+615.849.1]-036.8 | DOI: 10.21294/1814-4861-2023-22-5-84-95
Текст научной статьи Результаты комбинированного и химиолучевого лечения больных раком грудного отдела пищевода по данным регионального онкологического центра
Рак пищевода является одним из самых агрессивных и прогностически неблагоприятных онкологических заболеваний желудочно-кишечного тракта. В Российской Федерации в 2020 г. заболеваемость РП составила 10,2 на 100 000 населения, из которых III–IV стадия – 63,1 %, одногодичная летальность – 57,5 % [1].
За последние 20 лет применение комбинированного лечения больных раком грудного отдела пищевода привело к улучшению общей выживаемости, ведущую роль в этом отводят сочетанию предоперационной химиолучевой терапии с последующим хирургическим лечением [2]. В ГУЗ «Областной кинический онкологический диспансер» г. Ульяновска химиолучевая терапия (ХЛТ) местнораспространенного рака пищевода является стандартным
методом лечения, отобранным больным на втором этапе выполняется оперативное вмешательство.
Цель исследования – изучить эффективность химиолучевой терапии как в самостоятельном варианте, так и в качестве предоперационного воздействия в лечении больных раком грудного отдела пищевода.
Материал и методы
В период с 01.01.12 по 31.12.21 в региональном канцер-регистре взято на учет 940 больных раком грудного отдела пищевода, из них отобрано 178 пациентов, получавших одновременную ХЛТ по поводу РП I–III клинической стадии. При оценке непосредственных и отдаленных результатов данные пациентов (n=37), у которых на фоне ХЛТ возникли осложнения, требующие прерывания
Таблица 1/Table 1
|
Показатели/Parameters |
Число больных/Number of patients |
|
|
Стадия/Stage |
I |
3 (2,1 %) |
|
II |
40 (28,4 %) |
|
|
III |
98 (69,5 %) |
|
|
Нет/No |
89 (63,1 %) |
|
|
Операция/Surgery |
Да/Yes |
52 (36,9 %) |
|
Пол/Gender |
Мужчины/Males |
121 (85,8 %) |
|
Женщины/Females |
20 (14,2 %) |
|
|
Локализация опухоли в пищеводе/ |
Верхняя треть/Upper third |
15 (10,6 %) |
|
Location of the tumor in the |
Средняя треть/Middle third |
65 (46,1 %) |
|
esophagus |
Нижняя треть/Lower third |
61 (43,3 %) |
|
Гистологический тип опухоли/ |
Аденокарцинома/ Adenocarcinoma |
24 (17,0 %) |
|
Histological type of the tumor |
Плоскоклеточный/Squamous cell carcinoma |
117 (83,0 %) |
|
I |
23 (16,3 %) |
|
|
Дисфагия/Dysphagia |
II |
37 (26,2 %) |
|
III |
67 (47,5 %) |
|
|
IV |
14 (9,9 %) |
|
Примечание: таблица составлена авторами.
Note: created by the authors.
Таблица 2/Table 2
Распределение по стадиям заболевания в зависимости от вида химиотерапии distribution by disease stage depending on the type of chemotherapy
|
СтадияStage |
CF |
ХЛТ/CRT CС |
Cross |
p |
|
I стадия/Stage I |
1 (1,6 %) |
2 (6,7 %) |
0 (0,0) |
|
|
II стадия/Stage II |
14 (23,0 %) |
8 (26,7 %) |
18 (36,0 %) |
0,179 |
|
III стадия/Stage III |
46 (75,4 %) |
20 (66,7 %) |
32 (64,0 %) |
Примечание: СF – цисплатин + 5-фторурацил; CC – цисплатин + капецитабин; Cross – паклитаксел + карбоплатин; таблица составлена авторами.
Описательная статистика исследуемых пациентов descriptive statistics of patients
Note: CF – cisplatin + fluorouracil; CC – cisplatin + capecitabine; Cross – paclitaxel + carboplatin; created by the authors.
лечения, не учитывались. В окончательный анализ включены сведения о 141 больном РП (табл. 1, 2). Проведены анализ медицинской документации (амбулаторные карты, истории болезни), а также оценка общей и безрецидивной выживаемости. Средний возраст пациентов составил 60 ± 8 лет, остальные характеристики представлены в табл. 1.
Всем больным проводили радиотерапию РОД 1,8 Гр, СОД 45–60 Гр (в зависимости от того, планировалась неоадъювантная или радикальная программа) на фоне химиотерапии. Облучение проводили согласно протоколу RTOG: CTV на 4 см выше/ниже GTV (видимой опухоли) и на 1,0 см в радиальном направлении (с исключением критических органов – сердца, сосудов, костных структур) плюс равномерное расширение PTV на 0,5–1,0 см (в зависимости от выбранного аппарата) с последующим однородным равномерным расширением на 0,5–1,0 см вокруг GTV в течение последних трех фракций до 50,4 Гр. Химиотерапия проводилась по следующим схемам (рис. 1): паклитаксел 50 мг/м 2 + карбоплатин AUC 2, еженедельно во время лучевой
терапии (50 пациентов); цисплатин 75–100 мг/м 2 в 1-й день + 5-фторурацил, длительные инфузии 1000 мг/м 2 /сут в 1–4-й дни, каждые 4 нед (2 цикла с лучевой терапией и 2 цикла – после) (61 пациент); цисплатин – 30 мг/м 2 , 1 раз в нед + капецитабин 800 мг/м 2 , 2 раза в день с 1-го по 5-й дни, каждую неделю, в течение 5 нед с лучевой терапией (30 пациентов). Распределение пациентов в зависимости от применяемой схемы химиотерапии носит исторический характер, вначале основными препаратами являлись цисплатин + 5-фторурацил, затем при появлении препарата капецитабин, с 2017–18 гг., у больных с дисфагией I степени стали использовать эту схему лекарственной терапии; после включения режима паклитаксел + карбоплатин в клинические рекомендации эта схема химиотерапии стала назначаться чаще всего.
Стадирование проведено, согласно 7-й редакции классификации American Joint Committee on Cancer (AJCC). Основные характеристики больных РП в зависимости от использованной схемы химиотерапии представлены в табл. 3–6.
Таблица 3/Table 3
Распределение по группам в зависимости от ведения пациентов после завершения химиолучевого лечения (операция или отказ от операции)
distribution by groups after completion of chemoradiotherapy (surgery or refusal of surgery)
|
Операция/Surgery |
CF |
ХЛТ/CRT CC |
Cross |
p |
|
Да/Yes |
18 (29,5 %) |
12 (40,0 %) |
22 (44,0 %) |
0,267 |
|
Нет/No |
43 (70,5 %) |
18 (60,0 %) |
28 (56,0 %) |
Примечание: СF – цисплатин + 5-фторурацил; CC – цисплатин + капецитабин; Cross – паклитаксел + карбоплатин; таблица составлена авторами.
Note: CF – cisplatin + fluorouracil; CC – cisplatin + capecitabine; Cross – paclitaxel + carboplatin; created by the authors.
Таблица 4/Table 4
|
ХЛТ/CRT |
Me |
Возраст/Age Q₁–Q₃ |
n |
p |
|
CF |
60 |
55–65 |
61 |
|
|
CK |
63 |
55–70 |
30 |
0,342 |
|
Cross |
60 |
55–65 |
50 |
Примечание: СF – цисплатин + 5-фторурацил; CC – цисплатин + капецитабин; Cross – паклитаксел + карбоплатин; таблица составлена авторами.
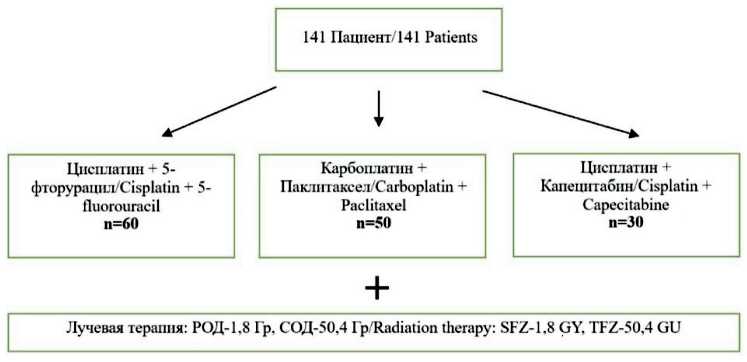
Рис. 1. Распределение пациентов в зависимости от схемы химиотерапии. Примечание: рисунок выполнен авторами
Fig. 1. Distribution of patients by the chemotherapy regimen. Note: created by the authors
Возрастные показатели исследуемых групп Age of patients in the study groups
Note: CF – cisplatin + fluorouracil; CC – cisplatin + capecitabine; Cross – paclitaxel + carboplatin; created by the authors.
Распределение больных по полу в зависимости от вида химиотерапии distribution of the patients by sex depending on the type of chemotherapy
Таблица 5/Table 5
|
Пол/Gender |
CF |
ХЛТ/CRT |
||
|
CC |
Cross |
p |
||
|
Женщины/Female |
7 (11,5 %) |
6 (20,0 %) |
7 (14,0 %) |
0,548 |
|
Мужчины/Male |
54 (88,5 %) |
24 (80,0 %) |
43 (86,0 %) |
|
Примечание: СF – цисплатин + 5-фторурацил; CC – цисплатин + капецитабин; Cross – паклитаксел + карбоплатин; таблица составлена авторами.
Note: CF – cisplatin + fluorouracil; CC – cisplatin + capecitabine; Cross – paclitaxel + carboplatin; created by the authors.
Таблица 6/Table 6
Распределение больных по гистологическому типу опухоли в зависимости от вида химиотерапии distribution of the patients by histological type of cancer depending on the type of chemotherapy
|
Гистотип опухоли/Histological subtype |
CF |
ХЛТ/CRT CC |
Cross |
p |
|
Аденокарцинома/Adenocarcinoma Плоскоклеточный/Squamous cell carcinoma |
13 (21,3 %) 48 (78,7 %) |
4 (13,3 %) 26 (86,7) |
7 (14,0 %) 43 (86,0 %) |
0,495 |
Примечание: СF – цисплатин + 5-фторурацил; CC – цисплатин + капецитабин; Cross – паклитаксел + карбоплатин; таблица составлена авторами.
Note: CF – cisplatin + fluorouracil; CC – cisplatin + capecitabine; Cross – paclitaxel + carboplatin; created by the authors.
Таблица 7/Table 7
Частота встречаемости негематологических осложнений
Frequency of non-hematological complications
|
Вид осложнений/Type of complications |
II степень/Grade II |
III степень/Grade III |
IV степень/Grade IV |
|
Тошнота, рвота/ Nausea, vomiting |
17 (12 %) |
11 (7,8 %) |
4 (2,8 %) |
|
Диарея/Diarrhea |
7 (5 %) |
4 (2,8 %) |
0 |
|
Нейропатия/ Neuropathy |
5 (3,5 %) |
2 (1,4 %) |
0 |
|
Анорексия/ Anorexia |
18 (12,8 %) |
2 (1,4 %) |
0 |
|
Эзофагит/ Esophagitis |
56 (39,7 %) |
10 (7 %) |
5 (3,5 %) |
Примечание: таблица составлена авторами.
Note: created by the authors.
Статистический анализ проводили с использованием программы StatTech v. 2.8.6 (разработчик – ООО «Статтех», Россия). Количественные показатели оценивали на предмет соответствия нормальному распределению с помощью критерия Колмогорова–Смирнова с поправкой Лиллиефорса. Непрерывные переменные, такие как возраст или рост, лабораторные и функциональные показатели выражались как среднее ± стандартное отклонение и анализировались с помощью параметрического критерия t-критерия Стъюдента. Категориальные переменные, такие как пол или статус курения, были представлены по частоте (%). Значение p<0,05 считалось значимым для всех исследуемых параметров. Выживаемость оценивали по методу Каплана–Мейера.
Результаты
Не смогли завершить лечение по причине непереносимости и тяжелых осложнений хими-олучевого лечения 37 (20,7 %) пациентов. Гематологическая токсичность III–IV степени на фоне лечения отмечена у 21 (14,8 %) пациента, включая лейкопению (82 %), тромбоцитопению (7 %), анемию (11 %). Среднее время начала гематологической токсичности III–IV степени составило 12–13 дней от начала лечения. При анализе не отмечено значимых различий в частоте гематологической токсичности в зависимости от использованной схемы химиотерапии. Коррекцию данных осложнений осуществляли путем введения гранулоцитарномакрофагального колониестимулирующего фактора (лейкостим), глюкокортикостероидов; при анемии и тромбоцитопении использовали с заместительной целью гемотрансфузию. Летальных исходов, связанных с гематологическими осложнениями, не было. Однако у 11 пациентов лечение было прервано, и в дальнейшем проводилась только лучевая терапия.
Негематологические осложнения II–IV степени возникли у 109 (77,3 %) пациентов (табл. 7). У 32 (22,7 %) пациентов осложнения были I степени. Наиболее частым негематологическим осложнением была дисфагия, возникающая на фоне развивающегося эзофагита. Для коррекции дисфагии III–IV степени пациентам устанавливали назогастральный зонд для длительной нутритивной поддержки или проводили стентирование зоны опухолевого стеноза.
После ХЛТ пациентам проводили комплексное исследование с целью оценки эффективности лечения. Для оценки эффективности лечения проводилась мультиспиральная компьютерная томография с внутривенным контрастным усилением и эзофагоскопия с обязательной биопсией для подтверждения остаточной опухоли. Далее пациенты были разделены на 4 группы (рис. 2):
– I группа – пациенты, которым проведено радикальное хирургическое лечение после химио-лучевой терапии;
– II группа – пациенты, у которых по данным исследования (МСКТ с внутривенным контрастным усилением и фиброэзофагогастродуоденоскопия с биопсией, при получении сомнительных данных для более точного исключения наличия резидуальной опухоли проводилась ПЭТ/КТ всего тела) получена информация о полном регрессе опухолевого процесса («clinical complete response», cCR). Относительно
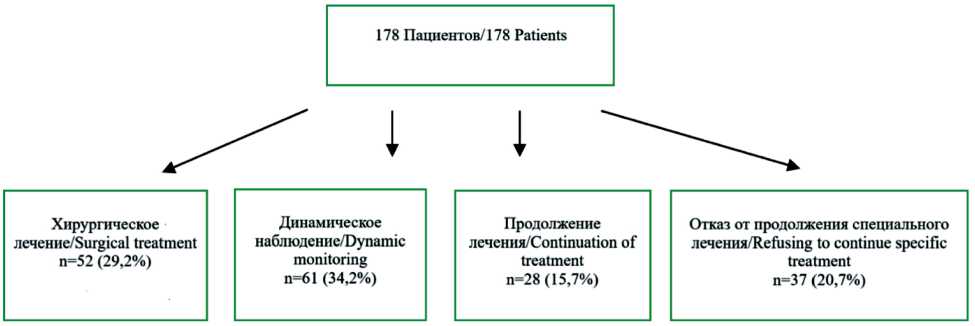
Рис. 2. Распределение больных по группам в зависимости от результатов проведенной ХЛТ.
Примечание: рисунок выполнен авторами Fig. 2. Distribution of patients into groups depending on CRT outcomes. Note: created by the authors
Таблица 8/Table 8
|
Вид осложнений/Type of complications |
Количество пациентов/ Number of patients |
|
Тошнота, рвота (III–IV степени)/Nausea, vomiting (grade III–IV) |
8 (21,6 %) |
|
Анорексия (III степени)/Anorexia (grade III) |
2 (5,4 %) |
|
Эзофагит (IV степени)/Esophagitis (grade IV) |
5 (13,6 %) |
|
Тромбоцитопения (IV степени)/Thrombocytopenia (grade IV) |
7 (18,9 %) |
|
Лейкопения (IV степени)/Leukopenia (grade IV) |
8 (21,6 %) |
|
Пищеводно-бронхиальный свищ/Esophageal-bronchial fistula |
3 (8,1 %) |
Пневмония/Pneumonia 4 (10,8 %)
Примечание: таблица составлена авторами.
Note: created by the authors.
Причины снятия пациентов с лечения
Reasons for treatment discontinuation in patients
больных с полным клиническим ответом повторно проводился мультидисциплинарный консилиум с участием торакального хирурга, химиотерапевта и анестезиолога, на котором оценивались риски оперативного вмешательства, пациенты информировались о степени операционного риска, и в качестве варианта им предлагалось строгое динамическое наблюдение. В этой группе также представлены пациенты, отказавшиеся от операции в пользу строгого динамического наблюдения;
– III группа – пациенты, у которых по данным клинических исследований получена информация о наличии резидуальной опухоли (и наличии противопоказаний для радикального хирургического лечения) или прогрессировании опухолевого процесса, этой категории была назначена дальнейшая полихимиотерапия, согласно рекомендациям АОР;
– IV группа – пациенты, которые были сняты с лечения на фоне ХЛТ ввиду некорректируемой гематологической токсичности, а также негематологических осложнений (табл. 8).
Критерии отказа от хирургического лечения: прогрессирование опухоли после неоадъювантного лечения; ограниченный функциональный статус пациента (индекс Карновского <60 %, ECOG ≥2); выраженная сопутствующая патология; индекс коморбидности Charlson >7; полный клинический ответ, зарегистрированный при обследовании после завершения ХЛТ; отказ больного от операции в пользу динамического наблюдения.
Выбор вида хирургического вмешательства (операция Льюиса или Мак-Кьюэна) зависел от локализации опухоли: при локализации в нижней трети пищевода выполняли вмешательство в объеме операции Льюиса, при раке среднегрудного отдела – в объеме операции Мак-Кьюэна. После ХЛТ оперативное лечение проведено 45 пациентам, из них операция Льюиса выполнена в 18 (40 %), операция Мак-Кьюэна – в 27 (60 %) наблюдениях. Послеоперационные осложнения возникли у 14 (28,8 %) пациентов, 90-дневная летальность составила 17 % (8 пациентов).
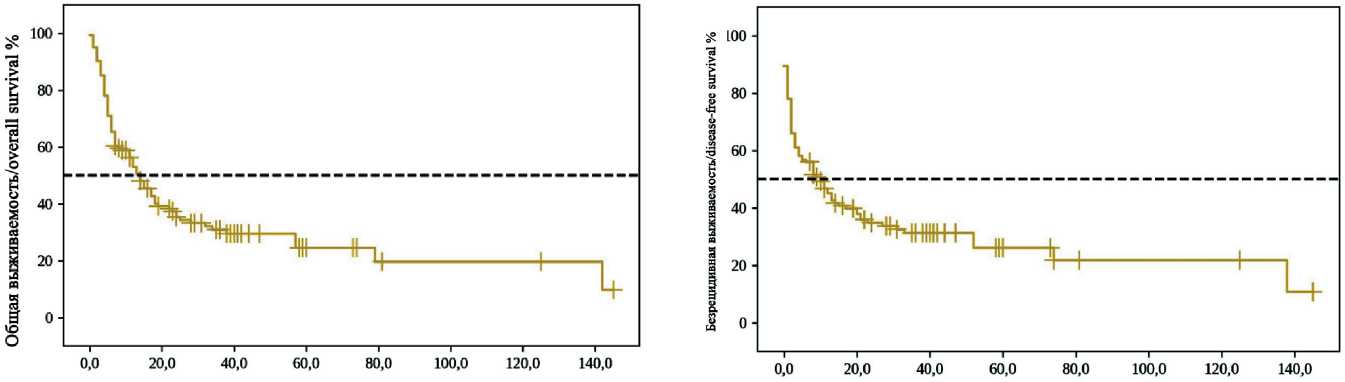
Показатели общей и безрецидивной выживаемости в целом представлены на рис. 3, 4. Медиана срока дожития составила 10,0 мес от начала наблюдения (95 % ДИ 4,0–14,0), 5-летняя безрецидивная выживаемость – 24 %.
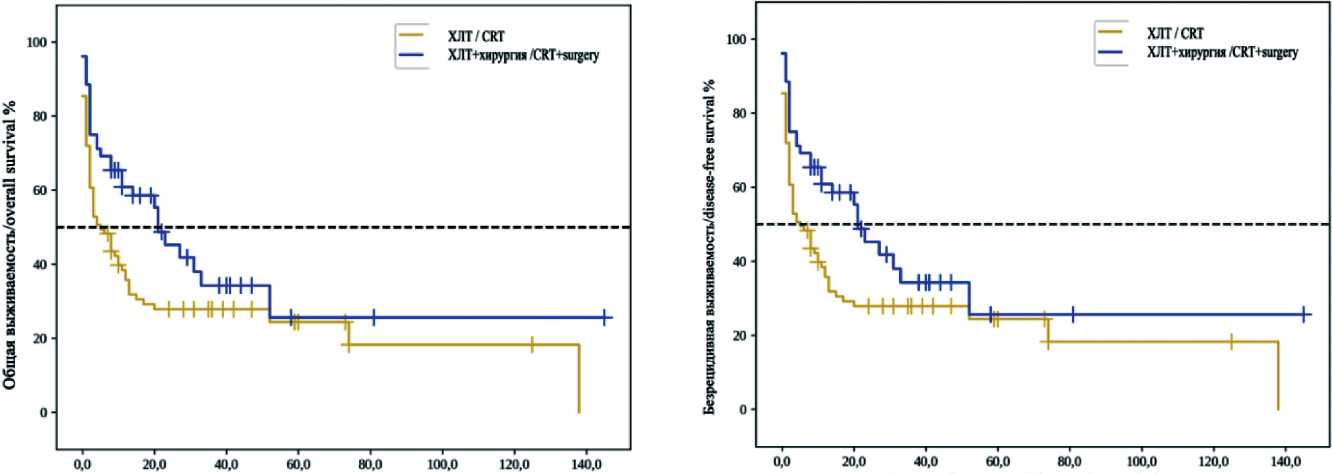
При оценке общей и безрецидивной выживаемости пациентов после химиолучевого лечения в самостоятельном варианте и больных, которым после ХЛТ выполнено оперативное вмешательство (рис. 5, 6), установлено, что медиана срока дожития в группе без операции составила 11,0 мес от начала наблюдения (95 % ДИ: 6,0–15,0), медиана срока дожития в группе оперированных пациентов – 25,0 мес от начала наблюдения (95 % ДИ: 12,0–38,0). Общая 5-летняя выживаемость – 24 и 27 % соответственно. Различия показателей общей выживаемости статистически значимы (p=0,020).
Медиана безрецидивной выживаемости у пациентов без операции составила 5,0 мес от начала наблюдения (95 % ДИ: 2,0–10,0), медиана безре-цидивной выживаемости в группе оперированных пациентов – 21,0 мес от начала наблюдения (95 % ДИ: 11,0–52,0). Пятилетняя безрецидивная выживаемость в группе неоперированных и оперированных больных составила 23,0 и 25,0 % соответственно. Различия показателей безреци-дивной выживаемости статистически значимы (p=0,018).
Частота полного патоморфологического ответа (по классификации ВОЗ) составила 43,5 % (у 20 из 46 оперированных пациентов после ХЛТ). Проведена сравнительная оценка выживаемости у пациентов с полным клиническим ответом (cCR) после ХЛТ, которых не оперировали (n=46), в сравнении с группой больных, у которых при плановом гистологическом исследовании удаленного препарата диагностирован полный морфологический ответ (n=20). Общая выживаемость представлена на рис. 7. Медиана срока дожития в группе динамического наблюдения с cCR составила 24,0 мес от начала наблюдения (95 % ДИ: 17,0–142,0), медиана срока дожития в группе хирургического лечения –
Срок наблюдения /Observation period
Рис. 3. Общая выживаемость у больных раком грудного отдела пищевода в целом по группе. Примечание: рисунок выполнен авторами
Срок наблюдения /Observation period
Срок наблюдения /Observation period
Рис. 5. Общая выживаемость у больных раком пищевода после химиолучевого лечения и химиолучевого лечения с последующей радикальной операцией. Примечание: рисунок выполнен авторами
Fig. 5. Оverall survival in patients with esophageal cancer after chemoradiotherapy and chemoradiotherapy followed by radical surgery. Note: created by the authors
Срок наблюдения /Observation period
Рис. 4. Безрецидивная выживаемость у больных раком грудного отдела пищевода в целом по группе. Примечание: рисунок выполнен авторами
Рис. 6. Безрецидивная выживаемость у больных раком пищевода после химиолучевого лечения и химиолучевого лечения с последующей радикальной операцией. Примечание: рисунок выполнен авторами
Fig. 6. Disease-free survival in patients with esophageal cancer after chemoradiotherapy and chemoradiotherapy followed by radical surgery. Note: created by the authors
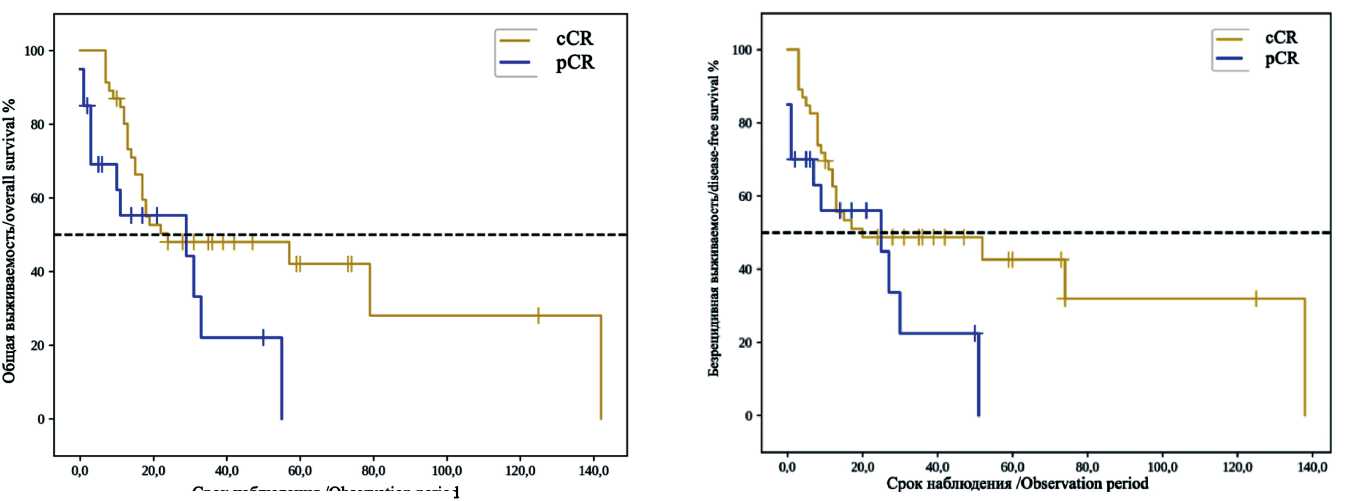
Рис. 8. Безрецидивная выживаемость пациентов с полным клиническим и полным морфологическим ответом. Примечание: рисунок выполнен авторами
Fig. 8. Disease-free survival of patients with complete clinical response and complete pathological response. Note: created by the authors
Срок наблюдения /Observation period
Рис. 7. Общая выживаемость пациентов с полным клиническим и полным морфологическим ответом. Примечание: рисунок выполнен авторами
Fig. 7. Оverall survival of patients with complete clinical response and complete pathological response. Note: created by the authors
29,0 мес от начала наблюдения (95 % ДИ: 3,0 – 33,0). Трехлетняя выживаемость составила 21 и 45 % соответственно, 5-летняя выживаемость у пациентов не достигнута ввиду малого срока наблюдения. Различия общей выживаемости, оцененные с помощью теста отношения правдоподобия, не были значимыми (p=0,050).
При оценке показателей безрецидивной выживаемости (рис. 8) установлено, что медиана срока дожития в группе полного клинического ответа составила 20,0 мес от начала наблюдения (95 % ДИ: 12,0–138,0), медиана срока дожития в группе хирургического лечения – 25,0 мес от начала наблюдения (95 % ДИ: 1,0–51,0). Трехлетняя выживаемость составила 23 и 49 %, 5-летняя выживаемость не достигнута ввиду малого срока наблюдения. Различия безрецидивной выживаемости, оцененные с помощью теста отношения правдоподобия, не были значимыми (p=0,103).
При анализе выживаемости в зависимости от морфологического типа опухоли (рис. 9) выявлено, что медиана срока дожития при аденокарциноме пищевода составила 12,0 мес от начала наблюдения (95 % ДИ: 4,0–18,0 мес.), при плоскоклеточном раке – 14,0 мес от начала наблюдения (95 % ДИ: 11,0–22,0 мес). Показатели общей 5-летней выживаемости составили 19 и 26 % соответственно, различия не были значимыми (p=0,249). Различия в безрецидивной выживаемости также не были достигнуты (p=0,209).
Обсуждение
В настоящее время преимущества мультимодальной терапии при лечении РП, включающей неоадъювантную химиолучевую терапию или периоперационную химиотерапию (при аденокарциноме пищевода), по сравнению с хирургическим
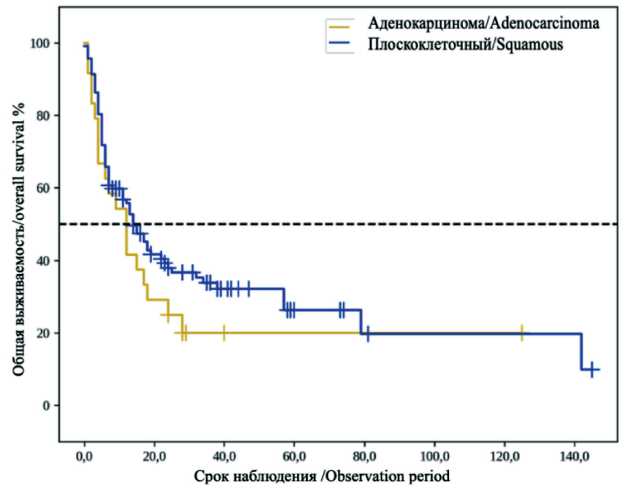
Рис. 9. Общая выживаемость в зависимости от гистологического типа опухоли. Примечание: рисунок выполнен авторами Fig. 9. Оverall survival depending on the histological type of the tumor. Note: created by the authors вмешательством подтверждены многочисленными исследованиями и метаанализами [3]. При этом объем необходимой суммарной очаговой дозы остается предметом дискуссий, СОД 50,4 Гр за 28 фракций обычно считается стандартной в США и странах Азии при трехмодальной терапии. Однако в исследовании CROSS использовалась СОД 41,4 Гр в 23 фракциях [4]. При данной схеме полный патологический ответ получен в 29 %, с частотой локо-регионарных рецидивов, равной 14 %, и медианой выживаемости 49,4 мес. Таким образом, по данным многочисленных исследований, повышение дозы выше 50,4 Гр увеличивает токсичность, без существенного выигрыша в выживаемости пациентов [5]. Мы использовали режим СОД 50,4 Гр, большой дозировка не применялась ввиду доказанной токсичности и отсутствия значимого выигрыша в общей и безрецидивной выживаемости, по данным литературы.
Характер лимфогенного распространения зависит от локализации первичной опухоли, поскольку опухолевые клетки могут перемещаться по пищеводу на значительном протяжении, прежде чем попасть в регионарные лимфатические узлы. Существующие стандарты полей облучения напрямую зависят от локализации опухоли, а также распространенности опухоли (по полученным данным КТ, ПЭТ-КТ). Текущий протокол RTOG требует проведения CTV на 4 см выше/ниже и CTV на 1,0–1,5 см в радиальном направлении плюс равномерное расширение PTV на 0,5–1,0 см до 45 Гр с последующим однородным равномерным расширением на 0,5–1,0 см вокруг GTV в течение последних трех фракций до 50,4 Гр [6]. По данным J. Wang et al., 96 % локорегионарных рецидивов возникали в пределах поля облучения, и, значит, они не были бы предотвращены более крупными полями облучения. Таким образом, выбор объема лучевой терапии, а также размеров полей должен быть индивидуальным в зависимости от локализации опухоли в пищеводе и распространенности лимфогенного метастазирования [7].
Выбор схемы химиотерапии напрямую зависит от объективного состояния пациента, а также стратегии лечения. В настоящее время наиболее изучены несколько схем химиотерапии при проведении совместной лучевой терапии. В частности, режим паклитаксел 50 мг/м2 + карбоплатин AUC 2 еженедельно во время лучевой терапии подробно изучен в исследовании CROSS. Авторами по итогам 10-летнего наблюдения получены следующие отдаленные результаты: в группе химиолучевой терапии и последующей хирургии умерли 117 из 178 пациентов, в группе только хирургии – 144 из 188 пациентов. Пациенты, получавшие химиолучевую терапию и операцию, имели лучшую 10-летную общую выживаемость по сравнению с больными РП из группы хирургии – 38 и 25 % соответственно. Данный протокол входит в стандарт лечения ESMO и АОР у пациентов с местнораспространенным раком пищевода [4].
Схема тримодальной терапии CF: цисплатин 75–100 мг/м 2 в 1-й день + 5-фторурацил длительные инфузии 1000 мг/м 2 /сут в 1–4-й дни, каждые 4 нед (2 цикла с лучевой терапией и 2 цикла – после), используется с конца XX века. При ее применении, по данным JCOG9516, получены следующие результаты: общая частота ответа составила 68,3 % (41/60), частота полного патоморфологического ответа – 15 % (9/60). Медиана выживаемости – 305,5 сут, 2-летняя выживаемость – 31,5 %. При проспективном анализе схемы CF и паклитаксел + карбоплатин последняя ассоциировалась с большей потерей массы тела, но лучшим патоморфологическим ответом. При этом не получено значимых различий в общей выживаемости, выживаемости без прогрессирования, а также послеоперационной летальности в зависимости от режима химиотерапии [8].
В ранее проведенных исследованиях показано, что комбинация CС, включающая цисплатин – 30 мг/м 2 1 раз в нед + капецитабин – 800 мг/м 2 2 раза в день с 1-го по 5-й дни, каждую неделю, в течение 5 нед с лучевой терапией, обладает схожей со схемой CF противоопухолевой и радиосенсибилизирующей активностью, однако меньшей токсичностью. Авторы связывают данный факт с еженедельным введением цисплатина, а также лучшей переносимостью капецитабина по сравнению с 5-фторурацилом. В исследовании F. Chen et. al. медиана безрецидивной и общей выживаемости составила 24,7 и 30,6 мес соответственно [9].
Мы использовали все три режима химиотерапии, которые продемонстрировали удовлетворительную переносимость пациентов, а также сопоставимые результаты в общей и безрецидив-ной выживаемости по сравнению с ранее опубликованными данными.
Вопрос о целесообразности химиолучевой терапии при аденокарциноме пищевода остается дискуссионным. Так, в исследовании CROSS у 42 пациентов с плоскоклеточным РП, получавших химиолучевую терапию, медиана выживаемости составила 81,6 мес, тогда как у 134 пациентов с аденокарциномой пищевода этот показатель равнялся 43,2 мес. При этом частота полного патологического ответа составила 49 и 23 % соответственно [4]. В настоящий момент продолжается набор пациентов в исследование ESOPEC – проспективное многоцентровое исследование фазы III, которое проводится 16 германскими исследовательскими центрами. В исследовании сравнивается режим CROSS с периоперационной химиотерапией по схеме FLOT (4 цикла до и после операции) при аденокарциноме пищевода и кардиоэзофагеальном раке (включая Siewert III). Результаты данного исследования позволят получить определенный ответ об эффективности мультимодального лечения аденокарциномы пищевода [10].
В нашем исследовании хирургическое лечение выполнено у 46 пациентов, выживаемость в данной группе была значимо лучше, чем у больных без операции, наши данные соответствуют многочисленным исследованиям, в которых было продемонстрировано улучшение выживаемости больных РП при включении хирургического этапа в мультимодальное лечение.
В настоящее время нет рандомизированных контролируемых исследований, в которых бы сравнивали наблюдение с хирургическим вмешательством у больных РП с полным клиническим ответом после неоадъювантного лечения. В нерандомизированном исследовании II фазы RTOG 0246 проанализированы результаты лечения 41 пациента, которые на первоначальном этапе были оценены как операбельные, и им на первом этапе назначена химиолучевая терапия, далее у 23 пациентов получен полный клинический ответ, у 18 – имелись данные о наличии остаточной опухоли. Пациентам с остаточной опухолью выполнено хирургическое вмешательство, 23 пациента с полным ответом оставлены под строгим динамическим наблюдением. В обеих группах одногодичная общая выживаемость составила 71 %. Показатели 5-летней выживаемости составили 51 %, из них 13 пациентов получили химиолучевую терапию с последующей операцией, 8 пациентов – только ХЛТ [11]. По данным метаанализа, общая выживаемость у пациентов с cCR после химиолучевой терапии, находящихся под активным наблюдением, была сопоставима с аналогичными показателями у пациентов, которым после ХЛТ выполнена стандартная эзофагэктомия. Частота локорегионарных рецидивов в группе с cCR составила 40 %, из них в 95 % случаев удалось выполнить радикальную операцию [12].
В нашем исследовании при оценке показателей выживаемости у больных с полным клиническим ответом и с лечебным патоморфозом IV степени получены данные, которые позволяют сделать выводы об изучении целесообразности выполнения эзофагэктомии у пациентов с cCR. По нашим данным, показатели 3-летней выживаемости у больных с полным патоморфологическим ответом, получавших хирургическое лечение, и у пациентов с полным клиническим ответом после химиолуче-вого лечения составили 21 и 45 %, при этом значимых различий не получено (p=0,050). Следует также учесть, что в раннем послеоперационном периоде при хирургическом лечении умерло 5 пациентов. Трехлетняя безрецидивная выживаемость в группе хирургического лечения составила 23 %, в группе динамического наблюдения – 49 %, значимых различий не получено (p=0,103). Отсутствие различий между группами мы связываем с эффективностью неоадъювантной терапии, а также имеющейся послеоперационной летальностью после эзофагэктомии (5 из 20 больных умерло в раннем послеоперационном периоде).
Заключение
Список литературы Результаты комбинированного и химиолучевого лечения больных раком грудного отдела пищевода по данным регионального онкологического центра
- Sostoyanie onkologicheskoi pomoshchi naseleniyu Rossii v 2020 godu. Pod red. A.D. Kaprina, V.V. Starinskogo, A.O. Shakhzadovoi. M., 2021. 252 s.
- Shah M.A., Kennedy E.B., Catenacci D.V., Deighton D.C., Goodman K.A., Malhotra N.K., Willett C., Stiles B., Sharma P., Tang L., Wijnhoven B.P.L., Hofstetter W.L. Treatment of Locally Advanced Esophageal Carcinoma: ASCO Guideline. J Clin Oncol. 2020; 38(23): 2677-94. https://doi.org/10.1200/JCO.20.00866. Erratum in: J Clin Oncol. 2020; 38(33): 3976.
- Kumar T., Pai E., Singh R., Francis N.J., Pandey M. Neoadjuvant strategies in resectable carcinoma esophagus: a meta-analysis of randomized trials. World J Surg Oncol. 2020; 18(1): 59. https://doi.org/10.1186/s12957020-01830-x.
- Eyck B.M., van Lanschot J.J.B., Hulshof M.C.C.M., van der Wilk B.J., Shapiro J., van Hagen P., van Berge Henegouwen M.I., Wijnhoven B.P.L., van Laarhoven H.W.M., Nieuwenhuijzen G.A.P., Hospers G.A.P., Bonenkamp J.J., Cuesta M.A., Blaisse R.J.B., Busch O.R., Creemers G.M., Punt C.J.A., Plukker J.T.M., Verheul H.M.W., Spillenaar Bilgen E.J., van der Sangen M.J.C., Rozema T., Ten Kate F.J.W., Beukema J.C., Piet A.H.M., van Rij C.M., Reinders J.G., Tilanus H.W., Steyerberg E.W., van der Gaast A.; CROSS Study Group. Ten-Year Outcome of Neoadjuvant Chemoradiotherapy Plus Surgery for Esophageal Cancer: The Randomized Controlled CROSS Trial. J Clin Oncol. 2021; 39(18): 1995-2004. https://doi.org/10.1200/jCO.20.03614.
- Hulshof M.C.C.M., Geijsen E.D., Rozema T., Oppedijk V., Buijsen J., Neelis K.J., Nuyttens J.J.M.E., van der Sangen M.J.C., Jeene P.M., Rein-ders J.G., van Berge Henegouwen M.I., Thano A., van Hooft J.E., van Laarhoven H.W.M., van der Gaast A. Randomized Study on Dose Escalation in Definitive Chemoradiation for Patients With Locally Advanced Esophageal Cancer (ARTDECO Study). J Clin Oncol. 2021; 39(25): 2816-24. https://doi.org/10.1200/JCO.20.03697.
- Luo H.S., Huang H.C., Lin L.X. Effect of modern high-dose versus standard-dose radiation in definitive concurrent chemo-radiotherapy on outcome of esophageal squamous cell cancer: a meta-analysis. Radiat Oncol. 2019; 14(1): 178. https://doi.org/10.1186/s13014-019-1386-x.
- Wang J., Milton D.R., He L., Komaki R., Liao Z., Crane C.H., Minsky B.D., Thall P.F., Lin S.H. Comparison of locoregional versus extended locoregional radiation volumes for patients with nonmetastatic gastro-esophageal junction carcinomas. J Thorac Oncol. 2015; 10(3): 518-26. https://doi.org/10.1097/JTO.0000000000000457.
- Ishida K., Ando N., Yamamoto S., Ide H., Shinoda M. Phase II study of cisplatin and 5-fluorouracil with concurrent radiotherapy in advanced squamous cell carcinoma of the esophagus: a Japan Esophageal Oncology Group (JEOG)/Japan Clinical Oncology Group trial (JCOG9516). Jpn J Clin Oncol. 2004; 34(10): 615-9. https://doi.org/10.1093/jjco/hyh107. Erratum in: Jpn J Clin Oncol. 2005; 35(2): 108.
- Chen F., Luo H., Xing L., Liang N., Xie J., Zhang J. Feasibility and efficiency of concurrent chemoradiotherapy with capecitabine and cisplatin versus radiotherapy alone for elderly patients with locally advanced esophageal squamous cell carcinoma: Experience of two centers. Thorac Cancer. 2018; 9(1): 59-65. https://doi.org/10.1111/1759-7714.12536.
- Hoeppner J., Lordick F., Brunner T., Glatz T., Bronsert P., Röthling N., Schmoor C., Lorenz D., Ell C., Hopt U.T., Siewert J.R. ESOPEC: prospective randomized controlled multicenter phase III trial comparing perioperative chemotherapy (FLOT protocol) to neoadjuvant chemoradiation (CROSS protocol) in patients with adenocarcinoma of the esophagus (NCT02509286). BMC Cancer. 2016; 16: 503. https://doi.org/10.1186/s12885-016-2564-y.
- Swisher S.G., Moughan J., Komaki R.U., Ajani J.A., Wu T.T., Hofstetter W.L., Konski A.A., Willett C.G. Final Results of NRG Oncology RTOG 0246: An Organ-Preserving Selective Resection Strategy in Esophageal Cancer Patients Treated with Definitive Chemoradiation. J Thorac Oncol. 2017; 12(2): 368-74. https://doi.org/10.1016/j.jtho.2016.10.002.
- van der Wilk B.J., Eyck B.M., Hofstetter W.L., Ajani J.A., Piessen G., Castoro C., Alfieri R., Kim J.H., Kim S.B., Furlong H., Walsh T.N., Nieboer D., Wijnhoven B.P.L., Lagarde S.M., Lanschot J.J.B.V. Chemoradiotherapy Followed by Active Surveillance Versus Standard Esophagectomy for Esophageal Cancer: A Systematic Review and Individual Patient Data Meta-analysis. Ann Surg. 2022; 275(3): 467-76. https://doi.org/10.1097/sLA.0000000000004930.


