Результаты комбинированного лечения больных раком гортани и гортаноглотки
Автор: Чойнзонов Евгений Лхамацыренович, Чижевская Светлана Юрьевна, Мусабаева Людмила Ивановна, Фролова Ирина Георгиевна, Авдеев Сергей Вениаминович, Синилкин Иван Геннадьевич, Зельчан Р.В., Суркова Полина Валерьевна, Кушнер А.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 (49), 2012 года.
Бесплатный доступ
Проведена оценка эффективности комбинированного лечения 178 больных с морфологически верифицированным плоско- клеточным раком гортани и гортаноглотки II-IV стадии опухолевого процесса за период с 2006 по 2011 г. Применение методов комбинированного лечения больных раком гортани и гортаноглотки с использованием современных противоопухолевых препаратов и режимов лучевой терапии в 34,4 ± 4,8 % случаев позволяет добиться полной регрессии опухоли и избежать операции, а в 31,7 ± 5,8 % выполнить органосохранные и функционально-щадящие операции, что способствует улучшению качества жизни пациентов.
Рак гортани и гортаноглотки, комбинированное лечение, неоадъювантная химиотерапия, лучевая терапия в режиме мультифракционирования дозы
Короткий адрес: https://sciup.org/14056187
IDR: 14056187 | УДК: 616.22+616.32]-006.6-059
Текст научной статьи Результаты комбинированного лечения больных раком гортани и гортаноглотки
Несмотря на значительные успехи в лечении рака гортани и гортаноглотки (РГГ), достигнутые в последнее десятилетие, многие аспекты этой проблемы остаются нерешёнными. Основным и наиболее эффективным методом лечения местнораспространённого РГГ остаётся комбинированное воздействие, в котором хирургическое лечение занимает центральное место. Выбор метода лечения должен решаться строго индивидуально с учётом клинических, морфологических и иммунобиологических особенностей опухолевого процесса [9, 12, 13].
Перспективным подходом к повышению эффективности лечения больных раком гортани и гортаноглотки является внедрение в клиническую практику современных цитостатиков в сочетании с лучевой терапией и хирургическим вмешательством [5, 8]. Особая роль химиотерапии при сочетании с лучевой состоит в том, что, кроме противоопухолевого действия, многие препараты оказывают радиосенсибилизирующий эффект [2, 4]. Применение цитостатиков приводит к лечебному патоморфозу III–IV степени у достаточно большого количества пациентов. В настоящее время химиотерапия часто используется в неоадъювантном режиме или же в сочетании с лучевой терапией для проведения органосохранного лечения, что ведёт к улучшению качества жизни радикально пролеченных больных [1, 4, 13, 14]. Теоретической предпосылкой проведения неоадъювантной химиотерапии (НАХТ) является суждение о возможности достижения более высокой частоты объективных ответов при создании высокой концентрации цитостатиков в ткани опухоли. Целями НАХТ являются уменьшение массы опухоли; уничтожение микрометастазов; проведение операции в абластичных условиях [11].
Однако назначение цитостатиков в монорежиме оказалось малоэффективным. Так, частота объективных эффектов при использовании метотрексата составила 31 %, проспидина – 17,3 %, блеомицина – 18 %, 5-фторурацила – 15–25 %, цисплатина – 16–39 %, виндезина – 0–25 %. Более обнадеживающие результаты были получены после введения в клиническую практику таксанов, непосредственная эффективность паклитаксела составила 34,5–43 %, доцетаксела – 32–42 % [6].
Уникальный механизм действия таксола обеспечивает высокую противоопухолевую активность препарата при лечении злокачественных новообразований различной локализации, в том числе и плоскоклеточного рака головы и шеи. Его синергизм с другими цитостатиками, в первую очередь с производными платины и антрациклинами, позволяет надеяться на создание новых эффективных комбинаций полихимиотерапии, что может значительно улучшить непосредственные и отдаленные результаты лечения. Использование паклитаксела в комбинации с препаратами платины позволяет повысить частоту объективных ответов до 80 %. Многочисленные исследования, стимулируемые высокой активностью и токсичностью цисплатина, были направлены на синтезирование аналогов препарата и привели к созданию карбоплатина, показавшего такую же активность и меньшую токсичность [6, 7].
По данным Российского онкологического научного центра им. Н.Н. Блохина РАМН, для правильной оценки эффективности лечения показано проведение не менее 2 курсов НАХТ. У больных с гистологически доказанным полным эффектом после химиотерапии выживаемость была выше, чем при частичной регрессии. После успешной химиотерапии можно проводить лучевую терапию или выполнить хирургическое вмешательство без серьезных осложнений, при этом снижается и частота отдаленного метастазирования. При проведении 2 курсов химиотерапии до облучения 5-летняя выживаемость составила 78,1 %, против 84,7 % при выполнении лекарственного лечения в процессе облучения [10].
Дополнительные возможности в повышении эффективности комбинированных методов лечения открываются с появлением новых высокоэффективных химиопрепаратов и более совершенных вариантов лучевой терапии [3]. Одним из перспективных направлений является облучение в режиме мультифракционирования дозы. Проведение расщепленного курса лучевой терапии позволяет довести СОД до 70,0–72,0 Гр, не увеличивая частоту лучевых осложнений [4, 10].
Таким образом, несмотря на достигнутые успехи в лечении рака гортани и гортаноглотки, многие аспекты этой проблемы остаются нерешенными. Все вышеизложенное обосновывает актуальность дальнейших исследований по поиску новых и совершенствованию существующих способов комбинированного лечения, оценки эффективности и качества жизни больных раком гортани и гортаноглотки.
Целью исследования является повышение эффективности лечения и улучшение качества жизни больных раком гортани и гортаноглотки путем разработки методов комбинированной терапии с использованием современных противоопухолевых препаратов и модифицированных режимов лучевой терапии.
Материал и методы
В исследование включено 178 больных с морфологически верифицированным плоскоклеточным раком гортани и гортаноглотки II-IV (T 2 -4 N 0_ 2 M 0 ) стадии, получивших комбинированное лечение в ФГБУ «НИИ онкологии» СО РАМН за период с 2006 по 2011 г. В основную группу вошло 96 пациентов, из них мужчин – 84, женщин – 12, средний возраст – 56 ± 1,8 года. Контрольная группа включала 82 пациента, из них мужчин – 73, женщин – 9, средний возраст – 58±1,4 года. У всех больных морфологически верифицированный плоскоклеточный рак гортани (81 % пациентов) и гортаноглотки (19 % пациентов). Сравниваемые группы были репрезентативны по основным клинико-морфологическим параметрам.
Пациентам основной группы проводилось 2 курса неоадъювантной химиотерапии с интервалом 3–4 нед по схеме паклитаксел – 175 мг/м2, карбоплатин – AUC-6, с последующей лучевой терапией в режиме мультифракционирования дозы по 1,3 Гр, 2 раза в день с интервалами в 4 ч, c оценкой эффекта на СОД 40 Гр по изоэффекту. Затем больным, у которых была достигнута полная регрессия, продолжалась лучевая терапия в режиме мультифракционирования дозы до СОД 65 изоГр. Пациентам, эффект лечения которых был оценен как частичная регрессия и стабилизация, выполнялось хирургическое лечение.
Больным, включённым в контрольную группу, проводилось лечение по стандартной схеме: лучевая терапия РОД 2 Гр 5 раз в нед, с оценкой эффекта на СОД 40 Гр. Затем больным, у которых была достигнута полная регрессия, продолжалась лучевая терапия по прежней схеме до СОД 60 Гр. Пациентам, эффект лечения которых был оценен как частичная регрессия и стабилизация, выполнялось хирургическое лечение.
Морфологическое исследование опухоли проводилось с оценкой гистотипа и степени дифференцировки, определения лечебного патоморфоза. Влияние противоопухолевой химиотерапии на эффективность комбинированного лечения сопоставляли по показателям регрессии первичного опухолевого очага. Оценка эффективности лечения проводилась с использованием шкалы ВОЗ на основании непосредственных и отдаленных результатов с учетом частоты и сроков возникновения рецидивов и метастазов. Токсичность противоопухолевой химиотерапии оценивали на основании учета частоты и выраженности побочных реакций и осложнений в соответствии с критериями Common Terminology Criteria for Adverse Events (CTCAE) Version 3.
Для статистического анализа полученных данных применялись стандартные методы медикобиологической статистики с использованием пакета программ «Statistica for Windows» (версия 6.0). Сравнительный анализ проводился с помощью критерия Стьюдента (t). Различия считали достоверными при 5 % уровне значимости (p<0,05).
Результаты и обсуждение
У пациентов основной группы после проведения 1-го этапа комбинированного лечения (2 курса ХТ с последующей лучевой терапией в режиме мультифракционирования дозы по 1,3 Гр, 2 раза в день с интервалами в 4 часа, c оценкой эффекта на СОД 40 изоГр) полная регрессия опухоли наблюдалась
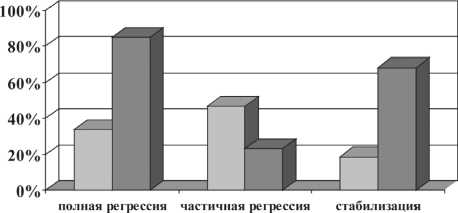
□ основная группа □ контрольная группа
Рис. 1. Непосредственная эффективность лечения больных раком гортани и гортаноглотки (р<0,05)
у 33 (34,4 ± 4,8%) больных, что подтверждалось данными фиброларингоскопии с биопсией (зарегистрирован лечебный патоморфоз IV ст.). Этим больным была продолжена лучевая терапия до достижения радикальной дозы – 65 изоГр, что в итоге позволило избежать радикального хирургического вмешательства и инвалидизации пациентов.
В контрольной группе полная регрессия опухоли отмечалась у 7 (8,5 ± 3,1 %) пациентов при оценке эффекта на СОД 40 Гр, что подтверждено данными фиброларингоскопии с биопсией (лечебный пато-морфоз IV ст.), а также данными ультразвукового исследования шейных узлов. Далее продолжена лучевая терапия до достижения радикальной дозы – 60 Гр (рис. 1).
Больным основной группы (65,6 ± 4,8 %), эффект лечения которых оценен как частичная регрессия (46,9 ± 5,1 %) и стабилизация процесса (18,7 ± 3,9 %), было выполнено хирургическое вмешательство, в том числе в 31,7 ± 5,8 % случаев – органосохранные операции, в 68,3 ± 5,8 % случаев – радикальные операции (ларингэктомия или комбинированная ларингэктомия с или без вмешательства на лимфопу-тях). Больным контрольной группы, эффект лечения которых оценен как частичная регрессия (23,2 ± 4,6 %) и стабилизация процесса (68,3 ± 5,1 %), также проводилось хирургическое лечение, в том числе в 16 ± 4,2 % случаев – органосохранные операции, в 84 ± 4,2 % случаев – радикальные операции (ларингэктомия или комбинированная ларингэктомия с или без вмешательства на лимфопутях). Таким образом, проведение 1-го этапа лечения у больных основной группы способствует повышению резектабельности опухоли, что в 31,7 ± 5,8 % случаев позволяет провести органосохранные операции.
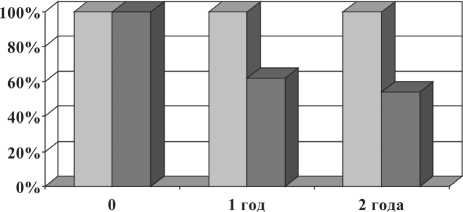
□ основная группа □ контрольная группа
Рис. 2. Показатели общей выживаемости больных раком гортани и гортаноглотки (р<0,05)
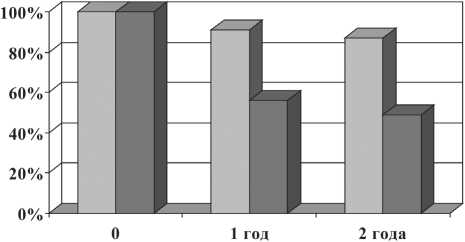
□ основная группа □ контрольная группа
Рис. 3. Показатели безрецидивной выживаемости больных раком гортани и гортаноглотки (р<0,05)
Пациенты основной группы удовлетворительно переносили лечение. Основными осложнениями, развившимися после проведения химиотерапии, были тошнота I–II ст. – у 7 (7,3 ± 2,7 %) пациентов, артралгия/миалгия – у 15 (15,6 ± 3,7 %) больных, аллергические реакции – у 3 (3,1 ± 1,7 %) пациентов. Все осложнения коррегировались в короткие сроки и переносились больными удовлетворительно. Аллопеция наблюдалась в 100 % случаев. Полученные результаты свидетельствуют о том, что проведение курсов химиотерапии в указанном режиме удовлетворительно переносится больными и не сопровождается гематологической и гастроинтестинальной токсичностью. После проведения курса лучевой терапии в режиме мультифракционирования дозы у 31 (32,3 ± 4,8 %) пациента зарегистрировано появление на коже полей облучения эритемы (I степень лучевых реакций по RTOG/EORTC), что не требовало специального лечения и прерывания курса облучения. У 21 (21,9 ± 4,2 %) больного отмечалось появление на коже полей облучения сухого эпидермита, а на слизистой – эпителиита, что соответствовало II степени выраженности лучевых реакций по RTOG/EORTC. Для купирования острых лучевых реакций проводилась магнито-лазерная терапия, включающая воздействие инфракрасного лазерного излучения [15]. Частота и выраженность лучевых реакций в контрольной группе статистически достоверно не отличались от показателей основной группы.
Последовательное применение химио- и лучевой терапии способствовало снижению токсичности проводимого лечения. Выявленные осложнения химиотерапии и лучевые повреждения не превыша- ли I–II степени по критериям Common Terminology Criteria for Adverse Events (CTCAE) Version 3 и шкале RTOG/EORTC, легко купировались и не влияли на сроки проведения дальнейшего лечения.
При сравнительном анализе общей выживаемости выявлено достоверное увеличение показателя в основной группе. Показатели общей 2-летней выживаемости в основной группе составили 100 %, в контрольной группе – 53,8 ± 5,5 % (рис. 2). Показатели 2-летней безрецидивной выживаемости больных раком гортани и гортаноглотки в основной группе достигали 87,3 ± 3,4 %, в контрольной – 49,2 ± 5,5 % (рис. 3).
Таким образом, полученные результаты свидетельствуют о том, что применение методов комбинированного лечения больных раком гортани и гортаноглотки с использованием современных противоопухолевых препаратов и режимов лучевой терапии, за счет полной регрессии опухоли в 34,4 ± 4,8 % случаев позволяет избежать операции, сохранив при этом функционально важный орган (гортань), а в 31,7 ± 5,8 % случаев выполнить органосохранные и функционально щадящие операции, что способствует улучшению качества жизни пациентов.


