Результаты лечения массивных диафизарных дефектов бедренной кости после огнестрельных ранений с использованием аддитивных технологий
Автор: Керимов А.А., Кукушко Е.А., Хоминец И.В., Беседин В.Д., Нелин М.Н., Кучеренко А.А., Грицюк А.А.
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Оригинальное исследование
Статья в выпуске: 4 (54), 2023 года.
Бесплатный доступ
Введение. Проблема замещения дефектов бедренной кости после огнестрельных переломов одна из самых сложных в травматологии и ортопедии. Цель исследования сравнить результаты хирургического лечения пациентов с огнестрельными дефектами диафизов бедренных костей при помощи аддитивных технологий и методом компрессионно-дистракционного остеосинтеза по Илизарову.Материал и методы. За период с 2019 г. по 2023 г. проведено проспективное одноцентровое последовательное контролируемое исследование, в которое включено 20 раненых с огнестрельными циркулярными дефектами средней трети диафиза бедренной кости (более 7 см). Основная группа (I - 8 раненых) замещение дефектов бедренной кости осуществляли при помощи аддитивной технологии - индивидуально изготовленным имплантатом, наполненным ауто- и аллотрансплантатами и фиксированный блокируемым интрамедуллярным штифтом, контрольная группа (II - 12 раненых) выполняли замещение дефекта бедренной кости методом компрессионно-дистракционного остеосинтеза по Илизарову. Возраст пациентов 29,3±3,3 лет, размер костного дефекта составил 9,8±2,4 см. Тяжесть состояния по шкале ВПХ-СП оценена в среднем 12,2±1,5 балла.
Огнестрельный дефект бедренной кости, 3-d имплантаты, аддитивные технологии, метод илизарова
Короткий адрес: https://sciup.org/142240734
IDR: 142240734 | УДК: 617.3 | DOI: 10.17238/2226-2016-2023-4-43-52
Текст научной статьи Результаты лечения массивных диафизарных дефектов бедренной кости после огнестрельных ранений с использованием аддитивных технологий
THE DEPARTMENT OF TRAUMATOLOGY AND ORTHOPEDICS
Огнестрельные ранения конечностей остаются одной из важнейших проблем военной медицины. Актуальность этой проблемы связана с постоянным развитием огнестрельного оружия и появлением новых ранящих снарядов, которые вызывают значительное разрушение кости и мягких тканей, что требует пересмотра некоторых установившихся за последние десятилетия тактических подходов к лечению данной патологии [1, 2].
Широко распространенным и хорошо изученным методом замещения дефектов длинных костей конечностей является билокальный последовательный компрессионно-дистракционный внеочаговый остеосинтез по Г. А. Илизарову [3, 4]. Однако, большая длительность и трудоемкость костного транспорта по Илизарову, относительно высокий уровень осложнений и необходимость повторных операций заставляет врачей-исследователей всего мира улучшать имеющиеся и искать новые варианты лечения [5, 6].
Для замещения дефектов кости после открытых инфицированных переломов и посттравматического остеомиелита в настоящее время применяются различные варианты алло- и аутотрансплантации [7, 8]. Значительно улучшить результаты лечения и снизить уровень осложнений позволила техника индуцированной мембраны по Masquelet [9, 10, 11].
Радикальные отличия боевых огнестрельных переломов от открытых механических (особые условия оказания медицинской помощи, большая зона первичного и вторичного повреждения, высокая вероятность осложненного течения и др.) заставляют искать технические решения, которые позволили бы минимизировать риски осложнений и обеспечить скорейшее анатомическое и наиболее полное функциональное восстановление раненого [12, 13].
Снизить риски инфекционных осложнений огнестрельного ранения позволяет радикальная хирургическая обработка и замещение дефекта кости методом острого укорочения с последующей остеотомией и удлинением [14, 15]. В свою очередь отсутствие некротизированных тканей и инфекции в ране является абсолютным условием для применения как хорошо освоенных (костный транспорт по Илизарову, аутопластика) [16, 17], так и перспективных ортопедических методик на основе аддитивных технологий [18, 19].
Анатомо-функциональные особенности бедра предопределяют значительные трудности при замещении дефекта бедренной кости. Ограниченные донорские ресурсы не всегда позволяют полностью заместить утраченный объем костной ткани. Длительная перестройка ауто- или аллотрансплантатов, недостаточная прочность предопределяют риск перелома и нарушения сращения. Длительные сроки фиксации внешними устройствами фрагментов кости и их перемещение приводят к формированию рубцовых сращений между мышечными и фасциальными образованиями. Прохождение фиксирующих элементов через глубокие каналы в массивах мягких тканей могут способствовать инфицированию и развитию остеомиелита [16, 17].
В последнее десятилетие в реконструктивной травматологии и ортопедии все шире применяются аддитивные технологии в сочетании с биоинженерными подходами, которые открывают новые перспективы в решении проблемы замещения костных дефектов. По данным поиска в известных базах медицинской литературы отмечается увеличение публикаций (более 3000 за предыдущий год), посвященных применению аддитивных технологий в различных направлениях хирургии [20, 21]. Применение биоинженерных конструкций при лечении огнестрельных дефектов бедренной кости ограниченно, в то же время - аддитивные технологии открывают новые возможности для замещения различных по величине и сложности огнестрельных дефектов бедра, особенно с биопринтингом васкуляризированных тканей [22, 23], высокая клиническая необходимость и значимость проблемы послужили толчком к проведению настоящего исследования.
Цель исследования сравнить результаты хирургического лечения пациентов с огнестрельными дефектами диафизов бедренных костей при помощи аддитивных технологий и методом компрессионно-дистракционного остеосинтеза по Илизарову.
Материал и методы. За период с 2019 г. по 2023 г. в Центре травматологии и ортопедии ФГБУ «ГВКГ им Н. Н. Бурденко» Минобороны России проведено проспективное одноцентровое последовательное контролируемое исследование, в которое включено 20 раненых с огнестрельными циркулярными дефектами средней трети диафиза бедренной кости. Пациентам основной группы (I - 8 раненых) замещение дефектов бедренной кости осуществляли при помощи аддитивной технологии, контрольная группа (II - 12 раненых), набрана ретроспективно произвольно выполняли замещение дефекта бедренной кости методом компрессионно-дистракционного остеосинтеза по Илизарову.
Критерии включения: раненные вне зависимости от пола и возраста (старше 18 лет) с огнестрельными переломами или первичными циркулярными дефектами диафизарной части бедренной кости не менее 7 см, циркулярный дефект бедренной кости образовался в результате огнестрельного ранения или после первичной (повторной) хирургической обработки, отсутствие противопоказаний к реконструктивным хирургическим вмешательствам, наличие информированного добровольного согласия на участие в исследовании, возможность наблюдения за пациентом не менее 12 месяцев после последней реконструктивной операции.
Критерии невключения: наличие хронического остеомиелита бедренной кости или очагов хронической инфекции вне поврежденного сегмента конечности, невозможность активного осознанного участия пациента в проведении исследования.
Критерии исключения: повторное ранение, отказ от продолжения участия в исследовании.
Все раненые до включения в исследование были информированы о исследовании и подписали информированное согласие, тема исследования утверждена Ученым советом ФГБУ «ГВКГ им Н. Н. Бурденко» Минобороны России (протокол №1 от 07.02.2023 г.), исследование одобрено независимым ЛЭК ФГБУ «ГВКГ им Н. Н. Бурденко» Минобороны России (выписка из протокола №263 от 25.01.2023 г.).
В основную группу I включены 8 раненых, у которых огнестрельный дефект бедренной кости замещался индивидуально изготовленным имплантатом, наполненным ауто- и аллотрансплантатами. Средний возраст был равен 28,1±5,6 лет, размер костного дефекта составил 9,2±3,0 см, мягкотканого дефекта –113,7±37,4 см2. Тяжесть состояния по шкале ВПХ-СП составила 11,5±1,9 баллов.
В контрольную группу II включены 12 раненных, которым выполнено замещение костного дефекта по Илизарову. Возраст пациентов 29,3±3,3 лет, размер костного дефекта составил 9,8±2,4 см, мягкотканного125,5±27,9 см2. Тяжесть состояния по шкале ВПХ-СП оценена в 12,2±1,5 балла. Основные показатели обеих групп раненых представлены в Таблице 1.
Таблица 1
Характеристика групп
|
Показатель |
Группа раненых |
р |
|
|
Основная группа (I) n=8 |
Контрольная группа (II) n=12 |
||
|
Возраст (лет) |
28,1±5,6 |
29,3±3,3 |
0,678* |
|
Время от момента ранения до доставки на этап ГВКГ (сутки) |
6,25±1,1 |
5,75±1,4 |
0,467* |
|
Тяжесть состояния шкале ВПХ-СП |
11,5±1,9 |
12,2±1,5 |
0,507* |
|
Размер костного дефекта (см) |
9,2±3,0 |
9,8±2,4 |
0,729* |
|
Размер мягкотканого дефекта (см2) |
113,7±37,4 |
125,5±27,9 |
0,563* |
|
Гемоглобин перед реконструк-тивной операцией (г/л) |
110,5±10,8 |
105,1±5,8 |
0,283* |
|
Альбумин перед реконструктивной операцией (г/л) |
68,9±6,9 |
69,2±5,6 |
0,935* |
|
Количество операций до реконструктивной операции |
4,0±1,2 |
5,0±0,6 |
0,038** |
*T-критерий Стьюдента для независимых выборок
**U-критерий Манна-Уитни
Все раненые были обследованы по протоколу госпиталя клиническими, лабораторными, инструментальными методами. Особенностью обследования основной группы раненых было выполнение мультиспиральной компьютерной томографии по- врежденного и здорового сегмента с толщиной среза 1 мм для предоперационного планирования, разработки и последующего изготовления индивидуального 3-D имплантата.
Раненые получали комплексное лечение, включающее коррекцию общего состояния, оперативные вмешательства, направленные на санацию огнестрельной раны, дренирование ран системами с отрицательным давлением. Антибактериальная терапия проводилась с учетом результатов бактериологического исследования и чувствительности микрофлоры к антибиотикам. Раны мягких тканей закрывали наложением первично-отсроченных или вторичных швов, расщепленными дерматомными, несвободными или свободными лоскутами с микрососудистыми анастомозами.
Раненым основной группы при замещении кожно-мышечного огнестрельного дефекта в 3 случаях (37,5 %) применили одномоментную реконструктивно-пластическую операцию в объеме замещения дефекта индивидуальным 3-D имплантатом и кровоснабжаемым лоскутом на микрососудистых анастомозах «конец-в-конец». Остальным 5 раненым (62,5 %) мягкотканый дефект замещали пластикой местными тканями.
Раненым контрольной группы применяли билокальный последовательный компрессионно-дистракционный внеоча-говый остеосинтез по Г. А. Илизарову в 7 случаях (58,5 %), у 5 раненных выполнили острое укорочение сегмента с последующим удлинением (41,5 %), при этом за счет укорочения удалось сблизить края раны и выполнить вторичный шов или аутодермопластику мягкотканой раны.
Реконструктивные операции в обеих группах выполняли под общей или спинномозговой анестезией в среднем - через 23 ± 2,3 суток с момента получения ранения.
Аддитивная технология замещения огнестрельного костного дефекта состоит из следующих этапов.
Первый – предоперационное планирование виртуальной операции. Выполняется мультиспиральная компьютерная томография поврежденного и здорового сегментов с толщиной среза 1 мм. На основе полученных материалов при помощи специальных программ на персональном компьютере создается модель поврежденной кости пациента. Проводится виртуальная операция по удалению всех свободнолежащих костных и металлических фрагментов, сопоставление с отзеркаленной моделью здорового сегмента. Далее хирургом создается рендер (набросок) будущего индивидуального 3-D имплантата и передается для дальнейшей обработки инженером.
Второй этап – проведение операции на полимерной модели. На основе предоперационного планирования создается полимерный прототип 3-D имплантата и точная копия поврежденной кости. Хирург отрабатывает технику операции и, при необходимости, вносит изменения в 3-D модель имплантата.
Третий этап – создание 3-D имплантата и шаблонов для остеотомий на 3-D принтере. Индивидуальный 3-D имплантат изготавливается из сплава титана, алюминия и ванадия (Ti - 90%, Al - 6%, V - 4%). Шаблоны для остеотомий изготавливаются из фотополимера. Весь комплект изделий, который передается хирургу, состоит из: 3-D имплантата, набора шаблонов для резекции, примерочных и анатомических моделей. 3-D имплантат представляет собой индивидуальный двухконтурный вкладыш для замещения фрагмента кости. Он состоит из внутреннего и наружного контура, имеет с дистальной и проксимальной сторон перемычки – опоры, на которые опирается кость, канал для проведения интрамедуллярного штифта серийного изготовления, отверстия для укладки костной стружки и обеспечения кровообращения на всей поверхности, фланцы для крепления имплантата к кости, охватывающие соответствующие отломки внахлест с упором края кости на внутренний контур. Поверхности имплантата конгруэнтны поверхностям опилов соответствующих отломков.
Четвертый этап – операция замещения дефекта 3-D имплантатом и остеосинтез интрамедуллярным штифтом с блокированием. При операции 3-D имплантат заполняли костными ауто- и аллотрансплантатами, в виде щебенки, смешанными с концентратом аспирата костного мозга из крыла подвздошной кости.
В послеоперационном периоде проводили реабилитационное лечение, направленное на восстановление функции нижней конечности. Дозированную нагрузку и разработку движений в пассивном режиме начинали со 2 суток после операции, полную нагрузку на ногу разрешали при наличии признаков интеграции имплантата. Начиная с 3 месяцев после операции при отсутствии боли при полной нагрузке на конечность в течение 3 суток (функциональная проба), назначали КТ бедренной кости и оценивали степень интеграции имплантата и бедренной кости, которую считали состоявшейся при полном циркулярном охвате концов имплантата периостальной костной мозолью по плотности схожей с кортикальной костью бедра (срок анатомического замещения дефекта). После чего разрешали полную нагрузку и проводили окончательную реабилитацию, после которой представляли раненого на ВВК, с окончанием срока лечения.
Лечение методом компрессионно-дистракционного остеосинтеза по Илизарову состояло из: наложения аппарата спи-це-стержневого типа и остеотомии с последующим периодом выжидания от 7 до 14 дней. Далее в зависимости от методики выполняли дистракцию/компрессию от одного до четырех-пяти месяцев, со средней скоростью около 1 мм в сутки, с рентгенологическим контролем дистракции. При этом разрешали дозированную нагрузку на конечность до 50 % веса тела и разрабатывали движения в смежных суставах. Продолжительность этого периода зависела от сложности и размера костного дефекта. Следующим этапом являлся период фиксации, который характеризовался неподвижностью костных фрагментов в достигнутом положении, когда происходило созревание костного регенерата. Во время данного периода раненому разрешали полную нагрузку на конечность без дополнительной опоры. Данный период, как правило, равнялся удвоенному перио- ду дистракции/компрессии, частота рентгенографии 1 раз в месяц. При сроке намеченного демонтажа аппарата внешней фиксации, при рентгенологическом созревании регенерата, при продолжающейся функциональной нагрузке, производили функциональную пробу - расслабляли гайки на вертикальных стержнях аппарата на 2—3 мм, давали полную нагрузку на регенерат кости, при отсутствии боли в бедре в течение 3-7 суток аппарат снимали. Снятие аппарата с последующим периодом иммобилизации гипсовой лонгетой (ортезом) на две-четыре недели, что считали сроком анатомического замещения дефекта кости. После чего проводили заключительную реабилитацию и ВВК.
Результаты лечения оценивали по следующим показателям: количество положительных результатов (успешное замещение дефекта – отсутствие укорочения конечности), конечной точкой анатомического замещения дефекта считали полное восстановление опорной функции и интеграции 3-D имплантата для основной группы или срок созревания регенерата и полной нагрузки без дополнительной опоры для контрольной группы. Определяли срок стационарного лечения, количество дополнительных операций после реконструктивной операции, показатели восстановления по шкале LEFS (Lower Extremity Functiona Scale, 1999 г.) [24]. Функциональное восстановление амплитуды движений в смежных суставах с определяли при ВВК, согласно результатам которой раненый мог быть возвращен на военную службу без изменения категории годности или с различными ограничениями.
Статистическую обработку полученных данных проводили с использованием приложения Microsoft Excel и пакета статистического анализа данных Statistica 10. Для анализа применен Т-критерий Стьюдента, для независимых выборок, U-критерий Манна-Уитни, а также Критерий χ2 Пирсона (р<0,05).
Результаты
Результаты лечения представлены в Таблице 2. В одном случае в основной группе у одного пациента результат оценили как неудовлетворительный, через 2 недели после реконструктивной операции в связи с развитием глубокой периимплантной инфекции, что потребовало удаления 3-D имплантата, в дальнейшем раненому было предложено лечение альтернативным методом. Таким образом, количество пациентов, у которых было достигнуто успешное замещение дефекта, в группе I составило 7 (87,5%), в группе 2 – 12 (100%).
По многим показателям, по нашему мнению, при сравнении отмечено существенное преимущество замещения дефекта 3-D имплантатом перед методом Илизарова.
Так, продолжительность стационарного лечения пациентов группы I оказалась значительно меньше по сравнению с группой II: 62,1±12,7 и 112,0±37,0 дней соответственно. В процессе лечения по Илизарову потребовалось проведение дополнительных операций, направленных на коррекцию по- ложения перемещаемого фрагмента кости, замену спиц при воспалении мягких тканей, удаления рубцовых тканей в зоне замещаемого дефекта и др. В среднем таких операций было выполнено 2,86±0,8, по сравнению с 0,4±0,6 в группе I, где в единичных случаях пришлось выполнить дополнительно пластику расщепленным кожным лоскутом или наложение первично-отсроченных швов.
Таблица 2
Результаты лечения
|
Показатель |
Группы раненых |
р |
|
|
Основная группа (I) n=8 |
Контрольная группа (II) n=12 |
||
|
Успешное замещение дефекта (чел) |
7 (87,5%) |
12 (100%) |
0,209** |
|
Продолжительность стационарного лечения (сутки) |
62,1±12,7 |
112,0±37,0 |
0,002* |
|
Количество операций после реконструктивной операции |
0,4±0,6 |
2,86±0,8 |
>0,001* |
|
Срок анатомического восстанов-ления (сутки) |
170,9±19,7 |
275,7±76,7 |
0,002* |
|
Общий срок лечения (сутки) |
219,1±20,4 |
369,9±87,9 |
0,002* |
|
Оценка по шкале LEFS 3 месяца после операции |
52,5±4,6 |
41,57±6,6 |
>0,001* |
|
Оценка по шкале LEFS 12 месяцев после операции |
70,9±6,1 |
61,43±6,9 |
0,002* |
|
Результаты ВВК (без изменения категории годности) |
5 (62,5%) |
7 (58,3%) |
0,852** |
*T-критерий Стьюдента для независимых выборок
**Критерий χ2 Пирсона
Средний срок анатомического восстановления или интеграции 3-D имплантата для 7 пациентов группы I закончивших лечение с положительным результатом составил 170,9±19,7 дней. В то время, как в группе II замещение дефекта костным транспортом и сращение отломков достигнуто через 275,7±76,7 дней. Соответственно, длительность лечения составила 219,1±20,4 и 369,9±87,9 дней. При этом максимально возможное функциональное восстановление, которое позволило обеспечить возвращение раненых к прежнему уровню физической активности и возвращению к службе без изменения категории годности достигнуто у 5 (62,5%) человек из 8 в группе I и у 7 (58,3%) из 12 в группе II – отличия статистически не значимые.
По шкале LEFS наблюдалось более быстрое и полное восстановление в группе I по сравнению с группой II. При оценке функционального состояния через 3 месяца после реконструктивной операции уровень восстановления пациентов группы 1 составил 52,5±4,6 баллов, в группе 2 – 41,57±6,6 баллов. В течении последующих 9 месяцев данные показатели выросли до 70,9±6,1 и 61,43±6,9 баллов соответственно.
Клинический пример применения аддитивной технологии военнослужащий Д., 24 лет получил огнестрельное пулевое слепое ранение правого бедра в нижней трети с многооскольчатым переломом диафиза бедренной кости (Рисунок 1 а). В медучреждении в районе боевых действий выполнена первичная хирургическая обработка раны с удалением костных отломков, наложен стержневой внеочаговый аппарат, рана частично ушита, дренирована.
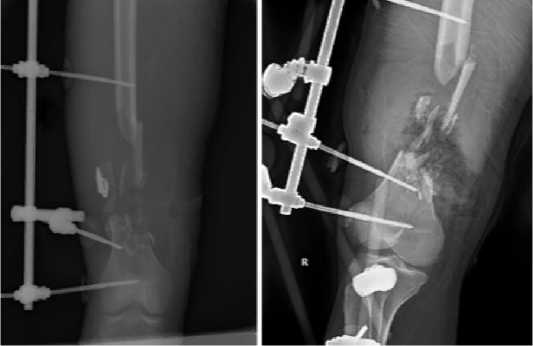
При поступлении в госпиталь на 3 сутки после ранения выполнена рентгенография, выявлено инородное тело в мягких тканях бедра, швы сняты, выполнена повторная хирургическая обработка раны, при которой инородное тело удалено, выполнен перемонтаж аппарата внешней фиксации, диагностирован первичный циркулярный дефект диафиза бедренной кости длиной 10 см (Рисунки 1 б, 2).
а
Рисунок 1 - Раненый Д. 24 года. Рентгенограммы правого бедра при поступлении в госпиталь: а - прямая проекция; б - прямая проекция после этапной хирургической обработки и удаления инородного тела (пули)
Пациенту выполнялись перемонтаж АВФ, этапные хирургические обработки с использованием системы для санации раневой поверхности Pulsаvac и терапией отрицательным давлением (вакуумное дренирование). На 9-е сутки после ранения наложены вторичные швы на рану. По результатам МСКТ осуществлено предоперационное планирование и изготовление индивидуального имплантата на 3-D принтере (Рисунок 3).
а б
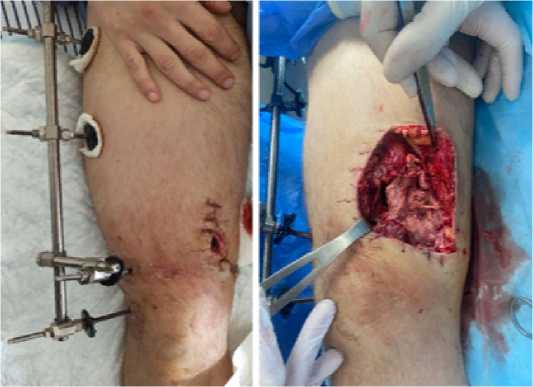
Рисунок 2 - Внешний вид бедра при поступлении: а - с наложенными на первичном этапе швами; б - после снятия швов
б
а
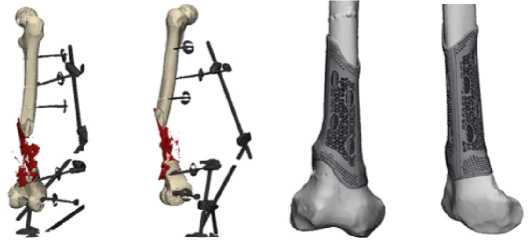
Рисунок 3 - МСКТ поврежденного сегмента в 3 d реконструкция: а - (прямая проекция); б - боковая проекция); цифровая модель индивидуального 3-D имплантата: в - прямая проекция; г - боковая проекция.
На 22 сутки после ранения выполнена реконструктивнопластическая операция: хирургическая обработка зоны дефекта бедренной кости, замещение дефекта индивидуальным 3-D имплантатом (Рисунок 4), заполненным костными ауто-и аллотрансплантатами с концентратом аспирата костного мозга из крыла подвздошной кости (Рисунок 5), фиксация бедренной кости и имплантата интрамедуллярным штифтом с блокированием (Рисунок 6).
В послеоперационном периоде проведено реабилитационное лечение, направленное на восстановление функции правой нижней конечности. Дозированная нагрузка и разработка движений в пассивном режиме начата по мере стихания болевого синдрома на 2 сутки после операции. Инфекционных осложнений не отмечено. При функциональной нагрузочной пробе через 3 месяца боли не отмечает, при КТ выявлена интеграция имплантата (Рисунок 7) и разрешена полная нагрузка на конечность.

а б
Рисунок 4 - Внешний вид 3-D имплантата: а - заполнение костными ауто-и б - аллотрансплантатами
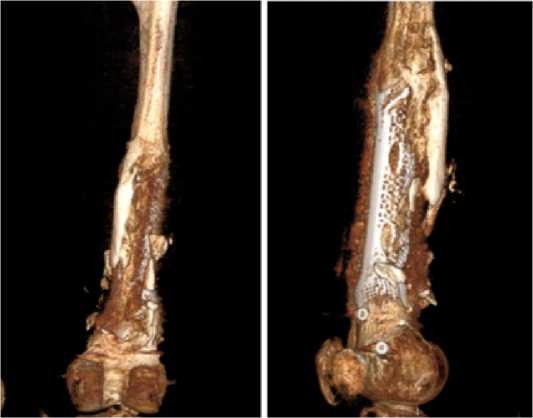
Рисунок 7 - КТ бедренной кости через 3 месяца после операции: а) прямая; б) боковая проекции
а б
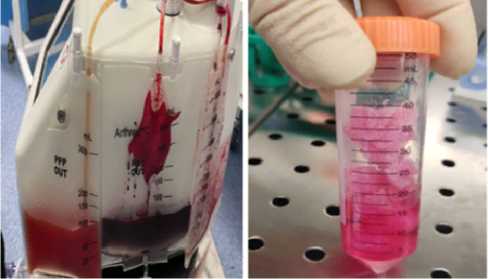
Рисунок 5 - Интраоперационная картина: а- забор концентрата аспирата костного мозга (BMAC), б – пропитывание аутотрансплантата из гребня подвздошной кости
Результат лечения после операции по шкале LEFS: через 3 месяца - 54 балла, через 6 месяцев - 67 баллов. Продолжительность стационарного лечения составила 41 сутки. Интеграция тканеинженерной конструкции в ложе костного дефекта наступила через 6 месяцев (Рисунок 8), через 7 месяцев пациент приступил к исполнению служебных обязанностей в прежнем объеме.
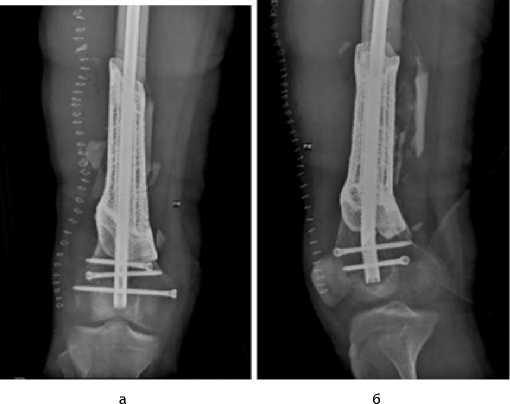
Рисунок 6 - Рентгенограммы бедра после операции: а - прямая; б) - боковая проекции
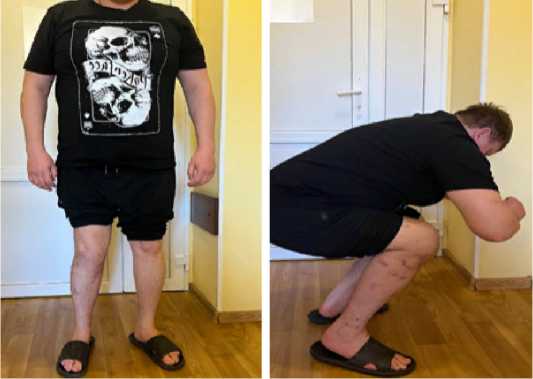
Рисунок 8 - Функциональный результат через 6 месяцев после операции
Результат лечения после операции по шкале LEFS через 12 месяцев - 78 баллов. Интеграция тканеинженерной конструкции в ложе костного дефекта через 12 месяцев представлена на Рисунке 9, отмечается врастание кости в просвет имплантата.
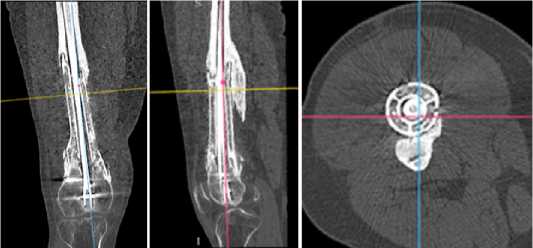
б в
Рисунок 9 - КТ бедренной кости через 12 месяцев после операции: а) прямая; б) боковая; в – аксиальная проекции
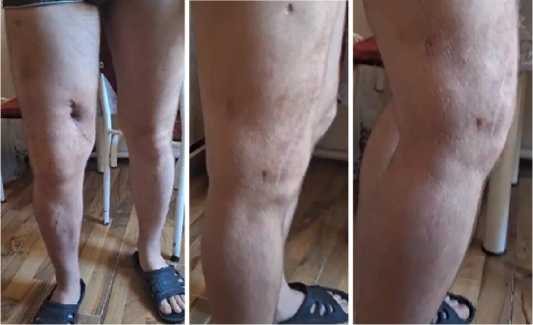
Рисунок 10 – Вид конечности пациента через 12 месяцев после операции
В настоящее время пациент несет боевое дежурство (Рисунок 10 и исполняет служебные обязанности в полном объеме.
Обсуждение
Диафизарные дефекты бедренной кости после огнестрельных ранений являются причиной глубокой инвалидизации пострадавших. Трудности и риски при проведении лечебных мероприятий на всех этапах обусловлены морфологическими особенностями огнестрельной раны и закономерностями течения репаративных процессов, которые необходимо учитывать при определении тактики лечения [24, 25].
Проблема замещения дефектов диафизов длинных костей конечностей может решаться различными путями. В России наибольшее распространение получили методики, разработанные школой Г. А. Илизарова и его последователями [3-6]. Прорывом в реконструктивной хирургии стали микрохирургические методики [7, 8]. До настоящего времени предпринимаются попытки применять массивные аллотрансплантаты. В последнее десятилетие активно разрабатывается техника Masquelet [9-11]. Однако, трудоемкость, высокий риск осложнений, большие экономические затраты, непредсказуемость результата, низкое качество жизни пациента и другие недостатки, которые в той или иной мере свойственны вышеперечисленным вариантам, предопределяют поиск более совершенных методов лечения данной патологии. Новые возможности хирургам дали аддитивные и биоинженерные технологии [17-18].
Наше исследование показало, что применение тканеинженерной конструкции на основе индивидуального 3-D имплантата в сочетании с компонентами ауто- и аллокости может служить достойной альтернативой имеющимся на вооружении травматологов-ортопедов технологиям. Данная методика позволяет относительно быстро (через 3 недели) до развития необратимых изменений в травмированной конечности осуществить исчерпывающее оперативное вмешательство. Механическая прочность системы кость–3-D имплантат – интрамедуллярный фиксатор обеспечила сокращение сроков послеоперационной реабилитации и возвращения к службе. Индивидуальный 3-D имплантат с наполнением из ауто- и аллокости успешно интегрирован зону дефекта за время незначительно превышающие средние сроки сращения неосложненного огнестрельного перелома. Отсутствие необходимости применения внеочагового внешнего фиксатора позволило избежать развития внеочаговых инфекционных осложнений и трудностей реабилитации, которые отрицательно сказываются на конечном результате при использовании методов Илизарова.
Несмотря на все предпринятые предосторожности и положительные стороны предложенной технологии сохраняется риск развития хирургической инфекции в зоне дефекта. Инфекционное осложнение в одном из наших наблюдений в группе I привело к необходимости радикального изменения в тактике лечения: удалению тканеинженерной конструкции и перехода на многоэтапную методику Илизарова. Как вариант, возможно применение двухэтапной техники Masquelet.
Полученный практический опыт подтверждает эффективность методики, ее преимущества, по сравнению с традиционными. Относительная безопасность, низкий уровень осложнений, повлиявших на исход, более раннее восстановление функции и возвращение пациентов в строй дает основания рассматривать данную технологию как перспективную для лечения огнестрельных дефектов бедренной кости. Однако, небольшое количество пролеченных пациентов группы I не позволяют рекомендовать метод к широкому внедрению. Результаты применения тканеинженерных конструкций в нашем исследовании требуют дальнейшего всестороннего изучения проблемы лечения огнестрельных переломов костей конечностей и служат обоснованием для продолжения исследований.
Результаты проведенного исследования позволяют судить о большей эффективности лечения пациентов с огнестрельными дефектами костей нижних конечностей с использованием аддитивных технологий в сравнении с методикой Илизарова в раннем и среднесрочном послеоперационных периодах.
Аддитивные технологии при лечении пациентов с огнестрельными дефектами костей нижних конечностей позволяют моде- лировать индивидуальные имплантаты любой сложности, тем самым обеспечить оптимальный подход к лечению конкретного пациента, заместить огнестрельный дефект костной ткани и достичь раннего восстановления функции поврежденной конечности.
Структура, остеоиндуктивные и остеокондуктивные свойства комбинированного имплантата в сочетании с использованием концентрата аспирата костного мозга обеспечили достаточную остеоинтеграцию с реципиентным ложем в короткие сроки с сохранением достигнутого результата в среднесрочной перспективе.
Вывод
Применение аддитивных технологий в лечении огнестрельных дефектов бедренной кости позволяют в короткие сроки выполнить реконструкцию кости и получить опороспособную конечность, сократить сроки стационарного лечения и возвращение раненого в строй, однако отдаленные последствия данного лечения требуют дальнейшего изучения.
Список литературы Результаты лечения массивных диафизарных дефектов бедренной кости после огнестрельных ранений с использованием аддитивных технологий
- Методические рекомендации по лечению боевой хирургической травмы / Д. В. Тришкин, Е. В. Крюков, А. П. Чуприна [и др.]. – Санкт-Петербург: Военно-медицинская академия имени С. М. Кирова, 2022. – 373 с. [Metodicheskie rekomendatsii po lecheniyu boevoi khirurgicheskoi travmy / D. V. Trishkin, E. V. Kryukov, A. P. Chuprina [i dr.]. – Sankt-Peterburg: Voenno-meditsinskaya akademiya imeni S. M. Kirova, 2022. – 373 p.]
- Керимов А. А., Нелин Н. И., Переходов С.Н., Фоминых Е. М., Ивашкин А. Н. Актуальные подходы к хирургической обработке огнестрелных травм конечностей// Медицинский вестник МВД / 2023;3(124):2-6. [Kerimov A. A., Nelin N. I., Perekhodov S.N., Fominykh E. M., Ivashkin A. N. Aktual’nye podkhody k khirurgicheskoi obrabotke ognestrel’nykh travm konechnostei// Meditsinskii vestnik MVD / 2023;3(124):2-6.]
- Ilizarov G. A. The principles of the Ilizarov method. Bull Hosp Jt Dis Orthop Inst. 1988; 48:1–11.
- Sen C, Kocaoglu M, Eralp L, et al. Bifocal compression-distraction in the acute treatment of grade III open tibia fractures with bone and softtissue loss: a report of 24 cases. J Orthop Trauma. 2004; 18:150–157. doi: 10.1097/00005131-200403000-00005.
- Chaddha M, Gulati D, Singh AP, et al. Management of massive posttraumatic bone defects in the lower limb with the Ilizarov technique. Acta Orthop Belg. 2010; 76:811–820.
- Papakostidis C, Bhandari M, Giannoudis PV. Distraction osteogenesis in the treatment of long bone defects of the lower limbs: effectiveness, complications, and clinical results; a systematic review and meta-analysis. Bone Joint J. 2013;95-B:1673–1680. doi: 10.1302/0301-620X.95B12.32385.
- Toros T, Ozaksar K. Reconstruction of traumatic tubular bone defects using vascularized fibular graft. Injury. 2021 Oct;52(10):2926-2934. doi: 10.1016/j.injury.2019.08.013
- Petrella G, Tosi D, Pantaleoni F, Adani R. Vascularized bone grafts for post-traumatic defects in the upper extremity. Arch Plast Surg. 2021 Jan;48(1):84-90. doi: 10.5999/aps.2020.00969
- Tong K, Zhong Z, Peng Y, Lin C, Cao S, Yang Y, Wang G. Masquelet technique versus Ilizarov bone transport for reconstruction of lower extremity bone defects following posttraumatic osteomyelitis. Injury. 2017 Jul;48(7):1616-1622. doi: 10.1016/j.injury.2017.03.042.
- Masquelet A, Kanakaris NK, Obert L, et al. Bone repair using the Masquelet technique. J Bone Joint Surg Am. 2019;101:1024–1036. doi: 10.2106/JBJS.18.00842.
- Masquelet AC, Begue T. The concept of induced membrane for reconstruction of long bone defects. OrthopClinNorthAm. 2010;41:27–37. doi: 10.1016/j.ocl.2009.07.011.
- Хоминец В.В., Щукин А. В., Михайлов С. В., Фоос И.В. Особенности лечения раненых с огнестрельными переломами длинных костей конечностей методом последовательного внутреннего остеосинтеза / Политравма. 2017;(3):12-22. ISSN 2541-867X. [Khominets V.V., Shchukin A. V., Mikhailov S. V., Foos I.V. Osobennosti lecheniya ranenykh s ognestrel’nymi perelomami dlinnykh kostei konechnostei metodom posledovatel’nogo vnutrennego osteosinteza / Politravma. 2017;(3):12-22. ISSN 2541-867X]
- Давыдов Д.В., Брижань Л.К., Нелин Н.И., Гречухин Д.А. Возможности и перспективы применения АВФ при оказании первичной специализированной травматологической помощи в локальных военных конфликтах и чрезвычайных ситуациях В сборнике:VI Пироговский форум травматологов-ортопедов, посвященный 50-летию кафедры травматологии, ортопедии и медицины катастроф МГМСУ им. А.И. Евдокимова. Сборник материалов форума. Москва, 2021:63-64. [Davydov D.V., Brizhan’ L.K., Nelin N.I., Grechukhin D.A. Vozmozhnosti i perspektivy primeneniya AVF pri okazanii pervichnoi spetsializirovannoi travmatologicheskoi pomoshchi v lokal’nykh voennykh konfliktakh i chrezvychainykh situatsiyakh V sbornike:VI Pirogovskii forum travmatologov-ortopedov, posvyashchennyi 50-letiyu kafedry travmatologii, ortopedii i meditsiny katastrof MGMSU im. A.I. Evdokimova. Sbornik materialov foruma. Moskva, 2021:63-64.]
- Артемьев А. А., Ивашкин А.Н., Соловьев Ю.С., Сысоев И.А. Укорачивающая резекция как наиболее рациональный вариант лечения инфицированных ложных суставов и дефектов длинных костей В книге: Травма 2018: мультидисциплинарный подход. Сборник тезисов Международной конференции. Российский национальный исследовательский университет им. Н. И. Пирогова. 2018:27-28. [Artem’ev A. A., Ivashkin A.N., Solov’ev Yu.S., Sysoev I.A. Ukorachivayushchaya rezektsiya kak naibolee ratsional’nyi variant lecheniya infitsirovannykh lozhnykh sustavov i defektov dlinnykh kostei V knige: Travma 2018: mul’tidistsiplinarnyi podkhod. Sbornik tezisov Mezhdunarodnoi konferentsii. Rossiiskii natsional’nyi issledovatel’skii universitet im. N. I. Pirogova. 2018:27-28.]
- Lerner, A., Reis, N.D., Soudry, M.: Primary limb shortening, angulation, and rotation to facilitate the closure of massive limb wounds without complex grafting procedures, combined with secondary corticotomy for limb reconstruction. Curr. Opin. Orthop. 2009;(20):191–194 DOI:10.1097/BCO.0b013e318193bfaa
- Барабаш А. П., Кесов Л. А., Барабаш Ю. А., Шпиняк С.П. Замещение обширных диафизарных дефектов длинных костей конечностей // Травматология и ортопедия России. 2014; (20)2:93-99. [Barabash A. P., Kesov L. A., Barabash Yu. A., Shpinyak S.P. Zameshchenie obshirnykh diafizarnykh defektov dlinnykh kostei konechnostei // Travmatologiya i ortopediya Rossii. 2014; (20)2:93-99.]
- Adamczyk A, Meulenkamp B, Wilken G, Papp S. Managing bone loss in open fractures. OTA Int. 2020 Mar 23;3(1): e059. doi: 10.1097/OI9.0000000000000059
- Fillat-Gomà F, Marcano-Fernández FA, Coderch-Navarro S, Martínez-Carreres L, Berenguer A. 3D printing innovation: New insights into upper extremity surgery planning. Injury. 2021 Jul;(52)4:117-124. doi: 10.1016/j.injury.2021.01.048
- Bizzotto N, Tami I, Santucci A, Adani R, Poggi P, Romani D, Carpeggiani G, Ferraro F, Festa S, Magnan B. 3D Printed replica of articular fractures for surgical planning and patient consent: a two years multi-centric experience. 3D Print Med. 2015;2(1):2. doi: 10.1186/s41205-016-0006-8
- Яриков А.В., Горбатов Р. О., Денисов А. А., Смирнов И. И., Фраерман А.П., Соснин А. Г., Перльмуттер О.А., Калинкин А. А. Применение аддитивных технологий 3D-печати в нейрохирургии, вертебрологии, травматологии и ортопедии. Клиническая практика. 2021;12(1):90–104. [Yarikov A.V., Gorbatov R. O., Denisov A. A., Smirnov I. I., Fraerman A.P., Sosnin A. G., Perl’mutter O.A., Kalinkin A. A. Primenenie additivnykh tekhnologii 3D-pechati v neirokhirurgii, vertebrologii, travmatologii i ortopedii. Klinicheskaya praktika. 2021;12(1):90–104.]
- Calvo-Haro, J.A., Pascau, J., Mediavilla-Santos, L. et al. Conceptual evolution of 3D printing in orthopedic surgery and traumatology: from “do it yourself” to “point of care manufacturing”. BMC Musculoskelet Disord 22, 360 (2021). doi: 10.1186/s12891-021-04224-6.
- Zhang J, Wehrle E, Rubert M, Müller R. 3D Bioprinting of Human Tissues: Biofabrication, Bioinks, and Bioreactors. Int J Mol Sci. 2021 Apr 12;22(8):3971. doi: 10.3390/ijms22083971.
- Zhu J, Wang Y, Zhong L, Pan F, Wang J. Advances in tissue engineering of vasculature through three-dimensional bioprinting. Dev Dyn. 2021 Dec;250(12):1717-1738. doi: 10.1002/dvdy.385
- Binkley JM, Stratford PW, Lott SA, Riddle DL. The Lower Extremity Functional Scale (LEFS): scale development, measurement properties, and clinical application. North American Orthopaedic Rehabilitation Research Network. Phys Ther. 1999 Apr; 79(4):371-83.
- Long WT, Brien EW, Boucree JB Jr, Filler B, Stark HH, Dorr LD. Management of civilian gunshot injuries to the hip. Orthop Clin North Am. 1995 Jan;26(1):123-31.
- Baum GR, Baum JT, Hayward D, MacKay BJ. Gunshot Wounds: Ballistics, Pathology, and Treatment Recommendations, with a Focus on Retained Bullets. Orthop Res Rev. 2022;(14):293-317. doi: 10.2147/ORR.S378278.


