Результаты международного многоцентрового двойного слепого рандомизированного клинического исследования i фазы препарата bcd-022 по сравнению с препаратом герцептин®, применяемых в сочетании с паклитакселом у больных метастатическим раком молочной железы с гиперэкспрессией HER2
Автор: Игнатова Е.О., Фролова М.А., Бурдаева О.Н., Нечаева М.Н., Печеный А.П., Копп М.В., Удовица Д.П., Котив Б.Н., Чубенко В.А., Строяковский Д.Л., Шевелева Л.П., Хоринко А.В., Прокопенко Т.И., Шаповалова Ю.С., Жевлакова И.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 4 (11), 2014 года.
Бесплатный доступ
В рамках многоцентрового двойного слепого рандомизированного клинического исследования была изучена фармакокинетика и безопасность препарата BCD-022 (трастузумаб, ЗАО «БИОКАД», Россия) по сравнению с препаратом Герцептин® (трастузумаб, Ф. Хоффманн-Ля Рош Лтд, Швейцария). Оценка эффективности не входила в задачи промежуточного анализа, результаты которого представлены. BCD-022 и Герцептин® применялись в комбинации с паклитакселом у пациенток метастатическим раком молочной железы с гиперэкспрессией HER2 (HER2 (+) мРМЖ). Методы. В анализ включено 46 больных HER2 (+) мРМЖ в возрасте от 29 до 71 года (22 - в группу исследуемого препарата BCD-022, 24 - в группу Герцептин®). Все пациентки получили 1 курс терапии по схеме BCD-022 или Герцептин® 8 мг/кг внутривенно капельно и паклитаксел 175 мг/м2 внутривенно в 1 день трехнедельного курса и продолжают лечение по той же схеме с использованием трастузумаба в дозе 6 мг/кг (обязательным в исследовании является проведение 6 курсов терапии). Рандомизация в группы производилась в соотношении 1:1. Первичной конечной точкой для оценки фармакокинетики была площадь под кривой«концентрация-время» (AUC0-504) трастузумаба после однократного применения, вторичными - Cmax, T1/2и Tmax. Безопасность оценивалась на основании частоты нежелательных явлений после первого курса терапии. Результаты. Среди нежелательных явлений наиболее часто встречалась гематологическая токсичность, миалгия, артралгия. Большинство зарегистрированных нежелательных явлений имели легкую и умеренную степень по СТСАЕ 4.03 и были обусловлены проведением миелосупрессивной химиотерапии. Статистически значимых различий между группами не было выявлено ни по одному из нежелательных явлений. Зарегистрировано6 серьезных нежелательных явлений: 2 - в группе исследуемого препарата BCD-022 и 4 - в группе Герцептин®. Все фармакокинетические показатели, включая первичную конечную точку (AUC0-504) и вторичные конечные точки (Cmax, T1/2 и Tmax), исследуемого препарата BCD-022 и Герцептин® не имели статистически значимых отличий. Заключение. BCD-022 (трастузумаб, ЗАО «БИОКАД», Россия) по своему профилю безопасностии фармакокинетическим свойствам полностью соответствует оригинальному препарату трастузумаба Герцептин® (Ф. Хоффманн-Ля Рош Лтд, Швейцария) и может быть рекомендован для дальнейшего клинического изучения.
Рак молочной железы, трастузумаб, биоаналог
Короткий адрес: https://sciup.org/14045518
IDR: 14045518
Текст научной статьи Результаты международного многоцентрового двойного слепого рандомизированного клинического исследования i фазы препарата bcd-022 по сравнению с препаратом герцептин®, применяемых в сочетании с паклитакселом у больных метастатическим раком молочной железы с гиперэкспрессией HER2
Фролова Мона Александровна — к.м.н., старший научный сотрудник отделения клинической онкологии ФГБНУ РОНЦ им Н. Н. Блохина, г. Москва.
Бурдаева Ольга Николаевна — Заведующая химиотерапевтическим отделением ГУЗ «Архангельский областной клинический онкологический диспансер», г. Архангельск.
Нечаева Марина Николаевна — онколог-химиотерапевт ГУЗ «Архангельский областной клинический онкологический диспансер», г. Архангельск.
Печеный Александр Петрович — к.м.н., Заведующий 5-м онкологическим отделением БУЗ ОО «Орловский онкологический диспансер», г. Орел.
Копп Михаил Валериевич — д.м.н., профессор, Заведующий отделением химиотерапии ГБУЗ «Самарский областной клинический онкологический диспансер», г. Самара.
Удовица Дмитрий Петрович — Заведующий гематологическим отделением ГБУЗ «Онкологический диспансер № 2», г. Сочи.
Котив Богдан Николаевич — д.м.н., профессор, начальник кафедры госпитальной хирургии ФГК ВОУ ВПО «ВМА им. С. М. Кирова» Минобороны России, г. Санкт-Петербург.
Чубенко Вячеслав Андреевич — к.м.н., заведующий отделением химиотерапии ФГБУ «НИИ онкологии имени
Н. Н. Петрова» МЗ РФ.
Строяковский Даниил Львович — Заведующий отделением химиотерапии ГУЗ «МГОБ № 62», Московская область.
Шевелева Людмила Петровна — Заведующая отделением химиотерапии ГУЗ «ВОКОД № 1», г. Волгоград.
Хоринко Андрей Витальевич — Заведующий химиотерапевтическим отделением ГУЗ «ПКОД», г. Пермь.
Прокопенко Татьяна Ивановна — онколог-химиотерапевт ГУЗ «ПКОД», г. Пермь.
Шаповалова Юлия Сергеевна — к.м.н., врач-клинический фармаколог НУЗ «Дорожная клиническая больница на ст. Челябинск ОАО «РЖД», г. Челябинск.
Жевлакова Ирина Александровна — врач-химиотерапевт НУЗ «Дорожная клиническая больница на ст. Челябинск ОАО «РЖД», г. Челябинск.
THE RESULTS OF INTERNATIONAL MULTICENTER RANDOMIZED DOUBLE BLIND PHASE I CLINICAL TRIAL COMPARING PHARMACOKINETICS AND SAFETY OF BCD-022 (TRASTUZUMAB BIOSIMILAR CANDIDATE BY CJSC BIOCAD, RUSSIA) USED WITH PACLITAXEL TO HERCEPTIN® (F. HOFFMANN-LA ROCHE LTD, SWITZERLAND) USED WITH PACLITAXEL IN THE FIRST-LINE TREATMENT OF HER2-POSITIVE METASTATIC BREAST CANCER PATIENTS
Ignatova E. O., Frolova M. A., Burdaeva O. N., Nechaeva M. N., Pechenyy A. P., Kopp M. V., Udovitsa D. P., Kotiv B. N., Chubenko V. A.; Stroyakovskiy D. L., Sheveleva L. P., Khorinko A. V., Prokopenko T. I., Shapovalova J. S.; Jelvakova I. A.
Background: BCD-022 is a trastuzumab biosimilar candidate manufactured by CJSC BIOCAD, Russia.
Pharmacokinetics and safety of BCD-022 were compared to Herceptin® in multicentre randomized double blind phase I clinical trial. Assessment of efficacy was not an objective of this study. BCD-022 and Herceptin® were used with paclitaxel in the first-line treatment of HER2-positive metastatic breast cancer (HER2 (+) mBC) patients.
Methods: 46 patients with verified HER2 (+) mBC at the age of 29 to 71 years were included in this study. Patients were randomly assigned into 2 groups (at a ratio of 1:1): 22 patients were included in the BCD-022 group and 24 patients — in the Herceptin® group. All 46 patients have received Cycle 1 — the first trastuzumab administration (BCD-022 or Herceptin®) at a dose of 8 mg/kg i.v. with paclitaxel 175 mg/m2 i.v. on Day 1 of 3-week cycle. All patients remained participation in the study up to 6 therapy cycles. The primary PK endpoint was AUC (0–504), the secondary endpoints included Cmax, T1/2 и Tmax. Trastuzumab serum concentrations were evaluated immediately before the first infusion and after 1.5 h, 3 h, 4.5 h, 6 h, 24 h, 96 h, 168 h, 336 h and 504 h. Safety analysis included assessment of adverse events after the 1st therapy cycle.
Собственные исследования
Results: BCD-022 and Herceptin® were well tolerated without any significant differences in AEs frequency between the groups. The most common AEs included hematological toxicity (leukopenia, neutropenia and anemia), myalgia and arthralgia. The majority of AEs was of Grade 1–2 (CTCAE 4.03) and was associated with myelosuppressive chemotherapy. There were no statistically significant differences in AE rate between the two investigational groups. Totally 6 SAE were reported: 2 (9.1%) in the study group and 4 (16.7%) in the reference drug group. All primary (AUC (0–504)) and secondary (Cmax, T1/2, Tmax) PK parameters demonstrated no statistically significant differences between the groups.
Conclusions: PK and safety characteristics of BCD 022 and Herceptin® after a single i.v. administration in patients with HER2 (+) mBC are considered to be equivalent. These data allow continue BCD-022 study aimed to assess efficacy and safety in the same population.
В структуре онкологической заболеваемости среди женщин рак молочной железы (РМЖ) занимает первое место, и частота его неуклонно растет [1]. Гиперэкспрессия/ам-плификация HER2 обнаруживается у 18–20% всех больных РМЖ и характерна для HER2-о-богощенного молекулярного подтипа РМЖ и люминального В подтипа с гиперэкспрессией HER2 [2]. Несмотря на определенные различия в прогнозе и терапевтических подходах, использование анти-HER2 препаратов имеет решающее значение для судьбы больных в обеих группах. Основным препаратом, не только прочно вошедшим в клиническую практику, но и позволяющим реально улучшить прогноз у пациенток с РМЖ с гиперэкспрессией HER2, является трастузумаб, оригинальный препарат которого выпускается под названием Герцептин® компанией Ф. Хоффманн-Ля Рош Лтд, Швейцария [3–7].
В настоящее время разработан биоаналог трастузумаба, BCD-022 (ЗАО «БИОКАД», Россия), который представляет собой полную копию оригинального препарата Герцептин®. Программа доклинических исследований препарата BCD-022 показала идентичность его физико-химических свойств, специфической активности и перекрестной реактивности, фармакокинетических и токсикологических показателей препарату Герцептин®.
Целью настоящего исследования явилось сравнение эквивалентности показателей фармакокинетики и безопасности препарата BCD-022 (трастузумаб, ЗАО «БИОКАД», Россия) и препарата Герцептин® (трастузумаб, Ф. Хоффманн-Ля Рош Лтд, Швейцария), применяемых в сочетании с паклитакселом у пациенток с метастатическим РМЖ с гиперэкспрессией HER2 (HER2 (+) мРМЖ). В задачи работы входило определение сывороточной концентрации трастузумаба, а также исследование частоты и тяжести нежелательных явлений (НЯ) у больных HER2 (+) мРМЖ после его однократного применения в рамках 1-го курса терапии комбинацией паклитаксела и трастузумаба.
Материалы и методы
По своему дизайну данное исследование представляло собой многоцентровое двойное слепое рандомизированное клиническое исследование I фазы, целью которого было определение эквивалентности показателей фармакокинетики, безопасности и переносимости препаратов BCD-022 и Герцептин®, применяемых в сочетании с паклитакселом в качестве первой линии терапии у больных HER2 (+) мРМЖ.
Для участия в исследовании допускались пациентки с HER2 (+) мРМЖ, которым ранее проводилась адъювантная и/или неоадъювантная химиотерапия, в том числе таксанами, трастузумабом и/или другими анти-HER2-пре-паратами. Так же было допустимо участие больных, которым проводилась эндокринная терапия в анамнезе. Не включались в исследование пациентки, которым уже проводилась ранее химиотерапия 1-й линии по поводу метастатического РМЖ.
После подписания информированного согласия и скринингового обследования больные стратифицировались и рандомизирова-
Результаты международного многоцентрового двойного слепого рандомизированного клинического исследования первой фазы препарата bcd-022 по сравнению с препаратом Герцептин®, применяемых в сочетании с паклитакселом у больных метастатическим раком молочной железы с гиперэкспрессией her2
лись в соотношении 1:1 в одну из двух групп: исследуемого препарата BCD-022 или препарата сравнения Герцептин®. Стратификация выполнялась в зависимости от предшествующего лечения (применялись или нет антрациклины и/или таксаны, трастузумаб и/или другие ан-ти-HER2-препараты), экспрессии гормональных рецепторов (есть/нет РЭ и/или РП) и возраста (<55/≥55 лет).
Все пациентки получали лечение по следующей схеме: BCD-022 или Герцептин® в нагрузочной дозе 8 мг/кг (1-й курс), затем в поддерживающей дозе 6 мг/кг, паклитаксел 175 мг/ м2 внутривенно 1 раз в 3 недели. Лечение продолжалось в течение 6 курсов, или до прогрессирования, или развития непереносимых токсических явлений. По окончании 6 курсов терапии больные с объективным полным и частичным ответом или стабилизацией заболевания, по решению врача, переводились в период поддерживающего лечения и наблюдения. В рамках поддерживающего лечения пациенты получали терапию BCD-022 вплоть до прогрессирования заболевания или развития непереносимых токсических явлений.
Для оценки фармакокинетики (ФК) препаратов BCD-022 и Герцептин® у всех больных в течение 1-го курса терапии производился забор образцов крови для исследования сывороточной концентрации трастузумаба по следующей схеме: непосредственно перед введением трастузумаба, затем через 1,5 ч (по окончании инфузии) и через 3, 4, 5, 6, 24, 96, 168, 336 и 504 часа после начала инфузии. Определение трастузумаба в сыворотке крови проводилось методом твердофазного иммуноферментного анализа (ELISIA).
На основании полученных данных о концентрациях трастузумаба в крови пациентов рассчитывался ряд ФК показателей: максимальная концентрация в плазме Cmax, площадь под кривой «концентрация-время» от момента приема препарата до последней точки забора крови — до 504 часов (AUC0–504), время достижения максимальной концентрации Тmax и период полувыведения Т 1/2, константа скорости элиминации Kel, общий клиренс Cl, стационарный объем распределения Vd и пр.
Безопасность оценивалась на основании данных о регистрации НЯ и серьезных НЯ
(СНЯ), а также данных общего осмотра, в т.ч. оценки по шкале ECOG, и определения физиологических показателей, результатов общего и биохимического анализов крови, общего анализа мочи, ЭКГ и Эхо-КГ.
Первичной конечной точкой исследования была AUC0–504 трастузумаба. Вторичные конечные точки включали: Cmax, Tmax, T1/2 трастузумаба также после однократного применения. Безопасность оценивалась на основании частоты НЯ после первого курса терапии.
Для установления эквивалентности ФК свойств препарата BCD-022 и Герцептин® рассчитывались 90% двусторонние доверительные интервалы (ДИ) для отношения средних геометрическихAUC0–504 трастузумаба после применения препаратов BCD-022 и Герцептина®. ФК профили препаратов считались эквивалентными в случае нахождения 90% ДИ для отношения AUC0–504 препаратов в диапазоне 80–125%. Прочие ФК показатели и параметры безопасности и переносимости сравнивались с помощью стандартных методов статистического сравнения.
Результаты и обсуждение
Популяция
В исследовании приняли участие 48 пациенток в возрасте от 29 до 71 года с верифицированным диагнозом HER2 (+) мРМЖ из 15 исследовательских центров на территории России и Беларуси. Двое больных из группы BCD-022 выбыло из исследования до начала терапии. Таким образом, в анализ безопасности включено 22 пациентки из группы исследуемого препарата BCD-022 и 24 пациентки из группы препарата сравнения Герцептин® (n=46), которые получили минимум по одному введению трастузумаба. Анализ основных показателей ФК проводился на основании данных, полученных от 38 больных (по 19 пациенток в каждой группе), соответствовавших критериям проведения анализа ФК.
Медиана возраста пациентов, включенных в группу BCD-022, составила 48,5 лет, в группу Герцептин® — 50,0 лет. По гистологическому типу, в большинстве случаев, был диагностирован инфильтративный протоко-
Собственные исследования вый РМЖ: у 14/22 (63,6%) и 20/24 (83,3%) в группах препаратов BCD-022 и Герцептин® соответственно; у одной пациентки в каждой из групп определялся инфильтративный дольковый РМЖ; у двух пациенток (8,3%) в группе препарата Герцептин® — медуллярный РМЖ. У 7/22 (31,8%) пациенток в группе BCD-022 и у 1/24 (4,2%) пациентки в группе препарата Герцептин® регистрировался низкодифференцированный РМЖ. У 4 больных гиперэкспрессия HER2 подтверждена методом FISH.
У большинства пациенток регистрировалось метастатическое поражение 2-х и более органов: у 17/22 (77,3%) и 19/24 (79,2%) больных в группах препаратов BCD-022 и Герцептин®, соответственно. Основными местами локализации отдаленных метастазов были следующие органы: печень, легкие и плевра, кости. Частота встречаемости метастазов в тех или иных органах была сопоставимой в двух группах.
Девять (40,9%) пациенток из группы BCD-022 и 16 (66,7%) пациенток из группы Герцептин® в анамнезе получали какую-либо терапию по поводу РМЖ. Большинству больных была проведена лучевая терапия и хирургическое лечение по поводу РМЖ, менее половины пациенток в обеих группах получали химиотерапию по поводу основного заболевания.
Подробная характеристика больных представлена в таблице 1.
Таким образом, группы были сопоставимы по основным характеристикам заболевания. Статистически значимые различия между группами по результатам экспрессии РП не являются клинически значимыми, с учетом того, что по всем другим демографическим показателям и характеристикам основного заболевания группы были уравновешены.
Анализ фармакокинетики
Методика сравнения ФК свойств в рамках данного исследования соответствует европейским рекомендациям по проведению клинических исследований биоаналогов, содержащих в качестве активного вещества моноклональные антитела [8], а также европейским рекомендациям по проведению исследований фармакокинетики терапевтиче- ских белков [9] и европейскому руководству по исследованию биоэквивалентности [10]. Была использована однокамерная модель анализа фармакокинетики.
В обеих группах концентрация трастузумаба после введения исследуемого препарата BCD-022 и препарата сравнения Герцептин® изменяется аналогичным образом. На рисунке 1 представлена динамика медиан концентраций трастузумаба в двух группах от момента введения препаратов и до 504 часов.
Статистическое сравнение по первичной фармакокинетической конечной точке (AUC0–504) и по одной из вторичных точек (Сmах) производилось путем расчета 90% ДИ для отношения средних геометрических соответствующих показателей исследуемого препарата BCD-022 и препарата Герцептин®. 90% ДИ для отношения AUC0–504 исследуемого препарата и препарата сравнения составил 80,42–120,87%, для Сmах- 83,69–123,05%, что соответствует установленным пределам эквивалентности фармакокинетических показателей 80–125% (см. табл. 2) [7].
Все рассчитанные ФК показатели исследуемого препарата BCD-022 и препарата Герцептин® были сходными и не имели статистически значимых различий (табл. 3). Медиана AUC0–504 составила 31579 (мкг/мл)•ч и 39472 (мкг/мл)•ч в группе исследуемого препарата BCD-022 и препарата Герцептин®, с коэффициентами вариации (КВ) 38,64% и 39,04%, соответственно. Сmах характеризовались меньшей вариабельностью в группе исследуемого препарата: 291 мкг/мл (КВ26,65%) и 298 мкг/мл (КВ39,43%) в группе BCD-022 и Герцептин®, соответственно. Тmax в обеих группах составило 5 часов. T1/2 в группе исследуемого препарата BCD-022–103 ч (КВ25,53%), в группе препарата сравнения Герцептин® — 113 ч (КВ22,34%).
Таким образом, сравнение испытуемых групп по первичной ФК конечной точке (AUC0– 504) и вторичным конечным точкам (Сmах, Тmax, T1/2) показало отсутствие статистически значимых различий между группами. На основании вышеизложенного можно сделать заключение об эквивалентности фармакокинетических свойств препарата BCD-022 и Герцептин® при однократном внутривенном введении пациентам.
Результаты международного многоцентрового двойного слепого рандомизированного клинического исследования первой фазы препарата bcd-022 по сравнению с препаратом Герцептин®, применяемых в сочетании с паклитакселом у больных метастатическим раком молочной железы с гиперэкспрессией her2
Таблица 1. Характеристики основного заболевания пациентов на момент включения в исследование
|
Показатель |
Группа |
Значение p |
|||
|
BCD-022 (n = 22) |
Герцептин® (n = 24) |
||||
|
n |
% |
n |
% |
||
|
Возраст |
|||||
|
Медиана (мин.— макс.), годы |
48,5 (29–71) |
50,0 (29–66) |
р = 0,506 |
||
|
Общее состояние по ECOG, n (%) |
|||||
|
0 баллов |
6 |
27,3 |
3 |
12,5 |
|
|
1 балл |
15 |
68,2 |
17 |
70,8 |
p = 0,241 |
|
2 балла |
1 |
4,5 |
4 |
16,7 |
|
|
Экспрессия HER-2, n (%) |
|||||
|
3+ |
21 |
95,5 |
21 |
87,5 |
р = 0,339 |
|
2+ |
1 |
4,5 |
3 |
12,5 |
|
|
Экспрессия гормональных рецепторов, n (%) |
|||||
|
РЭ |
5 |
22,7 |
10 |
41,7 |
р = 0,292 |
|
РП |
4 |
18,2 |
0 |
0,0 |
р = 0,045 |
|
Нет экспрессии |
13 |
59,1 |
14 |
58,3 |
р = 0,807 |
|
Гистологический тип, n (%) |
|||||
|
Инфильтративный протоковый |
14 |
63,6 |
20 |
83,3 |
|
|
Медуллярный |
0 |
0,0 |
2 |
8,3 |
р = 0,058 |
|
Инфильтративный дольковый |
1 |
4,5 |
1 |
4,2 |
|
|
Низкодифференцированный |
7 |
31,8 |
1 |
4,2 |
|
|
Число пораженных метастазами органов, n (%) |
|||||
|
1 орган |
5 |
22,7 |
5 |
20,8 |
р = 0,876 |
|
2 и более |
17 |
77,3 |
19 |
79,2 |
|
|
Локализация отдаленных метастазов, n (%) |
|||||
|
Кости |
8 |
36,4 |
14 |
58,3 |
р = 0,232 |
|
Печень |
16 |
72,7 |
12 |
50,0 |
р = 0,202 |
|
Легкие и плевра |
11 |
50,0 |
15 |
62,5 |
р = 0,578 |
|
Лимфатические узлы |
8 |
36,4 |
8 |
33,3 |
р = 0,925 |
|
Мягкие ткани |
2 |
9,1 |
1 |
4,2 |
р = 0,600 |
|
Прочие органы |
2 |
9,1 |
3 |
12,5 |
р = 1,000 |
|
Предшествующая терапия по поводу РМЖ, n (%) |
|||||
|
Какая-либо терапия в анамнезе |
9 |
40,9 |
16 |
66,7 |
р = 0,146 |
|
Адьювантная химиотерапия |
5 |
22,7 |
9 |
37,5 |
р = 0,346 |
|
Неоадьювантная химиотерапия |
4 |
18,2 |
2 |
8,3 |
р = 0,405 |
|
Лучевая терапия |
9 |
40,9 |
11 |
45,8 |
р = 0,969 |
|
Хирургическое лечение |
8 |
36,4 |
14 |
58,3 |
р = 0,232 |
Анализ безопасности
После проведения 1 курса терапии комбинацией трастузумаба и паклитаксела среди НЯ наиболее часто возникала гематологическая ток- сичность, миалгия, артралгия. Статистически значимых различий между группами не было выявлено ни по одному из нежелательных явлений.
Нейтропения 3–4 степени после проведения 1 курса терапии зафиксирована у 4/22
Собственные исследования
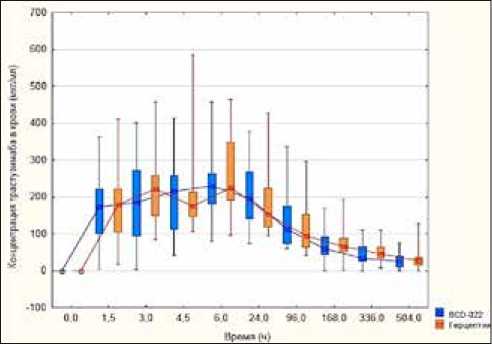
Рисунок 1. Динамика концентраций трастузумаба в двух группах от момента введения препаратов до 504 часов (представлены медианы с интерквантильными размахами и максимумы и минимумы) (n = 38)
Таблица 2. Статистическое сравнение групп с использованием 90% ДИ AUC0–504 и Сmах
|
Показатель |
90% ДИ |
Требуемый диапазон для 90% ДИ |
|
AUC0–504 |
80,42–120,87% |
80–125% |
|
Сmах |
83,69–123,05% |
80–125% |
Таблица 3. Расчетные фармакокинетические показатели в двух группах исследования
|
Группа |
||||
|
Параметр |
BCD-022 (n = 19) |
Герцептин® (n = 19) |
Значение р |
|
|
AUC0–504 (мкг/мл) •ч |
медиана [верх. и ниж. квартили] |
31579,0 [26833,0; 54769,0] |
39472,0 [28590,0; 46175,0] |
р = 0,885 |
|
КВ,% |
38,6 |
39,0 |
||
|
Cmax (мкг/мл) |
среднее ± СО |
291,0 ± 78,0 |
298,0 ± 117,0 |
р = 0,885 |
|
КВ,% |
26,6 |
39,4 |
||
|
T1/2 (ч) |
среднее ± СО |
103,0 ± 26,0 |
113,0 ± 25,0 |
р = 0,854 |
|
КВ,% |
25,5 |
22,3 |
||
|
Tmax (ч) |
медиана [верх. и ниж. квартили] |
5,0 [3,0; 6,0] |
5,0 [3,0; 6,0] |
р = 1,000 |
|
КВ,% |
181,0 |
96,3 |
||
|
Kel (ч-1) |
медиана [верх. и ниж. квартили] |
0,006392 [0,005715; 0,007579] |
0,006149 [0,005317; 0,007196] |
р = 0,452 |
|
КВ,% |
49,0 |
26,0 |
||
|
Cl (мл/ (ч•кг)) |
среднее ± СО |
15,0 ± 6,0 |
17,0± 7,0 |
р = 0,263 |
|
КВ,% |
37,8 |
64,4 |
||
|
Vd (мл/кг) |
среднее ± СО |
2213,0±1087,0 |
2836,0 ±1407,0 |
р = 0,284 |
|
КВ,% |
49,13 |
49,59 |
||
Результаты международного многоцентрового двойного слепого рандомизированного клинического исследования первой фазы препарата bcd-022 по сравнению с препаратом Герцептин®, применяемых в сочетании с паклитакселом у больных метастатическим раком молочной железы с гиперэкспрессией her2
(18,2%) и 9/24 (37,5%) больных в группе препаратов BCD-022 и Герцептин®, соответственно. Другие гематологические осложнения 3–4 степени выявлены не были. Анемия 1–2 степени зарегистрирована у 9/22 (40,9%) и у 10/24 (41,7%) пациентов в группе BCD-022 и Герцептин®, соответственно. Тромбоцитопения 1 степени выявлена у 2/24 (8,3%) больных в группе Герцептин®. Все зарегистрированные отклонения биохимических показателей относились к 1–2 степени тяжести по СТСАЕ 4.03. Повышение уровня ферментов АСТ, АЛТ, ЩФ несколько чаще отмечалось в группе препарата Герцептин® без статистически и клинически значимой разницы между группами. Артралгия 1–2 степени зарегистрирована у 2/22 (9,1%) и 3/24 (12,5%) пациентов в группах препаратов BCD-022 и Герцептин®, соответственно. Миалгия 1–2 степени зафиксирована у 2/22 (9,1%) и 3/24 (12,5%) больных в группе BCD-022 и Герцептин®, соответственно. Под-
робные данные о НЯ изученного режима представлены в таблице 4.
Таким образом, большинство зарегистрированных нежелательных явлений имели легкую и умеренную степень по СТСАЕ 4.03 и были обусловлены проведением мие-лосупрессивной химиотерапии (паклитаксел 175 мг/м2). Статистически значимых различий между группами не было выявлено ни по одному из нежелательных явлений. Кроме того, все зарегистрированные в рамках настоящего исследования нежелательные явления являлись ожидаемыми, поскольку наблюдались в проводившихся ранее клинических исследованиях, с применением аналогичной схемы химиотерапии с трастузумабом [5, 7].
Данные по клинической безопасности биоаналога трастузумаба BCD-022 при многократном применении, включая сведения об иммуногенности, будут проанализированы в рамках исследования III фазы.
Таблица 4. Характеристики основных НЯ в обеих группах исследования
|
Показатель |
Группа |
Значение p |
|||
|
BCD-022 (n = 22) |
Герцептин® (n = 24) |
||||
|
n |
% |
n |
% |
||
|
Гематологическая токсичность |
|||||
|
Анемия 1–2 ст. |
9 |
40,9 |
10 |
41,7 |
р = 0,804 |
|
Тромбоцитопения 1 ст. |
0 |
0,0 |
2 |
8,3 |
р = 0,490 |
|
Нейтропения |
|||||
|
любой ст. |
12 |
54,5 |
15 |
62,5 |
р = 0,804 |
|
3–4 ст. |
4 |
18,2 |
9 |
37,5 |
р = 0,197 |
|
Негематологическая токсичность |
|||||
|
Повышение АСТ 1–2 ст. |
10 |
45,5 |
12 |
50,0 |
р = 0,990 |
|
Повышение АЛТ 1–2 ст. |
8 |
36,4 |
12 |
50,0 |
р = 0,526 |
|
Повышение ЩФ 1–2 ст. |
9 |
40,9 |
13 |
54,2 |
р = 0,546 |
|
Миалгия 1–2 ст. |
2 |
9,1 |
3 |
12,5 |
р = 1,000 |
|
Артралгия 1–2 ст. |
2 |
9,1 |
3 |
12,5 |
р = 1,000 |
|
Стоматит 1 ст. |
0 |
0,0 |
1 |
4,2 |
р = 1,000 |
|
Тошнота 1 ст. |
2 |
9,1 |
0 |
0,0 |
р = 0,223 |
|
Рвота 2 ст. |
1 |
4,5 |
0 |
0,0 |
р = 0,478 |
Собственные исследования
Заключение
Исследуемый препарат BCD-022 (трастузумаб, ЗАО «БИОКАД», Россия) по своему профилю безопасности и фармакокинетическим
свойствам полностью соответствует оригинальному препарату трастузумаба Герцептин® (Ф. Хоффманн-Ля Рош Лтд, Швейцария) и может быть рекомендован для дальнейшего клинического изучения.
Список литературы Результаты международного многоцентрового двойного слепого рандомизированного клинического исследования i фазы препарата bcd-022 по сравнению с препаратом герцептин®, применяемых в сочетании с паклитакселом у больных метастатическим раком молочной железы с гиперэкспрессией HER2
- Давыдов М. И. Статистика злокачественных новообразований в России и странах СНГ в 2009 г./М. И. Давыдов, Е. М. Аксель//Вестник Российского онкологического научного центра имени Н. Н. Блохина РАМН.-2011.-T. 22, № 3.-С. 9-142
- Переводчикова Н. И. Молекулярная классификация и возможности индивидуализации терапии рака молочной железы/Н. И. Переводчикова, М. Б. Стенина//Лекарственная терапия рака молочной железы.-2014.-гл. 1.-С. 41-45
- Baselga, J. The epidermal growth factor receptor as a target for therapy in breast carcinoma/J. Baselga, J. Mendelsohn//Breast Cancer Res Treat.-1994.-29, № 1.-P. 127-138
- Joensuu, H. FinHer Study Investigators: Adjuvant docetaxel or vinorelbine with or without trastuzumab for breast cancer./H. Joensuu, P. L. Kellokumpu-Lehtinen, P. Bono//N Engl J Med.-2006.-354.-P. 809-820
- Piccart-Gebhart, M. J. Herceptin Adjuvant (HERA) Trial Study Team: Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer./M. J. Piccart-Gebhart, M. Procter, B. Leyland-Jones//N Engl J Med..-2005.-353.-P. 1659-1672
- Romond, E. H. Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer./E. H. Romond, E. A. Perez, J. Bryant//N Engl J Med.-2005.-353.-P. 1673-1684
- Slamon, D. J. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2/D. J. Slamon, B. Leyland-Jones, S. Shak//N Engl J Med.-2001.-344.-P. 783-92
- EMA. Guideline on similar biological medicinal products containing monoclonal antibodies (CHMP/BMWP/403543/2010)
- EMA. Revision of the Guideline on Similar Biological Medicinal Products Containing Biotechnology-Derived Proteins as Active Substance: Non-Clinical and Clinical Issues (Draft); EMA: London, UK, 2013; EMEA/CHMP/BMWP/42832/2005 Rev. 1
- Guideline on the investigation of bioequivalence (CHMP/EWP/QWP/1401/98)


