Результаты многокомпонентного лечения пациентов с прогрессированием первичных глиом головного мозга
Автор: Сарычева М.М., Важенин А.В., Доможирова А.С.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 1 т.22, 2023 года.
Бесплатный доступ
Цель исследования - определение наиболее эффективного подхода к лечению пациентов с продолженным ростом глиом головного мозга. Материал и методы. В исследование включено 200 пациентов с прогрессированием первичных глиом головного мозга, которым в период с 2001 по 2021 г. проведено лечение на базе ГАУЗ «ЧОКЦО и ЯМ». Средний возраст - 47,86 ± 11,47 года. Соотношение мужчин и женщин - 1:1. В 125 случаях диагностирован продолженный рост глиом высокой степени злокачественности, у 40 больных отмечено прогрессирование глиом низкой степени злокачественности, у 35 пациентов зафиксирована трансформация глиом низкой степени злокачественности в высокозлокачественные глиомы. Реоперация была проведена у 92 пациентов. Повторная лучевая терапия выполнена 140 пациентам. У 60 пациентов методом выбора явилась химиотерапия. Результаты. Медиана общей выживаемости (ОВ) составила 36 мес, показатели 1-летней ОВ - 96,0 %; 2-летней - 59,4 %. Метод-специфическая общая выживаемость - 15 мес. Отмечена тенденция к увеличению показателей ОВ у повторно прооперированных больных во всех подгруппах. При оценке влияния вида лучевой терапии наиболее высокие показатели метод-специфической ОВ отмечены при проведении стереотаксической лучевой терапии (СТЛТ) и сочетанной фотонно-нейтронной терапии (СФНТ) - 23 и 47 мес (р>0,05) - в подгруппе глиом высокой степени злокачественности 60 и 72 мес соответственно - у больных с продолженным ростом глиом головного мозга низкой степени злокачественности (р>0,05). У пациентов с трансформацией низкозлокачественных глиом в высокозлокачественные метод-специфическая ОВ была выше при проведении химиолучевой терапии по сравнению с пациентами, которые получили химиотерапию или лучевую терапию в самостоятельном варианте - 32, 12 и 24 мес соответственно (p>0,05). Заключение. Оптимальным подходом к лечению больных с продолженным ростом первичных глиальных опухолей головного мозга является повторная операция. Методом выбора при повторном курсе лучевой терапии могут быть СФНТ или СТЛТ. Лечение пациентов с трансформацией глиом низкой степени злокачественности в высокозлокачественные глиомы должно включать повторные курсы химиолучевой терапии.
Нейроонкология, рецидивные опухоли головного мозга, глиома, нейтронная лучевая терапия
Короткий адрес: https://sciup.org/140297834
IDR: 140297834 | УДК: 616.831-006.484-08-037 | DOI: 10.21294/1814-4861-2023-22-1-110-118
Текст научной статьи Результаты многокомпонентного лечения пациентов с прогрессированием первичных глиом головного мозга
Согласно гистологической классификации опухолей ВОЗ 2016 г. и ее пересмотру 2021 г., все глиальные опухоли головного мозга делятся на высоко- и низкозлокачественные [1]. Для высокозлокачественных глиом (ВЗГ) характерно агрессивное течение с высоким риском локального рецидива, предопределяющим неблагоприятный прогноз [2]. Низкозлокачественные глиомы (НЗГ), напротив, развиваются более медленно и, как правило, имеют относительно благоприятный прогноз. Однако в течение 5 лет после лечения они также рецидивируют в 70–75 % случаев [3]. Лечение рецидивирующих глиальных опухолей разной степени злокачественности остается сложной задачей, учитывая относительную неэффективность существующих методов и отсутствие рандомизированных исследований, на которых построилась бы базисная терапия. Так, согласно рекомендациям американской национальной онкологической сети, для лечения прогрессирующих злокачественных и
низкозлокачественных глиом могут применяться те же методы, что и при первичных опухолях: операция, химиотерапия и лучевая терапия [4].
Проспективные рандомизированные исследования, непосредственно оценивающие эффект повторной операции при прогрессировании первичных глиом головного мозга, в литературе не представлены. Имеющиеся на эту тему публикации в подавляющем большинстве приводят доказательства преимущества данного подхода. По мнению их авторов, повторное хирургическое вмешательство достоверно улучшает результаты лечения [5]. Не до конца определена роль химиотерапевтического компонента в лечении прогрессирующих глиом головного мозга. При лечении прогрессирования первичных НЗГ головного мозга используется всего 2 схемы с доказанной эффективностью – монохимиотерапия темозоломидом и комбинация планиносодержащих препаратов и винкристина [6]. Препаратами выбора для лечения прогрессирования первичных ВЗГ головного мозга
являются темозоломид, бевацизумаб, карбоплатин, прокабазин, винкристин, ломустин. Однако их эффективность также не очень высока [7, 8].
Среди наиболее часто используемых методов лечения глиом головного мозга – лучевая терапия, хотя мнения специалистов об эффективности повторного облучения противоречивы. Сообщается о достижении клинического эффекта в 9–80 % и объективного ответа – в 22–80 % наблюдений. Такой разброс в данных может быть обусловлен тем обстоятельством, что большая часть рецидивов (90–95 %) локализуется в поле облучения, в пределах 95 % изодозы, и в этой связи очевидно, что повторное стандартное облучение не всегда эффективно [9].
Возможности повторного облучения продолженного роста глиом головного мозга удалось расширить за счет современных технологий, обеспечивающих точное подведение высоких доз к ограниченной мишени, таких как брахитерапия и стереотаксичеcкая лучевая терапия. Другим направлением, позволяющим преодолеть радиорезистентность рецидивных опухолей, является применение лучевых технологий с большей биологической эффективностью, чем у фотонного излучения. Речь идет о разновидностях адронной терапии – протонной и нейтронной. Стереотаксическая лучевая терапия (СТЛТ) за счет высокого градиента дозы на границе с окружающими тканями имеет несомненные преимущества при повторном облучении. По данным литературы, медиана общей выживаемости у пациентов с прогрессированием первичных глиом головного мозга после СТЛТ колеблется от 10 до 26 мес, но недостатком метода являются ограничение по объему поражения и высокий риск возможного развития радионекроза [10]. В последние годы расширяется применение протонной терапии в лечении пациентов с продолженным ростом глиом головного мозга. По данным A.M. Saeed et al., медиана общей выживаемости (ОВ) после повторного облучения составляет 14,2 мес, но имеется высокий риск развития поздних токсических эффектов, таких как
радиационно-индуцированный некроз [11].
Также в лечении пациентов с рецидивами злокачественных глиом головного мозга применяется еще одна разновидность адронной терапии – нейтронная терапия, которая менее популярна в силу физических и технических проблем ее реализации. Вместе с тем, опыт применения нейтронов и результаты завершенных исследований свидетельствуют об их высокой эффективности в определенных клинических ситуациях, в частности при облучении местнораспространенных и рецидивных опухолей с высоким уровнем гипоксии, определяющим высокую радиорезистентность данных процессов [12–14]. Однако практически нет публикаций, посвященных влиянию нейтронной терапии на результаты лечения пациентов с прогрессированием первичных глиом головного мозга.
Целью исследования явилось определение наиболее эффективного подхода к лечению больных с продолженным ростом глиом головного мозга.
Материал и методы
В данное исследование вошли результаты лечения 200 пациентов с подтвержденным по данным гистологического заключения, МРТ-перфузии или ПЭТ-КТ с метионином прогрессированием глиальных опухолей головного мозга, находившихся на стационарном лечении в 2001–21 гг. в Челябинском областном центре онкологии и ядерной медицины. Средний возраст пациентов составил 47,8 ± 11,4 года. Соотношение мужчин и женщин было практически равным. Повторно прооперированы 92 (46 %) пациента. Ретроспективно все больные разделены на следующие группы:
‒ группа 1 – 125 (62,5 %) пациентов с прогрессированием высокозлокачественных глиом головного мозга;
‒ группа 2 – 40 (20 %) больных с прогрессированием глиом низкой степени злокачественности;
‒ группа 3 – 35 (17,5 %) пациентов с трансформацией глиом низкой степени злокачественности в ВЗГ на этапе процедива.
После подтверждения прогрессирования гли-
Òàблицà 1/Table 1
Õàðàêтåðиñтиêà пàциåнтîв иññлåдóåмыõ гðóпп
Characteristics of patients in the study groups
Нейтронная лучевая терапия проведена 43 больным, из них 15 – в самостоятельном варианте, 3 пациентам к нейтронной терапии добавлена химиотерапия темозоломидом, 25 больным проведен курс сочетанной фотонно-нейтронной терапии (СФНТ). Нейтронная терапия выполнялась в центре нейтронной терапии г. Снежинска нейтронным пучком (12 MВ) в режиме мультифракционирования с разовой очаговой дозой 0,3 Гр 2 раза в день, с интервалом между фракциями не менее 3 ч, до подведения суммарной очаговой дозы 2,4 Гр. Вклад нейтронного облучения в суммарную дозу нейтронно-фотонной терапии в среднем составлял 20–25 %.
Дистанционная лучевая терапия 50 пациентам выполнялась на линейных ускорителях Elekta Synergy, Varian Unique, Varian Clinac с разовой очаговой дозой 2 Гр на визуализируемые по данным МРТ (МРТ-перфузии) рецидивные опухолевые очаги размерами более 3 см, с отступом не менее 1–1,5 см, с подведением суммарной очаговой дозы 30–40 Гр (с учетом остаточной дозы от предыдущего курса лучевой терапии), до суммарной кумулятивной дозы, не превышающей 100 изоГр. Самостоятельный вариант дистанционной лучевой терапии получили 24 пациента, в 26 случаях к нему была добавлена монохимиотерапия темозоломидом.
Химиотерапия назначалась в самостоятельном варианте (n=61) или в дополнение к лучевому лечению (n=45). В последнем случае основными препаратами были темозоломид – в дозе 200 мг/м2, 1–5-й день, каждые 28 дней, 6–9 циклов (n=45) ‒ и комбинация препаратов по схеме бевоцезумаб в сочетании с иринотеканом в стандартных дозах (n=16).
Для определения оптимальной тактики лечения мы разделили пациентов каждой группы на 3 подгруппы: с проведением химиотерапии, с повторным курсом лучевой терапии, с сочетанием лучевого и химиотерапевтического методов лечения.
Статистическая обработка данных производилась при помощи пакетов прикладных программ IBM SPSS Statistics Version 20 (IBM, USA). Основными критериями оценки эффективности терапии при лечении пациентов с прогрессирова- нием первичных глиальных опухолей головного мозга были показатели 1-, 2-, 3- и 5-летней общей выживаемости (время от момента начала лечения до смерти от любой причины), рассчитанные по методу Каплана–Майера. Также с учетом того, что срок наступления прогрессирования после первичного лечения варьировал от 3 до 110 мес (медиана – 31 мес), проанализирована метод-специфическая ОВ. На наш взгляд, она также свидетельствует об эффективности проводимого лечения при прогрессировании опухолей мозга. Результаты по всем применяемым методам считались статистически значимыми при p<0,05.
Результаты и обсуждение
Медиана ОВ для всех пациентов с продолженным ростом глиом головного мозга после лечения составила 60 мес (95 % ДИ=49,2–70,8), 1-летняя ОВ – 97,0 %; 2-летняя – 74,1 %; 3-летняя – 63,7 % (рис. 1). Медиана ОВ после лечения рецидива для всех пациентов составила 24 мес (95 % ДИ=17,1–30,1).
Несмотря на то, что все пациенты имели только глиомы головного мозга, показатели выживаемости, прогноз и ответ на лечение отличались в зависимости от уровня злокачественности опухоли. В связи с этим анализ показателей выживаемости был проведен отдельно для группы прогрессировавших глиом высокой и низкой степени злокачественности, а также для подгруппы пациентов с трансформацией в высокозлокачественный вариант. Медиана ОВ пациентов с прогрессированием глиом высокой степени злокачественности составила 36 мес, 1-летняя ОВ – 96,0 %; 2-летняя ОВ –
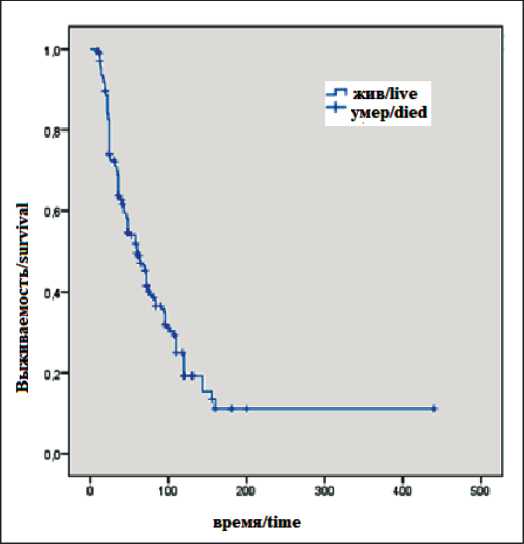
Рис. 1. Общая выживаемость пациентов с прогрессированием глиальных опухолей головного мозга, мес
Fig. 1. Overall survival of patients with glioma progression, months
Таблица 2/table 2
Выживаемость пациентов с прогрессированием ВЗГ головного мозга в зависимости от варианта лечения
survival rates in patients with progression of high-grade glioma according to treatment option
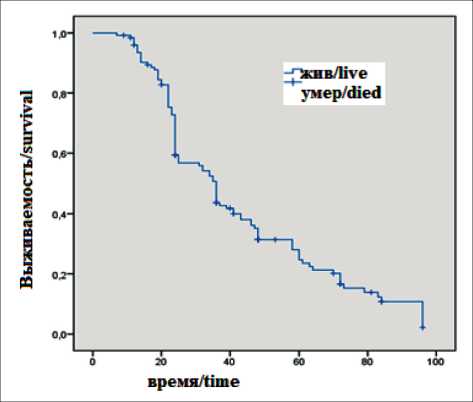
Рис. 2. Показатели общей выживаемости у пациентов с прогрессированием первичных высокозлокачественных глиом головного мозга, мес
Fig. 2. Overall survival rates in patients with progression of primary high-grade glioma, months
59,4 %, 3-летняя ОВ – 46,1 %, 5-летняя ОВ – 31,3 %. Метод-специфическая ОВ – 15 мес (рис. 2).
Анализируя результаты лечения с учетом выбранного варианта терапии, мы не выявили значимых различий (р=0,79), но отметили, что наибольшие показатели метод-специфической выживаемости были в подгруппе больных, получивших лучевую терапию, – 47 мес, а именно при сочетанном курсе СФНТ. При химиолучевом лечении наиболее эффективным оказалась СТЛТ с последующей монохимиотерапией темозоломидом – 23 мес. При оценке эффективности химиотерапевтического компонента отмечено незначительное преимущество, без значимых различий при назначении темозоломида в монорежиме в сравнении со схемой бевацизумаб + иринотекан – 17 и 12 мес (р=0,87) (табл. 2).
Показатель ОВ у пациентов с прогрессированием глиом головного мозга низкой степени злокачественности, как и ожидалось, был значительно выше – 130 мес, 1-летняя ОВ – 97,4 %; 5-летняя – 80,3 %. Метод-специфическая ОВ – 60 мес (рис. 3). Анализ показателей метод-специфической выживаемости у больных с прогрессированием НЗГ головного мозга, как и в случае с ВЗГ, продемонстрировал,
Таблица 3/table 3
Выживаемость пациентов с прогрессированием первичных НЗГ головного мозга в зависимости от варианта лечения survival rates in patients with progression of primary low-grade glioma according to treatment option
Анализируя результаты лечения больных с трансформацией НЗГ головного мозга в высокозлокачественные глиомы, установили, что метод-специфическая ОВ у данных больных была значительно ниже – 32 мес, ОВ – 98 мес (рис. 4). Одним из важных моментов нашей работы стало определение дальнейшей тактики лечения пациентов с трансформацией. Основной вопрос, возникший у нас: «Необходимо ли проводить курсы химиотерапии темозоломидом, рекомендованные для больных с прогрессированием глиом низкой степени злокачественности, или лечение должно быть более агрессивным и предусматривать
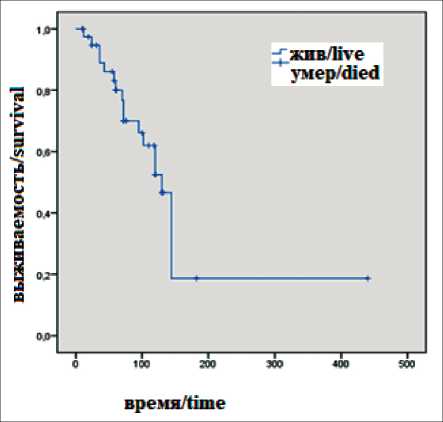
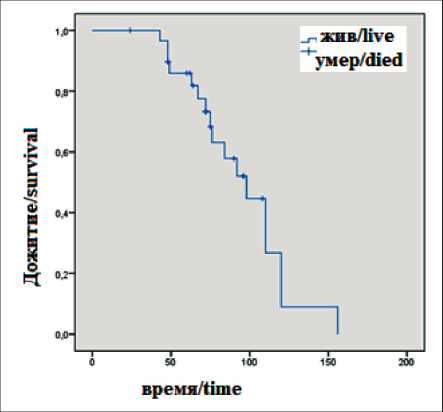
Рис. 4. Показатели общей выживаемости у пациентов с трансформацией глиом низкой степени злокачественности в высокозлокачественные глиомы, мес
Fig. 4. Overall survival rates in patients with transformation of low-grade glioma into high-grade gliomas, months
Рис. 3. Показатели общей выживаемости у пациентов с прогрессированием низкозлокачественных глиом головного мозга, мес
Fig. 3. Overall survival rates in patients with progression of low-grade brain glioma, months
Таблица 4/table 4
Показатели выживаемости у пациентов с трансформацией глиом низкой степени злокачественности в высокозлокачественные глиомы в зависимости от варианта лечения survival rates in patients with the transformation of low-grade glioma to high-grade glioma according to treatment option
|
Вариант лечения/ |
1-летняя ОВ/ 1 year OS |
3-летняя ОВ/ 3 year OS |
5-летняя ОВ/ 5 year OS |
Метод-специфическая ОВ (ОВ без прогрессии)/ Method-specific OS (OS without progression) |
|
|
Treatment |
|||||
|
Химиотерапия/ Chemotherapy (n=8) |
Темозоломид/ Temozolomide (n=8) |
98,9 % |
85,7 % |
68,6 % |
12 мес/months |
|
Лучевая терапия/ Radiation therapy (n=10) |
Дистанционная лучевая терапия/ External beam radiation therapy (n=10) |
92,3 % |
86.4 % |
64,0 % |
24 мес/months |
|
Химиолучевая |
Дистанционная лучевая терапия + химиотерапия/ External radiation therapy + chemotherapy (n=13) |
99,5 % |
91,3 % |
87,5 % |
32 мес/months |
|
терапия/ Chemoradiotherapy (n=17) |
Сочетанная фотоннонейтронная лучевая терапия + химиотерапия/ Combined photon-neutron radiation therapy + chemotherapy (n=4) |
100 % |
89,3 % |
50,3 % |
38 мес/months |
Список литературы Результаты многокомпонентного лечения пациентов с прогрессированием первичных глиом головного мозга
- Louis D.N., Perry A., Wesseling P., Brat D.J., Cree I.A., Figarella- Branger D., Hawkins C., Ng H.K., Pfister S.M., Reifenberger G., Soffietti R., von Deimling A., Ellison D.W. The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol. 2021; 23(8): 1231-51. https://doi.org/10.1093/neuonc/noab106.
- Salvati M., Bruzzaniti P., Relucenti M., Nizzola M., Familiari P., Giugliano M., Scafa A.K., Galletta S., Li X., Chen R., Barbaranelli C., Frati A., Santoro A. Retrospective and Randomized Analysis of Influence and Correlation of Clinical and Molecular Prognostic Factors in a Mono- Operative Series of 122 Patients with Glioblastoma Treated with STR or GTR. Brain Sci. 2020; 10(2): 91. https://doi.org/10.3390/brainsci10020091.
- Tom M.C., Park D.Y.J., Yang K., Leyrer C.M., Wei W., Jia X., Varra V., Yu J.S., Chao S.T., Balagamwala E.H., Suh J.H., Vogelbaum M.A., Barnett G.H., Prayson R.A., Stevens G.H.J., Peereboom D.M., Ahluwalia M.S., Murphy E.S. Malignant Transformation of Molecularly Classified Adult Low-Grade Glioma. Int J Radiat Oncol Biol Phys. 2019; 105(5): 1106-12. https://doi.org/10.1016/j.ijrobp.2019.08.025.
- Wen P.Y., Weller M., Lee E.Q., Alexander B.M., Barnholtz-Sloan J.S., Barthel F.P., Batchelor T.T., Bindra R.S., Chang S.M., Chiocca E.A., Cloughesy T.F., DeGroot J.F., Galanis E., Gilbert M.R., Hegi M.E., Horbinski C., Huang R.Y., Lassman A.B., Le Rhun E., Lim M., Mehta M.P., Mellinghoff I.K., Minniti G., Nathanson D., Platten M., Preusser M., Roth P., Sanson M., Schiff D., Short S.C., Taphoorn M.J.B., Tonn J.C., Tsang J., Verhaak R.G.W., von Deimling A., Wick W., Zadeh G., Reardon D.A., Aldape K.D., van den Bent M.J. Glioblastoma in adults: a Society for Neuro-Oncology (SNO) and European Society of Neuro-Oncology (EANO) consensus review on current management and future directions. Neuro Oncol. 2020; 22(8): 1073-1113. https://doi.org/10.1093/neuonc/noaa106.
- Zhao Y.H., Wang Z.F., Pan Z.Y., Péus D., Delgado-Fernandez J., Pallud J., Li Z.Q. A Meta-Analysis of Survival Outcomes Following Reoperation in Recurrent Glioblastoma: Time to Consider the Timing of Reoperation. Front Neurol. 2019; 10: 286. https://doi.org/10.3389/fneur.2019.00286.
- Nahed B.V., Redjal N., Brat D.J., Chi A.S., Oh K., Batchelor T.T., Ryken T.C., Kalkanis S.N., Olson J.J. Management of patients with recurrence of diffuse low grade glioma: A systematic review and evidence-based clinical practice guideline. J Neurooncol. 2015; 125(3): 609-30. https://doi.org/10.1007/s11060-015-1910-2.
- Wick W., Gorlia T., Bendszus M., Taphoorn M., Sahm F., Harting I., Brandes A.A., Taal W., Domont J., Idbaih A., Campone M., Clement P.M., Stupp R., Fabbro M., Le Rhun E., Dubois F., Weller M., von Deimling A., Golfinopoulos V., Bromberg J.C., Platten M., Klein M., van den Bent M.J. Lomustine and Bevacizumab in Progressive Glioblastoma. N Engl J Med. 2017; 377(20): 1954-63. https://doi.org/10.1056/NEJMoa1707358.
- Wei W., Chen X., Ma X., Wang D., Guo Z. The efficacy and safety of various dose-dense regimens of temozolomide for recurrent high-grade glioma: a systematic review with meta-analysis. J Neurooncol. 2015; 125(2): 339-49. https://doi.org/10.1007/s11060-015-1920-0.
- Buglione M., Pedretti S., Poliani P.L., Liserre R., Gipponi S., Spena G., Borghetti P., Pegurri L., Saiani F., Spiazzi L., Tesini G., Uccelli C., Triggiani L., Magrini S.M. Pattern of relapse of glioblastoma multiforme treated with radical radio-chemotherapy: Could a margin reduction be proposed? J Neurooncol. 2016; 128(2): 303-12. https://doi.org/10.1007/s11060-016-2112-2.
- Morris S.L., Zhu P., Rao M., Martir M., Zhu J.J., Hsu S., Bal- lester L.Y., Day A.L., Tandon N., Kim D.H., Shepard S., Blanco A., Esquenazi Y. Gamma Knife Stereotactic Radiosurgery in Combination with Bevacizumab for Recurrent Glioblastoma. World Neurosurg. 2019; 127: 523-33. https://doi.org/10.1016/j.wneu.2019.03.193.
- Saeed A.M., Khairnar R., Sharma A.M., Larson G.L., Tsai H.K., Wang C.J., Halasz L.M., Chinnaiyan P., Vargas C.E., Mishra M.V. Clinical Outcomes in Patients with Recurrent Glioblastoma Treated with Proton Beam Therapy Reirradiation: Analysis of the Multi-Institutional Proton Collaborative Group Registry. Adv Radiat Oncol. 2020; 5(5): 978-83. https://doi.org/10.1016/j.adro.2020.03.022.
- Musabaeva L.I., Choinzonov E.L., Gribova O.V., Startseva Zh.A., Velikaya V.V., Lisin V.A. Neitronnaya terapiya v lechenii radiorezistentnykh zlokachestvennykh novoobrazovanii. Sibirskii onkologicheskii zhurnal. 2016; 15(3): 67-71. https://doi.org/10.21294/1814-4861-2016-15-3-67-71.
- Musabaeva L.I., Golovkov V.M. Terapiya bystrymi neitronami v onkologii. Sibirskii onkologicheskii zhurnal. 2015; 1(2): 88-94.
- Kandakova E.Yu., Vazhenin A.V., Kuznetsova A.I., Vazhenin I.A., Pan'shin G.A., Tsallagova Z.S. Rezul'taty sochetannoi fotonno- neitronnoi terapii v usloviyakh eskalatsii dozy neitronov v obshchem kurse sochetannoi fotonno-neitronnoi terapii. Vestnik nauchnogo tsentra Rentgenoradiologii. 2014(14).


