Результаты обследования и лечения пациентов с коксовертебральным синдромом
Автор: Каргальцев А.А., Макаров М.А., Макаров С.А., Лила А.М.
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Оригинальное исследование
Статья в выпуске: 4 (54), 2023 года.
Бесплатный доступ
Введение. Сочетание поражения тазобедренного сустава и поясничного отдела позвоночника (коксовертебральный синдром, КВС) часто приводит к неэффективности хирургического лечения вследствие несовершенства диагностических алгоритмов - до 20-24% пациентов не отмечают улучшения самочувствия после проведнного тотального эндопротезирования тазобедренного сустава или декомпрессии стеноза поясничного отдела позвоночника.Цель исследования: оптимизация диагностики и улучшение результатов лечения пациентов с сочетанной патологией тазобедренного сустава и поясничного отдела позвоночника.Материалы и методы. В исследование было включено сто пациентов с сочетанным поражением тазобедренного сустава и поясничного отдела позвоночника, у которых были затруднения в выборе тактики лечения. Больным проводились инъекции в тазобедренный сустав под УЗ-навигацией (ропивокаин 0,75% - 3,0 мл). Пациенты были разделены на основную (55 пациентов) и контрольную (45 пациентов) группы. В основной группе дополнительно проводилась игольчатая электронейромиография (иЭНМГ) для оценки денервации мышц нижних конечностей и поясничного отдела позвоночника (ПОП). По результатам обследования пациентам проводилось оперативное лечение в виде декомпрессии стеноза ПОП и тотального эндопротезирование тазобедренного сустава (ЭПТБС). Динамика состояния оценивалась по шкалам Освестри, Харрис и ВАШ.
Остеоартрит, электронейромиография, стеноз поясничного отдела позвоночника, коксовертебральный синдром
Короткий адрес: https://sciup.org/142240733
IDR: 142240733 | УДК: 617.3 | DOI: 10.17238/2226-2016-2023-4-36-42
Текст научной статьи Результаты обследования и лечения пациентов с коксовертебральным синдромом
THE DEPARTMENT OF TRAUMATOLOGY AND ORTHOPEDICS
Наличие у пациентов коморбидных заболеваний требует от врача знаний смежных дисциплин, так как ошибки диагностики напрямую приводят к неудовлетворенности пациентов результатами лечения. Одной из таких мультидисциплинар-ных проблем является коксовертебральный синдром (КВС, hip-spine синдром в зарубежной литературе) – сочетание одновременного поражения тазобедренного сустава в виде остеоартрита и патологии поясничного отдела позвоночника в виде стеноза/спондилолистеза [1]. По одной лишь клинической картине и локализации жалоб у таких пациентов не всегда удается однозначно определить как источник боли, так и необходимый объем хирургического лечения [2, 3]. Согласно данным отечественных и зарубежных авторов, около 24% больных не отмечают как положительной динамики, так и улучшения походки после нейрохирургической декомпрессии стеноза [4]; при этом до 25% пациентов после проведенного хирургического лечения тазобедренного сустава (тотальное эндопротезирование) не отмечают регресса симптоматики [5, 6, 7].
Целью нашего исследования являлось совершенствование диагностики и улучшение результатов лечения пациентов с КВС.
Материалы и методы
Для достижения поставленной цели нами было обследовано 100 пациентов с сочетанием остеоартрита тазобедренного сустава и дегенеративного стеноза поясничного отдела позвоночника, у которых имелись диагностические трудности в определении ведущего источника боли.
В исследование включались пациенты, достигшие 18-летнего возраста, имеющие рентгенологически подтвержденные признаки остеоартрита тазобедренного сустава 2-й стадии и выше по классификации Kellgren-Lawrence, стеноз поясничного отдела позвоночника, подтвержденный результатами МРТ и с наличием жалоб, характерных для КВС без возможности определить ведущий источник боли при осмотре. Критериями исключения были пациенты с когнитивными нарушениями и с нейропатической болью вне зависимости от ее генеза.
Все пациенты были подразделены на две группы методом случайных чисел. В исследуемую группу вошло 55 больных, в контрольную – 45, нормальность распределения была проверена с помощью теста Колмогорова-Смирнова.
Всем пациентам проводилось клиническое обследование с осмотром, оценкой жалоб, ортопедического и неврологического статусов, проводились лабораторные исследования – клинический и биохимический анализы крови, коагулограмма, лучевые методы обследования – рентгенография тазобедренного сустава, магнитно-резонансная томография поясничного отдела позвоночника. Пациентам исследуемой группы так же проводилась игольчатая миография.
Лабораторная диагностика проводилась в рамках предоперационного обследования для исключения противопоказаний к хирургическим вмешательствам и оценке интраоперационных рисков.
Уровень боли оценивался по визуально-аналоговой шкале (ВАШ) от 0 до 100 мм, где за 0 принималось отсутствие боли, а за 100 мм – нестерпимая боль. Оценка функции тазобедренного сустава проводилась по шкале Харрис (Harris Hip Score) от 0 до 100 баллов со следующей интерпретацией: 69 баллов и менее свидетельствовало о неудовлетворительной функции тазобедренного сустава или о неудовлетворительных результатах эндопротезирования сустава, 70-79 – об удовлетворительной функции, 80-89 – о хорошей, при наборе от 90 до 100 баллов функция сустава или результаты эндопротезирования считались отличными.
Оценка нарушения жизнедеятельности из-за патологии поясничного отдела позвоночника проводилась по шкале Освестри, итоговый результат выражался в процентах от 0 до 100. При интерпретации полученных результатов минимально выраженному нарушению соответствовали показатели в 0-20%, умеренному нарушению – в 21-40%, тяжелому нарушению жизнедеятельности из-за патологии поясничного отдела позвоночника – в 41-60%, очень выраженное нарушение с ограничениями в мобильности выражалось в 61-80%, а значения от 81 до 100% соответствовали крайне тяжелой патологии (лежачий пациент), либо симуляции (преувеличении) симптомов пациентом. Эти шкалы использовались нами как для оценки состояния пациентов при первичном осмотре, так и для оценки динамики состояния через 3 месяца после проведенной операции.
Средние значения по шкалам для основной и контрольной групп представлены в табл. 1.
Таблица 1
Средние показатели шкал в основной и контрольных группах до хирургического лечения
|
Показатель |
Среднее значение, основная группа (n=55) |
Среднее значение, группа контроля (n=45) |
p |
|
Уровень боли по ВАШ, мм |
76,4±8,0 |
76,5±10,0 |
>0.05 |
|
Шкала Харрис, баллы |
51,9±7,5 |
53,4±8,5 |
>0.05 |
|
Шкала Освестри, % |
44,4±7,1 |
44,0±8,1 |
>0.05 |
Игольчатая миография выполнялась на аппаратах Keypoint Clinical System (Medtronic, США) и Нейро МВП-4 (Нейрософт,
Россия) методом введения в мышцы одноразового стерильного игольчатого электрода. Исследовались потенциалы двигательных единиц (ПДЕ) мышц нижних конечностей (четырехглавая, икроножная, передняя большеберцовая, длинная малоберцовая) и паравертебральных мышц, иннервирующихся с уровня стеноза, согласно данным МРТ/КТ, и ниже. Для исключения генерализованного нервно-мышечного поражения также проводилось исследование паравертебральных мышц грудного отдела позвоночника на уровне Т6 и – если было необходимо – мышц верхних конечностей. Наличие спонтанной активности (в виде потенциалов фибрилляций и потенциалов острых волн) являлось признаком денервации в мышцах.
Введение местного анестетика в тазобедренный сустава проводилось под ультразвуковым контролем. В качестве анестетика был выбран ропивокаин 0,75%, вводилось 3,0 мл. Через 30 минут после введения оценивался болевой синдром по ВАШ.
Полученные результаты
В основной группе пациентам были выполнены как внутрисуставное введение раствора ропивокаина 0,75% - 3,0 мл в тазобедренный сустава с использованием ультразвуковой навигации, так и игольчатая электронейромиография мышц нижних конечностей и паравертебральных мышц.
В зависимости от полученных результатов нами было сформировано 4 подгруппы пациентов.
В подгруппу 1.1 вошло 22 пациента со снижением уровня боли после внутрисуставной инъекции и отсутствием спонтанной активности по результатам миографии. Всем пациентам из этой группы в последующем было проведено тотальное эндопротезирование тазобедренного сустава. При оценке результатов через 3 месяца отмечена статистически значимое улучшение исследуемых показателей (табл. 2).
Таблица 2
Динамика показателей в группе 1.1, n=22
|
Показатель |
Перед операцией |
Через 3 месяца после |
р |
|
Уровень боли по ВАШ, мм |
77,7±9,2 |
2,7±4,3 |
<0,05 |
|
Шкала Харрис, баллы |
55±10,2 |
91,8±3,5 |
<0,05 |
|
Шкала Освестри, % |
43±6,9 |
4,6±2,7 |
<0,05 |
Подгруппу 1.2 составили пациенты с положительным эффектом от введения анестетика в тазобедренный сустав и с наличием денервации по данным миографии. Пациентам из этой группы была проведена нейрохирургическая декомпрессия стеноза, а затем, в связи с неполным регрессом жалоб, через 6 месяцев после первого вмешательства вторым этапом было выполнено тотальное эндопротезирование тазобедренного сустава. После каждого хирургического вмешательства оценивалось субъективное и объективное состояние пациентов (табл.3).
Таблица 3
Динамика показателей в группе 1.2, n=9
|
Показатель |
Перед операцией |
Нейрохирургическое вмешательство, через 3 месяца |
ЭПТБС, через 3 месяца |
P |
|
Уровень боли по ВАШ, мм |
80,0±7,0 |
35,6±5,3 |
1,6 |
<0,05 |
|
Шкала Харрис, баллы |
50,1±8,9 |
68,2±3,9 |
90,2±1,9 |
<0,05 |
|
Шкала Осве-стри, % |
52,2±6,9 |
23,1±2,9 |
2,6±2,6 |
<0,05 |
В подгруппу 1.3 вошли 14 пациентов, у которых не было отмечено снижения боли после введения анестетика в полость сустава, а по данным игольчатой миографии зарегистрировалась спонтанная активность в паравертебральных мышцах и мышцах нижних конечностей. Всем пациентам данной группы была проведена нейрохирургическая декомпрессия стеноза поясничного отдела позвоночника с выраженной положительной динамикой после вмешательства в виде регресса жалоб и улучшения (табл. 4).
Таблица 4
Динамика показателей в группе 1.3, n=14
|
Показатель |
Перед операцией |
Через 3 месяца после |
p |
|
Уровень боли по ВАШ, мм |
80,7±8,3 |
6,4±4,6 |
<0,05 |
|
Шкала Харрис, баллы |
52,8±7,0 |
88,6±4,2 |
<0,05 |
|
Шкала Освестри, % |
46,0±6,2 |
2,14±1,8 |
<0,05 |
Подгруппу 1.4 составили 10 пациентов с генерализованными изменениями во всех обследованных мышцах, в том числе в мышцах грудного отдела позвоночника и верхних конечностей). С учетом полученных результатов пациентам было рекомендовано дальнейшее обследование и лечение у специалистов-неврологов.
Пациентам контрольной группы в тазобедренный сустав так же проводилась инъекция, вводился раствор ропивокаина 0,75% - 3,0 мл. Как и в контрольной группе, оценке болевого синдрома проводилась через 30 минут. По результатам больные были нами разделены на 2 подгруппы.
В подгруппу К1 вошло 29 пациентов, у которые болевой синдром после инъекции снизился на 40 и более мм. Всем пациентам этой группы нами было выполнено тотальное эндопротезирование тазобедренного сустава, ближайшие результаты оценивались через 3 месяца (табл. 5). У шести больных из этой подгруппы не было отмечено существенного положительного эффекта от проведенной хирургической операци, нарушение функции сустава и поясничного отдела позвоночника, а так же болевой синдром у них сохранялся (табл. 6).
Таблица 5
Динамика показателей в группе К1, n=29
|
Показатель |
Перед операцией |
Через 3 месяца после |
p |
|
Уровень боли по ВАШ, мм |
77,2±7,5 |
13,9±25,8 |
<0,05 |
|
Шкала Харрис, баллы |
50,6±7,5 |
85,9±9,9 |
<0,05 |
|
Шкала Освестри, % |
44,7±7,5 |
7,2±9,8 |
<0,05 |
Таблица 6
Послеоперационные показатели у пациентов в группе К1, n=29
|
Показатель |
Хороший результат, N=23 |
Низкий эффект, N=6 |
p |
|
Уровень боли по ВАШ, мм |
1,1±2,1 |
63,3±5,2 |
<0,05 |
|
Шкала Харрис, баллы |
90,7±2,7 |
67,7±4,8 |
<0,05 |
|
Шкала Освестри, % |
2,6±2,3 |
25,2±5,8 |
<0,05 |
Таблица 7
Динамика показателей в группе К2, n=16
|
Показатель |
До операции |
3 мес |
p |
|
Уровень боли по ВАШ, мм |
77,2±7,5 |
12,5±22,2 |
<0,05 |
|
Шкала Харрис, баллы |
50,6±7,5 |
87,1±10,2 |
<0,05 |
|
Шкала Освестри, % |
44,7±7,5 |
5,3±8,4 |
<0,05 |
Таблица 8
Послеоперационные показатели у пациентов в группе К2, n=16
|
Показатель |
Хороший результат, N=13 |
Низкий эффект, N=3 |
p |
|
Уровень боли по ВАШ, мм |
2,3±3,3 |
56,7±5,8 |
<0,05 |
|
Шкала Харрис, баллы |
91,6±2,9 |
67,3±2,1 |
<0,05 |
|
Шкала Освестри, % |
1,4±1,5 |
22,0±2,0 |
<0,05 |
В подгруппу К2 было включено 16 пациентов, не отметивших снижения боли после внутрисуставного введения ропивокаина в тазобедренный сустав. Всем пациентам была выполнена декомпрессия поясничного отдела позвоночника с оценкой результатов через 3 месяца (табл.7). Эффекта от проведенного лечения не отмечали 3 пациента (табл.8).
Обсуждение полученных результатов.
Проблема диагностики КВС достаточно широко освещается в научной литературе [3, 5, 7-10]. Основная проблема заключается в том, что выявленные на рентгенограммах изменения в тазобедренном суставе, равно как и наличие стеноза или спондилолистеза по данным МРТ поясничного отдела позвоночника, не свидетельствуют однозначно о вкладе этих патологий в развитие боли у этих пациентов.
Метод игольчатой миографии широко зарекомендовал себя в качестве основного инструментального обследования для подтверждения наличия патологии периферических нервов, в том числе при дегенеративном стенозе ПОП [11, 12]. Так, он является важным при дифференциальной диагностике рентгенологического и симптоматического стеноза [13, 14], однако у пациентов с коксовертебральным синдромом его не применяли.
При обследовании пациентов основной группы использование игольчатой миографии, наряду с внутрисуставными инъекциями, позволило более точно диагностировать источник боли и определить приоритеты в выборе тактики лечения. Так, больным, у которых не было выявлено изменений в мышцах по результатам игольчатой электромиографии, однако отмечалось снижение боли в тазобедренном суставе после введения анестетика, нами было рекомендовано хирургическое лечение тазобедренного сустава (тотальное эндопротезирование тазобедренного сустава), которое продемонстрировало хороший результат. Пациентам, у которых по результатам игольчатой электромиографии, в мышцах нижних конечностей были выявлены денервационные изменения, рекомендовалось выполнение нейрохирургического вмешательства в первую очередь. Если же в результате внутрисуставных инъекций отмечалось снижение боль, то в таким пациентам вторым этапом было проведено хирургическое лечение тазобедренного сустава (тотальное эндопротезирование). Таким образом, опираясь на результаты игольчатой электромиографии мы могли сформулировать гипотезу о наличии стеноза, а по результатам внутрисуставной инъекции – о наличии боли из-за патологии тазобедренного сустава.
Наличие пациентов с генерализованными изменениями в мышцах среди больных с КВС (10 из 55) в литературе мы не встретили, хотя одновременное поражение и тазобедренного сустава, и поясничного отдела может быть связано со слабостью мышц-стабилизаторов из-за неврологической патологии [15]. Выявление таких больных очень важно для понимания патогенеза сочетанного поражения смежных и механически нагруженных структур опорно-двигательного аппарата и для определения тактики лечения. Проведение хирургических вмешательств у таких пациентов может быть ассоциировано с неудовлетворительными отдаленными результатами вследствие неврологического дефицита, не связанного с патологией поясничного отдела позвоночника.
Результаты проведенного лечения пациентов контрольной группы были неудовлетворительны у 9 из 45 пациентов, болевой синдром сохранялся высоким (выше 50 мм по ВАШ). Полученные нами результаты соответствуют описанным в литературе – до 20-25% пациентов, выбор операции которых основывался только на результатах инъекции с введением анестетика в сустав, не отметили положительной динамики после проведенного хирургического лечения.
По результатам проведенного исследования мы сформулировали алгоритм обследования пациентов с коксовертебральным синдромом (рис. 1). В случае наличия денервациионных признаков по данным игольчатой миографии рекомендовано проводить нейрохирургическое лечение. Если одновременно с этим у пациента отмечается выраженное снижение боли (на 40 мм по ВАШ и более), то таким пациентам вторым этапом рекомендуется проведение хирургического лечения тазобедренного сустава (тотальное эндопротезирование). При отсутствии денервации и снижении боли по результатам внутрисуставной инъекции показано проведение тотального эндопротезирования тазобедренного сустава, в случае же генерализованного поражения мышц по данным игольчатой электронейромиографии, пациентам рекомендуется дообследование у неврологов.
Пациент с коксовертебральным синдромом *
Внутрисуставное введение / анестетика в тазобедренный . / сустав \
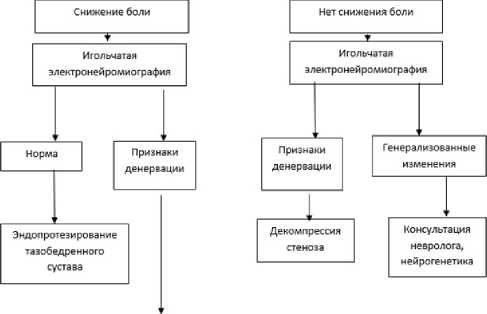
Декомпрессия стеноза, затем эндопротезирование тазобедренного сустава
Рисунок 1. Обследование и выбор тактики лечения у больных с коксовертебральным синдромом.
Список литературы Результаты обследования и лечения пациентов с коксовертебральным синдромом
- Offierski CM, MacNab I. Hip‐spine syndrome. Spine 8(3): 316, 1983. DOI: 10.1097/00007632-198304000-00014
- Alexander Zimmerer, Manuela Hoffmann, Andre Hofer et al. Hip-spine syndrome-current developments and state of the evidence. Orthopade. 2020 Oct;49(10):841-848. DOI: 10.1007/s00132-020-03972-y
- А. Лычагин, Г. Кавалерский, Я. Рукин, П. Петров, С. Демин, В. Черепанов. Эндопротезирование тазобедренного сустава при сопутствующей патологии позвоночника // Врач. 2017, 5, 16-19 // A. Lychagin, G. Kavalersky, Ya. Rukin, P. Petrov; S. Demin; V. Cherepanov. HIP ARTHROPLASTY FOR CONCOMITANT SPINAL PATHOLOGY. Vrach 2017, 5, 16-19.
- Rodkey DL, Alexander E Lundy, Robert W Tracey, Melvin D Helgeson. Hip-Spine Syndrome: Which Surgery First? Clin Spine Surg. 2022 Feb 1;35(1):1-3. DOI: 10.1097/BSD.0000000000001028
- Кирпичев И. В., М. Н. Кирпикова Внесуставной болевой синдром после первичного протезирования тазобедренного сустава. Клиницист 2016, 1, Т10, 17-21 // Kirpichev IV, Kirpikova MN. Changes in extra-articular pain in patients after primary hip replacement. The Clinician 2016, 1, V10, Р.17-21. DOI: 10.17650/1818-8338-2016-10-1-17-21.
- Hicks GE, Sions JM, Velasco TO. Hip Symptoms, Physical Performance, and Health Status in Older Adults With Chronic Low Back Pain: A Preliminary Investigation. Arch Phys Med Rehabil. 2018 Jul;99(7):1273-1278. DOI: 10.1016/j.apmr.2017.10.006
- Г.М. КАВАЛЕРСКИЙ, А.Л. КОРКУНОВ, А.В. ЛЫЧАГИН, А.П. СЕРЕДА, В.Г. ЧЕРЕПАНОВ. Тактика хирургического лечения дегенеративно-дистрофических поражений пояснично-крестцового отдела позвоночника при HIP-SPINE-синдроме. Хирургия. Журнал имени Н.И. Пирогова. 2014, 5, С. 54-59 // G.M. KAVALERSKIY, A.L. KORKUNOV, A.V. LYCHAGIN, A.P. SEREDA, V.G. CHEREPANOV. Tactics of surgical treatment of degenerative-dystrophic lesions of the lumbosacral spine in case of HIP-SPINE-syndrome. Pirogov Russian Journal of Surgery 2014, 5, Р. 54-59
- Jauregui Julio J., M.D. et al., Does Co-Existing Lumbar Spinal Canal Stenosis Impair Functional Outcomes and Activity Levels after Primary Total Hip Arthroplasty? The Journal of Arthroplasty 30 (2015) 1569–1573. DOI: 10.1016/j.arth.2015.03.017
- Eneqvist T. et al., Lumbar surgery prior to total hip arthroplasty is associated with worse patient reported outcomes, Bone Joint J 2017;99-B:759–65. DOI: 10.1302/0301-620X.99B6.BJJ-2016-0577.R2
- Eneqvist T, Bülow E, Nemes S et al. Patients with a previous total hip replacement experience less reduction of back pain following lumbar back surgery. J Orthop Res. 2018 Sep;36(9):2484-2490. DOI: 10.1302/0301-620X.99B6.BJJ-2016-0577.R2
- Haig Andrew J, Karen S J Yamakawa, Christopher Parres, Anthony Chiodo, Henry Tong. A prospective, masked 18-month minimum follow-up on neurophysiologic changes in persons with spinal stenosis, low back pain, and no symptoms. PM R. 2009 Feb;1(2):127-36. DOI: 10.1016/j.pmrj.2008.10.007
- Chang MC, Park D.Healthcare (Basel). Findings of Electrodiagnostic Studies in Moderate to Severe Lumbar Central Spinal Stenosis-Electrodiagnostic Studies in Lumbar Central Spinal Stenosis. 2021 Feb 3;9(2):164. DOI: 10.3390/healthcare9020164
- Lee Jung Hwan, Sang Ho Lee. Physical examination, magnetic resonance imaging, and electrodiagnostic study of patients with lumbosacral disc herniation or spinal stenosis. J Rehabil Med 2012; 44: 845–850. DOI: 10.2340/16501977-1034
- Sonoo M. Electrodiagnosis of Lumbar Spine Disorders and Cauda Equina Syndrome. Brain Nerve. 2021 Jun;73(6):715-724. DOI: 10.11477/mf.1416201821.
- Larson Scott T, Jason Wilbur. Muscle Weakness in Adults: Evaluation and Differential Diagnosis. Am Fam Physician. 2020 Jan 15;101(2):95-108


