Результаты патоморфологического анализа стенки мочевого пузыря при интерстициальном цистите или синдроме болезненного мочевого пузыря в эксперименте
Автор: Шолан Рашад Фархад Оглы
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 4 т.28, 2020 года.
Бесплатный доступ
Этиология и патогенез синдрома болезненного мочевого пузыря или интерстициального цистита не до конца выяснена. Для лучшего понимания патогенеза заболевания созданы его экспериментальные модели на животных. Предполагается, что гистопатологические особенности воспалительной реакции стенки мочевого пузыря могут играть важную роль в прогнозирующем моделировании симптомов интерстициального цистита. Установлено, что в образцах препаратов мочевого пузыря при интерстициальном цистите наблюдается увеличение количества функционально активных тучных клеток, как частично, так и полностью дегранулированных. Однако убедительные доказательства того, что тучные клетки могут служить клеточными маркерами этого заболевания отсутствуют. Цель исследования - идентификация клеток воспаления в гистологических препаратах слизистой оболочки мочевого пузыря в 3-х экспериментальных моделях интерстициального цистита. Исследование проведено на 37 кроликах-самках. Экспериментальным животным вводили в полость мочевого пузыря протамин сульфат (1-я группа); в стенку мочевого пузыря мочу, взятую из мочевого пузыря (2-я группа); в стенку мочевого пузыря 0,9% раствор NaCl (3-я группа). 4-я группа животных была интактной. Через 14 дней после моделирования животных выводили из эксперимента, производили цистэктомию, готовили препараты стенки мочевого пузыря и гистологические срезы. Среднее число всех типов лейкоцитов в тканях стенки мочевого пузыря животных 1-й группы превышало таковое в остальных группах (р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Мочевой пузырь, воспаление, интерстициальный цистит, синдром болезненного мочевого пузыря, экспериментальные модели, тучные клетки
Короткий адрес: https://sciup.org/143177451
IDR: 143177451 | DOI: 10.20340/mv-mn.2020.28(4)441
Текст научной статьи Результаты патоморфологического анализа стенки мочевого пузыря при интерстициальном цистите или синдроме болезненного мочевого пузыря в эксперименте
Шолан Р.Ф. Результаты патоморфологического анализа стенки мочевого пузыря при интерстициальном цистите или синдроме болезненного мочевого пузыря в эксперименте// Морфологические ведомости.- 2020.- Том 28.- № 4.- С. 55-60. (4):441
Sholan RF. The results of a patomorphological analysis of the bladder wall at the interstitial cystitis or painful bladder syndrome in an experiment. Morfologicheskie Vedomosti – Morphological Newsletter. 2020;28(4):55-60. (4):441
Введение . Интерстициальный цистит (далее – ИЦ) или синдром болезненного мочевого пузыря является распространенным расстройством, которое по различным данным встречается приблизительно в 16% случаев патологии мочевыводящих путей [1-3]. Поскольку ИЦ диагностируется при отсутствии бактериальной инфекции или явной патологии, этиология его симптомов остается неизвестной. Предполагают, что гистопатологические особенности мочевого пузыря могут играть важную роль в прогнозирующем моделировании симптомов ИЦ [4]. Для лучшего понимания его патогенеза были созданы модели животных c ИЦ [5]. За последние несколько десятилетий были разработано около 20 моделей ИЦ на животных [6-7]. Большинство моделей животных были получены путем инъекции химических токсинов или стимуляторов в мочевой пузырь или путем системного введения химических агентов, вирусов или антигенов, которые вызывают воспаление мочевого пузыря [5]. Сообщается, что невозможно эффективно охарактеризовать ИЦ у людей с использованием только одной модели, в связи с этим исследование проводится на моделях, которые широко отражают симптоматику и этиопатогенез заболевания у пациентов [5, 7]. В нескольких сообщениях указывалось, что в образцах мочевого пузыря с ИЦ наблюдается увеличение количества инфильтрирующих функционально активных тучных клеток, как частично, так и полностью дегранулированных [8-9]. Увеличение числа и активация тучных клеток в мочевом пузыре позволило предположить, что количество тучных клеток в слизистой оболочке является одним из основных показателей, связанных с патогенезом ИЦ. Однако, для подтверждения правильности использования тучных клеток в качестве патоморфологического клеточного маркера этого заболевания необходимо проведение соответствующих исследований.
Цель исследования: идентифицировать клеточный состав слизистой оболочки мочевого пузыря в различных экспериментальных моделях интерстициального цистита.
Материалы и методы исследования. Для моделирования использованы 37 белых новозеландских кроликов-самок массой 1500-2000 г. При содержании животных и проведении экспериментальных исследований соблюдались правила по уходу и использованию лабораторных животных (NIH Guide for the Care and Use of Laboratory Animals) [10]. Для получения моделей ИЦ в мочевой пузырь вводили различные раздражители, на основании чего животных разделили на 4 группы. Животным 1-й экспериментальной группы (n=7) в полость мочевого пузыря вводили протамин сульфат. Животным 2-й экспериментальной группы (n=15) вводили в стенку мочевого пузыря мочу, взятую из мочевого пузыря животного [11]. Животным 3-й экспериментальной группы (n=7) вводили в стенку мочевого пузыря 0,9% раствор NaCl. 4-я группа животных (n=8) была интактной. Известно, что воздействием протамина сульфата и мочой ИЦ у кроликов может быть индуцирован на 14 день [12-13]. Через 14 дней животных выводили из эксперимента передозировкой пентобарбитала в дозе 200 мг/кг, после чего посредством трансабдоминальной диссекции производили цистэктомию. Извлеченный мочевой пузырь фиксировали в 10%-ном буфере нейтрального раствора формалина в течение суток. На следующий день образец исследовали макроскопически. Фрагмент стенки мочевого пузыря был взят вблизи места инъекции. Из него готовили поперечные срезы стенки толщиной 0,30,4 см, что позволяло захватить все ее слои. Из полученных срезов стандартным методом готовили гистологические препараты. Срезы толщиной 3-5 микрон окрашивали гематоксилин-эозином, для выявления тучных клеток использовали метод Май-Грюнвальда-Гимзы [12]. В полученных гистологических препаратах были проанализированы 10 полей зрения при большом увеличении и подсчитаны нейтрофилы, эозинофилы и тучные клетки. Инфильтрацию клеток оценивали в каждом из этих участков с помощью следующей критериальной шкалы: 0 - нет экстраваскулярных лейкоцитов и тучных клеток; 1 - менее 20 лейкоцитов и тучных клеток; 2 - 20-45 лейкоцитов и тучных клеток; 3 - более 45 лейкоцитов и тучных клеток. Баллы всех 10 полей зрения складывали, делили на 30 (максимально возможный балл) и умножали на 100. Баллы по лейкоцитам и тучным клеткам для каждого мочевого пузыря были средними из 3-х исследованных срезов. Подсчет лейкоцитов и тучных клеток проводили при оптическом увеличении х200 [13]. Статистические данные представлены в виде M±o.
Результаты исследования и обсуждение . В тканях мочевого пузыря животных экспериментальных групп статистически значимый отличный от интактной группы уровень лейкоцитов выявлялся только у животных 1-й и 2-й групп (таблица 1).
Таблица 1
Среднее количество популяции лейкоцитов в группах исследования
|
Группы |
Тип клеток |
|||
|
Нейтрофилы |
Лимфоциты |
Эозинофилы |
Тучные клетки |
|
|
1 (n=7) |
23,857±5, 4592* / ** |
14,428±4,117* |
3,285±1,133* / ** |
0,571±1,133* |
|
2 (n=15) |
0,866±1,884* |
29,866±10,183* / ** |
0,333±0,899 |
14,200±5,796* / ** |
|
3 (n=7) |
1,428±2,699* |
2,285±3,728* |
0,142±0,377 |
0 |
|
4 (n=8) |
0 |
0,375±1,060 |
0,375±0,744 |
0 |
Примечание: * - статистическая значимость различий с контрольной (4) группой; ** - между группами исследования (0,001<р<0,05).
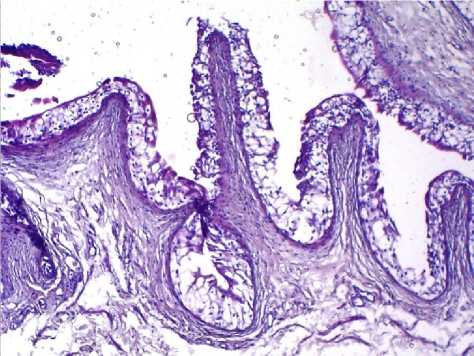
Рис. 1. Микрофото препарата стенки мочевого пузыря животных 4-й группы. Гистологическая картина интактной стенки. Окр.: гематоксилином-эозином.
Ув.: х100.
Среднее число всех типов лейкоцитов в 1-й группе статистически значимо превышало таковое в остальных группах (р<0,001). Тучные клетки определялись лишь в 1-й и 2-й группах. При этом во 2-й группе их количество было в 24,9 раза выше, чем в 1-й группе (р<0,001). Морфологические исследования стенки мочевого пузыря контрольных животных выявили отсутствие патологических изменений (рис. 1). Проведенное гистологическое исследование выявило в стенке мочевого пузыря животных после инъекции протамин сульфата ее инфильтрирование лимфоцитами и нейтрофилами в области сосудов (рис. 2а, 2б). В микропрепаратах животных 2-й группы с моделью ИЦ, полученной путем введения мочи в стенку мочевого пузыря, определялись некроз, смешанная воспалительная клеточная инфильтрация (рис. 3а), а также тучные клетки (рис. 3б). В микропрепаратах модели ИЦ, созданной введением 0,9% раствора NaCl, определялись рассеянные лимфоциты и отек ткани (рис. 4). Обращает на себя внимание, что в препаратах стенки мочевого пузыря животных 2-й группы, воспалительная инфильтрация ассоциировалась с большим количеством тучных клеток, выявленном при подсчете. В гистологических препаратах 3-й группы животных наблюдается отек, что, возможно, отражает ответную реакцию на инъекцию. При этом воспалительной инфильтрации в препаратах не наблюдали, встречались лишь единичные клетки воспаления, что подтверждалось количественным подсчетом клеток (таблица 1).
Тучные клетки в настоящее время признаны регуляторными и эффекторными клетками как врожденного, так и адаптивного иммунитета [14]. Они выявляются при воспалении, увеличение их количества в тканевых биоптатах используется в качестве диагностического критерия для оценки ИЦ [12]. Их функции зависят от способности реагировать на самые разнообразные стимулы и секретировать биологически активные сек-
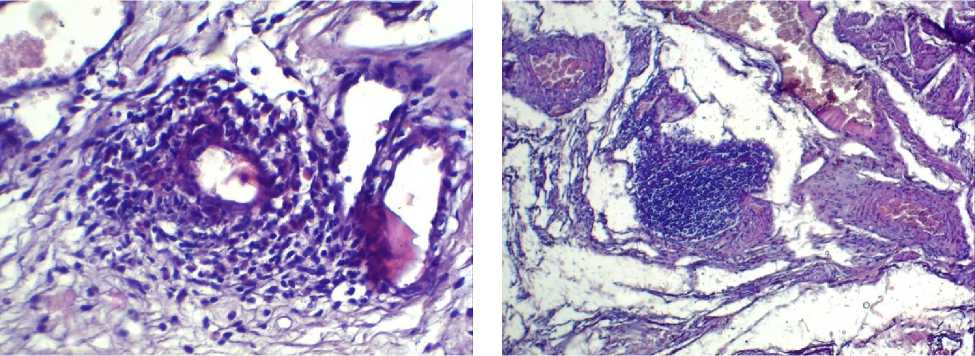
Рис. 2а . Микрофото препарата стенки мочевого пузыря животных 1-й группы. Инфильтрация лимфоцитами и нейтрофилами вокруг сосудов. Окр.: гематоксилином-эозином. Ув.: х100.
Рис. 2б. Микрофото препарата стенки мочевого пузыря животных 1-й группы. Инфильтрация лимфоцитами. Окр.: гематоксилином-эозином. Ув.: х100.
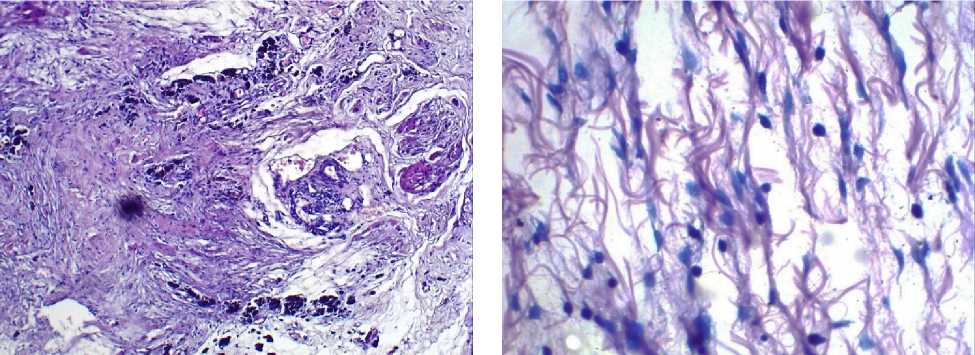
Рис. 3б. Микрофото препарата стенки мочевого пузыря животных 1-й группы. Инфильтрация тучными клетками. Окр.: по Май-Грюнвальду-Гимза. Ув.: х100.
Рис. 3а . Микрофото препарата стенки мочевого пузыря животных 1-й группы. Смешанная клеточная воспалительная инфильтрация. Окр.: гематоксилином-эозином. Ув.: х100.
реты с провоспалительными, противовоспалительными и(или) иммунодепрессивными свойства.
Тучные клетки играют также важную роль в аллергическом воспалении. Как клетки врожденного иммунитета, тучные клетки распознают микробные агенты (бактериальные, вирусные, паразитарные и грибковые) и эндогенные факторы, возникающие в результате повреждения клеток [14]. Вероятно, этим и объясняется отсутствие инфильтрации тучными клетками стенки мочевого пузыря животных 3-й и 4-й групп. В тоже время статистически значимое повышенное количество тучных клеток во 2-й группе может свидетельствовать о том, что при этом варианте моделирования повреждение слизистой оболочки мочевого пузыря более выражено и тучные клетки реагируют на это повреждение высокой степенью миграции в очаг воспаления. Универсальность функциональной активности тучных клеток свидетельствует о том, что они могут быть активированы различными механизмами.
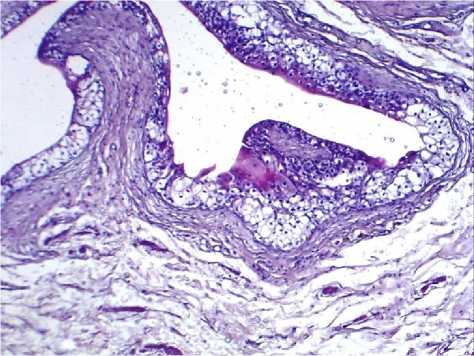
Рис. 4. Микрофото препарата стенки мочевого пузыря животных 3-й группы. Одиночные лимфоциты на фоне отека. Окр.: гематоксилином-эозином. Ув.: х100.
Считается, что тучные клетки играют важную роль в ИЦ, поскольку во многих случаях наблюдается увеличение их количества в мочевом пузыре [14]. Исследования на животных показали, что тучные клетки являются облигатными участниками развития воспаления мочевого пузыря и боли, наблюдаемой при ИЦ [3, 15].
Согласно полученным данным, число тучных клеток в ткани мочевого пузыря существенно увеличивалось под воздействием мочи. Возможно, это связано с тем, что основная функция мочевой системы заключается в выделении большого количества токсических веществ из организма. Мочевой пузырь играет важную роль, резервируя, удерживая и выделяя мочу. Конечные продукты обмена веществ и токсины выводятся вместе с мочой из организма. Воздействие этих веществ может привести к нарушениям функционирования мочевого пузыря [14, 16]. При введении мочи в слизистую оболочку мочевого пузыря путем инъекции, токсичные вещества из мочи, возможно, попадают в ткани [5]. Именно это и наблюдается в модели ИЦ, полученной путем введения в стенку мочевого пузыря мочи, взятой из мочевого пузыря животного.
В проведенном нами исследовании экспериментальные группы с введением в полость мочевого пузыря протамин сульфата, а также введением мочи, взятой из мочевого пузыря животного, в стенку мочевого пузыря показали высокий уровень ее инфильтрирования лимфоцитами и нейтрофилами. В тоже время во второй модели морфологическое исследование показало наличие в стенке мочевого пузыря инфильтратов тучных клеток, которые в свою очередь вызывали воспаление, о чем свидетельствовал развивающийся некроз в стенке мочевого пузыря животных этой группы. Полученные нами результаты сопоставимы с данными G.R. Sant et al. [15], которые считают, что пролиферация тучных клеток является основной особенностью аутоиммунной модели интерстициального цистита на лабораторных мышах.
Заключение . Таким образом, проведенное исследование показало повышение количества клеток воспаления в слизистой оболочке мочевого пузыря экспериментальных животных при моделировании интерстициального цистита, индуцированного воздействием протамина сульфат и вызванного введением мочи в стенку мочевого пузыря. Полученные данные могут быть полезны в изучении патогенетических механизмов воспалительных процессов при интерстициальном цистите.
Автор заявляет об отсутствии каких-либо конфликтов интересов при планировании, выполнении, финансировании и использовании результатов настоящего исследования.
Список литературы Результаты патоморфологического анализа стенки мочевого пузыря при интерстициальном цистите или синдроме болезненного мочевого пузыря в эксперименте
- McLennan MT. Interstitial cystitis: epidemiology, pathophysiology, and clinical presentation. Obstet. Gynecol. Clin. North Am. 2014;41:385-395. https://doi.org/10.1016/j.ogc.2014.05.004
- Mirkin YaB, Karapetyan AV, Shumov SYu. Interstitsial'nyy tsistit: diskussiya o patogeneze, diagnostike i lechenii. Chast' 1 - patogenez. Eksperimental'naya i klinicheskaya urologiya. 2017;4:96-100.
- Onopko VF, Kirilenko EA, Baranova EO, Golubeva VS. Interstitsial'nyy tsistit ili sindrom boleznennogo mochevogo puzyrya: sovremennyy vzglyad na problemu. Acta Biomedica Scientifica. 2016;1(1):65-69. https://doi.org/10.12737/21489
- Birder L, Andersson K-E. Animal Modelling of Interstitial Cystitis/Bladder Pain Syndrome. Int Neurourol J. 2018;22:3-59. https://doi.org/10.5213/inj.1835062.531
- Bjorling DE, Wang ZY, Bushman W. Models of inflammation of the lower urinary tract. Neurourol Urodyn. 2011;30:673-682. https://doi.org/10.1002/nau.21078
- Buffington T, Ruggieri MR, Klumpp D. Interstitial cystitis: Animal models. In Bladder Pain Syndrome - An Evolution. Springer International Publishing. 2017:33-36. https://doi.org/10.1007/978-3-319-61449-6_6
- Kwon W-A. Animal Model of Interstitial Cystitis/Bladder Pain Syndrome. Int Neurourol J. 2018;22:1-2. https://doi.org/10.5213/inj.1820edi.001
- Fang Z, Xu K. Interstitial Cystitis/Bladder Pain Syndrome: a Review and an Update. Current Bladder Dysfunction Reports. 2016;11(4):391-398. https://doi.org/10.1007/s11884-016-0387-y
- Liu H-T, Kuo H-C. Biomarkers for patients with interstitial cystitis/bladder pain syndrome. Urological Science. 2015;26(4):225-229. https://doi.org/10.1016/j.urols.2015.02.002
- National Research Council (US) Committee for the Update of the Guide for the Care and Use of Laboratory Animals. Guide for the Care and Use of Laboratory Animals. 8th edition. Washington (DC): National Academies Press (US). The National Academies Collection: Reports funded by National Institutes of Health. 2011:246. https://doi.org/10.17226/12910
- Sand PK. Proposed pathogenesis of painful bladder syndrome/interstitial cystitis. J Reprod Med. 2006;51(3):234-240.
- Mutsaddi S, Kotrashetti VS, Nayak RS, Pattanshetty SM. Comparison of histochemical staining techniques for detecting mast cells in oral lesions. Biotech Histochem. 2019;15:1-10. https://doi.org/10.1080/10520295.2019.1597986
- Bayrak O, Seckiner I, Solakhan M, Karakok M, Erturhan SM, Yagci F. Effects of intravesical dexpanthenol use on lipid peroxidation and bladder histology in a chemical cystitis animal model. Urology. 2012;79:1023-1026. https://doi.org/10.1016/j.urology.2012.01.025.
- Wang X, Liu W, O'Donnell M, Lutgendorf S, Bradley C, Schrepf A, Liu L, Kreder K, Luo Y. Evidence for the Role of Mast Cells in Cystitis-Associated Lower Urinary Tract Dysfunction: A Multidisciplinary Approach to the Study of Chronic Pelvic Pain Research Network Animal Model Study. PLoS One. 2016;11(12):e0168772. https://doi.org/10.1371/journal.pone.0168772
- Sant GR, Kempuraj D, Marchand JE, Theoharides TC. The Mast Cell in Interstitial Cystitis: Role in Pathophysiology and Pathogenesis. Urology. 2007;69(4A):34-40.
- Dahlin JS, Hallgren J. Mast cell progenitors: origin, development and migration to tissues. Mol. Immunol. 2015;63:9-17. https://doi.org/10.1016/j.molimm.2014.01.018


