Результаты предоперационного применения микронизированной очищенной флавоноидной фракции в составе схемы мультимодального обезболивания в хирургии аноректальной области: проспективное, рандомизированное, плацебо-контролируемое, двойное слепое исследование
Автор: Гарманова Т.Н., Маркарьян Д.Р., Казаченко Е.А., Ищенко Р.В., Лукьянов А.М., Кривоносова Д.А., Агапов М.А.
Журнал: Хирургическая практика @spractice
Рубрика: Хирургия
Статья в выпуске: 2 т.8, 2023 года.
Бесплатный доступ
Цель - оценить эффективность периоперационного применения микронизированной очищенной флавоноидной фракции (МОФФ) на выраженность боли в послеоперационном периоде у пациентов после оперативного лечения геморроидальной болезни.Материалы и методы. В клиническое проспективное исследование были включены пациенты, которым планировалось выполнение открытой геморроидэктомии. Все участники случайным образом были разделены на две группы: первая получала 1000 мг МОФФ за 15 дней до операции; в течение 7 дней после операции по схеме для лечения острого геморроя и далее по 1000 мг в сутки до 30 дня после операции, вторая группа - плацебо по указанной схеме. Главной конечной точкой являлась частота назначения наркотических обезболивающих в течение недели после операции.Результаты. В исследование было включено 182 пациента: в основной группе - 102, в контрольной - 82. Послеоперационный болевой синдром в покое и при дефекации был статистически значимо меньше в экспериментальной группе на 6-9-е дни после вмешательства (р ≤ 0,05). Прием опиоидов и других НПВС после операции не отличался в обеих группах (р = 0,717 и р = 0,564 соответственно). Показатели частоты побочных эффектов, времени от операции до возвращения к прежнему образу жизни не достигли значимой разницы между группами. Трудность при уходе за собой, тревога и беспокойство, наличие боли и дискомфорта, наличие остаточных жалоб были достоверно выше в контрольной группе.Заключение. Применение МОФФ в рамках периоперационной анальгезии является безопасным и эффективным в отношении снижения выраженности послеоперационного болевого синдрома в аноректальной хирургии. Применение МОФФ должно быть частью рутинного ведения пациентов в аноректальной хирургии в рамках мультимодальной анальгезии.
Микронизированная очищенная флаваноидная фракция (мофф), детралекс®, аноректальная хирургия, геморроидэктомия, операции на аноректальной области, диосмин, венотоники
Короткий адрес: https://sciup.org/142239967
IDR: 142239967 | УДК: 616.147.17-007.64 | DOI: 10.38181/2223-2427-2023-2-2
Текст научной статьи Результаты предоперационного применения микронизированной очищенной флавоноидной фракции в составе схемы мультимодального обезболивания в хирургии аноректальной области: проспективное, рандомизированное, плацебо-контролируемое, двойное слепое исследование
Доброкачественные заболевания аноректальной области — достаточно распространенная проблема во многих развитых странах [1]. Они не являются жизнеугрожающими и не влияют на продолжительность жизни, поэтому в настоящее время как пациенты, так и врачи крайне заинтересованы в безболезненном и минимально инвазивном лечении этих заболеваний. Тем не менее части пациентов требуется выполнение хирургического лечения с нарушением целостности слизистой анального канала и/или мышечного каркаса анального канала, например геморроидэктомии, послеоперационный период которой признан одним из самых болезненных. Это связано не только с выраженной послеоперационной болью, отеком, кровотечением, но и с длительным периодом восстановления и снижением качества жизни на несколько месяцев.
В патогенезе геморроидальной болезни большую роль играют как внешние факторы, такие как образ жизни, состояние здоровья и питание, так и внутренние, такие как наследственные причины и возрастные изменения [2]. При этом в последнее время помимо общеизвестных факторов риска венозной недостаточности стали выделять эндотелиальную дисфункцию и роль воспаления стенки сосудов [2]. Геморроидальные узлы представляют собой фиброваскулярную ткань с элементами гладкомышечных волокон. Сосудистый компонент узлов является артериовенозным шунтом между артериями и венами, кровоснабжающими нижнюю треть прямой кишки и анальный канал. При воздействии этиологических факторов фиброзный и мышечный компоненты растягиваются, кавернозная ткань узлов переполняется кровью [3].
Хроническое течение заболевания приводит к снижению тонуса, дилатации и пролапсу внутреннего геморроидального сплетения [3]. Это проявляется в виде отека, увеличения геморроидальных узлов и ощущения инородного тела в области ануса. Патогенез геморроидальной болезни включает в себя дегенерацию соединительной ткани, венозный стаз в геморроидальных сплетениях, миграцию и активацию клеток иммунной системы с последующим выделением воспалительных медиаторов, таких как простагландины и свободные радикалы, что приводит к асептическому воспалению. Именно воспаление — одна из причин болевого синдрома в послеоперационном периоде. Схожие изменения в анальном канале возникают после хирургического лечения, связанного с травмой слизистой анального канала или же сфинктерного аппарата.
В качестве лекарственных препаратов, воздействующих на патогенетические звенья геморроидальной болезни, применяют очищенную микронизированную флавоноидную фракцию (МОФФ).
МОФФ представляет собой микронизированный препарат семейства бензопиронов, состоящий на 90 % из диосмина и на 10 % из флавоноидов, таких как гесперидин (Арвенум 500 ® , Альвенор ® , Ардиум ® , Капивен ® , Дафлон ® 500 мг, Детралекс ® , Элатек ® , Флеботропин ® , Варитон ® , Венитол ® ). Микронизация — это хорошо зарекомендовавший себя метод, который позволяет повысить всасывание активных соединений из желудочно-кишечного тракта человека и достичь нужного эффекта за более короткий срок [4]. Значительный тонизирующий эффект для стенки вен достигается уже через час после применения 1000 мг препарата Дафлон ® (действующее вещество — МОФФ) и сохраняется от 4 до 24 часов в зависимости от способа введения [4—6].
Эта способность МОФФ позволяет снизить гиперпроницаемость капилляров до 83 % в экспериментальных условиях. По сравнению с другими флавоноидами МОФФ обладает выраженным противовоспалительным действием. При этом подавляется воспалительный процесс за счет снижения синтеза простагландинов (PG)E2, PGE2 и тромбоксана из макрофагов. Уровни свободных радикалов, высвобождаемых кислородом, образующихся во время воспалительной реакции, также снижаются. Чрезмерное образование этих про-воспалительных медиаторов способствует повреждению коллагена в базальной мембране сосудов и оболочке венул.
МОФФ также принимает участие в нормальной работе эндотелия сосудов. Применение Детралекса ® (действующее вещество — МОФФ) за 2 недели до выполнения склеротерапии способствует снижению уровня воспалительных маркеров, таких как СРБ, гистамин, интерлейкин-1, фактор некроза опухоли альфа, сосудистый эндотелиальный фактор роста в послеоперационном периоде [2; 7]. Также очищенная микронизированная флавоноидная фракция способна снижать маркеры воспаления при монотерапии хронической венозной недостаточности [8]. Таким образом, применение именно микронизированной фракции флавоноидов позволяет значительно уменьшить отек, снизить частоту и выраженность болевого синдрома у пациентов с геморроем.
В исследованиях фармакодинамического действия диосмина был показан его венотонический и защитный эффект в отношении сосудистой стенки: диосмин способствует снижению емкости вен и растяжимости сосудистой стенки. Такое действие достигается за счет увеличения длительности действия норэпинефрина на стенку сосудов [4—6]. Благодаря такому эффекту диосмин приводит к уменьшению частоты кровотечений в послеоперационном периоде и оказывает благоприятное влияние на другие симптомы. Кроме того, МОФФ увеличивает лимфатический дренаж и защищает микроциркуляторное русло от медиаторов воспаления, что также помогает уменьшению отека и боли.
Препарат обладает отличным профилем безопасности, что подтверждено как результатами исследований на животных, так и клиническими токсикологическими исследованиями.
Хирургические методы лечения, в частности открытая геморроидэктомия по Миллигану — Моргану как золотой стандарт лечения геморроидальной болезни III—IV степени, имеют достаточно высокую эффективность и низкую частоту рецидивов [9]. При этом практически любое оперативное вмешательство в зоне промежности связано с интенсивной послеоперационной болью, которая значительно снижает качество жизни в послеоперационном периоде и общую удовлетворенность пациентов лечением, увеличивает время пребывания в стационаре и потребление опиоидных анальгетиков [10; 11]. Еще одним серьезным послеоперационным осложнением является кровотече- ние, которое встречается примерно в 10 % случаев [12]. В исследовании [13] описывается достоверное снижение частоты кровотечений после геморроидэктомии при приме-22 нении МОФФ.
Мы предположили на основании данных о механизме действия МОФФ и клинической эффективности в отношении уменьшения послеоперационных осложнений у пациентов с варикозной болезнью нижних конечностей, что достаточно длительное до- (14 дней) и послеоперационное назначение данного препарата целесообразно при оперативном лечении заболеваний аноректальной области с целью уменьшения послеоперационного болевого синдрома и частоты послеоперационных осложнений. Данное исследование было создано для того, чтобы оценить, эффективно ли периоперационное назначение МОФФ в отношении снижения послеоперационного болевого синдрома и частоты осложнений у пациентов после операций на аноректальной области.
Цель
Оценить эффективность периоперационного применения флавоноидов (Детралекс ® , 1000 мг) перорально за 15 дней до и в течение 45 дней после хирургического вмешательства на аноректальной области в отношении снижения послеоперационного болевого синдрома, а также уменьшения частоты послеоперационных осложнений.
Методы
Дизайн исследования
Это проспективное, рандомизированное, двойное слепое одноцентровое исследование с двумя параллельными группами с соотношением распределения 1:1. Исследование проведено в хирургическом отделении Московского научно-образовательного центра МГУ им. М. В. Ломоносова с 25 ноября 2021 г. по 30 декабря 2022 г.
Критерии включения:
-
• Пациенты от 18 до 75 лет.
-
• Геморроидальная болезнь 2—4-й стадии.
-
• Наличие показаний к плановому оперативному лечению в объеме открытой геморро-идэктомии с использованием моно-или биполярной коагуляции с возможной комбинацией с другими малоинвазивными методами: геморроидопексией и мукопексией, геморроидэк-томией Ligasure.
-
• Отсутствие других заболеваний, вызывающих болевой синдром.
-
• I, II класс анестезиологического риска по классификации ASA.
-
• Добровольное подписание участником информированного согласия на проведение оперативного лечения и на участие в клиническом исследовании.
Критерии исключения пациентов
-
• Наличие следующих заболеваний: парапроктит, воспалительные заболевания кишечника, диабет и другие метаболические или эндокринные расстройства, алкоголизм, употребление наркотиков, нарушения свертывания крови, предшествующие заболевания на аноректальной области.
-
• Пациенты, имеющие противопоказания или техническую невозможность выполнения субарахноидальной анестезии.
-
• Пациенты, отказавшиеся от участия.
-
• Беременные женщины.
Письменное добровольное информированное согласие на участие в исследовании получено у всех пациентов до начала рандомизации.
Пациенты экспериментальной группы получали за 15 дней до операции 1000 мг Детра-лекса ® 1 раз в день, начиная с 1-х суток после операции — по 3000 мг в течение 4 дней, затем — 2000 мг в течение последующих 3 дней, затем по 1000 мг до 30-го дня после операции, а контрольной группы—таблетку, содержащую крахмал (плацебо).
Главные конечные точки
Главной конечной точкой была частота назначения опиоидных анальгетиков для недопущения повышения болевого синдрома выше 5 баллов по визуально-аналоговой шкале (ВАШ). В исследовании также оценивались следующие вторичные конечные точки: (1) выраженность болевого синдрома в покое и при дефекации, (2) частота приема других лекарственных препаратов в течение первой недели после операции, (3) частота повторных госпитализаций и (4) качество жизни на 7-й и 30-й дни, (5) время от операции до возвращения на работу и (6) частота осложнений (кровотечения, задержка мочи, инфекционные осложнения) в раннем послеоперационном периоде (в течение 30 дней после процедуры). Общее качество жизни оценивалось с помощью формы опросника пациента EQ-5D. Оценка уровня боли проводилась по визуально-аналоговой шкале (от 0 до 10 баллов, где 10 — максимальный балл). Исследователь, фиксирующий уровень боли, не принимал участие в формировании рандомизационной таблицы и не был информирован о том, к какой группе относился пациент.
Оперативный и послеоперационный этапы
Во время анестезии пациент находится в положении сидя. Игла вводится между промежутками L3 и L4 или между промежутками L4 и L5. Для спинномозговой анестезии использовался раствор бупивакаина 5 мг/мл. Никаких вспомогательных лекарственных средств для премедикации не применялось. Под спинномозговой анестезией пациента помещают в модифицированное литотомическое положение на спине с раздвинутыми ногами на опорах. Операционное поле трижды обрабатывают раствором антисептика. Далее выполняется соответствующее хирургическое вмешательство.
В послеоперационном периоде пациенту выдавался опросник и шкала для оценки болевого синдрома в покое и при дефекации в течение первых 2 недель после операции. В течение госпитализации медицинской сестрой заполнялся раздел по принимаемым препаратам, после выписки пациент заполнял этот раздел самостоятельно в течение 7 дней после хирургического вмешательства. По истечении 30 дней заполнялся раздел побочных эффектов, на 7-й и 30-й дни оценивалось качество жизни. Также пациенты указывали в отдельной графе, на какой день после операции они смогли полностью вернуться к прежнему образу жизни или полноценно выйти на работу.
В послеоперационном периоде пациентам проводилась анальгезия по схеме: 1000 мг ацетаминофена каждые 12 ч, 30 мг в/м кетопрофена каждые 8 ч. В случае неэффективности стандартной схемы обезболивания и появления на ее фоне выраженного болевого синдрома (6—10 баллов по ВАШ) пациентам проводилось введение 100 мг трамадола внутримышечно.
Все пациенты прошли контрольный мониторинг через 30 дней после операции для сбора послеоперационных данных, и при наличии каких-либо оставшихся симптомов или жалоб были приглашены для осмотра в клинику. Если пациент не приходил на прием, исследователь связывался с ним доступными средствами (телефон или электронная почта), чтобы уточнить все необходимые данные для исследования. Если исследователю не удавалось связаться с пациентом, то пациент считается потерянным для последующего наблюдения.
Хронология исследования
Хронологический план набора участников, хирургических вмешательств и оценки полученных результатов представлен в таблице 1.
Таблица 1. Хронологический план набора участников, хирургических вмешательств и оценки полученных результатов
Table 1. Chronological table of participants’ recruitment, surgical interventions and results evaluation
|
Действие |
Период |
|||||
|
Набор участников |
Рандомизация |
Хирургическое вмешательство |
Контроль [1]* |
Контроль (2)** |
Контроль (3)*** |
|
|
Критерии включения |
• |
|||||
|
Информированное согласие |
• |
|||||
|
Физикальный осмотр |
• |
|||||
|
Демографические данные |
• |
|||||
|
Распределение участников |
• |
|||||
|
Прием лекарственного средства |
• |
• |
• |
• |
||
|
Хирургическое вмешательство |
• |
|||||
|
Оценка первичных конечных точек |
• |
• |
||||
|
Оценка вторичных конечных точек |
• |
• |
• |
|||
Примечание: *контроль (1)—первый день после вмешательства;
**контроль (2)—первая неделя после вмешательства;
***контроль (3)—через 30 дней после вмешательства.
Размер выборки
Учитывая то, что это исследование по доказательству имеет более высокую эффективность, размер выборки был рассчитан с использованием одностороннего теста Блэк-велдера. По имеющимся данным, частота приема опиоидов после геморроидэктомии колеблется от 20 до 30 % [14]. Ожидаемая частота приема опиоидов после геморроидэктомии при предоперационной анальгезии составляет не более 10 %. Цель данного исследования— продемонстрировать, что потребление опиоидов у пациентов с предоперационной анальгезией ниже, чем без нее. Учитывая, что а = 0,05; статистическая мощность исследования составляет 80 %; пациенты рандомизированы на две группы с соотношением распределения 1: 1; предел неполноценности D = 5 %, необходимый объем выборки—144 пациента (по 72 пациента в каждой из двух групп).
Набор участников
В данном исследовании были рассмотрены все пациенты, которым планировалось хирургическое лечение заболеваний аноректальной области, а именно открытая ге-морроидэктомия в качестве радикального метода лечения геморроидальной болезни 2—4- й стадии.
Рандомизация участников
После получения письменного информированного согласия участники случайным образом были распределены в контрольную или экспериментальную группу с соотношением распределения 1:1 с использованием кластерной рандомизации с компьютеризированным генератором случайных чисел. Врач, не принимающий участие в других этапах исследования, генерировал последовательность распределения, регистрировал участников, получал информированное согласие и давал назначение по применению лекарственного препарата при необходимости. Хирург и команда анестезиологов не знали о данной последовательности распределения.
Все соответствующие данные из карты пациента, за исключением имен, внесены в электронную форму отчета о пациенте, которая содержит результаты всех обследований и анализов, включая анамнез и демографические данные пациента, заполненные анкеты, описание хода операции и послеоперационные обходы во время пребывания пациента в хирургическом отделении.
Сбор, обработка и анализ данных
Все данные собирались перспективно с использованием электронных форм отчета о пациенте, разработанных для этого исследования. Причины отказа от участия задокументированы. В ходе послеоперационного мониторинга врач-исследователь пытался связаться с каждым пациентом не менее трех раз, прежде чем признать их потерянными для наблюдения. Форма для выхода из исследования записана в электронной форме отчета о пациенте.
Все пациенты получили все необходимые разъяснения по всем этапам исследования и имели возможность обсудить их с руководителем исследования. Все данные о пациентах обрабатывались в соответствии с принципами конфиденциальности «врач — пациент», субъекты были анонимизированы и проанализированы с помощью индивидуальных идентификационных номеров.
Статистические данные
Количественные переменные описывались как средние значения со стандартными отклонениями, медианы, диапазон или межквартильный диапазон в зависимости от обстоятельств. Категориальные переменные описывались в абсолютных числах и процентах. Статистический анализ количественных переменных с независимыми группами проводился с помощью параметрического t-критерия Стьюдента, обеспечивающего выполнение условий его применения. В противном случае использовался непараметрический U-критерий Манна — Уитни. Статистический анализ для категориальных переменных осуществлялся с применением критерия Пирсона χ 2 или точного критерия Фишера. Множественные сравнения были проведены с учетом поправки Бонферони. В частности, вышеприведенные методы использовались для сравнения двух групп с точки зрения исходных характеристик, чтобы оценить, была ли рандомизация эффективной.
Результаты
Всего в исследование включено 226 пациентов. Каждый из пациентов соответствовал всем критериям включения. В ходе послеоперационного мониторинга в анализ вошли только те пациенты, которые пришли на повторный прием через 30 дней или с которыми удалось связаться. Таким образом, в анализ включены всего 182 пациента: 102 человека из экспериментальной группы и 80 из группы контроля, 44 человека не были включены в анализ по причине отсутствия связи с ними и невозможности собрать данные послеоперационного мониторинга. Демографические данные двух групп представлены в таблице 2. Значимые различия наблюдались по параметру возраста между исследуемыми группами (р = 0,018).
Таблица 2. Клинические данные пациентов
Table 2. Patients’ demographic data and clinical characteristics
|
Критерий |
Группа |
p |
|
|
Экспериментальная |
Контрольная |
||
|
Количество пациентов, чел. |
102 |
80 |
|
|
Возраст, лет |
40,8 (38,0—43,5) |
44,0 (41,9—46,1) |
0,018 |
|
Пол |
0,63 (0,52—0,73) |
0,51 (0,41—0,61) |
0,120 |
Частота применения наркотических обезболивающих препаратов в экспериментальной и контрольной группах составила 19,6 и 17,5 % соответственно, однако различия не были статически значимыми (р = 0,717). Также прием НПВС в послеоперационном периоде не имел значимой статистической разницы (р = 0,564).
В первые пять дней после операции разница в выраженности болевого синдрома в обеих группах не была достоверной. Через 6—9 дней после вмешательства уровень болевого синдрома в покое и при дефекации в экспериментальной группе был значимо ниже, чем в контрольной (табл. 3, рис. 1—4).
Таблица 3. Среднее значение уровня боли в послеоперационном периоде, баллов по ВАШ Table 3. The average pain level in the postoperative period
|
День |
Уровень боли |
p |
|
|
Контрольная группа (ДИ — 95 %) |
Экспериментальная группа (ДИ — 95 %) |
||
|
В покое |
|||
|
6-й |
3,83 (3,26—4,39) |
2,94 (2,46—3,42) |
0,012 |
|
7-й |
3,33 (2,75—3,90) |
2,53 (2,07—2,99) |
0,020 |
|
8-й |
2,95 (2,39—3,51) |
2.10 (1,65—2,54) |
0,007 |
|
9-й |
2,75 (1,99—3,51) |
1,74 (1,35—2,14) |
0,032 |
|
При дефекации |
|||
|
6-й |
6,40 (5,84—6,96) |
5,53 (5,04—6,02) |
0,028 |
|
7-й |
6,38 (5,71—7,04) |
4,91 (4,38—5,43) |
0,002 |
|
8-й |
5,50 (4,91—6,09) |
4,39 (3,92—4,87) |
0,004 |
|
9-й |
5,10 (4,51—5,69) |
4,14 (3,67—4,60) |
0,018 |
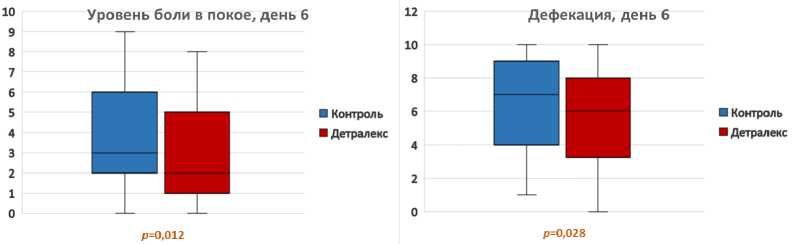
Рис. 1. Уровень боли по ВАШ в покое и при дефекации на 6-й день (ранговый критерий Манна — Уитни)
Fig. 1. Pain level according to VAS in rest and during defecation on day 6 (Mann-Whitney rank criterion)
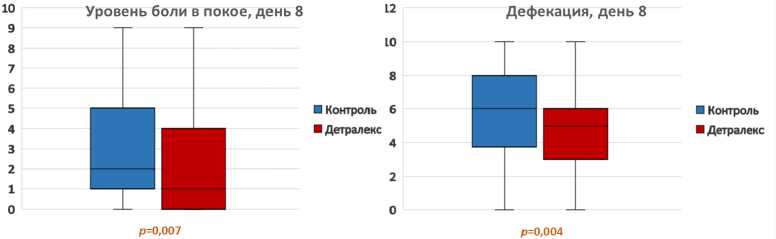
Рис. 2. Уровень боли по ВАШ в покое и при дефекации на 8-й день (ранговый критерий Манна — Уитни)
Fig. 2. Pain level according to VAS in rest and during defecation on day 8 (Mann-Whitney rank criterion)
Также за время наблюдения в группе исследования не было отмечено побочных действий препарата «Детралекс» и других применяемых лекарственных препаратов.
В среднем после оперативного вмешательства пациенты возвращались к труду или к прежнему образу жизни в течение первых 6 дней после операции, различия между группами оказались статистически незначимыми (р = 0,500).
Через 7 и 30 дней после оперативного вмешательства был проведен опрос для оценки качества жизни участников с помощью формы опросника пациента (EQ-5D). На 7-й день после операции пациенты из группы контроля достоверно чаще испытывали трудности при уходе за собой и тревогу/беспокойство по поводу своего состояния (р = 0,009 и р = 0,022 соответственно) (рис. 3). На 30-й день после операции значимые различия наблюдались в таких параметрах, как трудности при уходе за собой и наличие остаточной боли/дискомфорта в области операции (р = 0,039 и р = 0,018 соответственно) (рис. 4).
В течение 30 дней послеоперационного наблюдения повторные госпитализации, осложнения и рецидивы заболевания не были отмечены ни в одной группе. Наличие остаточных жалоб (боли при дефекации, выделения крови и сукровицы, неполное заживление послеоперационной раны) через 30 дней после операции чаще имели пациенты в группе контроля (р = 0,033) (рис. 5).
2,5
2,5
Тревога, беспокойство, день 7
Трудности при уходе, день 7

Рис. 3. Оценка качества жизни на 7-й день по параметрам «трудности при уходе за собой» и «тревога/беспокойство»
Fig. 3. Life quality assessment on day 7: «difficulties in self-care» and «anxiety/worry»
|
2,5 2 1,5 |
Трудности при уходе, день 30 |
2,5 2 1,5 |
Боль, дискомфорт, день 30 |
||||
|
|||||||
|
1 |
|
||||||
|
0,5 0 |
0,5 0 |
||||||
|
X |
X |
||||||
|
р=0,039 |
р=0,018 |
||||||
Рис. 4. Оценка качества жизни на 30-й день по параметрам «трудности при уходе за собой» и «тревога/беспокойство» Fig. 4. Life quality assessment on day 30: «difficulties in self-care» and «continuation of pain and discomfort»
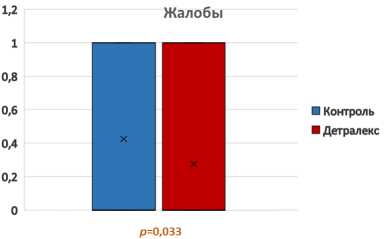
Рис. 5. Оценка наличия остаточных жалоб через 30 дней после операции
Fig. 5. Assessment of the residual complaints 30 days after surgery
Обсуждение
Главная проблема в послеоперационном периоде, возникающая у пациентов после операций на анальном канале, — это болевой синдром. Существует предположение, что основной причиной боли после вмешательства на аноректальной области является очень чувствительная слизистая оболочка заднего прохода, которая сильно травмируется во время оперативного вмешательства. Воспалительная реакция слизистой оболочки заднего прохода может дополнительно усиливать боль после операции. Таким образом, методы лечения, направленные на уменьшение воспалительной реакции или травмы, демонстрируют удовлетворительные результаты в отношении послеоперационной боли.
Во многих клинических исследованиях изучалась эффективность применения в дополнение к общей или спинномозговой анестезии местных анестетиков в перианальной области в отношении выраженности послеоперационной боли. Эти исследования показывают, что местные анестетики действуют в основном как блокада периферических нервов, но они также могут обладать и противовоспалительным действием. Инфильтрация раны местным анестетиком не только способствовала уменьшению послеоперационной боли, но и снижала потребность в дополнительном обезболивании после геморроидэктомии. Аналогичный положительный эффект был продемонстрирован при инфильтрации нестероидных противовоспалительных препаратов (НПВП) в область операции. Этот эффект был объяснен ингибированием фермента циклооксигеназы, который подавляет воспалительные реакции путем модификации каскада простагландинов в операционной ране.
Флавоноиды снижают активность ключевых воспалительных ферментов, в том числе фосфолипазы А2, высвобождающей арахидоновую кислоту из фосфолипидов мембран, циклооксигеназы, отвечающей за выработку простагландинов и являющейся мишенью НПВП, и липоксигеназы, катализирующей образование лейкотриенов. Сообщалось также, что «Дафлон» (препарат МОФФ) способен ингибировать свободные радикалы, которые могут вызывать повреждение тканей, снижает проницаемость микрососудов и улучшает кровообращение. Эти эффекты играют важную роль в защите тканей.
В большинстве опубликованных исследований, посвященных изучению влияния диос-мина, оценивалась его роль в лечении заболевания вен нижних конечностей [5; 6; 15—19]. Препараты диосмина (Детралекс ® , в частности) позволяют уменьшить выраженность симптомов хронической венозной недостаточности, таких как отек, тяжесть, боли в нижних конечностях, и рекомендуются иногда даже в качестве альтернативы хирургическому лечению [17; 19].
В исследовании [16] предоперационное применение препарата диосмина (Детралек-са ® ) у пациентов с варикозной болезнью нижних конечностей за 2 недели до хирургического вмешательства способствовало уменьшению послеоперационной боли и снижению потребления анальгетиков, уменьшению размера гематомы в области послеоперационной раны, а также повышению качества жизни пациентов. Аналогичные результаты были получены и в мультицентровом исследовании предоперационного применения Детралекса® при флебэктомиях [18].
В доступной литературе представлено несколько работ, в которых изучалась эффективность послеоперационного назначения МОФФ. В первом исследовании, посвященном этому вопросу [13], в основном обращали внимание на влияние Дафлона® (500 мг) на частоту послеоперационного кровотечения, которая снизилась с 6,1 до 0,9 балла. По результатам других исследований только на 7—8-й день после геморроидэктомии отмечались различия в выраженности болевого синдрома и частоты кровотечений у пациентов, которым назначали или не назначали МОФФ [20; 21]. Назначение МОФФ непосредственно после геморроидэктомии позволило уменьшить болевой синдром, длительность по-30 слеоперационного кровотечения, выраженность анального зуда и продолжительность госпитализации [13; 22—25]. Помимо этого был продемонстрирован результат эффективности применения МОФФ у пациентов с острым тромбозом геморроидальных узлов. Различия выраженности и длительность симптомов (ощущение дискомфорта, кровотечения, наличие выделений) по сравнению с группой плацебо оказались статистически значимыми [26—29].
При консервативном лечении геморроидальной болезни с помощью препаратов МОФФ удается достичь значимого снижения выраженности клинических проявлений геморроидальной болезни только через 2—4 недели ежедневного применения [30; 31]. Учитывая этот факт, мы предположили, что для получения оптимального эффекта в послеоперационном периоде рационально начать применение МОФФ за 1—2 недели до проведения оперативного лечения, что и было реализовано в нашем протоколе.
Мы считаем, что благодаря флеботропной активности, ангиопротективному эффекту и противовоспалительному действию МОФФ удается достичь значимого снижения выраженности симптомов геморроя и острого тромбоза геморроидальных узлов, а также предотвратить повторные случаи тромбоза.
Многочисленные эффекты МОФФ позволяют в целом достичь противоотечного эффекта в зоне воспаления при остром геморроидальном тромбозе. Была выдвинута гипотеза, что положительное влияние МОФФ на слизистую оболочку анального отверстия заключается как раз в уменьшении отека. Противовоспалительное действие МОФФ защищает послеоперационную рану вплоть до полного ее заживления.
Для реализации этих эффектов требуется применение препарата в течение как минимум 7—10 дней. Таким образом, в данном исследовании мы планируем оценить эффективность периоперационного назначения МОФФ, а в случае доказанности этой гипотезы — предложить модифицированную схему периоперационного ведения пациентов, которым проводится оперативное лечение заболеваний аноректальной области.
Заключение
Периоперационная анальгезия с применением МОФФ в аноректальной хирургии позволяет уменьшить болевой синдром в раннем послеоперационном периоде без увеличения частоты побочных эффектов, связанных с приемом лекарств. Назначение препаратов МОФФ («Детралекс») является безопасным и эффективным и рекомендуется применять соответствующим пациентам в рамках как предоперационного обезболивания в аноректальной хирургии, так и мультимодальной анестезии после аноректальных вмешательств.
Список литературы Результаты предоперационного применения микронизированной очищенной флавоноидной фракции в составе схемы мультимодального обезболивания в хирургии аноректальной области: проспективное, рандомизированное, плацебо-контролируемое, двойное слепое исследование
- Riss S, Weiser FA, Schwameis K, Riss T, Mittlböck M, Steiner G, Stift A. The prevalence of hemorrhoids in adults. Int J Colorectal Dis. 2012. Feb 27(2):215-220. https://doi.org/10.1007/s00384-011-1316-3.
- Mansilha A, Sousa J. Pathophysiological Mechanisms of Chronic Venous Disease and Implications for Venoactive Drug Therapy. Int J Mol Sci. 2018. Jun 5;19(6):1669. https://doi.org/10.3390/ijms19061669.
- Ganz RA. The evaluation and treatment of hemorrhoids: a guide for the gastroenterologist. Clin Gastroenterol Hepatol. 2013. Jun 11(6):593-603. https://doi.org/10.1016/j.cgh.2012.12.020.
- Amiel M, Barbe R. Etude de l’activité pharmacodynamique de Daflon 500 mg [Study of the pharmacodynamic activity of daflon 500 mg]. Ann Cardiol Angeiol (Paris). 1998. Mar 47(3):185-188 (in Fren.).
- Tsouderos Y. Venous tone: are the phlebotonic properties predictive of a therapeutic benefit? A comprehensive view of our experience with Daflon 500 mg. Z Kardiol. 1991;80 Suppl 7:95-101.
- Duchene Marullaz P, Amiel M, Barbe R. Evaluation of the clinical pharmacological activity of a phlebotonic agent. Application to the study of Daflon 500 mg. Int Angiol. 1988. Apr-Jun 7(2 Suppl):25-32.
- Bogachev VY, Boldin BV, Lobanov VN. Benefits of micronized purified flavonoid fraction as adjuvant therapy on inflammatory response after sclerotherapy. Int Angiol. 2018. Feb 37(1):71-78. https://doi.org/10.23736/S0392-9590.17.03868-8.
- Pietrzycka A, Kózka M, Urbanek T, Stpniewski M, Kucharzewski M. Effect of Micronized Purified Flavonoid Fraction Therapy on Endothelin-1 and TNF-α Levels in Relation to Antioxidant Enzyme Balance in the Peripheral Blood of Women with Varicose Veins. Curr Vasc Pharmacol. 2015;13(6):801-808. https://doi.org/10.2174/1570161113666150827124714.
- Altomare DF, Giuratrabocchetta S. Conservative and surgical treatment of haemorrhoids. Nat Rev Gastroenterol Hepatol. 2013. Sep 10(9):513-521. https://doi.org/10.1038/nrgastro.2013.91.
- Van Backer JT, Jordan MR, Leahy DT, Moore JS, Callas P, Dominick T, Cataldo PA. Preemptive Analgesia Decreases Pain Following Anorectal Surgery: A Prospective, Randomized, Double-Blinded, Placebo-Controlled Trial. Dis Colon Rectum. 2018. Jul 61(7):824-829. https://doi.org/10.1097/DCR.0000000000001069.
- Penprase B, Brunetto E, Dahmani E, Forthoffer JJ, Kapoor S. The efficacy of preemptive analgesia for postoperative pain control: a systematic review of the literature. AORN J. 2015. Jan 101(1):94-105.e8. https://doi.org/10.1016/j.aorn.2014.01.030.
- Pescatori M. Closed vs. open hemorrhoidectomy: associated sphincterotomy and postoperative bleeding. Dis Colon Rectum. 2000. Aug 43(8):1174-1175. https://doi.org/10.1007/BF02236571.
- Ho YH, Foo CL, Seow-Choen F, Goh HS. Prospective randomized controlled trial of a micronized flavonidic fraction to reduce bleeding after haemorrhoidectomy. Br J Surg. 1995. Aug 82(8):1034-1035. https://doi.org/10.1002/bjs.1800820809.
- Frasco PE, Sprung J, Trentman TL. The impact of the joint commission for accreditation of healthcare organizations pain initiative on perioperative opiate consumption and recovery room length of stay. Anesth Analg. 2005. Jan 100(1):162-168. https://doi.org/10.1213/01.ANE.0000139354.26208.1C.
- Rabe E, Agus GB, Roztocil K. Analysis of the effects of micronized purified flavonoid fraction versus placebo on symptoms and quality of life in patients suffering from chronic venous disease: from a prospective randomized trial. Int Angiol. 2015. Oct 34(5):428-436.
- Veverková L, Kalac J, Jedlicka V, Wechsler J. Analýza operacních výkonů na vena saphena magna v Ceské republice a efekt Detralexu pri jejím strippingu [Analysis of surgical procedures on the vena saphena magna in the Czech Republic and an effect of Detralex during its stripping]. Rozhl Chir. 2005. Aug 84(8):410-412, 414-416 (in Czech.).
- Богачев В. Ю., Болдин Б. В., Туркин П. Ю., Саменков А. Ю. Эффективность микронизированной очищенной флавоноидной фракции при лечении хронического венозного отека. Ангиология и сосудистая хирургия. 2020. Т. 26, № 2. С. 86-92. https://doi.org/10.33529/ANGI02020211.
- Покровский А. В., Савельев В. С., Кириенко А. И., Богачев В. Ю., Золотухин И. А., Сапелкин С. В., Швальб П. Г., Жуков Б. Н., Возлюбленный С. И., Сабельников В. В., Восканян Ю. Э., Кательницкий И. И., Бурлева Е. П., Толстихин В. Ю. Проведение оперативного вмешательства при варикозной болезни под прикрытием микронизированного диосмина (результаты российского многоцентровогоклинического исследования с контролем дефанс). Ангиология и сосудистая хирургия. 2007. Т. 13, № 2. С. 47-55.
- Kakkos SK, Nicolaides AN. Efficacy of micronized purified flavonoid fraction (Daflon®) on improving individual symptoms, signs and quality of life in patients with chronic venous disease: a systematic review and meta-analysis of randomized double-blind placebo-controlled trials. Int Angiol. 2018. Apr 37(2):143-154. https://doi.org/10.23736/S0392-9590.18.03975-5.
- Diana G, Catanzaro M, Ferrara A, Ferrari P. Attività della diosmina pura nel trattamento della malattia emorroidaria [Activity of purified diosmin in the treatment of hemorrhoids]. Clin Ter. 2000. Sep-Oct 151(5):341-344 (in Ital.).
- Babaikere MM, Huang HG, Re WN, Fan K, Chu H, Ai EH, Li-Mu MM, Wang YR, Wen H. How we can improve patients’ comfort after Milligan-Morgan open haemorrhoidectomy. World J Gastroenterol. 2011. Mar 21;17(11):1448-1456. https://doi.org/10.3748/wjg.v17.i11.1448.
- Chiaretti M, Fegatelli DA, Pappalardo G, Venti MDS, Chiaretti AI. Comparison of Centella with Flavonoids for Treatment of Symptoms in Hemorrhoidal Disease and After Surgical Intervention: A Randomized Clinical Trial. Sci Rep. 2020. May 14;10(1):8009. https://doi.org/10.1038/s41598-020-64772-0.
- La Torre F, Nicolai AP. Clinical use of micronized purified flavonoid fraction for treatment of symptoms after hemorrhoidectomy: results of a randomized, controlled, clinical trial. Dis Colon Rectum. 2004. May 47(5):704-710. https://doi.org/10.1007/s10350-003-0119-1.
- Colak T, Akca T, Dirlik M, Kanik A, Dag A, Aydin S. Micronized flavonoids in pain control after hemorrhoidectomy: a prospective randomized controlled study. Surg Today. 2003;33(11):828-832. https://doi.org/10.1007/s00595-003-2604-5.
- Sheikh P, Lohsiriwat V, Shelygin Y. Micronized Purified Flavonoid Fraction in Hemorrhoid Disease: A Systematic Review and Meta-Analysis. Adv Ther. 2020. Jun 37(6):2792-2812. https://doi.org/10.1007/s12325-020-01353-7.
- Cospite M. Double-blind, placebo-controlled evaluation of clinical activity and safety of Daflon 500 mg in the treatment of acute hemorrhoids. Angiology. 1994. Jun 45(6 Pt 2):566-573. https://doi.org/10.1177/000331979404500612.
- Jiang ZM, Cao JD. The impact of micronized purified flavonoid fraction on the treatment of acute haemorrhoidal episodes. Curr Med Res Opin. 2006. Jun 22(6):1141-1147. https://doi.org/10.1185/030079906X104803.
- Giannini I, Amato A, Basso L, Tricomi N, Marranci M, Pecorella G, Tafuri S, Pennisi D, Altomare DF. Flavonoids mixture (diosmin, troxerutin, hesperidin) in the treatment of acute hemorrhoidal disease: a prospective, randomized, triple-blind, controlled trial. Tech Coloproctol. 2015. Jun 19(6):339-345. https://doi.org/10.1007/s10151-015-1302-9.
- Meshikhes AW. Efficacy of Daflon in the treatment of hemorrhoids. Saudi Med J. 2002. Dec 23(12):1496-1498.
- Meshikhes AW. Daflon for haemorrhoids: a prospective, multi-centre observational study. Surgeon. 2004. Dec 2(6):335-338, 361. https://doi.org/10.1016/s1479-666x(04)80032-5.
- Zagriadskiĭ EA, Bogomazov AM, Golovko EB. Conservative Treatment of Hemorrhoids: Results of an Observational Multicenter Study. Adv Ther. 2018. Nov 35(11):1979-1992. https://doi.org/10.1007/s12325018-0794-x.


