Результаты применения биодеградирумых гелей при лечении ложных суставов костей верхних конечностей
Автор: Давыдов Д.В., Аль-ханих М.А., Брижань Л.К., Грицюк А.А.
Журнал: Кафедра травматологии и ортопедии @jkto
Статья в выпуске: 3 (45), 2021 года.
Бесплатный доступ
Цель исследования - улучшить результаты лечения атрофических ложных суставов костей верхних конечностей путем усиления регенераторного потенциала губчатого костного аутотрансплантата применением коллагенового гидрогеля.Материал и метод. Проведено проспективное контролируемое одноцентровое исследование 27 пациентов мужского пола, средний возраст 29,6±7,5 лет, с ложными суставами костей верхних конечностей, образовавшиеся в результате хирургического лечения по поводу травм 18 (76,7%) пациентов и огнестрельных ранений 9 (33,3%). Пациентам выполняли накостный остеосинтез с костной аутопластикой кортикально-губчатым трансплантатом, в исследуемой группе с применением коллагенового гидрогеля. Исследовали клинические, рентгенологические и КТ признаки сращения кости, функциональный результат лечения (тестирование по шкалам).Результаты. Клинические и рентгенологические признаки сращения ложного сустава при применении биогеля статистически значимо были меньше чем при стандартной костной аутопластике и составили 239,4±55,3 суток, во второй группе соответственно 299,74±67,9 суток (р=0,0023). При тестировании по шкалам DASH и SF-36 статистически значимой разницы выявлено не было.Вывод: применение коллагенового гидрогеля в сочетании с губчатым костным аутотрансплантатом позволяет улучшить результаты лечения атрофических ложных суставов костей верхних конечностей сокращая сроки сращения на 20% (р=0,0023) с сохранением функционального результата лечения.
Ложный сустав, лечение переломов и огнестрельных ранений верхних конечностей
Короткий адрес: https://sciup.org/142231470
IDR: 142231470 | УДК: 617.3 | DOI: 10.17238/issn2226-2016.2021.3.84-92
Текст научной статьи Результаты применения биодеградирумых гелей при лечении ложных суставов костей верхних конечностей
Несмотря на успехи в лечении переломов такие осложнения как замедленная консолидация и ложные суставы даже при низко энергетических повреждениях и закрытых переломах встречаются до 5% случаев [1]. При повреждениях верхних конечностей частота данных осложнений не уменьшается [2]. Потому вопросы анализа и прогнозирования факторов влияющих на репаративную регенерацию костной ткани остаются актуальными, учитывая экономические аспекты данной проблемы [3, 4]. При лечении огнестрельных ранений конечностей замедленная консолидация перелома, ложные суставы, дефекты кости наблюдаются у 6–9% раненых [5, 6].
С момента внедрения компрессионно-дистракционного метода Г.А. Илизарова в клиническую практику травматологии, данный метод является «золотым стандартом и эталоном» лечения ложных суставов, его эффективность достигает по данным некоторых авторов 97,7–100% [7, 8].
Другим методом лечения ложных суставов или нарушения регенерации является напряженный остеосинтез [9] или свободная костная аутопластика, которые при определенных условиях дают неплохие результаты [10]. В более тяжелых случаях применяют методы свободной или несвободной васкуляризированной костной пластики на питающих сосудах, которые повышают регенераторные возможности кости. Таких трансплантатов предложено большое количество в зависимости от локализации и особенностей кровоснабжения зоны повреждения [11, 12].
Однако сложность и трудоемкость данных методов, длительность лечения, а не редко неудовлетворительный функциональный результат восстановления дефекта костной ткани, высокий уровень осложнений заставляют искать новые методы реабилитации раненых и пострадавших с различными нарушениями репаративной остеорегенерации [13, 14].
Одним из перспективных направлений последних лет является тканевая инженерия, задачей которой состоит в разработке оптимального пластического материала и создание тканевых биоинженерных конструкций (скаффолдов), которые позволят не только замещать дефекты кости, но и стимулировать, эффективно управлять процессами регенерации костной ткани. В этих целях часто используют следующие материалы: природные полимеры или биомиметики (коллаген, целлюлоза, фибронектин, хитозан, агароза) [15-17]; синтетические полимеры – полилактид, или другие биоразлагаемые полиэфиры [18-21]; биокерамику (гидроксиапатит, трикальций фосфат) [22, 23]; и комбинации этих материалов [24]. Одним из таких биомиметиков является коллагеновый гидрогель стерильный биопластический коллагеновый материал нового поколения с полностью сохраненной нативной структурой, пред- ставляет собой коллаген I типа (полученный из кожи молодого крупного рогатого скота), который близок по биохимическому составу и структуре к человеческому коллагену и характеризуется высокими показателями стабильности, являясь матрицей для направленной тканевой регенерации.
Цель исследования - улучшить результаты лечения атрофических ложных суставов костей верхних конечностей путем усиления регенераторного потенциала губчатого костного аутотрансплантата применением коллагенового гидрогеля.
Материалы и методы
Проспективное контролируемое одноцентровое исследование проводилось с 2015 по 2019 годы, включено в исследование 27 пациентов с ложными суставами костей верхних конечностей, все пациенты мужского пола, средний возраст 29,6±7,5 лет, без серьезной сопутствующей патологии по шкале Американского общества анестезиологов (ASA I-II). Ложные суставы были гипотрофическо-го и атрофического типа, без потери костной массы, по сегментам были распределены следующим образом: ключица 12 (44,5%), плечевая кость 6 (22,2%) и кости предплечья 9 (33,3%). Средняя продолжительность лечения от момента травмы до госпитализации составил 357,1±78,1 суток. Травмы имели место у 18 (76,7%) пациентов, огнестрельные ранения 9 (33,3%), в структуре травм преобладали низкоэнергетические: бытовые и спортивные 13 (48,1%), высокоэнергетические: ДТП – 4 (14,8%), кататравма 1 (3,7%), среди огнестрельных ранений пулевые 6 (22,2%) и осколочные 3 (11,1%). Все переломы были закрытые (типа В и С по классификации АО), огнестрельные имели оскольчатый характер, при этом дефектов мягких тканей верхних конечностей не было, переломы при политравме были у 9 (33,3%) пострадавших. До поступления в госпиталь все пациенты были оперированы ранее, остеосинтез выполняли АВФ 6, накостный остеосинтез 17 интрамедуллярный 4 (14,8%), повторные операции были у 21 (77,8%) пациента: удаление металлоконструкций – 15 (55,6%), повторный остеосинтез – 2 (7,4%), костно-пластические операции – 4 (14,8%).
Критерии включения: пациенты обоего пола с гипотрофи-ческими и атрофическими ложными суставами средней трети диафиза костей верхних конечностей. Критерии невключения: внутрисуставные переломы, гипертрофические и инфицированные ложные суставы, циркулярные дефекты кости и мягких тканей, наличие сопутствующих заболеваний (ASA III и выше), повреждение нервов, отказ от участия в исследовании. Критерии исключения: инфекционные осложнения, недоступность пациента или отказ от участия в исследовании.
При поступлении и отбора пациентов по критериям включения и невключения, пациентам предлагалась операция накостно- го остеосинтеза с костной аутопластикой (фрагмент крыла подвздошной кости с кортикальной костью (16–59,3%) или губчатый (11–40,7%). Далее пациентам, отобранным хаотично для применения гидрогеля (через одного), объясняли его строение, необходимость и цель применения, при наличии добровольного согласия включали в основную группу исследования, при несогласии исключали из исследования. У всех пациентов получено информированное согласие на проводимое исследование, одобренное локальным этическим комитетом ГВКГ им. Н.Н. Бурденко (протоколы № 193 от 29.04.2017 г. и № 219 от 18.09.2019 г.).
В обеих подгруппах применяли внутренний накостный остеосинтез и пластику области ложного сустава аутотрансплантатом из гребня крыла подвздошной кости, в основной группе применяли коллагеновый гидрогель «КОЛЛОСТ®» производства ООО «БиоФАРМАХОЛДИНГ», в качестве биомиметика внеклеточного матрикса. В ходе операции удаляли рубцовые ткани в межотлом-ковой зоне (резекция ложного сустава) с одновременным удалением склерозированных участков раневой поверхности костных отломков. При необходимости усиления прочностных качеств трансплантата сохраняли кортикальную пластинку подвздошной кости, по ходу операций особое внимание уделяли сохранению (или восстановлению) длины, оси и ротации сегмента. Аутотрансплантаты укладывали в область ложного сустава, перекрывая отломки, при этом добиваясь плотного контакта между ними и реципиентным ложем, в некоторых случаях укрепляли винтами. При этом вокруг зоны ложного сустава и аутотрансплантата в мягких тканях формировали карман, на участки губчатой аутокости, дистальный и проксимальный отломки, равномерным слоем наносили коллагеновый гидрогель, после чего «карман» ушивали. В послеоперационном периоде пациентам обеих групп конечности иммобилизировали косыночной повязкой. Функциональную нагрузку на верхнюю конечность разрешали в ранние сроки в дозированном режиме. Протокол послеоперационного ведения пациентов в обеих группах был одинаковым.
Таблица 1
Распределение пациентов по группам
|
Группы пациентов |
Всего n=27 |
Р** |
||
|
Основная n=12 |
Сравнения n=15 |
|||
|
Средний возраст (лет) |
28,9±8,3* |
29,9±7,7 |
29,6±7,5 |
0,725 |
|
ASA I: II |
9:3 |
10:5 |
19:8 |
0,163 |
|
Сегмент (n, %): |
||||
|
Ключица |
6(22,2%) |
6(22,2%) |
12(44,4%) |
сзро*** |
|
Предплечье |
3(11,1%) |
6(22,2%) |
9(33,3%) |
сзро*** |
|
Плечо |
3(11,1%) |
3(11,1%) |
6(22,2%) |
сзро*** |
|
Средняя длительность предшествующего лечения (сут.) |
355,4±76,2 |
359,1±80,5 |
357,7±78,1 |
0,065 |
* - среднее значение ±среднеквадратичное отклонение;
** - р<0.05
***сзро - статистически значимая разница отсутствует
Результаты лечения оценивали по трем критериям: клинические признаки сращения (боль и физиологическая осевая нагрузка); рентгенологические и КТ признаки сращения (оценка костной мозоли и щели между отломками), функциональный результат лечения (клинический и тестирование по шкалам).
Для всех пациентов применяли опросник SF-36 (максимальная положительная оценка 100 баллов за 10 пунктов). Для пострадавших с патологией верхней конечности – по двум разделам опросника «Оценка исходов при нарушении функции руки, плеча, кисти (DASH Outcome Measure, USA Institute for a Work&Health). Максимальная сумма баллов в первом разделе 150, во втором –20; минимальная – 30 и 4 соответственно. Результаты данного теста интерпретировали согласно инструкции: отличные и хорошие –от 30 до 49 баллов, удовлетворительные – от 50 до 74 баллов, неудовлетворительные – от 75 до 100 баллов.
Статистическая обработка.
Для описания количественных переменных использовали средние значения и стандартные отклонения в виде M ± S. Сопоставление двух групп по числовым переменным проводили при помощи непараметрического метода Манна–Уитни. Статистическую значимость различий групп для бинарных и номинальных показателей определяли при помощи критерия Хи-квадрат Пирсона в случае независимых выборок и при помощи непараметрической ранговой корреляции по Спирмену. Анализ динамики показателей для сопоставления двух периодов осуществляли на основе непараметрического метода Уилкоксона. Для исследования влияния сразу нескольких независимых показателей на зависимую использовали многофакторный дисперсионный анализ (MANOVA). Уровень статистической значимости был зафиксирован на уровне 0,05. Статистическую обработку данных выполняли при помощи пакета прикладных программ IBM SPSS Statistics 22.
Результаты
Сращение ложного сустава (по клиническим и рентгенологическим признакам) при применении биогеля было быстрее (239,4±55,3 суток) чем при стандартной костной аутопластике (299,74±67,9 суток) статистически значимо (р=0,0023), что представлено на диаграмме 1.
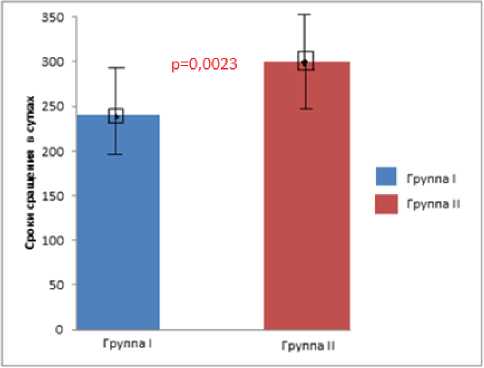
Диаграмма 1. Сроки сращения ложных суставов костей верхних конечностей в группах.
При тестировании по шкале DASH в первой группе результаты на сроках в 1 и 3 месяца были статистически значимо лучше, на более поздних сроках достоверной разницы отмечено не было, диаграмма 2.
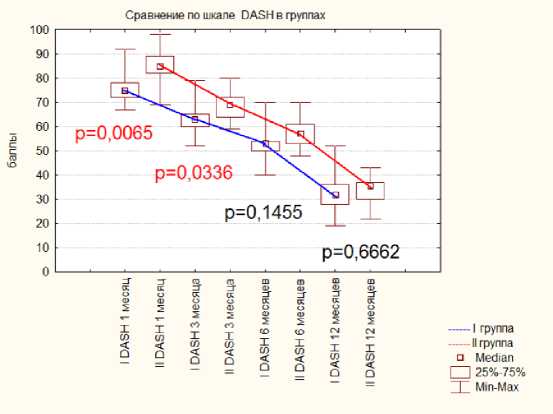
Диаграмма 2. Динамика результатов по шкале DASH в группах после операции.
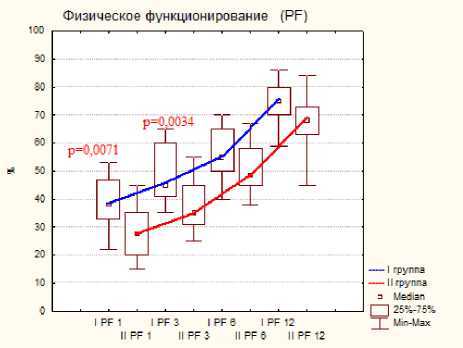
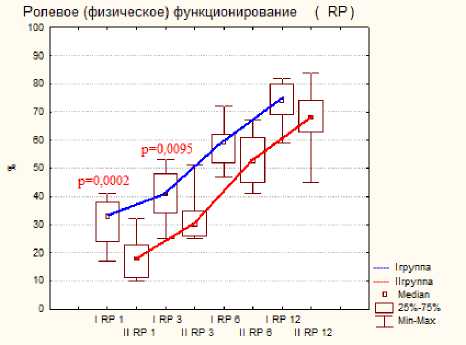
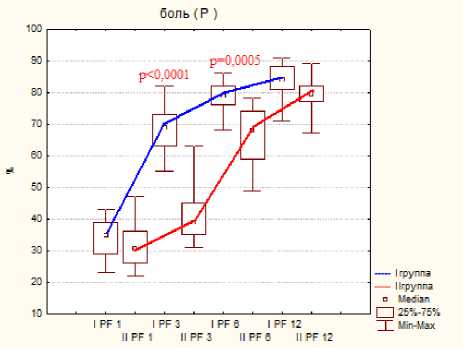
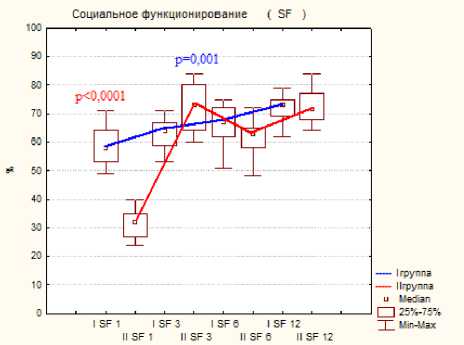
Тестирование по шкале SF-36 показало меньше различий показателей, но статистическая разница была отмечена на ранних сроках исследования при следующих критериях: это боль, физическое, ролевое и социальное функционирование, на поздних сроках статистической разницы отмечено не было, результаты представлены на диаграмме 3.
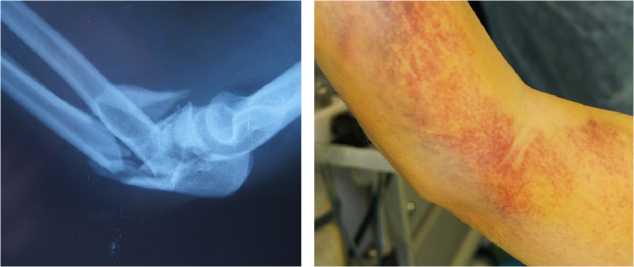
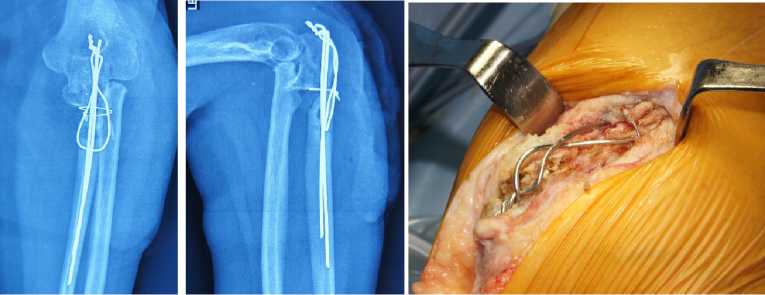
Клинический пример иллюстрирующий применение биогеля пациентка С, 56 лет, получила закрытый оскольчатый перелом локтевого отростка со смещением отломков, многооскольчатый перелом головки лучевой кости левого предплечья (Рисунок 1). выполнен остеосинтез локтевого отростка по Веберу и резекция головки лучевой кости (Рисунок 2). Через 6 месяцев после операции отмечается выраженный болевой синдром, контрактура локтевого сустава, при рентгенографии диагностирован атрофический ложный сустав левого локтевого отростка (Рисунок 3). Выполнено удаление металлоконструкций, иссечение рубцовых тканей и пластика области ложного сустава костным аутотрансплантатом из гребня подвздошной кости. Трансплантат плотно внедрен в проксимальный и дистальный отломки локтевого отростка, на трансплантат и костные отломки нанесен биогель, которые укрыты мягкими тканями (Рисунок 4).
в
г
Диаграмма 3. Динамика показателей по шкале SF-36 по группам пациентов после операции: а- физическое функционирование, б- ролевое функционирование, в- боль, г социальное функционирование.
а
б
Рисунок 1. А - рентгенограмма пациентки С., б – вид локтевого сустава перед операцией.
а б
в
Рисунок 2. А-б – рентгенограммы пациентки С., в- вид раны - остеосинтез по Веберу.
б
а
в г
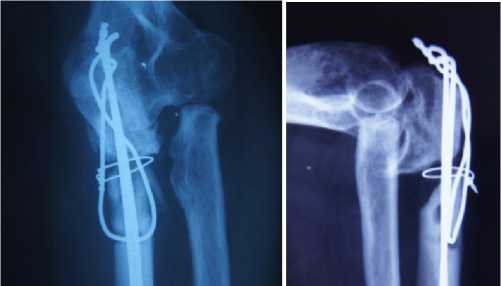
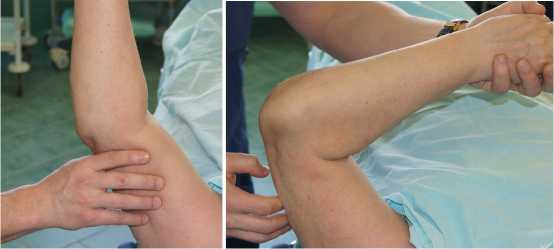
Рисунок 3. Пациентка С. через 6 мес. после остеосинтеза локтевого отростка по Веберу: А-б – рентгенограммы локтевого сустава: ложный сустав локтевого отростка, в-г вид конечности и объем движений в локтевом суставе.
б
в
д
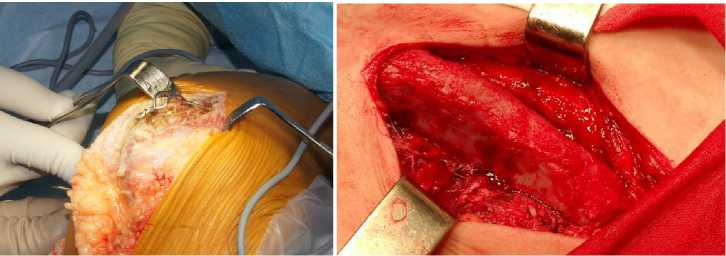
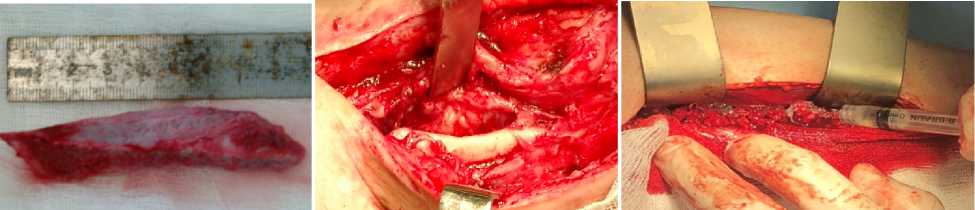
Рисунок 4. Пациентка С., интраоперационная картина: а- удаление проволоки, б- выделение гребня подвздошной кости, в – вид трансплантата, г – трансплантат внедрен в область ложного сустава, вдоль него полость заполняемая биогелем (д).
б
в
д
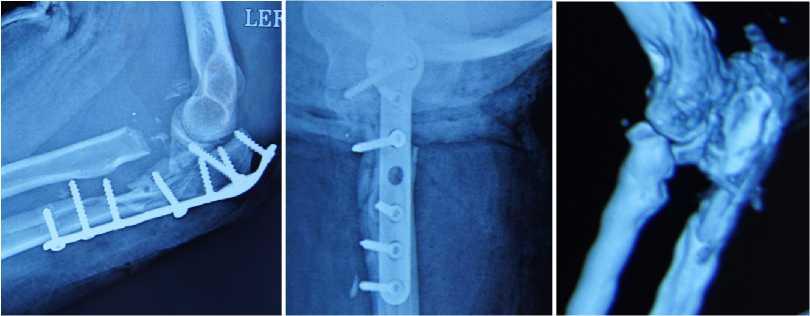
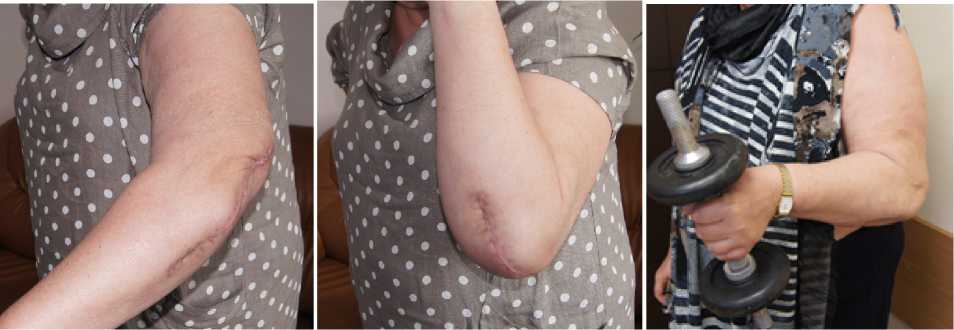
Рисунок 5. Пациентка С., через 8 мес. после пластики; А-б рентгенограммы локтевого сустава, в - 3D КТ реконструкция; г-д вид конечности и е- функциональный результат.
Далее выполнен остеосинтез локтевого отростка пластиной. Проведен курс восстановительной реабилитации и через 8 мес. диагностированы сращение локтевой кости и восстановлена функции левого локтевого сустава: SF-36 89 баллов; DASH – 38 баллов. (Рисунок 5).
Обсуждение
Процесс интеграции живой ткани организма с пластическим материалом отличается в зависимости от его состава и физико-химических свойств. Неорганические имплантаты интегрируются в кость за счет адсорбции на их поверхности ионов и протеинов с последующим формированием биопленки и адгезией клеток [19, 25]. Органические имплантаты интегрируются в кость и замещают дефект ткани за счет прорастания сосудов вглубь ткани имплантата. Такой механизм интеграции, основанный на постепенном замещении имплантата нативной тканью, является наиболее предпочтительным, поэтому использование тканеинженерных конструкций на основе природных полимеров (биомиметиков) является перспективным направлением биоинженерии [17, 23].
Органический компонент костной ткани составляет 45% от всего объема кости и состоит из коллагена (85–90 %), поэтому наличие коллагена в матрице тканеинженерной конструкции будет стимулировать остеорепарацию. Коллаген полимеризуясь образует белковые сферические тела, которые вступают во взаимодействие между собой и образуют прочную полимерную матрицу с 3D-объемной формой. Такая матрица способна менять свою консистенцию от жидкой до желеобразной без нарушения решетчатой структуры, что стимулирует прорастание сосудов, при этом в нормальном состоянии имеет гелеобразную, удобную для использования форму [19, 22, 25, 26].
Вышеописанные свойства гидрогелей придают матрице стабильность и контролируемую резорбцию, а природная биоактивность коллагена способствует неоангиогенезу и пролиферации клеток с остеогенным потенциалом [17, 21, 23].
Для усиления биоактивных свойств материала, а также для внедрения в конструкцию колонии остеогенных клеток авторы уже использовали губчатый аутотрансплантат из крыла подвздошной кости [27].
Губчатая аутокость обладает отличными индуктивными и кондуктивными свойствами, но быстро резорбируется, не успев обеспечить сращение ложного сустава. Применение предлагаемой в исследовании модели тканеинженерной конструкции, состоящей из скаффолда (коллагеновый гидрогель), остеогенной клеточной колонии (губчатая аутокость) с биологически активными веществами (фибриллярные белки, гликозаминогликаны, многочисленные растворимые факторы в области операционной раны), доказывает свою способность к оптимизации репаративной остеорегенерации, что проявилось в ускорении сращения ложного сустава [28]. Однако ввиду особенностей данного исследования (малой выборки, отсутствие рандомизации) факты успешного функционирование тканеинженерной конструкции с матрицей из коллагенового гидрогеля требуют дальнейшего исследования.
Вывод: применение коллагенового гидрогеля в сочетании с губчатым костным аутотрансплантатом позволяет улучшить результаты лечения атрофических ложных суставов костей верхних конечностей сокращая сроки сращения на 20% (р=0,0023) с сохранением функционального результата лечения.
Финансирование: исследование не имело спонсорской поддержки
Funding: the study had no sponsorship
Список литературы Результаты применения биодеградирумых гелей при лечении ложных суставов костей верхних конечностей
- Raven T.F., Moghaddam A., Ermisch C., Westhauser F., R. Heller, T. Bruckner,G. Schmidmaier. Use of Masquelet technique in treatment of septic and atrophic nonunion, Injury (2019), https://doi.org/10.1016/j.injury.2019.06.018
- Matar HE, Ali AA, Buckley S, Garlick NI, Atkinson HD. Surgical interventions for treating fractures of the olecranon in adults (Review) The Cochrane Library 2014, Issue 11 , 50 стр. http://www.thecochranelibrary.com
- Килимнюк Л.А. Прогнозирование нарушения сращения переломов на основании анализа факторов риска детерминированных особенностями пациента//Украинский научно-медицинский молодежный журнал. 2017. № 3 (103). С. 20–24. [Kilimnyuk L.A. Prognozirovanie narusheniya srashcheniya perelomov na osnovanii analiza faktorov riska determinirovannykh osobennostyami patsienta//Ukrainskii nauchno-meditsinskii molodezhnyi zhurnal. 2017. № 3 (103). p. 20–24.]
- Хоминец В.В., Тегза В.Ю., Фоос И.В., Пугаев Э.М. Сравнительный анализ экономических затрат на лечение пациентов, страдающих неинфекционными осложнениями внутреннего остеосинтеза// Вестник Российской Военно-медицинской академии. 2020. № 4 (72). С. 156–160.
- Penn-Barwell JG, Roberts SAG, Midwinter MJ, Bishop JRB. Improved survival in UK combat casualties from Iraq and Afghanistan 2003-2012. Journal of Trauma and Acute Care Surgery. 2015; 78(5): 1014-1020. [Khominets V.V., Tegza V.Yu., Foos I.V., Pugaev E.M. Sravnitel’nyi analiz ekonomicheskikh zatrat na lechenie patsientov, stradayushchikh neinfektsionnymi oslozhneniyami vnutrennego osteosinteza//Vestnik Rossiiskoi Voenno-meditsinskoi akademii. 2020. № 4 (72). p. 156–160]
- Schweizer MA, Janak JC, Graham B. Nonfatal motor vehicle related injuries among deployed US Service members: characteristics, trends, and risks for limb amputation. Journal of Trauma and Acute Care Surgery. 2019; 87(4): 907-914.
- Илизаров Г.А., Шевцов В. И. Бескровный компрессионно-дистракционный остеосинтез при лечении ложных суставов плечевой кости// Военно-медицинский журнал. 1974. Т. 295. № 6. С. 27–31. [Ilizarov G.A., Shevtsov V. I. Beskrovnyi kompressionno-distraktsionnyi osteosintez pri lechenii lozhnykh sustavov plechevoi kosti//Voenno-meditsinskii zhurnal. 1974. T. 295. № 6. p. 27–31.]
- Соколова М. Н. Лечение больных с дефектами и ложными суставами костей предплечья методом чрезкостного остеосинтеза//Автореферат диссертации на соискание ученой степени кандидата медицинских наук / Рос. науч. центр «Восстанов. травматология и ортопедия» им. Г.А. Илизарова. Курган, 2011, 24 стр. [Sokolova M. N. Lechenie bol’nykh s defektami i lozhnymi sustavami kostei predplech’ya metodom chrezkostnogo osteosinteza//Avtoreferat dissertatsii na soiskanie uchenoi stepeni kandidata meditsinskikh nauk / Ros. nauch. tsentr «Vosstanov. travmatologiya i ortopediya» im. G.A. Ilizarova. Kurgan, 2011, 24 p.]
- Ткаченко С. С., Гайдуков В.М. Компрессионный остеосинтез при лечении ложных суставов костей предплечья// Ортопедия, травматология и протезирование №2, 1991. С. 16–20. [Tkachenko S. S., Gaidukov V.M. Kompressionnyi osteosintez pri lechenii lozhnykh sustavov kostei predplech’ya// Ortopediya, travmatologiya i protezirovanie №2, 1991. p. 16–20.]
- Jaloux C., Bettex Q., Levadoux M. et al., Free vascularized medial femoral condyle corticoperiosteal flap with non-vascularized iliac crest graft for the treatment of recalcitrant clavicle non-union, Journal of Plastic, Reconstructive & Aesthetic Surgery, https://doi.org/10.1016/j.bjps.2020.03.018
- Маликов М. Х., Курбанов У. А., Давлатов А.А. Пересадка васкуляризированных костных трансплантатов при травматических дефектах и ложных суставах верхней конечности //Новости хирургии. 2012. Т. 20. № 5. С. 82–90. [Malikov M. Kh., Kurbanov U. A., Davlatov A.A. Peresadka vaskulyarizirovannykh kostnykh transplantatov pri travmaticheskikh defektakh i lozhnykh sustavakh verkhnei konechnosti //Novosti khirurgii. 2012. T. 20. № 5. S. 82–90.]
- Гайворонский И.В., Губочкин Н.Г., Микитюк С.И., Родионов А.А., Горячева И. А. Анатомические обоснования формирования костных трансплантатов на мышечно-сосудистой ножке в нижней трети предплечья и возможностей их перемещения//Вестник Российской Военно-медицинской академии. 2016. № 3 (55). С. 129–134. [Gaivoronskii I.V., Gubochkin N.G., Mikityuk S.I., Rodionov A. A., Goryacheva I. A. Anatomicheskie obosnovaniya formirovaniya kostnykh transplantatov na myshechno-sosudistoi nozhke v nizhnei treti predplech’ya i vozmozhnostei ikh peremeshcheniya//Vestnik Rossiiskoi Voenno-meditsinskoi akademii. 2016. № 3 (55). p. 129–134.]
- Казарезов М.В., Королева А. М., Бауэр И. В., Головнев В. А. Реабилитация больных с инфицированными тканевыми дефектами и псевдоартрозами. Новосибирск: НГМА, 2004. 250 с. [Kazarezov M.V., Koroleva A. M., Bauer I. V., Golovnev V. A. Reabilitatsiya bol’nykh s infitsirovannymi tkanevymi defektami i psevdoartrozami. Novosibirsk: NGMA, 2004. 250 s.]
- Азизов М. Ж., Абдулхаков Н.Т., Рахимов А. М. Хирургические методы лечения ложных суставов костей предплечья//Врач-аспирант. 2013. Т. 57. № 2.2. С. 245–249. [Azizov M. Zh., Abdulkhakov N.T., Rakhimov A. M. Khirurgicheskie metody lecheniya lozhnykh sustavov kostei predplech’ya//Vrach-aspirant. 2013. T. 57. № 2.2. p. 245–249.]
- Агапова О. И., Ефимов А.Е., Мосейнович М.М., Богуш В.Г., Агапов И. И. Сравнительный анализ трехмерной наноструктуры пористых биодеградируемых матриксов из рекомбинантного спидроина и фиброина шелка для регенеративной медицины //Вестник трансплантологии и искусственных органов. 2015. Т. XVII, № 2. C. 37–44.) [Agapova O. I., Efimov A.E., Moseinovich M.M., Bogush V.G., Agapov I. I. Sravnitel’nyi analiz trekhmernoi nanostruktury poristykh biodegradiruemykh matriksov iz rekombinantnogo spidroina i fibroina shelka dlya regenerativnoi meditsiny //Vestnik transplantologii i iskusstvennykh organov. 2015. T. XVII, № 2. p. 37–44.)]
- Севастьянов В. И. Технологии тканевой инженерии и регенеративной медицины //Вестник трансплантологии и искусственных органов. 2014. Т. XVI, № 3. С. 93–108.) [Sevast’yanov V. I. Tekhnologii tkanevoi inzhenerii i regenerativnoi meditsiny //Vestnik transplantologii i iskusstvennykh organov. 2014. T. XVI, № 3. p. 93–108.)]
- Севастьянов В. И. Клеточно-инженерные конструкции в тканевой инженерии и репаративной медицине //Вестник трансплантологии и искусственных органов. 2015. Т. XVII, № 2. С. 127–130.) [Sevast’yanov V. I. Kletochno-inzhenernye konstruktsii v tkanevoi inzhenerii i reparativnoi meditsine//Vestnik transplantologii i iskusstvennykh organov. 2015. T. XVII, № 2. p. 127–130.)]
- Sheikh FA, Ju HW, Moon BM, Lee OJ, Kim JH, Park HJ, et al. Hybrid scaffolds based on PLGA and silk for bone tissue engineering. Journal of tissue engineering and regenerative medicine. 2016; 10(3): 209–221. DOI: 10.1002/term.1989.
- Wong SW, Lenzini S, Bargi R, Feng Z, Macaraniag C, Lee JC, et al. Controlled deposition of 3D matrices to direct single cell functions. Adv Sci (Weinh). 2020; 7(20): 2001066. DOI: 10.1002/advs.202001066.
- Hasany M, Thakur A, Taebnia N, Kadumudi FB, Shahbazi MA, Pierchala MK, et al. Combinatorial screening of nanoclay-reinforced hydrogels: a glimpse of the «Holy Grail» in orthopedic stem cell therapy? ACS Appl Mater Interfaces. 2018; 10(41): 34924–34941. DOI: 10.1021/acsami.8b11436.
- Xin S, Gregory CA, Alge DL. Interplay between degradability and integrin signaling on mesenchymal stem cell function within poly(ethylene glycol) based microporous annealed particle hydrogels. Acta Biomater. 2020; 101: 227–236. DOI: 10.1016/j.actbio.2019.11.009.
- Кузнецова Д. С., Тимашев П. С., Баграташвили В.Н., Загайнова Е.В. Костные имплантаты на основе скаффолдов и клеточных систем в тканевой инженерии (обзор) //Современные технологии в медицине. 2014. Т. 6, № 4. С. 201–212.) [Kuznetsova D. S., Timashev P. S., Bagratashvili V.N., Zagainova E. V. Kostnye implantaty na osnove skaffoldov i kletochnykh sistem v tkanevoi inzhenerii (obzor) //Sovremennye tekhnologii v meditsine. 2014. T. 6, № 4. p. 201–212.)]
- Остеоинтеграция биоактивных имплантов при лечении переломов длинных трубчатых костей: учебное пособие /под ред. Попкова А. В.; Томский политехнический университет. Томск: Изд-во Томского политехнического университета, 2017. 304 с. [Osteointegratsiya bioaktivnykh implantov pri lechenii perelomov dlinnykh trubchatykh kostei: uchebnoe posobie /pod red. Popkova A. V.; Tomskii politekhnicheskii universitet. Tomsk: Izd-vo Tomskogo politekhnicheskogo universiteta, 2017. 304 p.]
- Gandhimathi C, Venugopal JR, Tham AY, Ramakrishna S, Kumar SD. Biomimetic hybrid nanofibrous substrates for mesenchymal stem cells differentiation into osteogenic cells. Mater Sci Eng C Mater Biol Appl. 2015; 49: 776-785. DOI: 10.1016/j.msec.2015.01.
- Balasubramanian P, Prabhakaran MP, Sireesha M, Ramakrishna S. Collagen in human tissues: structure, function, and biomedical implications from a tissue engineering perspective. Advances in Polymer Science. 2013; 251: 173-206.
- Lenzini S, Bargi R, Chung G, Shin JW. Matrix mechanics and water permeation regulate extracellular vesicle transport. Nat Nanotechnol. 2020; 15(3): 217-223. DOI: 10.1038/s41565-020-0636-2.
- Чирва Ю.В., Бабич М. И., Аль-Ханих Мурад. Репаративная регенерация дефекта кости при помощи скаффолд-технологий у онкоортопедического больного (клинический случай) //Гены и Клетки. 2020. Т. 15, № 3. C. 71-77.
- Давыдов Д. В., Чирва Ю.В., Брижань Л.К., Бабич М. И., Федуличев П.Н., Аль-Ханих М.А. Перспективный метод восстановления костной ткани у пострадавших с тяжелыми нарушениями остеорегенерации (опыт клинического применения скаффолд-технологий) //ПОЛИТРАВМА / POLYTRAUMA. 2021. № 1, С. 41–50. DOI: 10.24411/1819-1495-2020-10005. [Davydov D. V., Chirva Yu.V., Brizhan’ L.K., Babich M. I., Fedulichev P.N., Al’-Khanikh M.A. Perspektivnyi metod vosstanovleniya kostnoi tkani u postradavshikh s tyazhelymi narusheniyami osteoregeneratsii (opyt klinicheskogo primeneniya skaffold-tekhnologii)//POLITRAVMA / POLYTRAUMA. 2021. № 1, S. 41–50. DOI: 10.24411/1819-1495-2020-10005.]


