Результаты применения двухпучковой пластики передней крестообразной связки синтетическим имплантатом при ее полном разрыве
Автор: Шорманов A.M., Бахтеева Н.Х., Садыков Р.Ш., Норкин А.И., Чибриков А.Г.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Травматология и ортопедия
Статья в выпуске: 4 т.11, 2015 года.
Бесплатный доступ
Цель: улучшить результаты хирургического лечения больных с полным разрывом передней крестообразной связки путем её двухпучковой пластики синтетическим имплантатом. Материал и методы. Объектом исследования явились 7 пациентов с полным разрывом передней крестообразной связки, которым осуществили двухпучковую пластику с использованием эндопротеза из синтетического материала Дона-М. Результаты. Применение двухпучковой пластики передней крестообразной связки с использованием эндопротеза из синтетического материала Дона-М позволило достичь абсолютной стабильности коленного сустава в первые часы после операции и полностью восстановить объем движений в коленном суставе в срок до 6 месяцев. Заключение. Применение двухпучковой пластики передней крестообразной связки является анатомически обоснованным, а также обеспечивает надежную стабилизацию коленного сустава, возможность ранней активизации и реабилитации пациентов.
Передняя крестообразная связка, разрыв, синтетический материал дона-м, эндопротез
Короткий адрес: https://sciup.org/14918200
IDR: 14918200
Текст научной статьи Результаты применения двухпучковой пластики передней крестообразной связки синтетическим имплантатом при ее полном разрыве
1Введение. Частота повреждений капсульно-связочного аппарата коленного сустава достигает 50% всех травм суставов [1]. В структуре повреждений связок коленного сустава ведущее место занимают травмы передней крестообразной связки (ПКС), так как она является основным внутрисуставным стабилизатором [2]. Так, по данным разных авторов, пациенты с изолированными и сочетанными повреждениями ПКС составляют от 0,3 до 1,0% от всего населения России [3, 4, 5].
Учитывая высокую частоту повреждений передней крестообразной связки, в настоящее время описано около 250 методик хирургического восстановления ПКС, которые подразумевают ее замещение трансплантатом из собственных тканей (собственная связка надколенника, сухожилие полусухожильной мышцы, сухожилие тонкой мышцы, сухожилие четырехглавой мышцы), донорским (аллоткани) или синтетическим материалом (лавсан, полиэстер, синтетический материал Дона-М) [9]. Значительное разнообразие используемых методик свидетельствует о необходимости разработки новых, более эффективных и малотравматичных способов пластики, а также приоритетности использования ауто- или аллотканей [6].
Инновационным прорывом в области хирургии коленного сустава явилось применение нового поколения синтетических связок LARS®, используемых для пластики ПКС. Подтверждением этому явилось проведенное 5-летнее наблюдение, которое не выявило послеоперационного синовита ни у одного из пациентов [7].
Ряд авторов, обладающих опытом использования синтетических эндопротезов, рекомендуют воссоздавать оперативным путем изначальную анатомию ПКС, устанавливая не один, а два трансплантата, которые будут заменять переднемедиальный и заднелатеральный пучки [8]. Другие авторы указывают, что главным недостатком такой операции является её значительное техническое усложнение [9].
Таким образом, лечение больных с повреждением ПКС коленного сустава в настоящее время является актуальной проблемой травматологии.
Цель: улучшить результаты хирургического лечения больных с полными разрывами ПКС путем её двухпучковой пластики синтетическим имплантатом Дона-М.
Материал и методы. Объектом исследования явились 7 пациентов обоего пола с полным разрывом ПКС в возрасте 31±7,9 года, находившихся на лечении в травматолого-ортопедическом отделении ФГБУ «СарНИИТО» Минздрава России в период 2013–2014 гг. Повреждение ПКС возникло в результате бытовой травмы у 4 (57,1%) больных, занятий спортом — у 3 (42,9%). Критериями включения пациентов в исследование были наличие полного разрыва ПКС, подтвержденного данными магнитно-резонансной томографии, а также положительные симптомы Лахмана, переднего «выдвижного ящика» и pivot shift тест. Всем больным выполнили двухпучковую пластику ПКС синтетическим имплантатом Дона-М по оригинальной методике (патент № 2506057 от 10 февраля 2014 г.). Для этого больных укладывали на операционном столе со свешенными голенями. Осуществляли переднелатеральный доступ в коленный сустав, через который вводили артроскоп. Затем осуществляли переднемедиальный доступ, через ко-
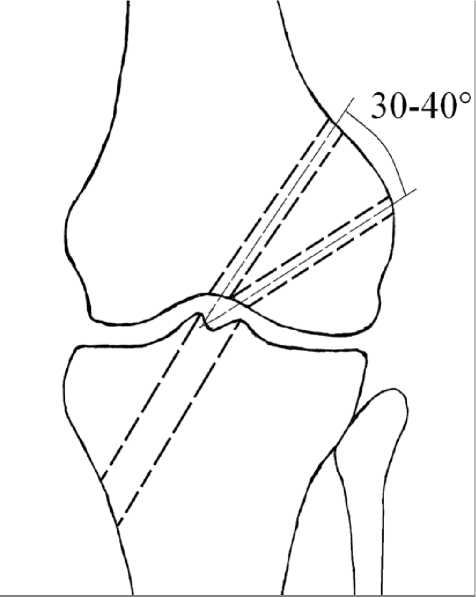
Рис. 1. Формирование каналов в бедренной кости торый под контролем артроскопа в коленный сустав вводили транстибиальный направитель. По последнему, в направлении снутри кнаружи и снизу вверх под углом 50-60̊, проводили направляющую спицу к месту анатомического выхода ПКС у возвышенности большеберцовой кости. По направляющей спице канюлированным сверлом формировали сквозной канал диаметром 8 мм. При сгибании в коленном суставе 100–110° в сформированный канал вводили бедренный направитель, по которому проводили направляющую спицу в наружный мыщелок бедренной кости с его внутренней поверхности через место анатомического прикрепления ПКС. Бедренный направитель извлекали. По направляющей спице канюлированным сверлом формировали сквозной первый канал в эпифизе бедренной кости диаметром 4 мм. При сгибании в коленном суставе 80–90° с использованием того же бедренного направителя, в наружный мыщелок бедренной кости вводили направляющую спицу на 1 см выше по его высоте. По спице канюлированным сверлом диаметром 4 мм формировали второй сквозной канал в эпифизе бедренной кости таким образом, чтобы продольные оси первого и второго каналов образовали угол 30–40° (рис. 1).
В проекции наружных отверстий каналов в эпифизе бедренной кости выполняли разрез кожи для их визуализации, соответствующий кратчайшему расстоянию между ними. Затем осуществляли установку трансплантата. В качестве трансплантата использовали эндопротез ПКС из синтетического материала Дона-М. Для этого проводили с помощью гибкой ни-тиноловой ушковой спицы-проводника трансплантат через канал большеберцовой кости в полость сустава и через один из каналов бедренной кости с выходом на её наружную сторону. После аналогичным образом проводили трансплантат назад в сустав через свободный канал бедренной кости, обеспечивая перекидывание трансплантата через участок кортикального слоя между наружными отверстиями каналов в эпифизе бедренной кости, и выводили трансплантат наружу через канал большеберцовой кости. Осуществляли фиксирование концов трансплантата путем введения интер-ферентного винта в канал в эпифизе большеберцовой кости со стороны его наружного отверстия (рис. 2).
В первые часы после операции применяли локальную гипотермию области коленного сустава. Иммобилизацию не применяли. Активизацию больных проводили на 2-е сутки после операции. Больные передвигались с дополнительной опорой на костыли сроком до двух недель. В послеоперационном периоде проводили пункции коленного сустава по поводу гемартроза, а также симптоматическую и антибактериальную терапию. Тестирование связок коленного сустава проводили в первые часы после операции (под действием анестезии), а также через 3 и 6 месяцев.
Результаты. В первые часы после операции у всех семи больных признаков нестабильности коленного сустава выявлено не было, тесты на повреждение ПКС были отрицательные. Дефицит сгибания в коленном суставе составил 25±5%. Гемартроз купировался у 5 (71,4%) больных на 3±1 сутки, у 2 (28,6%) — сохранялся до 5±1 суток.
К 3-му месяцу после операции у всех больных признаков нестабильности коленного сустава не отмечали, тесты переднего выдвижного ящика, Лахмана, pivot shift также были отрицательными. Объем движений в коленном суставе был восстановлен полностью у 5 (71,4%) больных, у 2 (28,6%) — дефицит движений в суставе составил 20%. Воспалительных реакций в коленном суставе не отмечали.
К 6-му месяцу после операции все больные вернулись к повседневному уровню физической активности, вплоть до занятий контактными видами спорта. Тестирование связок показало абсолютную стабильность в суставе. У всех больных восстановился полный объем движений в коленном суставе.
С целью демонстрации эффективности применяемой нами двухпучковой пластики ПКС при ее полных разрывах приводим клинический пример.
Больной Ч., 35 лет . Поступил в травматолого-ортопедическое отделение с диагнозом: «Разрыв ПКС правого коленного сустава». Травму получил при занятии спортом. Клинически определялась болезненность, отек, ограничение функции правого коленного сустава. При объективном осмотре выявлялись положительные симптомы Лахмана, переднего выдвижного ящика и pivot shift тест. При магнитно-резонансной томографии был выявлен полный разрыв ПКС правого коленного сустава, признаки гемартроза. Выполнена операция: артроскопическая пластика ПКС по предложенной оригинальной методике (рис. 3). Признаков нестабильности коленного сустава в первые часы после операции выявлено не было (рис. 4). На второй день после операции больному разрешили ходить при помощи костылей с частичной нагрузкой (до 50% веса) на оперированную ногу. При этом внешняя иммобилизация конечности не потребовалась. Гемартроз купировался на третьи сутки. Амплитуда движений в коленном суставе была ограничена на 30%. Больной был выписан на 7-е сутки после операции без признаков нестабильности в суставе. К 3-му месяцу после операции нестабильности в коленном суставе больной не отмечал, передвигался без дополнительной опоры, не хромая. Движения в коленном суставе были безболезненны и восстановлены в полном объеме. К 6-му месяцу после операции нестабильности в коленном суставе
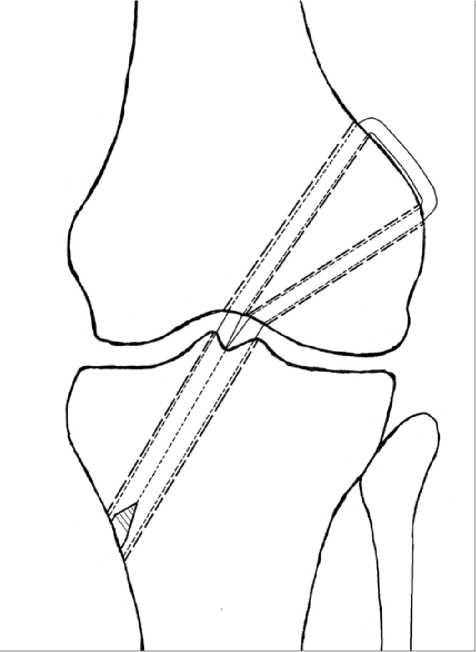
Рис. 2. Схематический вид установки трансплантата
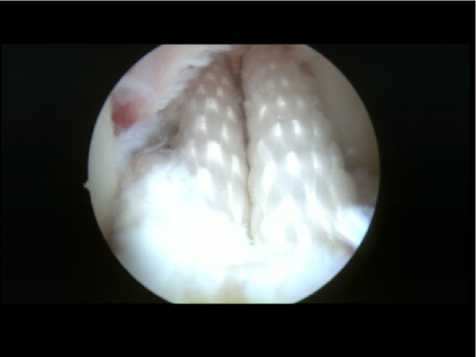
Рис. 3. Эндофото. Артроскопия коленного сустава. Внешний вид двухпучкового трансплантата ПКС также не было. Движения в коленном суставе были безболезненны и сохранялись в полном объеме. Больной возобновил занятия футболом с полной нагрузкой на оперированную ногу.
Обсуждение. Формирование двух каналов в эпифизе бедренной кости и одного канала в эпифизе большеберцовой кости с заданным месторасположением и определёнными размерами, а также осуществление установки трансплантата через сформированные каналы по разработанной нами методике позволяют восстановить анатомо-физиологические особенности неповреждённой ПКС, имеющей V-образную форму, сократив число фиксаторов, являющихся инородными телами, до одного без
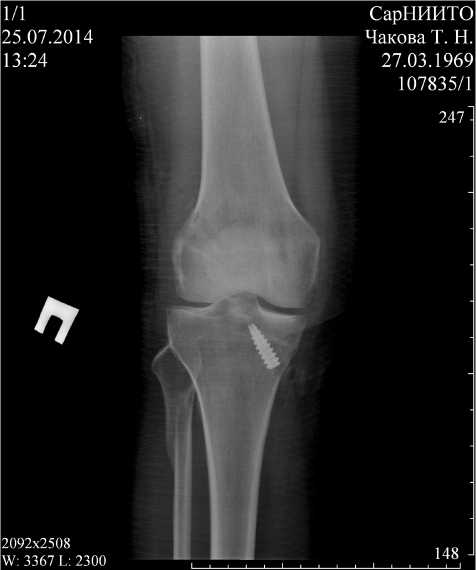
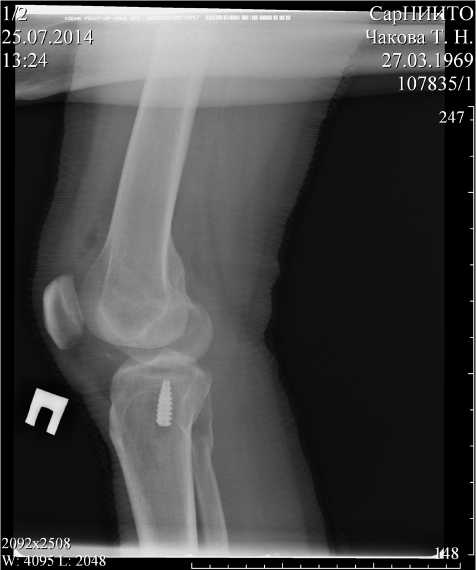
Рис. 4. Рентгенограмма правого коленного сустава в двух проекциях больного Ч., 35 лет. Ds: «Разрыв передней крестообразной связки» через 3 месяца после операции: артроскопическая двухпучковая пластика ПКС потери прочности фиксации, тем самым уменьшив травматичность проводимого лечения и снизив риск возникновения послеоперационных осложнений. Это соответствует рекомендациям, приводимым в работе А. А. Ахпашева (2009) о необходимости снижения травматичности выполняемых пластических операций на ПКС [9]. Осуществление фиксирования трансплантата в эпифизе бедренной кости пу- тем обеспечения его перекидывания через участок кортикального слоя между наружными отверстиями каналов позволяет повысить прочность фиксации за счет исключения возможности проскальзывания трансплантата в полость коленного сустава, а следовательно, снизить риск возникновения рецидива нестабильности коленного сустава до минимума [10].
Заключение. Применение двухпучковой пластики ПКС является анатомически обоснованным, так как повторяет анатомическое строение ПКС человека, а также обеспечивает надежную стабилизацию коленного сустава, возможность ранней активизации и реабилитации пациентов.
Список литературы Результаты применения двухпучковой пластики передней крестообразной связки синтетическим имплантатом при ее полном разрыве
- Котельников Г.П., Чернов А.П., Измалков С.Н. Нестабильность коленного сустава. Самара: Самарский дом печати, 2001; 267 с.
- Королев А.В. Комплексное восстановительное лечение пациентов с повреждениями менисков и связок коленного сустава с использованием артроскопических методик: дис.... д-ра мед. наук. Москва, 2004; 364 с.
- Лазишвили Г.Д., Кузьменко В.В., Гиршин В.Э. Артроскопическая реконструкция передней крестообразной связки коленного сустава. Вестник травматологии и ортопедии им. Приорова Н.Н. 1997; (1): 23-27
- Федорук Г.В. Артроскопическая пластики передней крестообразной связки коленного сустава ауг-ментированным hamstring трансплантатом: автореф. дис.... канд. мед. наук. Москва, 2013; 18 с.
- Федорук Г.В., Голева А.В., Бровкин С.С., Невзоров A.M. Современные технологии в эндопротезировании передней крестообразной связки коленного сустава. Земский врач 2012; 13 (2): 21-23
- Рябинин M.B. Обоснование тактики лечения больных с частичным повреждением передней крестообразной связки коленного сустава: автореф. дис.... канд. мед. наук. Санкт-Петербург, 2009; 4 с.
- Steckel Н., Starman JS., Baums МН., et al. Anatomy of the anterior cruciate ligament double bundle structure: a macroscopic evaluation. Scand J Med Sci Sports 2007; (17): 387-392
- Дубров В.Э. Хирургическая коррекция крестообразных и коллатеральных связок коленного сустава в остром периоде травмы (клинико-экспериментальное исследование): дис.... д-ра. мед. наук. Москва, 2003; 434 с.
- Ахпашев А.А. Выбор оптимального метода фиксации трансплантата при артро-скопической пластике передней крестообразной связки: автореф. дис.... канд. мед. наук, Москва, 2008; 166 с.
- Шорманов A.M., Богатое В.Б., Садыков Р.Ш. Удаление импланта после пластики передней крестообразной связки. Врач -аспирант 2014; 6.1 (67): 130-135.


