Результаты применения иммунотерапевтических препаратов при немелкоклеточном раке легкого в реальной клинической практике
Автор: Моисеенко Ф. В., Волков Н. М., Абдулоева Н. Х., Левченко Н. В., Чубенко В. А., Жабина А. С., Чернобривцева В. В., Шугинова Т. Н., Шелехова К. В., Хенштейн В. А., Степанова М. Л., Крамчанинов М. М., Белухин С. А., Хабичева А. М., Артемьева Е. В., Носова М. В., Тулейко В. М., Моисеенко В. М.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Диагностика и лечение опухолей. Состояние проблемы
Статья в выпуске: 1 т.10, 2020 года.
Бесплатный доступ
Совершенствование лекарственной терапии злокачественных опухолей позволяет существенно увеличить продолжительность жизни пациентов, но неминуемо ведет на ранних этапах внедрения к повышению затрат на лекарственное обеспечение. Ни одна из стран мира на настоящий момент не может позволить себе полное обеспечение новейшими лекарственными препаратами всех больных. Двукратное увеличение расходов на лекарственное лечение на территории РФ в течение 2019 года позволило обеспечить современными препаратами 70% нуждавшихся пациентов немелколеточным раком легкого (НМРЛ). Цель. Оценить клиническую эффективность различных методов лекарственной терапии рака легкого в реальной клинической практике. Материалы и методы. В анализ включались пациенты с гистологически верифицированным неоперабельным НМРЛ, получавшие первую или вторую линию терапии в 2018-2019 гг. В исследование были включены 287 пациентов с НМРЛ: 230 больных для оценки эффективности первой линии, 100 - второй. Были оценены: время без прогрессирования, общая выживаемость, частота объективных ответов. Результаты. Применение ингибиторов контрольных точек в любом из зарегистрированных вариантов (первая линия при PD-L1 > 1%, химиоиммунотерапия независимо от статуса PD-L1, вторая линия независимо от статуса PD-L1) позволяет снизить одногодичную летальность с 61% до 33%, однако приводит к достоверному увеличению затрат на лекарственное обеспечение (р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Немелкоклеточный рак легкого, иммунотерапия, финансирование, лекарственная терапия
Короткий адрес: https://sciup.org/140251217
IDR: 140251217 | DOI: 10.18027/2224-5057-2020-10-1-5-20
Текст научной статьи Результаты применения иммунотерапевтических препаратов при немелкоклеточном раке легкого в реальной клинической практике
Рак легкого является одной из самых частых и смертоносных солидных опухолей [1,4]. Принципиально в структуре опухолей легкого выделяется мелкоклеточный рак (МРЛ), характеризующийся высокой первичной чувстви-
тельностью к лекарственной и лучевой терапии, а также крайне высокой частотой рецидивов заболевания несмотря на первичный ответ, а также немелкоклеточный рак (НМРЛ), составляющий 70–80% всех первичных опухолей легкого. НМРЛ, в свою очередь, является крайне гетерогенным заболеванием.
РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ ИММУНОТЕРАПЕВТИЧЕСКИХ ПРЕПАРАТОВ ПРИ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГО В РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКЕ
Диагностика и лечение опухоли. Состояние проблемы
Применяемые в настоящий момент алгоритмы лекарственной терапии базируются на клинических рекомендациях, разработанных профессиональным сообществом и относительно недавно одобренных Минздравом РФ. С целью обеспечения больных РФ наиболее современными возможностями терапии, рекомендации регулярно обновляются с учетом новых данных, полученных в крупных международных клинических исследованиях. Нам представляется крайне важным, что актуальные рекомендации включают весь спектр лекарственных комбинаций от старых вариантов, до наиболее современных препаратов, преимущество которых было показано относительно недавно. Новейшие варианты лечения, обладая неоспоримым и доказанным преимуществом
относительно более старых, практически всегда имеют значимый недостаток — значительно более высокую стоимость. К сожалению, выбор в пользу более эффективных вариантов лечения зачастую не регламентирован клиническими факторами, а основан на доступности конкретного варианта лечения в рамках ОМС отдельного региона. При этом, до настоящего момента, определение затрат на обеспечение лечения основан не на расчетах необходимого объема лекарственных препаратов для отдельно взятого региона и регламентации наиболее эффективных из финансово доступных лекарственных схем для конкретных категорий пациентов, а исходя из эпидемиологической ситуации и финансовых возможностей региона.
МАТЕРИАЛЫ И МЕТОДЫ
Целью исследования было оценить клиническую эффективность различных методов лекарственной терапии рака легкого в реальной клинической практике. Для достижения поставленной цели было запланировано решение нескольких задач
-
1. Оценить влияние различных методов лекарственной терапии на отдаленные и непосредственные показатели лечения НМРЛ (частоту объективных ответов (ЧОО), время без прогрессирования (ВБП), общую выживаемость (ОВ),)
-
2. Оценить затраты на различные варианты лекарственной терапии первой и второй линии
Анализ эффективности различных вариантов лекарственной терапии рака легкого был проведен на основании собранных ретроспективно клинических данных о больных, зарегистрированных в медицинской информационной системе и получавших лечение по поводу неоперабельного рака легкого на базе ГБУЗ «СПб КНПЦ СВМП (о)».
В анализ включались пациенты с гистологически верифицированным неоперабельным НМРЛ, получавшие первую или вторую линию терапии в 2018– 2019 гг. CONSORT диаграмма включения больных в исследование представлены на рис. 1.
Первая линия терапии
Вторая линия терапии
Анализ эффективности
Больные НМРЛ, получавшие первую линию терапии в 2018-2019 гг.
2018—128 2019—102
Цитостатическая терапия 76 • Монохимиотерапия (27)
с препаратами платины /о «Иммунотерапия (40)
• Таргетная терапия (9)
Включены в анализ эффективности второй линии НМРЛ
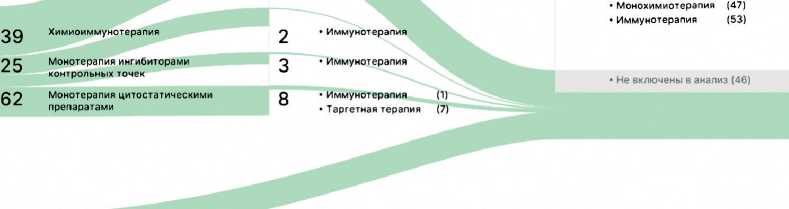
Больные НМРЛ, получавшие первую линию терапии до 2018 гг., а вторую линию терапии в 2018-2019 гг.

Рисунок 1. Диаграмма включения больных с НМРЛ в анализ эффективности первой и второй линий системной терапии.
Все пациенты получали лечение в соответствие с рекомендациями RUSSCO от 2018 года и клиническими рекомендациям АОР от 2019 года [2,3]. С целью исследования эффективности первой линии проведенного лечения были выделены следующие категории противоопухолевой терапии: монохимиотерапия (пероральный этопозид, ви-норельбин), платиновые дуплеты (паклитаксел + карбоплатин (ТС) +/ — бевацизумаб, цисплатин/карбоплатин
РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ ИММУНОТЕРАПЕВТИЧЕСКИХ ПРЕПАРАТОВ ПРИ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГО
В РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКЕ
Диагностика и лечение опухоли. Состояние проблемы
+ гемцитабин, цисплатин/карбоплатин + пеметрексед, этопозид + цисплатин), иммунохимиотерапия (пембро-лизумаб + пеметрексед + карбоплатин, пембролизумаб + ТС, атезолизумаб + бевацизумаб + ТС), иммунотерапия (пембролизумаб).
Выбор между монотерапией и дуплетом с препаратом платины осуществлялся в зависимости от состояния пациента на момент определения тактики лечения: больным с выраженной сопутствующей патологией и/или ECOG-2 проводилась монотерапия. Подавляющее большинство режимов, включавших ингибиторы контрольных точек, были назначены в 2019 году в соответствие со следующими принципами: — при наличии данных ИГХ окраски PD-L1 (DAKO 22C3 и VENTANA PD-L1 (SP263)) и экспрессией ≥ 50% проводилась монотерапия пембролизумабом; — при экспрессии менее 50% или отсутствие возможности выполнения исследования рекомендовалась комбинированная химиоммунотерапия.
Среди пациентов, получавших вторую линию лекарственной терапии, были выделены две группы: химиотерапии и иммунотерапии. Во второй линии большинство пациентов получали монохимиотерапию: пероральный этопозид, винорельбин, CCNU, и лишь у 5 из 100 пациентов проводилась полихимиотерапия дуплетами на основе препаратов платины. Иммунотерапия во второй линии применялась в соответствии с инструкцией к препаратам: ниволумаб и атезолизумаб всем пациентам без учета уровня экспрессии PD-L1, пембролизумаб — больным с экспрессией PD-L1 ≥ 1%.
Оценка эффективности проведенного лечения производилась в соответствие с рутиной клинической практикой — методом спиральной компьютерной томографии с внутривенным контрастированием при отсутствии противопоказаний. Визуализации подвергались зоны с наличием опухолевых очагов на момент начала лечения. Эффект проводимой терапии оценивался в соответствие с критериями RECIST 1.1 [5]. Выживаемость без прогрессирования на фоне первой линии терапии рассчитывалось от первого дня первого цикла терапии до регистрации прогрессирования по данным очередной компьютерной томографии, появления клинических признаков прогрессирования заболевания или смерти, если она была констатирована без подтверждения прогрессирования болезни объективными методами. Выживаемость без прогрессирования на фоне второй линии терапии оценивалось как время от первого дня первого цикла второй линии и до регистрации прогрессирования при очередном клиническом обследовании или клинического ухудшения пациента. Общая выживаемость больных рассчитывалась от первого дня первого цикла первой линии терапии до даты его смерти или даты последнего контакта с пациентом. Доля больных без прогрессирования на шесть и девять месяцев рассчитывалась на основании актуальной таблицы дожития, сравнение показателей проведено с помощью теста Вилкоксона. С целью сравнения агрессивности течения заболевания у больных, получавших вторую линию
терапии по поводу НМРЛ, между различными ее вариантами был расcчитан показатель длительности метастатического заболевания, определявшийся от даты установки диагноза метастатического заболевания до первого дня первого цикла второй линии терапии.
Расчет стоимости лечения производился на основании тарифов для законченных случаев КСГ, выставленных на отдельного пациента в соответствие с классификатором для Санкт-Петербурга, актуального в 2020 году.
Достоверность статистических различий между номинальными величинами оценивалась методом хи-квадрат, для непрерывных величин — т-тест или дисперсионный анализ (ANOVA), для множественных сравнений — с поправкой Бонферони. Исследование показателей выживаемости производилось моделированием методом Ка-плана– Мейера, сравнение статистической достоверности выявленных различий — методом log-rank.
РЕЗУЛЬТАТЫ
Всего в исследование было включено 287 пациентов с НМРЛ. Клинические характеристики и различия в их частоте среди включенных пациентов представлены в табл. 1, 2 и 3.
У 128 пациентов проведение первой линии лечения было начато в 2018 году, а у 102 — в 2019 году. Все больные, которые получали тот или иной вариант иммунотерапии в первой линии начали лечение в 2019 году. Длительность наблюдения была достоверно выше в группе полихимиотерапии, чем в других группах — 9,2 месяца против 6,6 для монохимиотерапии, 5,5 месяцев для химиоиммунотерапии и 5,3 месяца для моноиммунотерапии. Среднее число циклов химиотерапии составило 2,9 (1–9), 4,1 (1–7) и 4,2 (1–8) для монохимиотерапии, химиотера-пиии с платиновыми дуплетами и химиоиммунотерапии, соответственно.
Отдаленные и непосредственные показатели эффективности первой линии терапии НМРЛ
Эффективность первой линии терапии НМРЛ была оценена у 230 пациентов. лечение которым было инициировано в 2018–2019 гг. Использованные варианты терапии были принципиально разделены на четыре группы: монохимиотерапия (имелись данные о 62 пациентах), комбинированная цитостатическая терапия на основе препаратов платины (n = 104), химиоиммунотерапия (n = 39) и монотерапия ингибиторами контрольных точек (n = 25). Клинические характеристики больных представлены в табл. 1. Существенных различий между группами с точки зрения полового и возрастного распределения (за исключением достоверно более пожилого возраста группы пациентов, получавших монохимиотерапию), стадий, метастатического поражения головного мозга, а также распределения гистологических форм не наблюдалось. Важно отметить, что селекция боль-
РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ ИММУНОТЕРАПЕВТИЧЕСКИХ ПРЕПАРАТОВ ПРИ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГО
В РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКЕ
Диагностика и лечение опухоли. Состояние проблемы
Таблица 1. Клиническая характеристика больных НМРЛ, включенных в анализ эффективности первой линии терапии
|
Характеристика |
МоноХТ |
ХТ |
ХИТ |
ИТ |
р |
Всего |
|||||
|
(n = 62) |
% |
(n = 104) |
% |
(n = 39) |
% |
(n = 25) |
% |
(n = 230) |
% |
||
|
Пол |
0,201 |
||||||||||
|
М |
52 |
83,9% |
83 |
79,8% |
29 |
74,4 % |
16 |
64,0% |
180 |
78,3% |
|
|
Возраст |
0,000 * |
||||||||||
|
Средний (мин-макс) |
69,2 (49–82) |
63,8 (38–89,8) |
60,7 (32,5 – 75,4) |
65,4 (46,7–80) |
64,9 (32,5–89,8) |
||||||
|
Гистологическая форма |
0,391 |
||||||||||
|
Аденокарцинома |
25 |
40,3% |
39 |
37,5% |
23 |
59,0% |
13 |
52,0% |
100 |
43,5% |
|
|
Плоскоклеточный |
33 |
53,2% |
54 |
51,9% |
14 |
35,9% |
12 |
48,0% |
113 |
49,1% |
|
|
Крупноклеточный |
1 |
1,6% |
6 |
5,8% |
1 |
2,6% |
0 |
0,0% |
8 |
3,5% |
|
|
Другие |
2 |
3,2% |
5 |
4,8% |
1 |
2,6% |
0 |
0,0% |
8 |
3,5% |
|
|
PD-L1 ИГХ |
0,000 |
||||||||||
|
0 |
0 |
0,0% |
9 |
8,7% |
4 |
10,3% |
1 |
4,0% |
16 |
7,0% |
|
|
1–49 |
1 |
1,6% |
7 |
6,7% |
8 |
20,5% |
3 |
12,0% |
24 |
10,4% |
|
|
>= 50 |
0 |
0,0% |
2 |
1,9% |
4 |
10,3% |
18 |
72,0% |
66 |
28,7% |
|
|
Не оценен |
61 |
98,4% |
86 |
82,7% |
23 |
59,0% |
3 |
12,0% |
124 |
53,9% |
|
|
Стадия НМРЛ |
0,600 |
||||||||||
|
III |
20 |
32,3% |
27 |
26,0% |
8 |
20,5% |
6 |
24,0% |
61 |
26,5% |
|
|
IV |
42 |
67,7% |
77 |
74,0 % |
31 |
79,5% |
19 |
76,0% |
169 |
73,5% |
|
|
Мтс в головном мозге до начала терапии |
0,663 |
||||||||||
|
9 |
12,0% |
12 |
8,2% |
2 |
5,0% |
0 |
0,0% |
23 |
8,0% |
||
|
Вариант иммунотерапии |
0,000 |
||||||||||
|
Нет |
62 |
100% |
104 |
100% |
0 |
0% |
0 |
0% |
166 |
72,2% |
|
|
Пембролизумаб |
0 |
0% |
0 |
0% |
19 |
48,7% |
23 |
92,0% |
42 |
18,3% |
|
|
Ниволюмаб |
0 |
0% |
0 |
0% |
0 |
0,0% |
1 |
4,0% |
1 |
0,4% |
|
|
Атезолизумаб |
0 |
0% |
0 |
0% |
20 |
51,3% |
1 |
4,0% |
21 |
9,1% |
|
|
Схема терапии 1-й линии |
0,000 |
||||||||||
|
ТС |
0 |
0,0% |
53 |
51,0% |
18 |
46,2% |
0 |
0,0% |
71 |
30,9% |
|
|
ТС + bev |
0 |
0,0% |
5 |
4,8% |
15 |
38,5% |
0 |
0,0% |
20 |
8,7% |
|
|
CDDP+Gem |
0 |
0,0% |
15 |
14,4% |
0 |
0,0% |
0 |
0,0% |
15 |
6,5% |
|
|
CDDP/Cb+Pem |
0 |
0,0% |
16 |
15,4% |
4 |
10,3% |
0 |
0,0% |
10 |
8,7% |
|
|
EP |
0 |
0,0% |
9 |
8,7% |
2 |
5,1% |
0 |
0,0% |
11 |
4,8% |
|
|
Другие схемы |
0 |
0,0% |
6 |
5,8% |
0 |
0,0% |
0 |
0,0% |
6 |
2,6% |
|
|
Монотерапия без платины (этопозид, винорельбин) |
62 |
100% |
0 |
0% |
0 |
0% |
0 |
0% |
62 |
27,0% |
|
Примечания. МоноХТ – монотерапия цитостатическими препаратами (этопозид. винорельбин), ХТ – комбинированная цитостатическая терапия платиновыми дуплетами, ХИТ – комбинированная терапия платиновым дуплетом и ингибитором контрольных точек, ИТ – монотерапия ингибитором контрольных точек.
ных для определения тактики лечения на основании уровня PD-L1 была активно внедрена в клиническую практику в 2019 году, что определяет достоверное большее число пациентов, которым оценка этого критерия была проведена в группах химиоиммунотерапии и иммунотерапии.
Показатели эффективности первой линии терапии НМРЛ представлены в табл. 2. Существенных различий в зависимости от гистологической формы опухоли выявлено не было, в связи с чем далее эффективность
оценивалась для всей группы НМРЛ в целом. Сравнение ЧОО выявило существенное преимущество режимов с иммунотерапевтическим компонентом. Так, частота и полных, и частичных регрессов была выше в группах с применением иммунотерапии (рис. 1). Максимальные показатели ЧОО (33,3%) были выявлены при применении иммунотерапии в отобранной на основании высокой экспрессии PD-L1 группе пациентов. Ожидаемо наихудшие показатели и ЧОО, и ВБП показала монохимиотерапия,
РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ ИММУНОТЕРАПЕВТИЧЕСКИХ ПРЕПАРАТОВ ПРИ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГО В РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКЕ
Диагностика и лечение опухоли. Состояние проблемы что, по-видимому, может быть связано с селекцией больных с более выраженной сопутствующей патологией для этого менее агрессивного и токсичного варианта терапии. Так, ВБП в числовом значении была ниже в группе монотерапии — (4,87 мес (95% ДИ 3,36–6,37) при сравнении с остальными группами, объединенными вместе 6,87 (95% ДИ 6,43–7,31), р = 0,054), достоверные различия в пользу более агрессивных подходов были выявлены
и в ЧОО (10% против 16,7–33,3%, р < 0,000) и в общей продолжительности жизни больных (7,4 мес. (95% ДИ 4,98–9,81) против 29,4 (95% ДИ 14,5–44,3), р < 0,000). При этом статистически достоверные различия во времени до прогрессирования болезни были выявлены только между монохимиотерапией и моноиммунотерапией (р = 0,001). Графическая интерпретация результатов представлена на рис. 2–6.
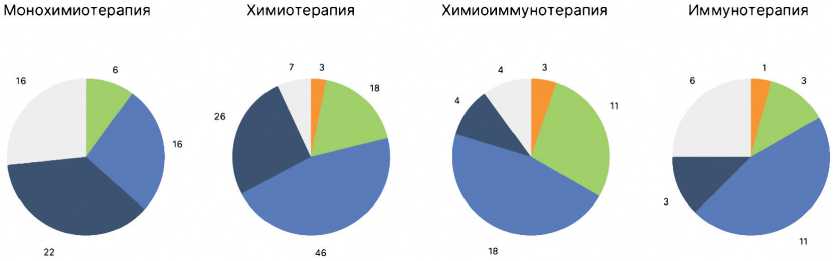
Таблица 2. Показатели эффективности и особенности первой линии терапии больным НМРЛ
|
Характеристика |
МоноХТ |
ХТ |
ХИТ |
ИТ |
р |
||||
|
(n = 62) |
% |
(n = 104) |
% |
(n = 39) |
% |
(n = 62) |
% |
||
|
Среднее время наблюдения |
6,6 (95% ДИ 5,1–8,2) |
9,2 (95% ДИ 8,0–10,4) |
5,5 (95% ДИ 4,1–6,9) |
5,3 (95% ДИ 3,4–7,2) |
ANOVA 0,000 |
||||
|
Среднее число циклов ХТ (мин-макс) |
3 (1–9) |
4,1 (1–7) |
4,2 (1–8) |
0 |
ANOVA с поправкой Бонферони p = 1,000 |
||||
|
Среднее число введений ИТ (мин-макс) |
0 |
0 |
5,4 (1–18) |
6,4 (1–28) |
ANOVA с поправкой Бонферони p = 0,698 |
||||
|
Средняя стоимость (мин – макс) |
147 217,638 (50 648,27– 455 834,43) |
374 699,022 (50 648,27– 1 158 332,64) |
2 632 731,86 (404 528,43– 7 281 511,74) |
2 997 443,83 (494 642,89– 13 850 000,9) |
ANOVA с поправкой Бонферони 0,000 * |
||||
|
Медиана ВБП (95%ДИ) |
4,1 (95% ДИ 2,3–5,9) |
6,2 (95% ДИ 4,9–7,5) |
6,5 (95% ДИ 6,0–7,0) |
NA |
|||||
|
МоноХТ |
0,043 |
0,085 |
0,001 |
||||||
|
ХТ |
0,043 |
0,942 |
0,011 |
||||||
|
ХИТ |
0,085 |
0,942 |
0,080 |
||||||
|
ИТ |
0,001 |
0,011 |
0,080 |
||||||
|
6-ти мес. ВБП |
29% |
43% |
45% |
67% |
Тест Вилкоксона 0,021 |
||||
|
ОВ |
7,4 (95% ДИ 5,0–9,8) |
20,1 (95% ДИ 7,0–33,2) |
NA |
NA |
|||||
|
МоноХТ |
0,001 * |
> 0,000 * |
> 0,000 * |
||||||
|
ХТ |
> 0,000 * |
0,016 |
0,023 |
||||||
|
ХИТ |
> 0,000 * |
0,016 |
0,544 |
||||||
|
ИТ |
> 0,000 * |
0,023 |
0,544 |
||||||
|
18-ти мес. ОВ |
7% |
35% |
84% |
96% |
|||||
|
ЧОО |
Хи-квадрат > 0,000 |
||||||||
|
Полный регресс |
0 |
0,0% |
3 |
3,0% |
2 |
5,1% |
1 |
4,2% |
|
|
Частичный регресс |
6 |
10,0% |
18 |
18,0% |
11 |
28,2% |
3 |
12,5% |
|
|
Стабилизация |
16 |
26,7% |
46 |
46,0% |
18 |
46,2% |
11 |
45,8% |
|
|
Прогрессирование |
22 |
36,7% |
26 |
26,0% |
4 |
10,3% |
3 |
12,5% |
|
|
Не оценен |
16 |
26,7% |
7 |
7,0% |
4 |
10,3% |
6 |
24,0% |
|
Рисунок 2. Диаграмма соотношения объективных ответов в зависимости от первой линии терапии.
CR ^ SD He оценен
РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ ИММУНОТЕРАПЕВТИЧЕСКИХ ПРЕПАРАТОВ ПРИ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГО В РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКЕ
Диагностика и лечение опухоли. Состояние проблемы
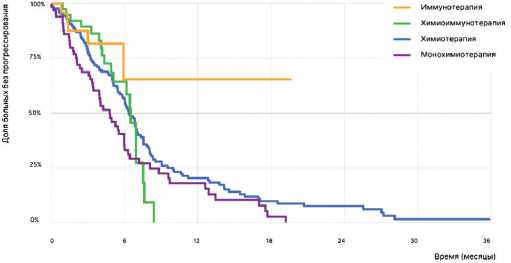
Рисунок 3. Кривые Каплана – Мейера для выживаемости без прогрессирования на фоне различных вариантов первой линии терапии НМРЛ.
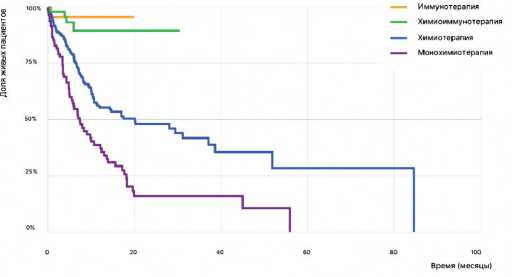
Рисунок 6. Кривые Каплана–Мейера общей продолжительности жизни на фоне различных вариантов терапии первой линии.
Мы сравнили 6-ти месячную выживаемость без прогрессирования между всеми исследованными вариантами лечения, применявшимися в первой линии НМРЛ. Максимальный показатель был выявлен для ИТ — 67%, для ХИТ — 45 %, для цитостатических режимов значения этого показателя составили 29% и 44% для моно- и комбинированной терапии. При апостериорном анализе с поправкой для множественных сравнений значимые различия в 6-ти месячном ВБП были выявлены между монотерапией и комбинированной химиотерапией (р = 0,028), химиоиммунотерапией (р = 0,006) и моноиммунотерапией (р = 0,018).
Затраты на лечение
Одним из аспектов нашей работы явилась оценка финансовых затрат на проведенную лекарственную терапию. Средняя стоимость пролеченного больного была максимальной в группе моноиммунотерапии (2 997 443,83 руб/пац) и ХИТ (2 632 731,86 руб/пац), что, видимо, связано с большим числом введений ингибиторов контрольных точек в группе монотерапии. Для цитостатических вариантов терапии значения были существенно меньше: 374 699,022 руб/пациент для комбинации с препаратами платины и 147 217,638 руб/пациент для различных вариантов монотерапии. Важно отметить, что все различия имели статистическую достоверность. Графическое сравнение средних представлено на рис. 7.
5 000 000 руб.
4 000 000 руб.
3 000 000 руб.
2 000 000 руб.
1 000 000 руб.
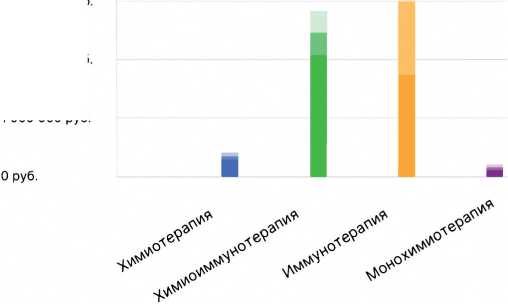
Рисунок 7. Диаграмма средних значений и 95% ДИ расходов на лечение пациента для разных вариантов лекарственной терапии. Проведено попарное сравнение методом т-тест: ХИТ vs ИТ 0,028;ХТ vs моноХТ 0,000; ХТ vs ИТ 0,000; ХТ vs ХИТ 0,000.
РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ ИММУНОТЕРАПЕВТИЧЕСКИХ ПРЕПАРАТОВ ПРИ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГО
В РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКЕ
Диагностика и лечение опухоли. Состояние проблемы
Немаловажно, что стоимость терапии напрямую зависела от применения более современных и дорогостоящих лекарственных препаратов. В случае нашего анализа подобным классом препаратов являются ингибиторы иммунных контрольных точек (ниволумаб, пембролизумаб и атезолизу-маб). Эти препараты были зарегистрированы на территории РФ в конце 2018 — начале 2019 гг., что с учетом длительности процедур их планирования и закупки определило их преимущественное использование в 2019 году, а также достоверное увеличение стоимости лечения в последние годы (ANOVA p < 0,000). Распределение вариантов первой линии терапии в зависимости от года ее начала представлено в табл. 3. При сравнении показателей продолжительности жизни были выявлены достоверные различия между больными, начавшими терапию в 2018 г. (n = 128) и 2019 г (n = 102) (Log-rank p = 0,006) (рис. 8, 9).
Таблица 3. Распределение различных вариантов терапии, использованной в первой линии, в зависимости от срока их начала
|
2018 г. |
2019–2020 гг. |
р |
|||
|
n = 128 |
% |
n = 102 |
% |
||
|
ХТ |
69 |
53,9% |
35 |
34,3% |
Хи-квадрат Пирсона p < 0,000 |
|
ХИТ |
2 |
1,6% |
37 |
36,3% |
|
|
ИТ |
2 |
1,6% |
23 |
22,5% |
|
|
МоноХТ |
55 |
43,0% |
7 |
6,9% |
|
|
Средняя стоимость руб/пац (мин – макс) |
1636267,5 (95% ДИ 214871,9 – 665244,7) |
1636267,5 (95% ДИ 1293023,8 – 1979511,2) |
ANOVA p < 0,000 |
||
|
Медиана ОВ (мес) |
9,1 (95% ДИ 6,6 – 11,6) |
Не достигнута |
Log-rank p = 0,006 |
||
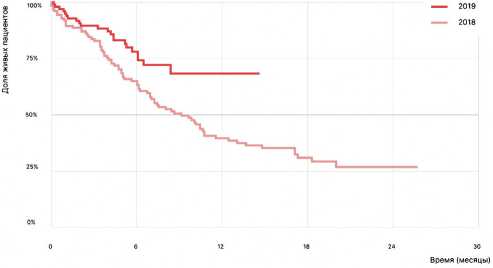
Рисунок 8. Моделирование общей продолжительности жизни методом Каплана– Мейера vв зависимости от года начала первой линии терапии
Отдаленные и непосредственные показатели эффективности второй линии терапии НМРЛ
Исследование эффективности второй линии терапии у больных НМРЛ было проведеноу 100 пациентов. В зависимости от характера проведенного лечения среди включенных в анализ пациентов было выделено две группы: пациенты, получавших химиотерапию или иммунотерапию. Распределение по полу, возрасту и гистологическим формам существенно не различалось между группами (табл. 4). Исследование уровня экспрессии PD-L1 было проведено у 25% пациентов (10,6% в группе цитостатической терапии и у 37,7% в группе иммунотерапии). Важно обратить внимание на то, что в группе иммунотерапии у 9,4% больных был выявлен высокий (> 50%) уровень экспрессии PD-L1. Клинические характеристики больных, включенных в анализ второй линии, а также проведенного лечения представлены в табл. 4.
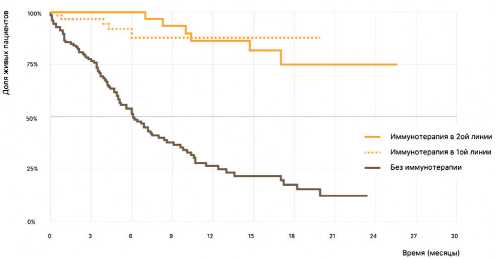
Рисунок 9. Моделирование общей продолжительности жизни методом Каплана–Мейера в зависимости от линии применения иммунотерапии: синяя — без иммунотерапии, зеленая — в первой линии, желтая — во второй.
РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ ИММУНОТЕРАПЕВТИЧЕСКИХ ПРЕПАРАТОВ ПРИ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГО В РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКЕ
Диагностика и лечение опухоли. Состояние проблемы
Таблица 4. Клинические характеристики больных НМРЛ, получавших вторую линию терапии и включенных в анализ
|
Характеристика |
ХТ |
ИТ |
Хи-квадрат |
Всего |
|||
|
(n = 47) |
% |
(n = 53) |
% |
(n = 100) |
% |
||
|
Пол |
0,292 |
||||||
|
М |
40 |
85,1% |
39 |
73,6% |
79 |
79,0% |
|
|
Ж |
7 |
14,9% |
14 |
26,4% |
21 |
21,0% |
|
|
Возраст |
|||||||
|
Средний (мин – макс) |
62,7 (38,0 – 80,0) |
63,4 (38,6 – 89,8) |
NA |
63,0 (38,0 – 89,8) |
|||
|
Гистологическая форма |
0,188 |
||||||
|
Аденокарцинома |
19 |
40,4% |
25 |
47,2% |
44 |
44,0% |
|
|
Плоскоклеточный |
22 |
46,8% |
27 |
50,9% |
49 |
49,0% |
|
|
Крупноклеточный |
4 |
8,5% |
1 |
1,9% |
5 |
5,0% |
|
|
Другие |
2 |
4,3% |
0 |
0,0% |
2 |
2,0% |
|
|
PD-L1 ИГХ |
0,026 |
||||||
|
0 |
4 |
8,5% |
4 |
7,5% |
8 |
8,0% |
|
|
1–49 |
0 |
0,0% |
11 |
20,8% |
11 |
11,0% |
|
|
>= 50 |
1 |
2,1% |
5 |
9,4% |
6 |
6,0% |
|
|
Не оценен |
42 |
89,4% |
33 |
62,3% |
75 |
75,0% |
|
|
Длительность метастатического заболевания мес (мин – макс) |
9,24 (1,87–29,47) |
10,98 (2,87–45,57) |
0,235 |
10,18 (2,87–45,57) |
|||
|
Вариант иммунотерапии |
0,000 * |
||||||
|
Нет |
47 |
100,0% |
0 |
0% |
47 |
47,0% |
|
|
Пембролизумаб |
0 |
0% |
8 |
15,1% |
8 |
8,0% |
|
|
Ниволумаб |
0 |
0% |
40 |
75,5% |
40 |
40,0% |
|
|
Атезолизумаб |
0 |
0% |
5 |
9,4% |
5 |
5,0% |
|
|
Цитостатическая схема |
0,000 * |
||||||
|
Не было |
0 |
0% |
53 |
100% |
53 |
53,0% |
|
|
ТС |
10 |
21,3% |
0 |
0% |
10 |
10,0% |
|
|
Этопозид пероральный |
10 |
21,3% |
0 |
0% |
10 |
10,0% |
|
|
Доцетаксел |
14 |
29,8% |
0 |
0% |
14 |
14,0% |
|
|
Винорельбин |
13 |
27,7% |
0 |
0% |
13 |
13,0% |
|
Эффективность второй линии терапии была оценена у 100 пациентов. Среднее число циклов, проведенных больным, соответствовало 4,4 в обеих группах. В группе цитостатической терапии ЧОО составила 6,4% (1/47 полный регресс и 2/47 частичных регресса), а частота контроля заболевания (полный регресс, частичный регресс и стабилизация) — 38,3%. Аналогичные показатели на фоне ингибиторов контрольных точек были достоверно выше — ЧОО 7,5% (0/53 полный регресс и 4/53 частичных регресса), а вероятность контроля заболевания — 58,4% (р = 0,003). ВБП на фоне второй линии терапии при использовании цитостатических препаратов составила 3,7 месяцев (95% ДИ 2,4–5,2), а ингибиторов контрольных точек 8,1 месяц (95% ДИ 4,7–11,5) — р = 0,005. Графические результаты моделирования показателей выживаемости методом Каплана–Мейера представлены на рис. 10. Сравнение стоимости проведенного лечения подтвердило очевидное предположение о повышении затрат при переходе на современный метод лечения 132 606,393 руб./пациента против 2 066 275,86 руб/пациента (ANOVA 0,000). Графические результаты сравнения представлены в виде диаграммы на рис. 11.
3 000 000 руб.
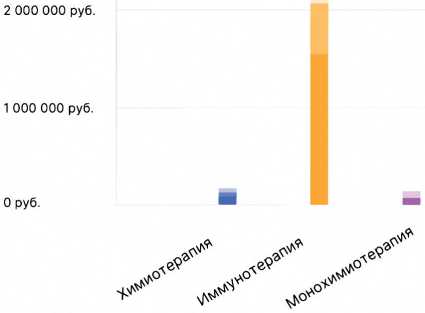
Рисунок 11. Столбчатая диаграмма средних значений расходов на пациента в зависимости от выбора варианта лекарственной терапии.
РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ ИММУНОТЕРАПЕВТИЧЕСКИХ ПРЕПАРАТОВ ПРИ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГО
В РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКЕ
Диагностика и лечение опухоли. Состояние проблемы
Независимо от линии в 2018 и 2019 гг. терапия ингибиторами контрольных точек проводилась 110 пациентам. 168 пациентов не получали иммунотерапевтических препаратов. При сравнении показателей продолжительности жизни между группой с иммунотерапией и без иммунотерапии независимо от линии достоверно более высокая выживаемость наблюдалась при применении современных препаратов (8,6 против 55,9 мес, р < 0,000) (рис. 12).
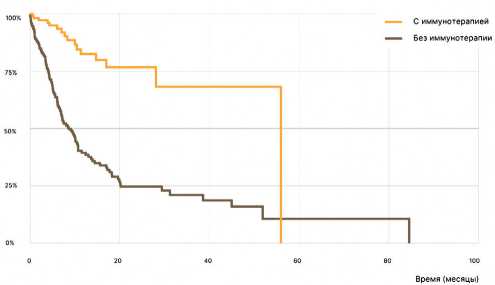
Рисунок 12. Кривые Каплана– Мейера общей выживаемости в зависимости от применения на любом из этапов лечения ингибиторов контрольных точек.
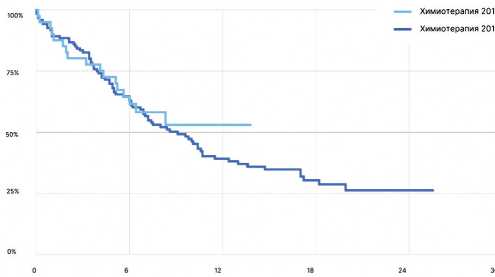
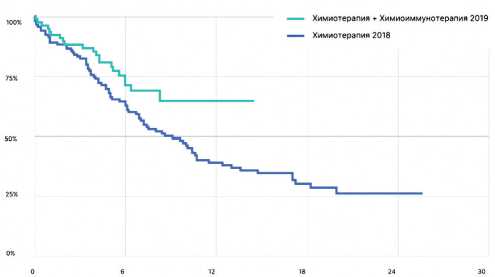
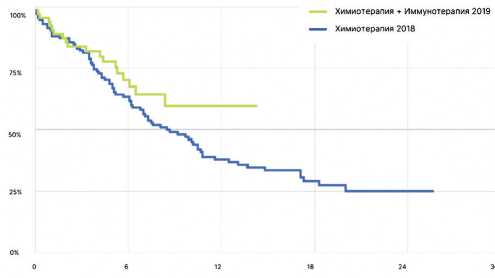
Важно заметить, что с целью подтверждения роли иммунотерапии в увеличении показателей выживаемости было проведено сравнение выживаемости больных, получавших только цитостатическую терапию в 2018 и 2019 гг. (различий не выявлено), при сравнении выживаемости после цитостатической терапии в 2018 году и терапии на основе платины в комбинации с иммунотерапевтическими препаратами или без них выявлены достоверные различия (р = 0,029). При этом, различия в показателях отдаленной выживаемости не были связаны с особенностями цитостатической терапии, проводившейся в 2018 и 2019 гг., а определялись дополнением современных ингибиторов контрольных точек (рис. 13).
Отдельно был исследован вопрос влияния применения иммунотерапевтических препаратов или комбинаций с ними в первой или во второй линиях терапии. В результате существенных различий в продолжительности жизни больных, получавших в течение болезни ингибиторы контрольных точек в зависимости от линии лечения выявлено не было (0,482), в то время как выживаемости и при использовании в первой (р < 0,000) и во второй линиях (р < 0,000) была выше, чем в группе без иммунотерапии. Больные, получавшие иммунотерапию на любом из этапов лечения, имели существенное преимущество в продолжительности жизни по сравнению с больными, которые не получали эти препараты вообще.
ОБСУЖДЕНИЕ
В нашей работе была оценена эффективность терапии неоперабельного рака легкого в реальной клинической практике, а также ее изменения в течение времени с появлением новых лекарственных препаратов и увеличением затрат на лекарственное обеспечение.
В рамках проведенного ретроспективного анализа мы оценили эффективность различных лекарственных подходов, использованных у больных с НМРЛ и МРЛ в течение последних двух лет.
В нашем исследовании медиана и 6-месячная ВБП на фоне комбинации иммунохимиотерапии были несколько ниже, чем представленные в международных клинических исследованиях: 6,5 месяцев и 45% против 8,9 месяцев и 77% в исследованиях KEYNOTE-189 и KEYNOTE -21G [6,7]. Любопытно, что показатели выживаемости и эффективность лечения, наблюдавшиеся в группе стандартной платиносодержащей цитостатической терапией были сходны с историческими (ВБП — 6,2 месяца, ОВ — 20,1 месяц, ЧОО — 21% против например для комбинации пеметрексед + карбоплатин + бевацизумаб — 6,0, 18,0 месяцев, 34% соответственно [8–11].
Таблица 5. Показатели эффективности второй линии терапии НМРЛ
|
Характеристика |
ХТ |
ИТ |
Р |
||
|
n = 47 |
% |
n = 53 |
% |
||
|
Среднее число циклов ХТ (мин–макс) |
4,4 (1 – 9) |
0 |
|||
|
Среднее число введений ИТ (мин–макс) |
0 |
4,4 (1 – 7) |
|||
|
Средняя стоимость руб/пац (мин – макс) |
132 606,393 (98 660,1443–66 552,641) |
2 066 275,86 (1 554 124,34–2578 427,37) |
0,000 |
||
|
Медиана ВБП (мес) |
3,7 (95% ДИ 2,4–5,2) |
8,1 (95% ДИ 4,7–11,5) |
0,005 |
||
|
6-ти мес ВБП |
19% |
57% |
0,001 * |
||
|
12-ти мес ВБП |
13% |
36% |
|||
|
ЧОО |
0,003 |
||||
|
Полный регресс |
1 |
2,1% |
0 |
0,0% |
|
|
Частичный регресс |
2 |
4,3% |
4 |
7,5% |
|
|
Стабилизация |
15 |
31,9% |
27 |
50,9% |
|
|
Прогрессирование |
17 |
36,2% |
9 |
17,0% |
|
|
Не оценен |
12 |
25,5% |
8 |
15,1% |
|
РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ ИММУНОТЕРАПЕВТИЧЕСКИХ ПРЕПАРАТОВ ПРИ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГО
14 В РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКЕ
Диагностика и лечение опухоли. Состояние проблемы
В равной мере согласованность с результатами ХИТ в эффективности проведенного лечения наблюдалась и в группе с высоким уровнем PD-L1, получавшей монотерапию пем-бролизумабом, а также монотерапии цитостатическими препаратами [12,13]. При соотнесении результатов лечения, наблюдавшихся во второй линии, на фоне относительно сравнимого с литературными данными ВБП для различных вариантов монохимиотерапии (4,5 месяца) нельзя не обратить внимание на высокие показатели в группе больных, получавших иммунотерапевтическое лечения — 8 месяцев против 2,3–4,0 месяца в международных исследованиях [14–19]. До определенной степени, несмотря на отсутствие статистически достоверной корреляции, объяснением этого наблюдения может быть селекция чувствительных к иммунотерапевтическому лечению пациентов на основании более высокого уровня экспрессии PD-L1, индолентного течения заболевания.
Важнейшим элементом нашей работы, который в том числе определили целесообразность ее проведения в современной России, являлось сравнение различных показателей, применяющихся в реальной клинической практике лекарственных подходов. Результаты анализа отдаленных показателей выживаемости однозначно показывают, что наибольшей эффективностью обладают лекарственные режимы с использованием современных иммунотерапевтических препаратов — анти-PD-1 (пембролизумаб, ниволумаб) и анти-PD-L1 (атезолизумаб).
К сожалению, на основании анализа результатов судить о различиях в эффективности химиоиммунотерапии без селекции на основании PD-L1 статуса и моноиммунотерапии пембролизумабом у больных с высоким уровнем экспрессии невозможно. Тем не менее, с учетом отсутствия значимых различий в эффективности теоретически меньшая токсичность безцитостатических режимов определяет обоснованность проспективной селекции пациентов для моноиммунотерапии.
При исследовании отдаленных показателей выживаемости были выявлены существенные различия в общей продолжительности жизни пациентов, начавших терапию в 2018 и 2019 гг. В то время как медиана общей продолжительности жизни среди пациентов, начавших проведение первой линии в 2019 г., не была достигнута, данный показатель для больных, получивших первую линию лечения ранее, составил 9,1 месяца, что в значительной мере соответствует показателям, полученным прежде в исследованиях первой линии цитостатической терапии платиновыми дуплетами [20,21]. Одним из возможных объяснений существенных различий может быть наличие значимых различий в вариантах, использованных в первой линии в 2018 и 2019–2020 гг. Так, на более позднем этапе чаще применялась современное поколение иммунотерапевтических препаратов, что сопровождалось также и значимым приростом затрат на лечение больных. Тем не менее, нельзя исключить, что столь выраженные различия в выживаемости были определены недостаточным периодом наблюдения за больными, получавшими лечение в 2019–2020 гг.
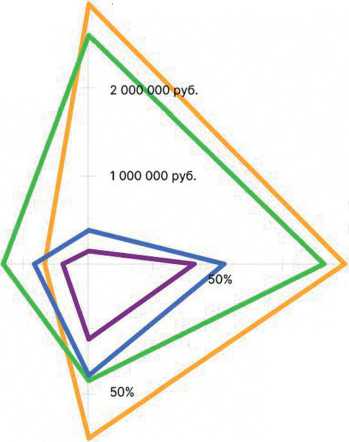
Любопытным наблюдением, сделанным в рамках нашей работы, можно считать существование различий в частоте применения монотерапии в первой линии НМРЛ. Вероятнее всего, доля больных, получавших монохимиотерапию в 2018 году (43%), в большей степени отражает реальное число больных, которые в силу сопутствующей патологии и/или состояния не являлись кандидатами для проведения комбинированной цитостатической терапии с препаратами платины. В тоже время значимое снижение доли этих больных в 2019–2020 гг. может быть отражением, во-первых, появления монотерапии ингибиторами контрольных точек как опции в первой линии лечения у PD-L1 позитивных пациентов, а во-вторых, значительного увеличения финансовых возможностей обеспечения этими лекарственными препаратами в 2019 гг. Показатели финансовых затрат на обеспечение первой линии терапии и клинические показатели ее эффективности суммированы на рис. 14.
Частота объективных ответов
100%
Средняя стоимость
3 000 000 руб.
50%
100%
Иммунотерапия
। ■ Химиоиммунотерапия
^— Химиотерапия
— Монохимиотерапия
12 месяцев выживаемость
6 месяцев без прогрессирования юо%
Рисунок 14. Сравнительная диаграмма средней стоимости 1-й линий лечения больных НМРЛ, получавших лечение в 2018 и 2019 гг., непосредственных и отдаленных результатов терапии.
РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ ИММУНОТЕРАПЕВТИЧЕСКИХ ПРЕПАРАТОВ ПРИ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГО В РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКЕ
Диагностика и лечение опухоли. Состояние проблемы
Наши данные показывают, что общая выживаемость больных, получавших на любом из этапов иммунотерапевтические препараты нового поколения, существенно превосходит аналогичный показатель для больных, не получавших ингибиторы контрольных точек, что согласуется с представленными ранее данными нескольких мета-анализов западной популяции пациентов [22,23].
При этом в нашем анализе различий в выживаемости больных, которые получали ИТ в первой или второй линиях,
выявлено не было. Однако подобные наблюдения требуют критического осмысления ввиду различий в частоте проведения второй линии терапии между группами с агрессивным и индолентным течением болезни.
Объединенные показатели затрат на проведенное лечение и анализ его результатов представлены в табл. 6. Важно отметить, что существенное повышение расходов на лекарственную терапию позволило достичь существенного снижения одногодичной летальности.
Таблица 6. Сравнительная таблица финансовых и клинических характеристик лечения в зависимости от года начала первой линии терапии
|
Средняя стоимость пациента (1 линия/2 линия) |
n |
Общий расход на 1/2 линию лечения |
Стандартизованный показатель на лечение 100 больных |
Доля больных, получавших ИТ |
Одногодичная летальность |
|
|
2018 |
440 058,27/853 862,95 |
128 |
56 327 458,8/52 085 639,9 |
84 697 732,80 |
21% |
61% |
|
2019 |
1 636 267,51/1 160 795,24 |
102 |
165 263 019,0/26 698 290,6 |
188 197 362,00 |
69,6% |
33% |
Таким образом, в нашей работе было показано, что показатели эффективности лечения (ЧОО и ВБП) были значимо выше при применении иммунотерапевтических препаратов. При этом достоверных различий в эффективности моноиммунотерапии и комбинированной химиоиммунотерапии выявлено не было, что подтверждает оправданность стратификации больных на основании статуса экспрессии PD-L1.
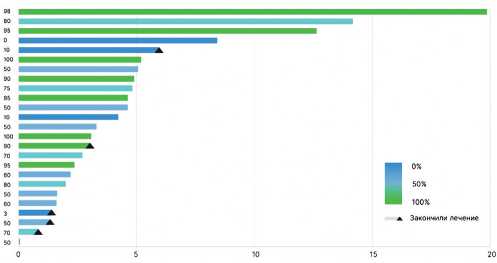
Рисунок 4. «Swimmers-plot» длительности первой линии терапии с использованием ингибиторов контрольных точек у пациентов НМРЛ с уровнем экспрессии PD-L1 > 50%.
С нашей точки зрения, полученные данные иллюстрируют целесообразность обеспечения больных раком легкого иммунотерапевтическим лечением. В условиях ограничения финансирования и растущего арсенала новых дорогостоящих лекарственных препаратов крайне необходимо проведение глубокого фармакоэкономического анализа для каждого вида лечения и расстановка приоритетов в распределении средств на те или иные лекарственные средства с одновременным поддержанием этих приоритетов в рациональных клинических рекомендациях. Так, 2-кратное увеличение расходов на лекарственное лечение позволило обеспечить современными препаратами 70% нуждавшихся пациентов НМРЛ. Подобные меры в условиях реальной клинической практики позволили достоверно повысить ОВ больных, а также снизить такой значимый показатель эффективности лечения, контролируемый на государственном уровне, как одногодичную летальность фактически вдвое, что, вне всякого сомнения, является достойным результатом принятых финансовых мер. Тем не менее, рациональное использование подобных ресурсов требует выработки жестких критериев для того или иного дорогостоящего метода лечения.
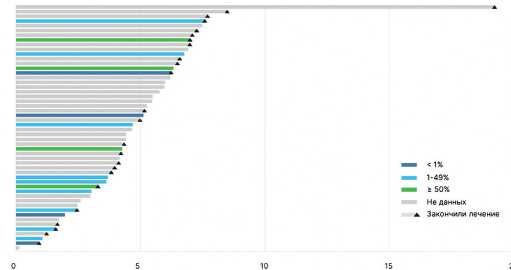
Рисунок 5. «Swimmers-plot» длительности первой линии терапии с использованием химиоиммунотерапии у пациентов НМРЛ с уровнем экспрессии PD-L1 1–49%.
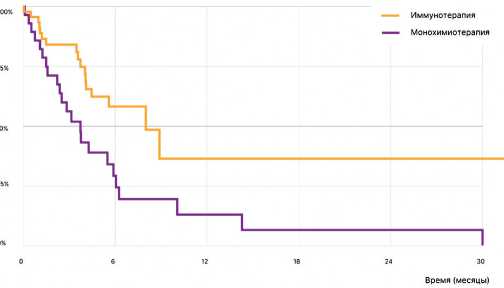
Рисунок 10. Кривые Каплана–Мейера для времени без прогрессирования на фоне различных вариантов терапии, использованных во второй линии лечения НМРЛ.
РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ ИММУНОТЕРАПЕВТИЧЕСКИХ ПРЕПАРАТОВ ПРИ НЕМЕЛКОКЛЕТОЧНОМ РАКЕ ЛЕГКОГО
В РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКЕ
Диагностика и лечение опухоли. Состояние проблемы
А.
Б.
В.
Рисунок 13. Моделирование общей продолжительности жизни методом Каплана–Мейера в зависимости от года начала первой линии терапии. А. ХТ 2018 (n = 120) vs ХТ 2019 (n = 41); Б. ХТ 2018 (n = 120) vs ХТ+ХИТ 2019 (n = 77) P = 0,029 *; В. ХТ 2018 (n = 120) vs ХТ+ИТ 2019 (n = 63) P = 0,104.
Список литературы Результаты применения иммунотерапевтических препаратов при немелкоклеточном раке легкого в реальной клинической практике
- Под ред. А. Д. Каприна, В. В. Старинского, Г. В. Петровой Злокачественные новообразования в России в 2018 году (заболеваемость и смертность) М.: МНИОИ им. П. А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России, 2019. илл. 250 с. 978-5-85502-243-8 ISBN: 978-5-85502-243-8
- Лактионов К. К., Артамонова Е. В., Бредер В. В., Горбунова В. А., Моисеенко Ф. В., Реутова Е. В. и соавт. Практические рекомендации по лекарственному лечению немелкоклеточного рака легкого. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2019 (том 9). С. 32 - 48.
- Клинические рекомендации Министерства здравоохранения Российской Федерации: Рак легкого [Электронный ресурс]/ ред. совет: А. А. Алахвердиев [и др.]. - Москва; 2019. - Режим доступа: http://www.oncology.ru/ association / clinical- guidelines/ 2018 / rak_legkogo_pr2018. pdf.
- Siegel R, Ma J, Zou, Z, Jemal A. Cancer statistics, 2014. // CA Cancer J Clin. 2014; 64 (1): 9 - 29.
- Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R, Dancey J, Arbuck S, Gwyther S, Mooney M, Rubinstein L, Shankar L, Dodd L, Kaplan R, Lacombe D, Verweij J. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). // Eur J Cancer. 2009; 45 (2): 228 - 247.
- Gandhi L, Rodríguez-Abreu D, Gadgeel S, Esteban E, Felip E, De Angelis F, Domine M, Clingan P, Hochmair MJ, Powell SF, Cheng SY, Bischoff HG, Peled N, Grossi F, Jennens RR, Reck M, Hui R, Garon EB, Boyer M, Rubio-Viqueira B, Novello S, Kurata T, Gray JE, Vida J, Wei Z, Yang J, Raftopoulos H, Pietanza MC, Garassino MC, KEYNOTE-189, I. Pembrolizumab plus Chemotherapy in Metastatic Non-Small-Cell Lung Cancer. // N Engl J Med; 2018; 378 (22); 2078 - 2092.
- Borghaei H, Langer CJ, Gadgeel S, Papadimitrakopoulou VA, Patnaik A, Powell SF, Gentzler RD, Martins RG, Stevenson JP, Jalal SI, Panwalkar A, Yang JC, Gubens M, Sequist LV, Awad MM, Fiore J, Saraf S, Keller SM, Gandhi L. 24-Month Overall Survival from KEYNOTE-021 Cohort G: Pemetrexed and Carboplatin with or without Pembrolizumab as First- Line Therapy for Advanced Nonsquamous Non-Small Cell Lung Cancer. // J Thorac Oncol. 2019; 14 (1): 124 - 129.
- Sandler A, Gray R, Perry MC, Brahmer J, Schiller JH, Dowlati A, Lilenbaum R, Johnson DH Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer. // N Engl J Med. 2006; 355 (24): 2542 - 2550.
- Murakami S, Saito H, Kondo T, Oshita F, Yamada K. Phase II study of bevacizumab, cisplatin, and pemetrexed in advanced non-squamous non-small cell lung cancer (NS-NSCLC) with EGFR wild-type. // J Exp Ther Oncol. 2019; 13 (2): 131 - 138.
- Barlesi F, Scherpereel A, Rittmeyer A, Pazzola A, Ferrer Tur N, Kim JH, Ahn MJ, Aerts JG, Gorbunova V, Vikström A, Wong EK, Perez-Moreno P, Mitchell L, Groen HJ Randomized phase III trial of maintenance bevacizumab with or without pemetrexed after first-line induction with bevacizumab, cisplatin, and pemetrexed in advanced nonsquamous non-small-cell lung cancer: AVAPERL (MO22089). // J Clin Oncol. 2013; 31 (24): 3004 - 3011.
- Rittmeyer A, Scherpereel A, Gorbunova VA, Gervais R, Vikström A, Chouaid C, Chella A, Kim JH, Ahn MJ, Reck M, Pazzola A, Kim HT, Aerts J, Groen HJM, Morando C, Loundou A, Barlesi F. Effect of maintenance bevacizumab (Bev) plus pemetrexed (Pem) after first-line cisplatin/ Pem/ Bev in advanced nonsquamous non-small cell lung cancer (nsNSCLC) on overall survival (OS) of patients (pts) on the AVAPERL (MO22089) phase III randomized trial. // Journal of Clinical Oncology. 2013; 31 (15 \\ _suppl): 8014 - 8014.
- Reck M, Rodríguez-Abreu D, Robinson AG, Hui R, Csőszi T, Fülöp A, Gottfried M, Peled N, Tafreshi A, Cuffe S, O'Brien M, Rao S, Hotta K, Vandormael K, Riccio A, Yang J, Pietanza MC, Brahmer JR. Updated Analysis of KEYNOTE-024: Pembrolizumab Versus Platinum-Based Chemotherapy for Advanced Non-Small-Cell Lung Cancer With PD-L1 Tumor Proportion Score of 50 % or Greater. // J Clin Oncol. 2019; 37 (7): 537 - 546.
- Reck M, Rodríguez-Abreu D, Robinson AG, Hui R, Csőszi T, Fülöp A, Gottfried M, Peled N, Tafreshi A, Cuffe S, O'Brien M, Rao S, Hotta K, Leiby MA, Lubiniecki GM, Shentu Y, Rangwala R, Brahmer JR, KEYNOTE-024, I. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. // N Engl J Med. 2016; 375 (19): 1823 - 1833.
- Clarke SJ, Abratt R, Goedhals L, Boyer MJ, Millward MJ, Ackland SP. Phase II trial of pemetrexed disodium (ALIMTA, LY231514) in chemotherapy-naïve patients with advanced non-small-cell lung cancer. // Ann Oncol. 2002; 13 (5): 737 - 741.
- Fossella FV, DeVore R, Kerr RN, Crawford J, Natale RR, Dunphy F, Kalman L, Miller, V, Lee JS, Moore M, Gandara D, Karp D, Vokes E, Kris M, Kim Y, Gamza F, Hammershaimb L. Randomized phase III trial of docetaxel versus vinorelbine or ifosfamide in patients with advanced non-small-cell lung cancer previously treated with platinum-containing chemotherapy regimens. The TAX 320 Non-Small Cell Lung Cancer Study Group. // J Clin Oncol. 2000; 18 (12): 2354 - 2362.
- Borghaei H, Paz-Ares L, Horn L, Spigel DR, Steins M, Ready NE, Chow LQ, Vokes EE, Felip E, Holgado E, Barlesi F, Kohlhäufl M, Arrieta O, Burgio MA, Fayette J, Lena H, Poddubskaya E, Gerber DE, Gettinger SN, Rudin CM, Rizvi N, Crinò L, Blumenschein GR, Antonia SJ, Dorange C, Harbison CT, Graf Finckenstein F, Brahmer JR. Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. // N Engl J Med. 2015; 373 (17): 1627 - 1639.
- Brahmer J, Reckamp KL, Baas P, Crinò L, Eberhardt WE, Poddubskaya E, Antonia S, Pluzanski A, Vokes EE, Holgado E, Waterhouse D, Ready N, Gainor J, Arén Frontera O, Havel L, Steins M, Garassino MC, Aerts JG, Domine M, Paz-Ares L, Reck M, Baudelet C, Harbison CT, Lestini B, Spigel DR Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer. // N Engl J Med. 2015; 373 (2): 123 - 135.
- Herbst RS, Baas P, Kim DW, Felip E, Pérez-Gracia JL, Han JY, Molina J, Kim JH, Arvis CD, Ahn MJ, Majem M, Fidler MJ, de Castro G, Garrido M, Lubiniecki GM, Shentu Y, Im E, Dolled-Filhart M, Garon EB. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. // Lancet. 2016 Apr 9;387 (10027):1540 - 1550.
- Rittmeyer A, Barlesi F, Waterkamp D, Park K, Ciardiello F, von Pawel J, Gadgeel SM, Hida T, Kowalski DM, Dols MC, Cortinovis DL, Leach J, Polikoff J, Barrios C, Kabbinavar F, Frontera OA, De Marinis F, Turna H, Lee JS, Ballinger M, Kowanetz M, He P, Chen DS, Sandler A, Gandara DR, OAK, S. G. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial. // Lancet. 2017; 389 (10066): 255 - 265.
- Schiller JH, Harrington D, Belani CP, Langer C, Sandler A, Krook J, Zhu J, Johnson DH. Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer. // N Engl J Med. 2002; 346 (2): 92 - 98.
- Scagliotti GV, Parikh P, von Pawel J, Biesma B, Vansteenkiste J, Manegold C, Serwatowski P, Gatzemeier U, Digumarti R, Zukin M, Lee JS, Mellemgaard A, Park K, Patil S, Rolski J, Goksel T, de Marinis F, Simms L, Sugarman KP, Gandara D. Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer. // J Clin Oncol. 2008; 26 (21): 3543 - 3551.
- Wang S, Hao J, Wang H, Fang Y, Tan L. Efficacy and safety of immune checkpoint inhibitors in non-small cell lung cancer. // Oncoimmunology. 2018; 7 (8): e1457600.
- Kim BJ, Kim JH, Kim HS. Survival benefit of immune checkpoint inhibitors according to the histology in non-small-cell lung cancer: A meta-analysis and review. // Oncotarget. 2017; 8(31): 51779-51785.


