Результаты применения ингибиторов контрольных точек (ИКТ) Пембролизумаб и Ниволумаб в III линии лечения у пациентов c метастатическим раком желудка
Автор: Семёнов Н.Н., Федянин М.Ю., Жукова Л.Г., Хатьков И.Е., Строяковский Д.Л., Покатаев И.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 3 т.24, 2025 года.
Бесплатный доступ
Введение. Данные по эффективности ингибиторов контрольных точек (ИКТ) в III линии лечения метастатического рака желудка малочисленны и противоречивы. Цель исследования – сравнить выживаемость без прогрессирования (ВБП) и общую выживаемость (ОВ) у пациентов с метастатическим раком желудка, получавших иммунотерапию или химиотерапию в III линии лечения. Материал и методы. Ретроспективно оценены отдаленные результаты (ВБП и ОВ) применения ИКТ (n=93) или химиотерапии (n=77) в III линии лечения пациентов с метастатическим раком желудка. В анализ вошли данные о 170 пациентах (мужчины – 63,4 %, женщины – 53,2 %). Средний возраст пациентов в группах ИТ и ХТ составил 65,5 и 63,7 года, ECOG 2 – 22,6 и 16,9 % соответственно. В группе ИКТ отмечались худшая ВБП на II линии лечения (2,8 и 4,8 мес, р=0,0014) и меньшее число пациентов, продолживших лечение после прогрессирования (14 и 39 %, р=0,002). В группе химиотерапии в IV и последующих линиях 80 % получали ИКТ. Результаты. Анализ показал, что ВБП было лучше в группе химиотерапии, чем в группе ИКТ (4,3 vs 2,4 мес, р=0,12, ОР 1,28, 95 % ДИ 0,94–1,76), общая выживаемость также была лучше в группе химиотерапии (7,8 vs 4,8 мес, р=0,064, ОР 1,35, 95 % ДИ 0,98–1,85), хотя и не значимо. Влияния уровня CPS (0–9/неизвестно и ≥10) в группе ИКТ также не установлено: ВБП 2,1 и 2,4 мес (р=0,75), ОВ 4,1 и 4,4 мес (р=0,62). При сравнении ВБП и ОВ у пациентов с MSI/dMMR, получавших ИКТ (n=6) и химиотерапию (n=5), преимущества применения ИКТ показать не удалось (ВБП – 3,4 и 9,7 мес, р=0,75, а ОВ – 11,9 и 13,0 мес, р=0,56). При первом контроле динамики заболевания стабилизация болезни отмечена у 26 и 44,2 % пациентов соответственно (р=0,015 %). Заключение. Применение ИКТ в III линии лечения метастатического рака желудка уступило по ВБП и ОВ стандартным схемам лечения (независимо от уровня CPS и наличия MSI). Учитывая риски быстрого прогрессирования на фоне ИКТ, наличие небольшой подгруппы пациентов (не более 10 %), которые выигрывают у классических подходов лечения при длительных сроках наблюдения, необходимо продолжить поиск факторов, ассоциированных с эффективностью ИТ.
Рак желудка, иммунотерапия, III линия, химиотерапия, микросателлитная нестабильность, время без прогрессирования, общая выживаемость
Короткий адрес: https://sciup.org/140310577
IDR: 140310577 | УДК: 616.33-006.6-08:615.28+615.37 | DOI: 10.21294/1814-4861-2025-24-3-93-102
Текст научной статьи Результаты применения ингибиторов контрольных точек (ИКТ) Пембролизумаб и Ниволумаб в III линии лечения у пациентов c метастатическим раком желудка
Материал и методы
В анализ включено 170 пациентов (93 получали монотерапию ИКТ и 77 – химиотерапию (n=33) ± рамуцирумаб (n=34)). В связи с отсутствием различий в показателях ОВ в группах с химиотерапией и химиотерапией + рамуцирумаб (ОВ – 7,5 и 9,6 мес, р=0,28) для дальнейшего сравнительного анализа было принято решение объединить этих пациентов в общую группу – ХТ. Медиана времени наблюдения составила 37,9 мес (15,8–98,3 мес) Характеристика пациентов представлена в табл. 1. Пембролизумаб получали 43 пациента, ниволумаб – 50 пациентов.
При оценке основных характеристик оказалось, что группы были сопоставимы по основным показателям, за исключением анамнестических данных (в группе ИКТ в I–II линии чаще использовался рамуцирумаб, худшее ВБП II линии), и по последующему лечению (значимо больше пациентов в группе химиотерапии получили 4 и более линии, и почти все далее получали ИКТ).
Статистический анализ
Для статистической обработки использовалась программа IBM SPSS Statistics версия 26. Непараметрические данные анализировались с использованием теста χ2 или критерия Фишера в зависимости от количества наблюдений. Выживаемость рассчитывалась методом Каплана–Мейера, различия оценивались log-rank тестом, многофакторный анализ проводился с использованием регрессии Кокса; для медианы выживаемости определялся 95 % доверительный интервал (ДИ). Различия считались статистически значимыми при p<0,05. Время без прогрессирования (ВБП) исчислялось как время от начала III линии противоопухолевого лечения до прогрессирования заболевания или смерти от любой причины, а ОВ – до даты смерти или последнего наблюдения. Проведен однофакторный и многофакторный анализ влияния признаков на ВБП и ОВ с последующим сравнением выживаемости пациентов в соответствии с лечебным режимом и корректировкой по независимым факторам прогноза.
|
Õàðàêтåðиñтиêà пàциåнтîв Patients’ characteristics |
Òàблицà 1/Table 1 |
||
|
Характеристика/Characteristics |
Иммунотерапия/ Immunotherapy (n=93) |
Химиотерапия/ Chemotherapy (n=77) |
р |
|
Мужчины/Men |
61 (63,4 %) |
42 (53,2 %) |
0,16 |
|
Возраст (лет)/Age (years) |
65,5 (28,8–85,7) |
63,7 (35,7–82) |
0,74 |
|
ECOG |
|||
|
0 |
2 (2,5 %) |
4 (5,2 %) |
0,41 |
|
1 |
70 (75,3 %) |
59 (76,6 %) |
0,86 |
|
2 |
21 (22,6 %) |
13 (16,9 %) |
0,44 |
|
Первичная опухоль/Primary tumor |
|||
|
Желудок/Stomach |
72 (88,9 %) |
64 (85,1 %) |
0,44 |
|
Синхронные метастазы/Synchronous metastases |
70 (75,3 %) |
61 (83,6 %) |
0,59 |
|
Локализация метастазов/Metastasis location |
|||
|
Печень/Liver |
46 (49,5 %) |
27 (37,7 %) |
0,06 |
|
Брюшина/Peritoneum |
24 (25,8 %) |
31 (40,3 %) |
0,049 |
|
Печень + Брюшина/Liver + Peritoneum |
6 (6,5 %) |
7 (9,1 %) |
0,57 |
|
Другое/Others |
17 (18,3 %) |
12 (15,6 %) |
0,69 |
|
Число органов с метастазами ( ± первичная опухоль)/Number of organs with metastases ( ± primary tumor) |
|||
|
1 |
19 (20,4 %) |
13 (16,9 %) |
0,69 |
|
2 |
54 (58,1 %) |
52 (67,5 %) |
0,1 |
|
3 и более/3 and more |
20 (21,5 %) |
12 (15,6 %) |
0,43 |
|
Аденокарцинома/Adenocarcinoma |
82 (88,9 %) |
60 (77,9 %) |
0,09 |
|
HER2/neu |
|||
|
Положительный/Positive |
12 (18,2 %) |
9 (13,2 %) |
0,64 |
|
Неизвестно/Unknown |
25 (29,0 %) |
9 (14,3 %) |
0,002 |
|
MSI/dMMR |
7 (13,7 %) |
5 (11,6 %) |
1 |
|
Неизвестно/Unknown |
38 (45,1 %) |
34 (48,0 %) |
0,12 |
|
CPS |
|||
|
0 |
14 (21,5 %) |
16 (34,0 %) |
0,28 |
|
1–9 |
30 (46,2 %) |
18 (38,3 %) |
0,33 |
|
> 10 |
21 (32,3 %) |
13 (27,7 %) |
0,53 |
|
Неизвестно/Unknown |
28 (30,1 %) |
30 (39,0 %) |
0,25 |
|
«Таргетная» терапия в I–II линии/First-and second-line targeted therapy |
|||
|
Трастузумаб/Trastuzumab |
7 (7,0 %) |
5 (6,6 %) |
1 |
|
ИКТ/ICIs |
0 |
10 (13,2 %) |
0,002 |
|
Рамуцирумаб/Ramucirumab |
31 (33,7 %) |
17 (21,7 %) |
0,03 |
|
ВДП/PFS |
|||
|
I линия/First-line |
5,1 мес/months |
6,6 мес/months |
0,26 |
|
II линия/Second-line |
3,8 мес/months |
4,8 мес/months |
0,014 |
|
IV и более линии/Fourth-and later lines |
13 (14,0 %) |
30 (39 %) |
0,002 |
|
Химиотерапия/Chemotherapy |
13 (92,9 %) |
14 (46,7 %) |
0,006 |
|
Рамуцирумаб/Ramucirumab |
4 (28,6 %) |
5 (16,7 %) |
0,43 |
|
ИКТ/ICIs |
0 |
24 (80,0 %) |
0,0001 |
|
Другое (Трастузумаб-эмтанзин, Регорафениб)/ Other (Trastuzumab-emtansine, Regorafenib) |
0 |
2 (6,7 %) |
0,56 |
Примечание: таблица составлена авторами.
Note: created by the authors.
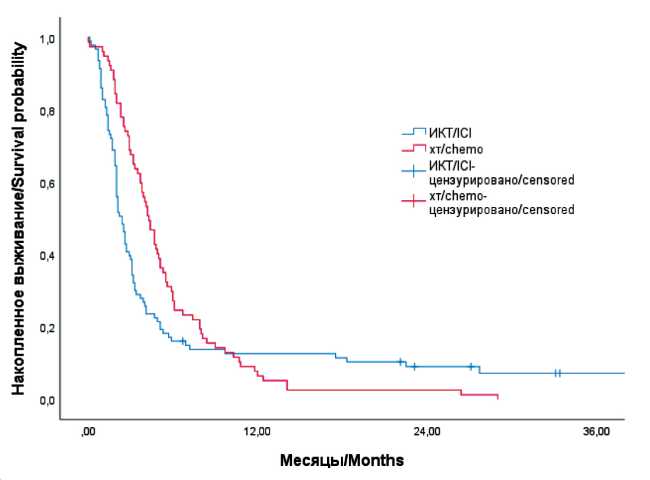
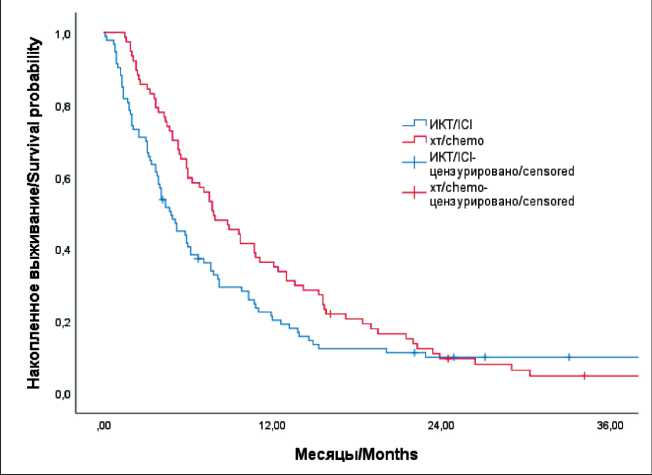
Рис. 2. Общая выживаемость у пациентов, получавших ИКТ или химиотерапию.
Примечание: рисунок выполнен авторами Fig. 2. OS of patients treated with ICIs or chemotherapy. Note: created by the authors
Рис. 1. Выживаемость без прогрессирования у пациентов, получавших ИКТ или химиотерапию.
Примечание: рисунок выполнен авторами Fig. 1. PFS of patients treated with ICT or chemotherapy. Note: created by the authors
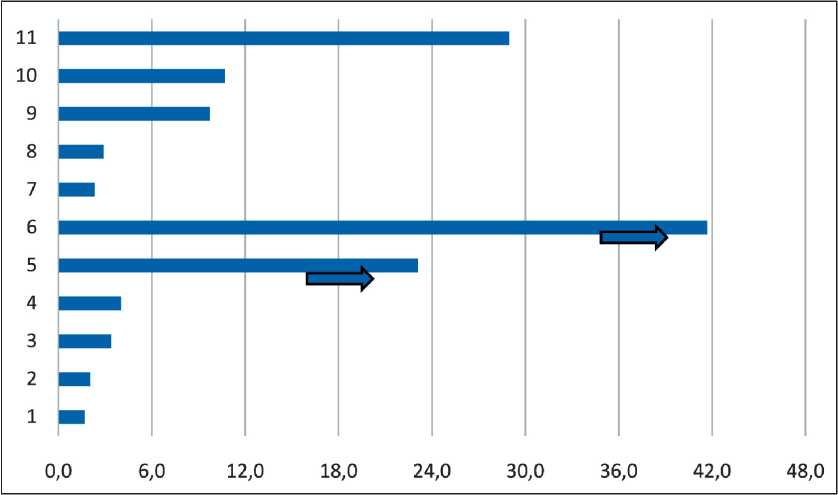
Рис. 3. Время без прогрессирования в III линии у пациентов с MSI, получавших ИКТ или химиотерапию. Примечания: пациенты 1–6 получали ИКТ, 7–11 – только химиотерапию. Пациентов с CPS>10 не было, стрелка – отсутствие прогрессирования на момент последнего наблюдения; рисунок выполнен авторами.
Fig. 3. PFS in third-line therapy in patients with MSI who received ICIs or chemotherapy. Notes: patients 1–6 received ICIs and 7–11 received only chemotherapy. There were no patients with CPS>10, the arrow means the absence of progression at the time of the last follow-up; created by the authors
Результаты
Анализ эффективности лечения во всей группе пациентов
В связи с тем, что при назначении терапии ИКТ в 3 и более линиях уровень CPS может не учитываться, мы оценили ВБП и ОВ в общей группе. Анализ показал, что ВБП было лучше в группе химиотерапии, чем в группе ИКТ (4,3 vs 2,4 мес, р=0,12, ОР 1,28, 95 % ДИ 0,94–1,76), и в отношении ОВ лучшие результаты также были отмечены у пациентов, получавших химиотерапию (7,8 vs 4,8 мес, р=0,064, ОР 1,35, 95 % ДИ 0,98–1,85), хотя и не значимо (рис. 1, 2).
Нами был проведен однофакторный анализ признаков, влияющих на ОВ (табл. 2), при котором негативное влияние на ОВ имели: наличие метастазов в печень и/или брюшину, перстневидноклеточный рак, ВБП на II линии менее 4 мес и MSS.
При многофакторном анализе было показано, что значение имели наличие перстневидноклеточного рака (ОР 0,56, 95 % ДИ 0,35–0,9, р=0,017) и метастазы в печень и/или брюшину (ОР 0,63,
95 % ДИ 0,4–0,998, р=0,049). В соответствии с результатами многофакторного анализа были выделены 3 прогностические группы, в которых была оценена эффективность ИКТ в сравнении с химиотерапией (табл. 3). В результате показано, что наличие хотя бы одного фактора неблагоприятного прогноза обусловливало неэффективность использования ИКТ.
Анализ эффективности лечения в зависимости от экспрессии PDL у пациентов с MSS или неизвестным статусом микросателлитной нестабильности
Òàблицà 2/Table 2
Îднîфàêтîðныé àнàлиз пðизнàêîв, влияющиõ нà îбщóю выживàåмîñтьUnivariate analysis of factors affecting overall survival среди пациентов, получавших химиотерапию, прогрессирование отмечалось значительно реже (55,8 % пациентов, р=0,015) (табл. 5). Таким образом, и по показателю эффективности при первом контроле использование ИКТ демонстрировало значимо худшие результаты, чем при проведении химиотерапии.
Анализ эффективности терапии при MSI
Наличие MSI фенотипа установлено у 11 пациентов (6 – в группе ИКТ и 5 – в группе химиотерапии). В группе пациентов, получавших
химиотерапию, лишь 1 далее получал ИКТ. Оценка MSI фенотипа с использованием ПЦР в группе ИКТ выполнена у 4, в группе химиотерапии – у 3 пациентов. Более наглядно, в связи с небольшим числом наблюдений, результаты представлены в виде диаграммы (рис. 3). В качестве критерия эффективности было выбрано время без прогрессирования, для исключения влияния последующего лечения. Медиана ВБП в общей группе составила 4 мес. При сравнении ВБП и ОВ у пациентов с MSI/
|
Характеристика/Characteristics |
n |
ОВ, мес/OS, months |
р |
|
Пол/Gender |
|||
|
Мужчины/Man |
103 |
6,2 |
0,77 |
|
Женщины/Woman |
67 |
6,0 |
|
|
Возраст/Age |
|||
|
<60 |
48 |
7,6 |
0,69 |
|
> 60 |
122 |
5,9 |
|
|
ECOG |
|||
|
0–1 |
135 |
6,7 |
0,74 |
|
2 |
34 |
4,1 |
|
|
Первичная опухоль/Primary tumor |
|||
|
Желудок/Stomach |
136 |
6,2 |
0,54 |
|
КЭП/GEJ |
20 |
3,7 |
|
|
Метастазы/Metastases |
|||
|
Синхронные/Synchronous |
131 |
5,4 |
0,12 |
|
Метахронные/Metachronous |
39 |
8,8 |
|
|
Локализация метастазов/Location of metastases |
|||
|
Печень/Liver |
73 |
5,9 |
0,004 |
|
Брюшина/Peritoneum |
55 |
5,5 |
0,08 |
|
Печень + Брюшина/Liver + Peritoneum |
13 |
7,7 |
0,09 |
|
Другое/Others |
29 |
9,7 |
Реф |
|
Число органов с метастазами ( ± первичная опухоль)/Number of organs with metastases ( ± primary tumor) |
|||
|
1–2 |
138 |
6,7 |
0,45 |
|
3 и более/3 and more |
32 |
3,9 |
|
|
Гистотип опухоли/Histotype of tumor |
|||
|
Аденокарцинома/Adenocarcinoma |
147 |
7,1 |
0,004 |
|
Перстневидноклеточный рак/Signet-ring cell carcinoma |
23 |
4,1 |
|
|
HER2/neu |
|||
|
Положительный/Positive |
21 |
4,9 |
0,31 |
|
Отрицательный/Negative |
115 |
7,1 |
|
|
MSI/dMMR MSS/pMMR |
|||
|
MSI/dMMR |
12 |
11,9 |
0,07 |
|
MSS/pMMR |
86 |
6,2 |
|
|
CPS |
|||
|
0–9 |
78 |
6,7 |
0,88 |
|
> 10 |
34 |
4,9 |
|
|
ВБП II линии/PFS, second-line therapy |
|||
|
<4 мес/months |
79 |
4,9 |
|
|
0,039 |
|||
|
>4 мес/months |
91 |
7,7 |
|
|
Примечание: таблица составлена авторами. |
|||
Note: created by the authors.
Òàблицà 3/Table 3
Эффåêтивнîñть ИÊÒ и õимиîтåðàпии в зàвиñимîñти îт нàличия фàêтîðîв нåблàгîпðиятнîгî пðîгнîзà
The effectiveness of ICIs and chemotherapy, depending on the presence of unfavorable prognosis factors
|
ВБП (мес)/ |
ОВ (мес)/ |
||||
|
Метод лечения/Therapy |
n |
PFS (months) |
р |
OS (months) |
р |
Нет факторов риска/No risk factors
|
ИКТ/ICIs Химиотерапия/Chemotherapy |
16 11 |
5,9 6,1 |
0,45 ОР1 1,37 95 % ДИ2 0,6–3,2 |
8,1 10,7 |
0,63 ОР 1,23 95 % ДИ 0,52–2,91 |
|
1 фактор риска/1 risk factor |
|||||
|
ИКТ/ICIs |
68 |
2,4 |
0,024 |
4,4 |
0,01 |
|
ОР 0,65 |
ОР 0,61 |
||||
|
Химиотерапия/Chemotherapy |
55 |
4,2 |
95 % ДИ 0,45–0,95 |
7,8 |
95 % ДИ 0,42–0,89 |
|
2 фактора риска/2 risk factors |
|||||
|
ИКТ/ICIs |
9 |
1,4 |
0,033 |
3,1 |
0,14 |
|
ОР 0,35 |
ОР 0,46 |
||||
|
95 % |
95 % |
||||
|
Химиотерапия/Chemotherapy |
11 |
4,7 |
ДИ 0,14–0,92 |
4,7 |
ДИ 0,19–1,27 |
Примечание: таблица составлена авторами.
Notes: OР = HR (hazard ratio); ДИ = CI (confidence interval); created by the authors.
Òàблицà 4/Table 4
Эффåêтивнîñть пðимåнåния ИÊÒ или õимиîтåðàпии в зàвиñимîñти îт óðîвня CPS The effectiveness of the use of ICIs or chemotherapy depending on the level of CPS
|
Метод лечения/Therapy |
ВДП (мес)/ n PFS (months) |
р |
ОВ (мес)/ OS (months) |
р |
|
CPS 0–9/Неизвестно/Unknown |
||||
|
ИКТ/ICIs |
66 2,1 |
0,097 |
4,1 |
0,066 |
|
ОР1 0,73 |
ОР 0,71 |
|||
|
95 % |
95 % |
|||
|
Химиотерапия/Chemotherapy |
60 4,2 |
ДИ2 0,51–1,06 |
7,7 |
ДИ 0,49–1,02 |
|
CPS > 10 |
||||
|
ИКТ/ICIs |
20 2,4 |
0,304 |
4,4 |
0,275 |
|
ОР 0,68 |
ОР 0,65 |
|||
|
Химиотерапия/Chemotherapy |
12 4,3 |
95 % ДИ 0,33–1,42 |
6,0 |
95 % ДИ 0,3– 1,41 |
Примечание: таблица составлена авторами.
Notes: OР = HR (hazard ratio); ДИ = CI (confidence interval); created by the authors.
Òàблицà 5/Table 5
Îцåнêà эффåêтивнîñти пî ÊÒ пðи пåðвîм îбñлåдîвàнии CT assessment of effectiveness during the first follow-up
|
Метод лечения/ Therapy |
1 st Прогрессирование/ Progression |
follow-up Без прогрессирования/ No progression |
р |
Умерли до первого контроля/ Died before 1st follow-up |
р |
|
ИКТ/ICIs (n=93) |
74 % |
26 % |
46 % |
||
|
Химиотерапия/ Chemotherapy (n=77) |
55,8 % |
44,2 % |
0,015 |
31,2 % |
0,04 |
Примечание: таблица составлена авторами.
Note: created by the authors.
dMMR, получавших ИКТ (n=6) и химиотерапию (n=5), преимущества применения ИКТ показать не удалось (ВБП – 3,4 и 9,7 мес, р= 0,75, ОВ – 11,9 и 13,0 мес, р=0,56).
Обсуждение
В настоящее время в рекомендациях РФ присутствует возможность применения пембролизумаба в III и последующих линиях лечения у пациентов с функциональным статусом по шкале ECOG 0–2 и экспрессией PDL1 CPS≥1 [14]. По рекомендациям RUSSCO только в 2024 г. применение ИКТ в III и последующих линиях не обсуждается [15]. В США возможно применение во II и последующих линиях ниволумаба/ипилимумаба у пациентов с MSI/ dMMR или пембролизумаба с высокой TMB (≥10 мутаций), рекомендации ESMO не предусматривают применения ИКТ у этой категории пациентов.
С целью выявления категории пациентов, значительная часть которых могла бы получить пользу от продолжения противоопухолевого лечения, в разное время определялись факторы прогноза. К негативным факторам могли относиться статус по ECOG ≥2, альбумин <40 г/л, время до прогрессирования на II линии лечения <2,7 мес, низкодифференцированные опухоли [16] или статус по ECOG ≥2, 3 зоны метастазирования, уровень гемоглобина <10 г/л, время на предшествовавших линиях лечения <10 мес [4]. Оценка факторов неблагоприятного прогноза в российской популяции также выявила сходные факторы: статус по ECOG ≥2, уровень гемоглобина <10 г/л и время до прогрессирования на I линии <5 мес [17].


