Результаты применения ингибиторов контрольных точек иммунного ответа (ИКТ) пембролизумаба и ниволумаба у больных метастатическим раком желудка в I линии. опыт онкологической службы г. Москвы
Автор: Семнов Н.Н., Федянин М.Ю., Жукова Л.Г., Хатьков И.Е., Строяковский Д.Л., Покатаев И.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.15, 2025 года.
Бесплатный доступ
Введение: Применение препаратов иммунотерапии в комбинации с химиотерапией показало свою эффективность в рандомизированных исследованиях в I линии лечения метастатического рака желудка. В работе рассмотрен опыт онкологической службы г. Москвы по оценке эффективности пембролизумаба и ниволумаба у больных метастатическим раком желудка в зависимости от морфологических (CPS, MSI) характеристик.Цель исследования: сравнить выживаемость без прогрессирования (ВБП) и общую выживаемость (ОВ) в первой линии у больных распространенным раком желудка, которым проводилась иммунотерапия (в монорежиме или в комбинации с химиотерапией) или стандартная химиотерапия с включением оксалиплатина и фторпиримидинов.Результаты: Критериям включения соответствовали 194 пациента. Из них ингибиторы контрольных точек (ИКТ) получали 52 пациента (18 - только иммунотерапию; 31 - в сочетании с химиотерапией, пембролизумаб получали 15, ниволумаб - 37 больных). Химиотерапию CAPOX или FOLFOХ без ИКТ получили 142 пациента. Медиана наблюдения составила 29,5 мес. (17,4-62,0 мес.). Мужчин в группах было 55,8 % и 57,7 %, средний возраст - 64,5 и 65,9 лет, ECOG 2 отмечен у 15,4 % и 8,5 %. Другие характеристики также были сопоставимы: CPS > 10 у 69,2 % и 19,7 % (р = 0,0001), MSI - у 26,2 % и 4,9 % (р = 0,009), 2 и более линий лечения получали 36,5 % и 69,3 % (р = 0,0001) соответственно.ВБП в общей группе составила 7,9 мес. и 6,4 мес. (ОР 0,46; 95 % ДИ 0,32-0,67, р = 0,0001), а ОВ - 17,3 мес. и 14,6 мес. (ОР 0,71; 95 %ДИ 0,49-1,04, р = 0,076) соответственно. При проведении однофакторного анализа был установлен только 1 фактор прогноза выживаемости: число органов, пораженных метастазами. В соответствии с этим анализ показал, что при наличии метастазов в 1-2 органах использование ИКТ имело преимущество в ВБП (р = 0,051 и р = 0,001), при 3 и более метастазах преимущество отсутствовало (р = 0,62). Оценивая влияние уровня CPS у больных с MSS фенотипом показано, что при CPS 0-9 преимущества в ВБП (6,1 мес. и 6,9 мес., р = 0,7) и ОВ (8,8 мес. и 14,9 мес., р = 0,39) не было. При CPS > 10 отмечено преимущество при добавлении ИКТ по ВБП (9,9 мес. и 4,4 мес., р = 0,0001), и ОВ 18,2 мес. и 12, 1 мес. (р = = 0,23). Однако при уровне CPS > 50 результаты не отличались. При оценке результатов лечения больных с MSI показано, что при медиане ВБП 6,6 мес. и 5,2 мес. (ОР 0,48; 95 %ДИ 0,17-1,4; р = 0,165) медиана ОВ у пациентов, получивших ИКТ с или без ХТ, была значимо выше - 24,3 мес. и 11,1 мес., соответственно (ОР 0,4; 95 %ДИ 0,13-1,21; р = 0,11).Выводы: использование ИКТ в I линии терапии метастатического рака желудка (по сравнению с только ХТ) увеличивает долю пациентов, живущих без прогрессирования 12 и более месяцев, и более чем в 2 раза увеличивает общую выживаемость. Пороговый уровень CPS для назначения ИКТ, возможно, должен составлять > 10. Взаимосвязь эффективности иммунотерапии и экспрессии PD-L1 при раке желудка с MSI опухолями требует дальнейшего изучения на большей выборке пациентов. Информация об уровне CPS, наличии MSI и HER2 / neu должны быть известны к моменту обсуждения тактики лечения в дебюте метастатической болезни.
Рак желудка, ингибиторы контрольных точек иммунитета, химиотерапия
Короткий адрес: https://sciup.org/140310081
IDR: 140310081 | DOI: 10.18027/2224-5057-2025-039
Текст научной статьи Результаты применения ингибиторов контрольных точек иммунного ответа (ИКТ) пембролизумаба и ниволумаба у больных метастатическим раком желудка в I линии. опыт онкологической службы г. Москвы
В целом исследования потенциала использования только цитостатиков, в том числе попытки увеличения эффективности за счет количества препаратов, были завершены к 2009 году, и медиана ОВ составила примерно 12 мес. В настоящее время самыми используемыми режимами являются комбинации оксалиплатина с ФУ (FOLFOX) или капецитабином (CAPOX). При удовлетворительном общем состоянии пациента нередко используется режим FLOT (оксалиплатин/ФУ/доцетаксел).
Добавление в I линию анти-HER2/neu препарата трастузумаба к стандартной химиотерапии было успешным у пациентов с HER2/neu положительными опухолями (23% в исследовании TOGA) [6], и позволило увеличить как ВБП с 5,5 мес. до 6,7 мес. (р = 0,0002), так и ОВ с 11,1 мес. до 13,8 мес. (р = 0,0046). Можно отметить, что эффект был более выраженным при использовании режима химиотерапии с капецитабином.
В последние годы значительно вырос интерес к лекарственной активации иммунной системы при лечении злокачественных опухолей (в рекомендациях RUSSCO препараты иммунотерапии впервые рекомендованы к применению с 2017 года при меланоме, почечноклеточном раке и немелкоклеточном раке легкого).
Применение данных прогностических маркеров позволило выделить группу пациентов с более высокой вероятностью улучшения выживаемости в исследованиях по комбинации анти-PD-1 антител с оксалиплатин-содержащими схемами лечения. Так, в исследовании CheckMate 649 [9] добавление ниволумаба к химиотерапии при опухолях с экспрессией PD-L1, оцененных как CPS > 5, определило улучшение медианы ОВ до 14,4 мес. против 11,1 мес. в группе плацебо, р = 0,0001. Аналогичная взаимосвязь экспрессии PD-L1 и выживаемости продемонстрирована и в исследовании KEYNOTE-859 с пем-бролизумабом [10]. И если данные по неэффективности комбинаций четко представлены для групп с CPS < 1, то определить эффективность добавления иммунотерапии в подгруппах с CPS 1–5 или 5–9 и при более высоких пороговых значениях экспрессии биомаркера не представляется возможным из приведенных исследований. Также ограничены данные по эффективности комбинации иммунотерапии и оксалиплатин-содержащих режимов и монотерапии анти-PD1 антителами в 1 линии при наличии в опухоли MSI.
Именно этим целям посвящено данное ретроспективное многоцентровое исследование.
Материалы и методы: нами проведено ретроспективное, многоцентровое, когортное исследование.
Критерии включения в исследование
Выживаемость без прогрессирования (ВБП) исчислялась как время от начала противоопухолевого лечения до прогрессирования заболевания или смерти от любой причины, а ОВ —до даты смерти или последнего наблюдения.
Обследование проводилось каждые 2–3 месяца. Ни одного случая, соответствующего критериям псевдопрогрессирования при терапии ИКТ не было отмечено
Статистический анализ
Для статистической обработки использовалась программа IBM SPSS Statistics версия 26.
Непараметрические данные анализировались с использованием теста χ 2 или критерия Фишера в зависимости от количества наблюдений. Выживаемость рассчитывалась методом Каплана–Мейера, различия оценивались log-rank-тестом; для медианы выживаемости указывался 95% доверительный интервал (ДИ). Различия считались статистически значимыми при p < 0,05. Отношение рисков прогрессирования и смерти рассчитывалось с помощью регрессии Кокса.
РЕЗУЛЬТАТЫ
Характеристика пациентов
Критериям включения соответствовали 194 пациента. Из них ингибиторы контрольных точек (ИКТ) получали 52 пациента, из них 18-только иммунотерапию (12 пембро-лизумаб, 6 ниволумаб); 31-в сочетании с химиотерапией CAPOX или FOLFOХ (2 с пембролизумабом, 29 с ниволу-мабом), 3 пациента — с химиотерапией FLOT (1 с пембро-лизумабом, 2 с ниволумабом). Пембролизумаб получали 15, ниволумаб — 37 больных. Химиотерапию CAPOX или FOLFOХ без ИКТ получили 142 пациента.
Медиана наблюдения составила 29,5 мес. (17,4–62 мес.).
Планировалось деление на группы CPS1–5 и CPS6–9, но в связи с тем, что CPS6–9 отмечалось только у 4 и 3 пациентов, группы были объединены в CPS0, CPS1–9 и CPS > 10.
Подробнее характеристика пациентов представлена в таблице 1.
В целом, группы были сопоставимы по основным параметрам, однако отмечено ожидаемое превалирование пациентов с MSI и CPS > 10 опухолями в группе ИКТ.
Таблица 1. Характеристика пациентов, включенных в анализ
Table 1. Characteristics of patients included in the analysis
|
Характеристика |
ИКТ + химиотерапия (n = 52) |
Химиотерапия (n = 142) |
р |
|
Мужчины |
29 (55,8%) |
82 (57,7%) |
0,74 |
|
Возраст (лет) |
64,5 (32,8–88,6) |
65,9 (37,9–84,6) |
0,82 |
|
> 60 |
37 (71,2%) |
108 (76,1%) |
0,58 |
|
ECOG |
0,77 |
||
|
0 |
6 (11,5%) |
11 (7,7%) |
0,15 |
|
1 |
38 (73,1%) |
118 (83,1%) |
0,18 |
|
2 |
8 (15,4%) |
12 (8,5%) |
|
|
Первичная опухоль |
44 (84,6%) |
117 (82,4%) |
0,82 |
|
Желудок |
|||
|
Синхронные метастазы |
36 (69,2%) |
114 (80,3%) |
0,2 |
|
Метахронные |
15 (28,8%) |
27 (23,5%) |
0,17 |
|
Только первичная |
|||
|
опухоль |
1 (1,9%) |
1 (0,7%) |
0,46 |
|
Локализация мета- |
|||
|
стазов |
|||
|
Печень |
17 (32,7%) |
53 (37,3%) |
0,74 |
|
Брюшина |
21 (40,4%) |
70 (49,3%) |
0,33 |
|
Другое |
14 (26,9%) |
27 (19,0%) |
0,23 |
|
Число зон |
|||
|
метастазирования |
|||
|
1 |
11 (21,2%) |
21 (14,8%) |
0,27 |
|
2 |
36 (69,2%) |
97 (68,3%) |
1 |
|
3 и более |
5 (9,6%) |
24 (16,9%) |
0,26 |
|
Аденокарцинома |
45 (86,5%) |
120 (84,5%) |
0,61 |
|
Перстневидноклеточный |
7 (13,5%) |
22 (15,5%) |
|
|
HER2/neu |
|||
|
Положительный |
2 (4,7%) |
4 (2,9%) |
0,48 |
|
MSI |
11 (26,2%) |
7 (4,9%) |
0,009 |
|
Неизвестно |
9 (19,2%) |
13 (9,2%) |
0,04 |
|
CPS |
|||
|
0 |
4 (7,7%) |
54 (38,0%) |
0,0001 |
|
1–9 |
11 (21%) |
60 (42,3%) |
0,017 |
|
> 10 |
36 (69,2%) |
28 (19,7%) |
0,0001 |
|
2 линия |
19 (36,5%) |
104 (69,3%) |
0,0001 |
|
ИКТ |
— |
20 (19,2%) |
0,04 |
|
Трастузумаб |
1 (5,2%) |
3 (2,9%) |
0,24 |
|
Рамуцирумаб |
12 (63,1%) |
66 (63,4%) |
1 |
|
3 линия |
|||
|
и последующие |
3 (5,8%) |
46 (30,7%) |
0,0001 |
|
ИКТ |
— |
38 (82,6%) |
0,0001 |
|
Трастузумаб |
1 (20%) |
2 (4,3%) |
0,27 |
|
Рамуцирумаб |
1 (20%) |
17 (37,0%) |
0,64 |
|
Общая выживаемость на |
|||
|
II и последующих линиях |
|||
|
лечения |
9,5 мес. |
10,1 мес. |
0,82 |
Таблица 2. Результаты ВБП и ОВ в группах ИКТ и химиотерапии
Table 2. PFS and OS results in the ICI and chemotherapy groups
|
Режим |
n |
ВБП (мес.) |
р |
ОВ (мес.) |
р |
|
ИКТ ± ХТ |
52 |
7,9 |
0,0001 (ОР |
17,3 |
0,076 (ОР 0,71; |
|
ХТ |
142 |
6,4 |
0,46; 95%ДИ 0,32– 0,67) |
14,6 |
95%ДИ 0,49–1,04) |
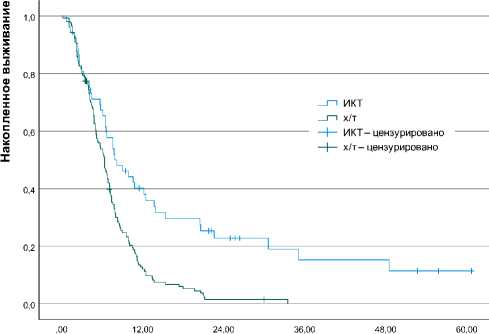
Месяцы
Рисунок 1. ВБП в общей группе
Figure 1. PFS in the overall group
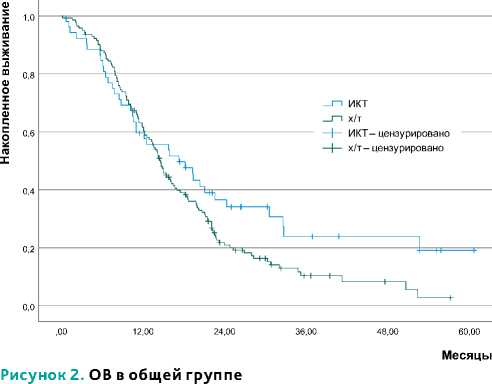
Figure 2. OS in the general group
Также значительно большее число пациентов продолжали лечение после прогрессирования на 1 линии в группе химиотерапии.
В дальнейшем из числа пациентов, продолжавших лечение, в группе химиотерапии практически все получали ИКТ. Трастузумаб во 2–3 линиях лечения был назначен пациентам
Таблица 3. Оценка факторов, влияющих на общую выживаемость
Table 3. Assessment of factors affecting overall survival
Оценка ВБП и ОВ
Во всей группе пациентов медиана ВБП и ОВ составила 6,6 мес. и 16,7 мес., соответственно. При сравнении ВБП и ОВ в группе ИКТ и ХТ получены следующие данные (табл. 2, рис. 1, 2).
В группе ИКТ (без учета уровня CPS и наличия MSI) продемонстрированы преимущества в отношении ВБП и ОВ по сравнению с только химиотерапией (хоть и не достигшие статистически значимого различия в ОВ).
Таблица 4. Результаты ОВ в группах ИКТ и ХТ в зависимости от числа органов, пораженных метастазами
Table 4. OS results in the ICI and CT groups depending on the number of organs with metastases
|
Режим |
n |
ОВ (мес.) |
р |
|
1 орган |
|||
|
ИКТ ± ХТ |
11 |
52,7 |
0,132 (ОР 0,46; |
|
ХТ |
21 |
19,8 |
95%ДИ 0,17–1,26) |
|
2 органа |
|||
|
ИКТ ± ХТ |
36 |
18,2 |
0,213 (ОР 0,75; |
|
ХТ |
97 |
14,5 |
95%ДИ 0,48–1,18) |
|
3 и более органа |
|||
|
ИКТ ± ХТ |
5 |
10,6 |
0,38 (ОР 1,55; |
|
ХТ |
24 |
13,8 |
95%ДИ 0,57–4,2) |
Проведен однофакторный анализ признаков, влияющих на ОВ (табл. 3).
Таким образом, при однофакторном анализе влияние на отдаленные результаты имело только метастатическое поражение 3 и более органов.
Проведено сравнение ОВ группах с ИКТ и ХТ с корректировкой по прогностическим факторам. (табл. 4).
Продемонстрировано, что использование ИКТ у пациентов с невысокой опухолевой нагрузкой сохраняет свое преимущество (несмотря на отсутствие статистически значимого различия), а при его наличии преимуществ не отмечено.
Оценка влияния экспрессии PD-L1 (CPS) на ВБП и ОВ
Данный анализ проведен для пациентов с наличием MSS фенотипа опухоли или неизвестным его статусом (табл. 5).
Показано, что при уровне CPS 0–9 использование ИКТ не влияет на отдаленные результаты, в то время как при CPS > 10 ВБП была очевидно лучше при использовании ИКТ, и отсутствие статистически значимого преимущества в ОВ можно объяснить различной частотой лечения во II и последующих линиях. Также складывается впечатление, что с увеличением степени CPS эффективность химиотерапии снижается.
Таблица 5. ВБП и ОВ у пациентов с MSS или неизвестным фенотипом опухоли, получавших ИКТ или химиотерапию в зависимости от уровня CPS
Table 5. PFS and OS in patients with MSS or unknown tumor phenotype who received ICI or chemotherapy depending on the CPS level
|
Режим |
n |
ВБП (мес.) |
р |
ОВ (мес.) |
р |
|
CPS0–9 |
|||||
|
ИКТ |
10 |
6,1 |
0,7 (ОР 1,15; |
8,8 |
0,39 (ОР 1,36; |
|
ХТ |
107 |
6,9 |
95%ДИ 0,58–2,29) |
14,9 |
95%ДИ 0,68–2,71) |
|
CPS > 10 |
|||||
|
ИКТ |
31 |
9,9 |
0,0001 (ОР 0,26; |
18,2 |
0,23 (ОР 0,7; |
|
ХТ |
28 |
4,4 |
95%ДИ 0,15–0,49) |
12,1 |
95%ДИ 0,39–1,26) |
|
CPS > 50 |
|||||
|
ИКТ |
14 |
10,8 |
0,012 (ОР 0,23; |
19,3 |
0,68 (ОР 0,78; |
|
ХТ |
6 |
4,3 |
95%ДИ 0,07–0,72) |
9,9 |
95%ДИ 0,24–2,54) |
ПЦР у 1-го и 4-х пациентов, соответственно, у остальных — методом ИГХ.
Оценка показала, что при медианах ВБП 6,6 мес. и 5,2 мес. соответственно (ОР 0,48; 95%ДИ 0,17–1,4; р = 0,165) медиана ОВ у пациентов, получивших ИКТ с или без ХТ, была значительно выше — 24,3 мес. и 11,1 мес. соответственно (ОР 0,4; 95%ДИ 0,13–1,21; р = 0,11), отсутствие достоверного различия может быть объяснено малым числом наблюдений.
Результаты по ВБП и ОВ представлены на рисунке 3 и 4.
Необходимо отметить, что в группе пациентов, получавших в качестве I линии только химиотерапию, 91,7% больных в последующих линиях получали ИКТ.
Более наглядно результаты представлены в виде диаграммы (рис. 5).
В качестве критерия эффективности была выбрана выживаемость без прогрессирования, для исключения влияния последующего лечения. Медиана ВБП в общей группе, получивших ИКТ в I линии, составила 6,5 мес.
На рисунке 3 представлены данные о выживаемости без прогрессирования пациентов с MSI.
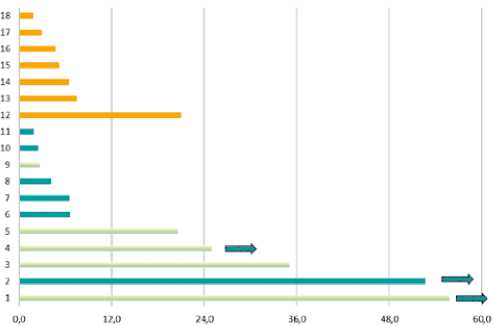
Рисунок 5. Медиана ВБП у пациентов с MSI
Пациенты 1–11 получали ИКТ, 12–18 — только химиотерапию.
Светлым отмечены пациенты с CPS > 10, стрелка — отсутствие прогрессирования на момент последнего наблюдения.
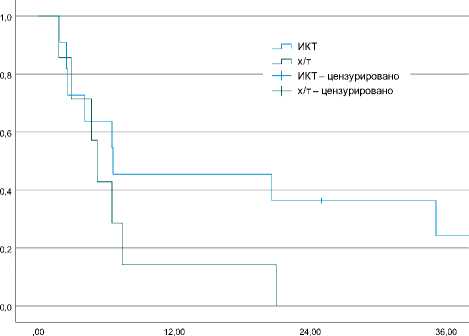
Месяцы
Рисунок 3. ВБП у больных с MSI фенотипом
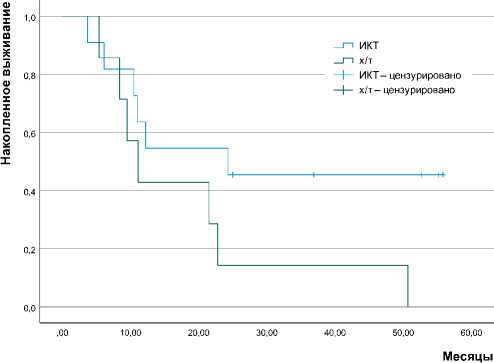
Рисунок 4. ОВ у больных с MSI фенотипом
-
Figure 3. PFS in patients with MSI phenotype
-
Figure 4. OS in patients with MSI phenotype
-
Figure 5. Median PFS in patients with MSI
ОБСУЖДЕНИЕ
Результаты проведенных исследований показали, что усиление эффекта цитостатиков стало возможным при добавлении анти-HER2/neu препаратов (трастузумаб) и ингибиторов контрольных точек (пембролизумаб и ниво-лумаб), но лишь в таргетных популяциях.
Несмотря на трудности (на основе наших данных) в обсуждении порогового уровня CPS для назначения ИКТ, складывается вполне обоснованное суждение о том, что этот уровень, возможно, должен составлять 10 и более. Малое число наблюдений не позволило определить группу пациентов, которым будет достаточно монотерапии ИКТ, но, по всей видимости, это могут быть пациенты с MSI и CPS > 10 опухолями.


