Результаты применения эндоскопического колоректального стентирования металлическими стентами в качестве оказания паллиативной помощи
Автор: Самсонян Э.Х., Емельянов С.И., Луцевич О.Э., Секундова М.А., Баширов Р.А., Фролова Е.В., Курганов И.А., Светашов В.С., Галахов В.П.
Журнал: Московский хирургический журнал @mossj
Рубрика: Абдоминальная хирургия
Статья в выпуске: 1 (91), 2025 года.
Бесплатный доступ
Цель исследования. Отработать оптимальную оперативную технику эндоскопического колоректального стентирования. Проанализировать результаты выполнения эндоскопического колоректального стентирования у пациентов со стенозирующими нерезектабельными опухолями ободочной кишки.Материалы и методы. В период с 2016 по 2022 год нами были изучены результаты эндоскопического колоректального стентирования различных отделов ободочной кишки металлическими стентами у 86 пациентов со стенозирующими нерезектабельными опухолями ободочной кишки.Результаты. У 14 пациентов (16,3 %) на фоне труднодоступной локализации стенозирующей опухоли и сложной анатомии ободочной кишки мы применили прозрачный пластиковый колпачок на дистальном конце колоноскопа. Интраоперационных осложнений зафиксировано не было. Технический и клинический успех достигнут в 98,8 % случаев. У 19 пациентов (22,1 %) в период госпитализации сохранялись явления болевого синдрома; хронический болевой синдром зафиксирован у 3 (3,5 %) пациентов в послеоперационном периоде. Через 3 месяца после операции колоректальное рестентирование по типу «стент-в-стент» на фоне повторной опухолевой обструкции выполнено 13 пациентам (15,1 %.) Случаев миграции стента через 3 месяца после операции не зафиксировано.Заключение. Эндоскопическое колоректальное стентирование является высокоэффективным и безопасным вмешательством, которое позволяет добиться быстрого купирования клинических симптомов толстокишечной непроходимости, демонстрирует низкую частоту послеоперационных осложнений. При наличии сложной анатомии кишки, а также труднодоступной локализации стенозирующей опухоли, считаем целесообразным применение дистального прозрачного пластикового колпачка, что обосновано более адекватным визуальным позиционированием просвета кишки, позволяющим проводить более качественное эндоскопическое стентирование кишки.
Эндоскопическое стентирование толстой кишки, рак толстой кишки, металлический стент, обтурационная толстокишечная непроходимость, дистальный колпачок
Короткий адрес: https://sciup.org/142244685
IDR: 142244685 | УДК: 616.34-007.272 | DOI: 10.17238/2072-3180-2025-1-64-75
Текст научной статьи Результаты применения эндоскопического колоректального стентирования металлическими стентами в качестве оказания паллиативной помощи
Актуальность. Опухолевая обтурационная толстокишечная непроходимость является одним из наиболее частых осложнений колоректального рака, который занимает третье по распространенности место среди всех онкологических заболеваний желудочно-кишечного тракта и второе место по значимости причиной летального исхода [1]. На данный момент современная колопроктология достигла существенного прогресса в хирургическом лечении пациентов с опухолевой обтурационной толстокишечной непроходимостью. Однако несмотря на это, статистика по летальности после паллиативных операций остаётся высокой и составляет от 17 % до 54,5 %, а после радикальных вмешательств – от 9,2 % до 46,3 %. Кроме того, сохраняется высокий риск септических осложнений (от 38,6 % до 80 %) и тромбоэмболических осложнений (от 9,1 % до 19,4 %) [2]. Одним из приоритетных и эффективных малоинвазивных паллиативных методов декомпрессии ободочной кишки при опухолевой обструкции у пациентов с нерезекта-бельными опухолями различных отделов ободочной кишки является эндоскопическое колоректальное стентирование (ЭКС) металлическими саморасширяющимися стентами [3].
Впервые об успешном эндоскопическом стентировании ободочной кишки при опухолевой обтурационной толстокишечной непроходимости было доложено M. Dohmoto в 1991 году [4]. После этого периода, количество исследований и публикаций по данной теме стало возрастать, и на сегодняшний день проведение ЭКС является достаточно эффективным и безопасным методом разрешения обтурационной кишечной непроходимости.
Возможности методики эндоскопического колоректального стентирования на сегодняшний день изучены не до конца, однако, в ряде исследований эффективность эндопротезирования опухолевой стриктуры ободочной кишки составляет более 80 %, а частота возникновения осложнений после эндоскопического стентирования ободочной кишки не превышает 10–20 % [5].
При стентировании опухолевой обструкции ободочной кишки применяются различные по своей структуре покрытия металлические саморасширяющиеся стенты: полностью покрытые (полиуретановое покрытие металла), частичнопокрытые (цельноплетенные), непокрытые стенты («голый» металл). Покрытые стенты снижают риск врастания опухоли через ячейки стента в дальнейшем, но при этом они обладают меньшей фиксирующей способностью, в связи с чем у них больший риск миграции по сравнению с непокрытыми стентами, поэтому были разработаны частично-покрытые стенты, имеющие меньший процент частоты миграции и врастания опухоли в просвет стента. Однако, в клинической практике данные три вида стентов по клинической и технической успешности малоразличимы [6].
На сегодняшний день, основными показаниями для ЭКС являются: необходимость разрешения симптомов толстокишечной непроходимости в случае нерезектабельной опухоли ободочной кишки с целью оказания паллиативной помощи пациенту при наличии противопоказаний к формированию колостомы или как ее альтернатива; а также предоперационная подготовка к одноэтапной резекции ободочной кишки путем разрешения симптомов обтурационной толстокишечной непроходимости, что дает возможность также провести дообследование и комплексную адекватную подготовку пациента к плановому радикальному или циторедуктивному оперативному вмешательству, а также проведению химиотерапии при необходимости. Ограничиться ЭКС можно в случае неблагоприятного течения заболевания, неоперабельного опухолевого образования, возраста пациента или на терминальных стадиях онкологии [7].
Клиническая эффективность эндоскопического стентирования толстой кишки при опухолевом стенозе подтверждена данными мировой литературы. Бокарев М.И. и соавторы [8] оценили результаты выполнения 211 ЭКС с целью ликвидации опухолевой обтурационной толстокишечной непроходимости различной локализации. В данной работе авторы использовали двойные покрытые и непокрытые стенты. По данным описанных результатов, клиническая эффективность составила 83,5 %, а частота осложнений 8,3 %. При этом в 192 случаях установка стента привела к разрешению симптомов толстокишечной непроходимости, а у 19 пациентов положительной динамики не наблюдалось, в связи с чем возникли угрожающие жизни состояния, требующие экстренного хирургического вмешательства. Основные послеоперационные осложнения, зафик-сированые авторами, были следующими: перфорация толстой кишки (14 (6,6 %) случаев), миграция стента (1 (0,5 %) случай), также у 4 (1,9 %) больных отмечалось усугубление симптомов толстокишечной непроходимости. Авторы также отмечают, что помимо осложнений, связанных непосредственно с установкой стента, были отмечены и соматические осложнения в 27 (11,7 %) случаев и 11 (4,8 %) случаев летального исхода. Среди основных осложнений, не связанных со стентированием, были выявлены: пневмония у 21 (9,95 %) пациента, полиорганная недостаточность у 5 (2,4 %) пациентов и тромбоэмболия легочной артерии зафиксирована в 3 (1,4 %) случаев.
Б.Т. Цулеискири и соавторы [9] также провели исследование, в котором было выполнено 40 ЭКС с целью разрешения кишечной непроходимости опухолевого генеза за счет установки стента в просвет толстой кишки. Метод предполагал проведение колоноскопии, определение уровня дистального края опухоли, визуализацию опухолевого стеноза и, при наличии технической возможности, определение ее протяженности. Далее через просвет опухолевого стеноза проводилась струна-проводник под рентгенологическим контролем. По этой струне в зону опухолевого стеноза доставлялся непокрытый саморасширяющийся стент. По полученным результатам, у 36 (90 %) пациентов удалось установить стент, а в 33 (91,7 %) случаев наблюдался положительный эффект в виде разрешения симптомов обтурационной толстокишечной непроходимости. Таким образом, ЭКС в данном исследовании было клинически эффективным в 33 из 40 случаев (82,5 %), а процент осложнений составил 8,3 %. По результатам работы, авторы определяют метод ЭКС как эффективный для разрешения толстокишечной непроходимости. По данным полученных результатов были зафиксированы ранние послеоперационные осложнения (перфорация стенки кишки стентом по причине его неверной установки в 2,8 % случаев, непроходимость стента в опухолевом канале при наличии изгиба канала в 5,6 % случаев), а также поздние осложнения (миграция стента в проксимальном направлении в 6,1 % случаев). По результатам данного исследования, авторы отметили, что необходимым условием для успешного эндоскопического стентирования толстой кишки является визуализация устья опухолевого канала. Также авторы отмечают, что условием для наиболее безопасной реканализации толстой кишки является размер и протяженность опухоли до 5 см, так как при большем сужении возрастает риск истончения стенки кишки в месте развития опухоли, в связи с чем увеличивается риск перфорации стенки кишки.
Таким образом, наиболее частыми ранними осложнениями, встречающимеся после ЭКС опухолевого стеноза ободочной кишки, по данным обзора мировой литературы, являются перфорация толстой кишки (от 2,5 % до 3,8 % случаев), кровотечение, миграция стента (от 7 % до 15 % случаев), болевой синдром и тенезмы. Поздними осложнениями являются формирование ректовагинальных и ректовезикальных свищей, прорастание стента опухолью (от 10 % до 20 % случаев) [10].
Несмотря на наличие существующих осложнений, многие авторы отмечают эффективность методики ЭКС и рассматривают ее в качестве более предпочтительного варианта разрешения симптомов опухолевой обтурационной толстокишечной непроходимости, чем выполнение резекции ободочной кишки с последующим формированием колостомы. Mabardy A. и соавторы [11] в своем исследовании выполнили 956 ЭКС пациентам с опухолевой обтурацией толстой кишки, и провели сравнительное исследование результатов выполнения ЭКС до оперативного вмешательства (с резекцией кишки и формированием колостомы) и во время экстренной операции. По данным авторов отмечается, что при дооперационном эндоскопическом стентировании частота развития общих послеоперационных осложнений была ниже (10,5 % против 21,7 % соответственно).
Стентирование толстой кишки имеет как преимущества, так и недостатки, проявляющиеся по-разному при схожих симптомах у заболеваний различного генеза, поэтому исследование применения данной технологии в различных клинических ситуациях является актуальной темой исследования.
Однако, несмотря на значительные достижения малоинвазивных методов декомпрессии толстой кишки при обтурационной опухолевой толстокишечной непроходимости путем выполнения ЭКС, ряд вопросов требует дальнейшей разработки. В частности, вопрос стандартизации оперативной техники эндоскопического колоректального стентирования и выбора вида используемого металлического стента (покрытого или непокрытого) в различных клинических ситуациях, а также уменьшение частоты осложнений и, соответственно, улучшение показателей качества жизни пациентов в послеоперационном периоде.
Цель исследования. Отработать оптимальную оперативную технику эндоскопического колоректального стентирования. Проанализировать собственные результаты выполнения эндоскопического колоректального стентирования у пациентов со стенозирующими нерезектабельными опухолями ободочной кишки, а также провести сравнительный анализ результатов, исходя из данных, опубликованных в международных научных работах.
Материал и методы
В период с 2016 по 2022 год нами были проанализированы результаты ЭКС различных отделов ободочной кишки саморасширяющимися металлическими стентами у 86 пациентов со стенозирующими нерезектабельными опухолями ободочной кишки в качестве оказания паллиативной помощи.
ЭКС проводилось как минимально инвазивное паллиативное вмешательство пациентам с нерезектабельными первичными или вторичными образованиями, осложненными злокачественной обструкцией различных отделов ободочной кишки с клиническими симптомами толстокишечной непроходимости без явлений перфорации полого органа и перитонита. У большинства пациентов при комплексном обследовании были выявлены сопутствующие осложнения, связанные с основным заболеванием. Среди них – анемия различной степени тяжести, гипоальбуминемия, раковая интоксикация и печеночная энцефалопатия.
Критериями для включения пациентов были установлены следующие: наличие нерезектабельного образования различных отделов ободочной кишки с суб- или декомпенсированным стенозом просвета органа; отсутствие противопоказаний к проведению ЭКС; наличие информированного согласия на оперативное вмешательство.
Критерии невключения пациентов были установлены следующие: стенозирующее образование ободочной кишки с клиническими признаками перфорации полого органа и перитонита; наличие противопоказаний к проведению внутривенной анестезии; выявление в ходе предоперационного обследования состояний, препятствующих проведению хирургического вмешательства; терминальное состояние пациента.
Критериями исключения из нашего исследования пациентов были приняты следующие: невыполнение рекомендаций лечащего врача в послеоперационном периоде (пациентам было рекомендовано употреблять протертую блендерную пищу в послеоперационном периоде), отказ пациента от прохождения контрольного обследования (всем пациентам назначается контрольное обследование (выполнение колоноскопии с целью оценки проходимости стента, миграции стента, исключения повторной опухолевой обструкции) через 3 месяца после операции. При этом другие методы комплексного обследования или при необходимости проведение курсов химиотерапии пациенты проходят намного раньше, в связи с постоянным наблюдением у онколога).
Перед проведением оперативного вмешательства нами были проанализированы ключевые предоперационные параметры изучаемых больных (табл. 1).
Таблица 1
Основные предоперационные показатели в исследуемой группе
Table 1
The main preoperative indicators in the study group
|
Показатель Indicator |
Исследуемая группа (n=86) Study group (n=86) |
|
Мужчины / женщины, n (%) male / female, n (%) |
45 (52,3) / 41 (47,7) |
|
Возраст, лет age, years |
63,3 ± 11,7 |
|
Рак ректосигмоидного отдела ободочной кишки / рак сигмовидной кишки / рак печеночного изгиба ободочной кишки, n (%) Cancer of the rectosigmoid colon / cancer of the sigmoid colon / cancer of the hepatic bend of the colon, n (%) |
41 (47,7) / 38 (44,2) / 7 (8,1) |
|
Индекс массы тела, кг/м2 Body mass index, kg/m2 |
14,2 ± 2,1 |
|
Анемия, n (%) Anemia, n (%) |
81 (94,2) |
|
Альбумин, г/л Albumin, g/l |
31,1 ± 3,4 |
|
Общий белок, г/л Total protein, g/l |
54,1 ± 6,3 |
|
Печеночная энцефалопатия, n (%) Hepatic encephalopathy, n (%) |
8 (9,3) |
|
Общий билирубин, мкмоль/л Total bilirubin, mmol/l |
14,3 ± 4,1 |
|
Протромбин (по Квику), % Prothrombin (by Quick), % |
88,7 ± 10,3 |
|
Асцит, n (%) Ascites, n (%) |
64 (74,4) |
|
Длительность клинических симптомов, мес. Duration of clinical symptoms, months |
1,3 ± 0,7 |
|
Протяженность стеноза, см Length of stenosis, cm |
5,2 ± 3,8 |
|
Диаметр оставшегося просвета, мм Diameter of the remaining lumen, mm |
4,9 ± 3,9 |
|
Химиотерапия до оперативного вмешательства, n (%) Chemotherapy before surgery, n (%) |
39 (45,3) |
Согласно представленным данным, средний возраст пациентов составил 65 лет, самому молодому пациенту, включенному в исследование, было 51 год, а самому возрастному – 86 лет. В большинстве случаев в исследовании преобладали пациенты со злокачественным образованием ректосигмоидного отдела ободочной кишки (41 случаев; 47,7 %), в остальных случаях исследовались пациенты с раком сигмовидной кишки (38 случаев; 44,2 %) и раком печеночного изгиба ободочной кишки (7 случаев; 8,1 %).
Значения индекса массы тела (ИМТ) у пациентов перед оперативным вмешательством варьировал от 12,1 до 17,3 кг/м2, что согласно данным Всемирной организации здравоохранения указывает о наличии недостаточной массы тела или выраженной гипотрофии, белково-энергетической недостаточности и дефицита нутритивного статуса.
По данным нашего исследования, у 81 пациента (94,2 %) была выявлена анемия: у 16 больных (19,8 %) наблюдалась легкая степень тяжести, средняя степень тяжести была отмечена у 54 пациентов (66,7 %) и у 11 пациентов (13,5 %) – тяжелая степень тяжести. В большинстве случаев причиной анемии являлась хроническая кровопотеря на фоне повышенной контактной хронической кровоточивости стенозирующего образования ободочной кишки.
Все пациенты были госпитализированы с клинической картиной толстокишечной непроходимости с соответствующими клиническими проявлениями: вздутие живота, тошнота, рвота желчью или съеденной пищей, затруднение отхождения газов и стула. Продолжительность этих клинических симптомов до момента госпитализации составляла в среднем 1,3±0,7 месяцев.
В предоперационном периоде всем пациентам проводилось комплексное обследование и предоперационная подготовка. Всем больным в обязательном порядке проводилась диагностическая колоноскопия, а в некоторых случаях с одномоментным проведением эндоскопического стентирования ободочной кишки. Проведение колоноскопии позволяло визуализировать точный уровень локализации опухолевого стеноза, диаметр оставшегося просвета (рис. 1).
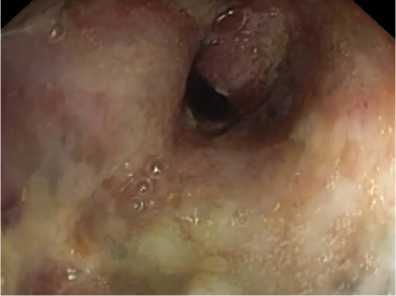
Рис. 1 . Диагностическая колоноскопия (опухолевый стеноз ободочной кишки)
Fig. 1 . Diagnostic colonoscopy (colon tumor stenosis)
Кроме того, пациентам в обязательном порядке проводилось полное комплексное стационарное обследование, и при необходимости предоперационная подготовка, включающая: лабораторные методы обследования; обзорная рентгенография органов брюшной полости с целью исключения признаков перфорации полого органа, а также оценки кишечных уровней при непроходимости; ирригоскопия толстой кишки с использованием бариевой взвеси проводилась при технической невозможности оценки протяженности опухолевого стеноза во время проведения колоноскопии. Пациентам, которым необходимо было определить стадию заболевания и степень распространенности процесса выполнялась компьютерная томография (КТ) органов грудной клетки и брюшной полости с внутривенным контрастированием. Данные КТ позволяли определить локализацию стеноза, диаметр оставшегося просвета, протяжённость опухолевого стеноза, а также распространённость процесса (наличие или отсутствие отдалённых метастазов). Кроме того, оценивалась степень распространённости внутригрудной и внутрибрюшной лимфоаденопатии. На основе результатов КТ проводилось стадирование заболевания, оценивалось наличие явлений перитонита или перфорации полого органа, а также определялась возможность выполнения радикального хирургического лечения или курсов химиотерапии в послеоперационном периоде.
Наименьший диаметр оставшегося просвета ободочной кишки составлял 3,5 мм (декомпенсированный стеноз), а наибольший – 10,2 мм (субкомпенсированный стеноз). Протяженность опухолевого стеноза варьировала от 4,2 до 7,9 см. У 39 пациентов (45,3 %) в анамнезе проводились курсы химиотерапии до проведения хирургического вмешательства.
ЭКС выполнялось натощак под внутривенной анестезией. При проведении ЭКС применяли колоноскоп Olympus СF-Q150L, с диаметром рабочего канала 3,2 мм. В подавляющем большинстве случаев (83 (96,5 %) случаев), ЭКС проводилось под рентгеноскопическим контролем на аппарате Электрон КРД-ОКО. На основании проведенного предоперационного обследования производился выбор длины и диаметра устанавливаемого металлического стента, который определялся по критерию диаметра оставшегося просвета и протяженности опухолевого стеноза. Металлический саморасширяющийся стент устанавливался таким образом, чтобы его длина была на 2–3 см больше протяженности зоны опухолевого поражения. Это позволяло позиционировать стент в пределах здоровых тканей. Перед выполнением эндоскопического стентирования ободочной кишки не выполнялись сеансы бужирования просвета и лазерной коагуляции опухоли. Мы считаем, что эти методы нецелесообразны из-за высокого риска кровотечения или перфорации полого органа. Во всех случаях мы устанавливали полностью непокрытые стенты типа Wallflex Colonic.
Оперативная техника. Положение пациента на операционном столе – на левом боку. Первым этапом колоноскоп проводили в просвет толстой кишки непосредственно к уровню опухолевой обструкции и проводили полную аспирацию и санацию кишечного содержимого через колоноскоп с целью улучшения обзора операционного поля. Далее через инструментальный канал эндоскопа вводили полужесткую струну-проводник длиной 240 см и диаметром 0,035 in (0,89 мм) (рис. 2).
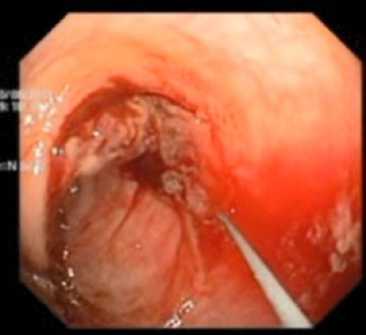
Рис. 2. Проведение полужесткой струны-проводника за зону опухолевого стеноза
Fig. 2. Conducting a semi-rigid guidewire behind the area of tumor stenosis
Струну проводили за зону опухолевого стеноза в проксимальные отделы ободочной кишки под рентгеноскопическим либо эндоскопическим контролем (удалось пройти за зону стеноза эндоскопом в 3 (3,5 %) случаях). Следующим этапом проводили непосредственно установку металлического стента: по струне-проводнику через инструментальный канал эндоскопа проводили доставочное устройство выбранного металлического саморасширяющегося стента.
В исследуемой группе мы использовали доставочное устройство металлического саморасширяющегося стента, состоящее из внутренней трубки, вложенной во внешнюю трубку. До-ставочное устройство проводили по струне-проводнику за область опухолевого стеноза (рис. 3).
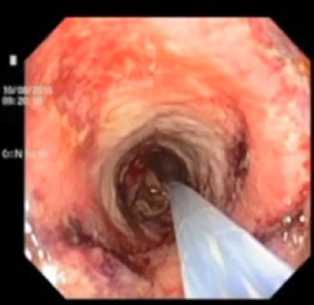
Рис. 3. Проведение доставочного устройства стента по струне-проводнику за зону опухоли
Fig. 3. Carrying the stent delivery device along the guide string beyond the tumor area
Далее позиционировали проксимальный и дистальный края стента на 2-3 см от краев опухоли и выполняли постепенное раскрытие стента. Этап раскрытия стента и его окончательный вид после высвобождения контролировался рентгеноскопически и эндоскопически (рис. 4, рис. 5, рис. 6).
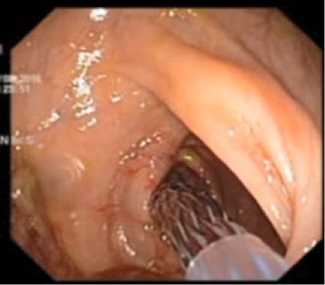
Рис. 4. Эндоскопический контроль раскрытия стента (этап непосредственного раскрытия)
Fig. 4. Endoscopic control of stent opening (the stage of direct opening)
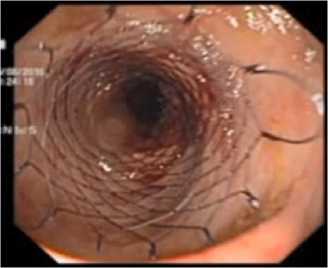
Рис. 5 . Эндоскопический контроль раскрытия стента (вид проксимального края стента после раскрытия)
Fig. 5 . Endoscopic control of stent opening (view of the proximal side of the stent after opening)
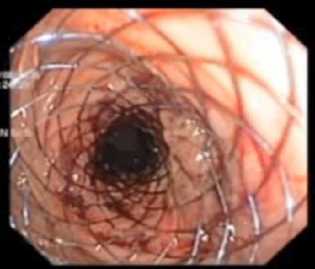
Рис. 6 . Эндоскопический контроль раскрытия стента (эндоскоп проведен в просвет стента)
Fig. 6 . Endoscopic control of stent opening (the endoscope is inserted into the lumen of the stent)
У 14 пациентов (16,3 %) с локализацией стенозирующей опухоли в труднодоступных изгибах толстой кишки, в част- ности в области изгиба ректосигмоидного отдела ободочной кишки и «сложных» многочисленных изгибах сигмовидной кишки, а также при наличии выраженной фиксации левых отделов ободочной кишки (на фоне спаечного процесса в брюшной полости) при попытке адекватного интраоперационного позиционирования просвета кишки мы столкнулись с техническими сложностями проведения стентирования. В частности, технически не удавалось адекватно позиционировать колоноскоп с целью доступа к зоне стенозирующей опухоли и, соответственно, визуализации оставшегося просвета кишки с целью проведения струны-проводника за зону опухоли. В связи с этим, колоноскоп полностью извлекался, на дистальный конец колоноскопа был установлен дистальный прозрачный пластиковый колпачок. Колоноскоп с дистальным прозрачным колпачком успешно проводился непосредственно к зоне стенозирующей опухоли и адекватно позиционировался оставшийся просвет кишки, что позволило нам качественно выполнить эндоскопическое колоректальное стентирование. Дальнейшие этапы стентирования не отличались от стандартной методики. Через инструментальный канал эндоскопа проводили полужест-кую струну-проводник длиной 240 см и диаметром 0,035 in (0,89 мм) (рис. 7).
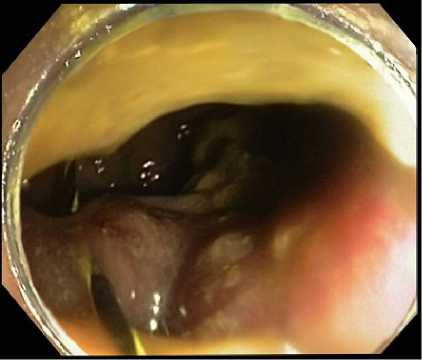
Рис. 7 . Проведение полужесткой струны-проводника за зону опухолевого стеноза с применением дистального прозрачного колпачка
Fig. 7 . Conducting a semi-rigid guidewire over the area of tumor stenosis using a distal cap
Далее по струне-проводнику проводили доставочное устройство металлического стента (рис. 8) и выполняли его раскрытие (рис. 9).
Во всех случаях после полного высвобождения стента проводилось извлечение струны-проводника совместно с доставоч-ным устройством металлического стента. Далее проводилась аспирация воздуха из просвета толстой кишки и извлекался колоноскоп. После выполнения ЭКС пациента переводили в профильное отделение, с целью наблюдения и проведения инфузионной и анальгезивной терапии.
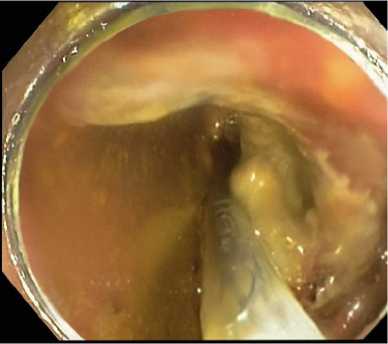
Рис. 8. Проведение доставочного устройства стента по струне-проводнику за зону опухоли с применением дистального прозрачного колпачка Fig. 8. Conducting a stent delivery device along a guidewire behind the tumor area using a distal cap
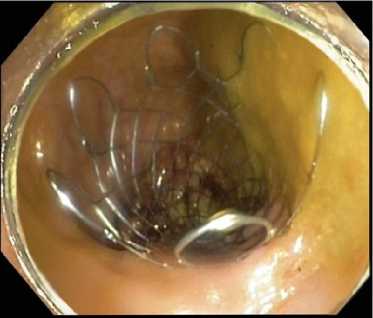
Рис. 9 . Эндоскопический контроль раскрытия стента (эндоскоп с дистальным прозрачным колпачком проведен в просвет стента)
Fig. 9. Endoscopic control of stent opening (an endoscope with a distal cap is inserted into the lumen of the stent)
Результаты
Нами были проанализированы непосредственные результаты проведенных оперативных вмешательств (табл. 2).
Средняя продолжительность проведения эндоскопического колоректального стентирования в исследуемой группе составило 21,2±5,7 мин.
Спустя 4 часа после оперативного вмешательства пациентам разрешалось пить воду в течение суток в связи с постепенным максимальным раскрытием стента через 24 часа после операции. На следующий день пациенты употребляли воду и жидкую протертую блендерную пищу в малых порциях дробно. Через 24 часа после оперативного вмешательства мы проводили контрольное обзорное рентгеноскопическое исследование брюшной полости с целью оценки диаметра раскрытия стента, наличия или отсутствия миграции стента (рис. 10).
Таблица 2
Непосредственные результаты выполненных оперативных вмешательств в исследуемой группе
Table 2
The immediate results of performed surgical interventions in the study group
|
Показатель Indicator |
Исследуемая группа (n=86) Study group (n=86) |
|
Среднее время операции, мин Average operation time, min |
21,2 ± 5,7 |
|
Технический успех, n (%) Technical success, n (%) |
85 (98,8) |
|
Клинический успех, n (%) Clinical success, n (%) |
85 (98,8) |
|
Миграция стента, n (%) Stent migration, n (%) |
1 (1,2) |
|
Перфорация органа, n (%) Perforation of the organ, n (%) |
0 (0) |
|
Кровотечение, n (%) Bleeding, n (%) |
0 (0) |
|
Срок госпитализации, сут. Duration of hospitalization, days |
6,1 ± 2,1 |
|
Выраженный болевой синдром, n (%) Severe pain syndrome, n (%) |
19 (22,1) |
|
Хронический болевой синдром, n (%) Chronic pain syndrome, n (%) |
3 (3,5) |
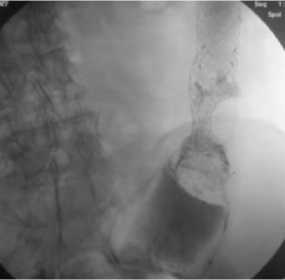
Рис. 10. Рентгеноскопический контроль раскрытия стента через 24 часа после выполнения операции
Fig. 10. Fluoroscopy monitoring of stent opening after 24 hours after performing operation
Госпитализация пациентов в стационаре составила 7–11 дней.
Интраоперационных осложнений в нашем исследовании зафиксировано не было. Также в раннем послеоперационном периоде случаев перфорации и эпизодов кровотечения отмечено не было.
Технический и клинический успех был достигнут у 85 пациентов (98,8 % случаев). У 85 пациентов (98,8 %) были купированы симптомы толстокишечной непроходимости, нормализовалось отхождение газов и жидкого стула, а также возобновилось энтеральное питание в полном объеме.
У 1 пациента (1,2 %) технический и, соответственно, клинический успех в виде купирования симптомов толстокишечной непроходимости и сопутствующих ему клинических проявлений не был достигнут после эндоскопического колоректального стенирования в связи с миграцией стента в дистальном направлении от опухолевого стеноза при контрольном обследовании через 48 часов. Данный факт мы связываем по причине распадающейся опухоли толстой кишки и, соответственно, кашицеобразной и мягкой консистенции опухолевой ткани, в связи с чем стент не зафиксировался адекватно в просвете опухолевого стеноза ободочной кишки. Данному пациенту была выполнена колоноскопия, при которой извлечь ранее установленный стент и произвести рестентирование толстой кишки не удалось. В связи с чем, по жизненным показаниям было выполнено паллиативное оперативное вмешательство – формирование колостомы с положительным эффектом в послеоперационном периоде в виде купирования явлений толстокишечной непроходимости.
У 19 пациентов (22,1 %) в исследуемой группе после выполнения ЭКС во время пребывания в стационаре сохранялись явления болевого синдрома умеренной степени в области операции, купирующиеся самостоятельно в течение 2–3 суток либо приемом ненаркотических анальгетиков. Отдельно следует указать, что хронический болевой синдром зафиксирован у 3 (3,5 %) пациентов в послеоперационном периоде. Других осложнений зафиксировано не было.
С целью оценки отдаленных результатов после выполненной операции все пациенты через 3 месяца после операции проходили комплексное обследование (табл. 3).
Необходимо отметить, что все пациенты находились под постоянным динамическим наблюдением онколога и эндоскописта. Пациентам назначались препараты для симптоматического лечения, при отсутствии противопоказаний проводились курсы химиотерапии.
По данным контрольной колоноскопии через 3 месяца после проведенного эндоскопического колоректального стентирования у 13 пациентов (15,1 %) в исследуемой группе были выявлены явления частичной толстокишечной непроходимости с соответствующими клиническими симптомами (тяжесть после еды, тошнота, рвота съеденной пищей, затруднения отхождения газов и стула) на фоне рецидива повторной обструкции стента опухолью сквозь ячейки стента у 7 пациентов (8,1 %) или продолженного роста опухоли в проксимальном или дистальном направлениях у 6 пациентов (6,9 %). Однако, давность возникновения повторной обструкции стента по- сле операции во всех случаях неизвестна и не подтверждена более ранними результатами видеоколоноскопии, в связи с тем, что данные пациенты впервые обратились за помощью в стационар через 3 месяца после операции, при этом, с их слов, жалобы появились за 6–7 дней до момента их госпитализации в наше медицинское учреждение. Всем данным пациентам было выполнено повторное эндоскопическое колоректальное стентирование опухолевого стеноза по типу «стент-в-стент».
Таблица 3
Результаты проведенных оперативных вмешательств в исследуемой группе через 3 месяца после выполнения операции
Table 3
The results of performed surgical interventions in the study group 3 months after the operation)
|
Показатель Indicator |
Исследуемая группа (n=86) Study group (n=86) |
|
Рецидив повторной обструкции стента опухолью сквозь ячейки стента, n (%) Recurrence of repeated stent obstruction by the tumor through the stent cells, n (%) |
7 (8,1) |
|
Продолженный рост опухоли, n (%) Continued tumor growth, n (%) |
6 (6,9) |
|
Миграция стента, n (%) Stent migration, n (%) |
0 (0) |
|
Необходимость повторного стентирования, n (%) The need for repeated stenting, n (%) |
13 (15,1) |
|
Летальность, n (%) Mortality, n (%) |
17 (19,8) |
В течение трёх месяцев наблюдения после ЭКС не было зарегистрировано ни одного случая миграции стента.
Трехмесячный показатель летальности в целом составил 19,8 % в связи с прогрессированием основного заболевания.
Обсуждение
Эндоскопическое колоректальное стентирование – это малоинвазивное хирургическое вмешательство, которое позволяет оказать паллиативную помощь пациентам с неоперабельной злокачественной обструкцией толстой кишки и характеризующаяся низким уровнем травматичности [12].
Полученные нами результаты выполнения ЭКС у 86 пациентов со злокачественной обструкцией толстой кишки продемонстрировали технический и клинический успех в 98,8 % случаев, а также низкую частоту ранних и отдаленных послеоперационных осложнений. ЭКС оказалось эффективным в исследуемой нами группе, что позволило разрешить клинические симптомы толстокишечной непроходимости, нормализовалось отхождение газов и жидкого стула, а также возобновилось энтеральное питание в полном объеме, тем самым улучшив показатели белково-энергетической недостаточности.
Результаты проведения методики ЭКС по данным различных авторов демонстрируют соответствие полученных нами результатам.
E.H. Emo и соавторы [13] провели сравнительный многоцентровой метаанализ 86 исследований выявления частоты возникновения перфорации толстой кишки у 4086 пациентов, перенесших колоректальное стентирование в период с 2005 по 2011 год. Перфорация толстой кишки, по их данным, была зарегистрирована в 207 случаев; общая частота возникновения перфорации толстой кишки составила 7,4 %. При этом, отмечено, что при стентировании доброкачественных стриктур была отмечена более высокая частота перфорации толстой кишки (18,4 %), чем при злокачественной обструкции (7,5 %). Также по данным проведенного исследования было отмечено, что частота перфорации после выполнения баллонной дилатации стриктуры была увеличена на 20,4 %. Таким образом, исходя из представленных данных риск перфорации толстой кишки выше при стентировании доброкачественных стриктур и после выполнения баллонной дилатации. Пациенты с доброкачественными стриктурами толстой кишки не были включены в наше исследование, также мы не применяли баллонную дилатацию перед колоректальным стентированием, в связи с чем случаев перфорации ободочной кишки в нашем исследовании зафиксировано не было.
В нашем исследовании технический и клинический успех был достигнут у 85 пациентов (98,8 % случаев) – были разрешены симптомы толстокишечной непроходимости, нормализовалось отхождение газов и жидкого стула, а также возобновилось энтеральное питание в полном объеме. Однако, у 1 пациента (1,2 %) технический и, соответственно, клинический успех не был достигнут в связи с миграцией стента в раннем послеоперационном периоде в дистальном направлении от опухолевого стеноза при контрольном обследовании через 48 часов, вероятно, на фоне распадающейся опухоли толстой кишки и, соответственно, кашицеобразной и мягкой консистенции опухолевой ткани, в связи с чем не произошла адекватная и плотная фиксация стента в просвете опухолевого стеноза. Данному пациенту было выполнено по жизненным показаниям паллиативное оперативное вмешательство – формирование колостомы с положительным эффектом в послеоперационном периоде в виде купирования явлений толстокишечной непроходимости. Других случаев миграции стента в послеоперационном периоде в нашем исследовании отмечено не было. Aaron J.S. и соавторы [14] провели анализ результатов частоты возникновения осложнений после эндоскопического стентирования ободочной кишки у 168 пациентов, которым стентирование проводилось в качестве паллиативной меры и у 65 пациентов, которым стентирование толстой кишки проводилось с целью предоперационной подготовки к радикальному хирургическому вмешательству. По представленным данным, показатели технического и клинического успеха составили 96 % и 99 % в паллиативной группе соответственно, и 95 % и 98 % в предоперационной группе соответственно. У 41 пациента (24,4 %) в паллиативной группе были отмечены такие осложнения, как перфорация толстой кишки (9 %), повторная обструкция опухоли (9 %), миграция стента (5 %), эрозия или язвенный дефект зоны установки стента опухолевого стеноза (2 %).
В нашем исследовании при выполнении эндоскопического стентирования у 14 пациентов (16,3 %) мы столкнулись с техническими сложностями проведения стентирования в связи с невозможностью адекватного позиционирвоания просвета кишки и, соответственно, оставшегося диаметра просвета кишки на фоне труднодоступной локализации стенозирующей опухоли при выраженной петлистости и фиксации ободочной кишки. В связи с этим, эндоскопическое колоректальное стентирование нам удалось успешно выполнить с применением прозрачного пластикового колпачка на дистальном конце колоноскопа, что позволило нам пройти труднодоступные изгибы и адекватно позиционировать оставшийся просвет кишки с целью качественного проведения колоректального стентирования. Fung B.M. и соавторы [15] выполнили 3 эндоскопических колоректальных стентирования у пациентов со злокачественной обструкцией кишки, стенозирование просвета кишки на фоне дивертикулита и обструкция кишки на фоне болезни Крона. Во всех 3 случаях, с целью улучшенной визуализации просвета кишки авторы применяли дистальный колпачок при выполнении стентирования. По данным анализа полученных данных, авторы отметили, что применение дистального колпачка целесообразно использовать в случаях, когда стандартные методы неэффективны или когда изначально ожидается техническая сложность в проведении вмешательства в случаях с выраженной петлистостью кишки или особенно плотными, рыхлыми экзофитными обструктивными поражениями. При изучении данных литературы мы не обнаружили больше источников, в которых бы приводились результаты применения дистального колпачка при колоректальном стентировании.
В тоже время результаты применения самой методики колоректального стентирования по данным различных авторов демонстрируют качественное соответствие полученным нами результатам.
Заключение
Эндоскопическое колоректальное стентирование – это малоинвазивная процедура, которая отличается высокой эффективностью и безопасностью, проводимая с паллиативной целью у пациентов с нерезектабельными опухолевыми обструкциями ободочной кишки. При этом, при наличии сложной анатомии кишки, а также труднодоступной лока- лизации стенозирующей опухоли, считаем целесообразным применение дистального прозрачного пластикового колпачка, что обосновано более адекватным визуальным позиционированием просвета кишки, позволяющим проводить более качественное эндоскопическое стентирование кишки. Методика ЭКС позволяет добиться быстрого купирования клинических симптомов толстокишечной непроходимости, восстановления энтерального питания и имеет низкий риск осложнений после оперативного вмешательства, тем самым способствуя повышению качества жизни у пациентов с не-резектабельными опухолями ободочной кишки.


