Результаты применения новой методики «открытой» имплантации самораскрывающегося транскатетерного протеза аортального клапана в эксперименте
Автор: М.О. Жульков, К.В. Козырь, И.С. Зыков, А.Р. Таркова, Х.А. Агаева, А.К. Сабетов, Д.А. Сирота, Д.С. Сергеевичев, А.М. Чернявский
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Экспериментальные статьи
Статья в выпуске: 2 т.26, 2022 года.
Бесплатный доступ
Актуальность. В качестве альтернативы «открытому» протезированию все чаще выполняют транскатетерную имплантацию аортального клапана. Малоинвазивный характер технологии обеспечивает благоприятный клинический исход в большинстве случаев. Отсутствие потребности в стернотомии и искусственном кровообращении значительно снижает риск послеоперационной летальности и осложнений. Вместе с тем недостатки имеющихся моделей заставляют ученых разрабатывать и испытывать новые искусственные клапаны для транскатетерной имплантации. Проблема экспериментальных исследований новых моделей самораскрывающихся транскатетерных протезов аортального клапана главным образом обусловлена анатомическими особенностями аортального корня животных. Это определяет актуальность разработки надежной методики имплантации клапанных протезов в эксперименте. Цель. Разработка протокола «открытой» имплантации транскатетерного протеза аортального клапана сердца в эксперименте и оценка отдаленных результатов. Методы. Для разработки экспериментальной модели использовали самок свиней породы ландрас весом 129,83 ± 9,00 кг. Имплантацию выполняли в условиях искусственного кровообращения и умеренной гипотермии (33–34 °С) через поперечную аортотомию под контролем зрения. Во время эксперимента проводили инвазивный мониторинг артериального давления, центрального венозного давления, ритма сердца, температуры тела, газового состава крови, активированного времени свертываемости. Правильность позиционирования и параметры гемодинамики после имплантации оценивали с помощью транспищеводной эхокардиографии. Результаты. В серии хронических экспериментов выполнили 18 «открытых» имплантаций самораскрывающихся транскатетерных протезов аортального клапана. Успешного позиционирования достигли в 100 % случаев. Разработанный протокол «открытой» имплантации позволил добиться надежной фиксации протеза в ортотопической позиции, предупредить его миграцию, митральную регургитацию, парааортальные фистулы и нарушения коронарного кровообращения. Заключение. Разработанный способ «открытой» имплантации транскатетерного протеза аортального клапана сердца в эксперименте надежен и позволяет избежать жизнеугрожающих осложнений.
Малоинвазивная хирургия, самораскрывающийся протез аортального клапана, стеноз аортального клапана, транскатетерная имплантация аортального клапана
Короткий адрес: https://sciup.org/142232023
IDR: 142232023 | DOI: 10.21688/1681-3472-2022-2-49-57
Текст научной статьи Результаты применения новой методики «открытой» имплантации самораскрывающегося транскатетерного протеза аортального клапана в эксперименте
М.О. Жульков, К.В. Козырь, И.С. Зыков, А.Р. Таркова, Х.А. Агаева, А.К. Сабетов, Д.А. Сирота, Д.С. Сергеевичев,
Стеноз аортального клапана занимает третье место в структуре патологий системы кровообращения после артериальной гипертензии и ишемической болезни сердца [1–3]. Максимальному риску подвержены старшие возрастные группы: в развитых странах это наиболее частотный порок сердца среди пожилых пациентов [4]. Растет число больных старше 60 лет с критическим аортальным стенозом, которые нуждаются в оперативном лечении: по некоторым данным, их доля достигает 15–20 % [5–9]. Сложившаяся ситуация стимулировала исследователей к поиску новых способов хирургической коррекции аортального стеноза. Малоинвазивная технология транскатетерной имплантации протеза аортального клапана значительно уменьшает риск осложнений и длительность госпитализации (до 2–4 дней) по сравнению с традиционной «открытой» коррекцией, что, в свою очередь, способствует сокращению затрат на проведение вмешательства [10]. Поэтому транскатетерную имплантацию протеза аортального клапана все чаще выбирают для лечения пациентов высокого риска и больных тяжелым стенозом [11–13].
Проблема экспериментальных исследований новых моделей самораскрывающихся протезов аортального клапана для транскатетерной имплантации главным образом определяется анатомическими особенностями аортального корня здоровых животных [14]. Высокая эластичность фиброзного кольца и близость важных анатомических структур приводят к сокращению посадочной зоны и значительно повышают риск неудач (миграции клапанного протеза, нарушения коронарного кровообращения, атриовентрикулярной блокады, аорто-левожелудочковых фистул и митральной регургитации) при экспериментальной апробации новых моделей протезов аортального клапана для малоинвазивной эндоваскулярной имплантации [15–18]. Специфические механические осложнения ограничивают послеоперационный период наблюдения и изучения прочностных характеристик кла- панных протезов, при этом максимальный период наблюдения, описанный в литературе, составляет 140 дней. По данным K. Nakatsuma и соавт., миграция каркаса наблюдалась в 50 % случаев имплантации свиньям [18]. Сказанное определяет актуальность разработки надежной методики имплантации клапанных протезов в эксперименте.
В статье описаны результаты применения новой методики «открытой» хирургической имплантации самораскрывающегося протеза аортального клапана в эксперименте. Протокол включает описание предоперационной подготовки, анестезиологического пособия, проведения искусственного кровообращения и послеоперационного ухода за животными.
Методы
Для разработки экспериментальной модели использовали самок свиней породы ландрас весом 129,83 ± 9,00 кг. Уход за животными, обеспечение эксперимента, наблюдение и анестезиологические процедуры (обезболивание, седацию, эвтаназию и другие) выполняли в соответствии с этическими нормами, регламентирующими эксперименты на животных и закрепленными в международных и российских нормативных правовых документах: Европейской конвенции о защите позвоночных животных, используемых для экспериментов и иных научных целей EST № 123 (Страсбург, 18 марта 1986 г.); приказе Минздрава России «Об утверждении Правил надлежащей лабораторной практики» от 1 апреля 2016 г. № 199н; межгосударственном стандарте ГОСТ 33044-2014 «Принципы надлежащей лабораторной практики» (введен в действие приказом Росстандарта от 20 ноября 2014 г. № 1700-ст). Накануне вечером животное лишали приема пищи, доступ к воде не ограничивали. Анестезиологическое обеспечение на всех этапах ведения животного осуществляли совместно анестезиолог и ветеринарный врач, сертифицированные в соответствии со стандартами надлежащей лабораторной практики (англ. Good Laboratory Practice).
Рис. 1. Транскатетерный протез аортального клапана сердца: общий вид (A); основные размерные параметры каркаса (B)

За 1 час до вмешательства после подтверждения ветеринарным врачом удовлетворительного состояния животного проводили премедикацию препаратом Золетил 100 в дозе 5–7 мг/кг внутримышечно в область у основания уха. Для минимизации стресса седацию выполняли в вольере постоянного содержания. При наступлении целевого уровня седации (оценивали по снижению уровня рефлексов) животных транспортировали на носилках в помещение предоперационной подготовки, где проводили санитарно-гигиеническую обработку операционного поля. Для периферического венозного доступа катетеризировали подкожную вену на наружной поверхности уха катетером Venflon 18–20 G (Becton Dickinson, Хельсингборг, Швеция). Индукцию анестезии проводили внутривенным введением фентанила 0,005 % (0,006–0,008 мг/кг), пропофола (4–6 мг/кг) и ардуана (0,10–0,15 мг/кг), после чего проводили интубацию трахеи через рот методом прямой ларингоскопии клинком. Животное переводили на искусственную вентиляцию легких аппаратом Julian Plus (Dräger, Любек, Германия). Исходные параметры искусственной вентиляции легких устанавливали с контролем по объему из расчета 6–8 мл/кг и положительным давлением в конце выдоха до 10 см вод. ст., с 50% подачей кислорода. Адекватность искусственной вентиляции легких оценивали по показаниям капнографа и газоанализатора i-STAT System (Abbott, Эббот-Парк, США), поддерживая состояние нормокапнии (парциальное давление углекислого газа в артериальной крови 36–43 мм рт. ст.). После перевода животного на искусственную вентиляцию легких анестезию поддерживали ингаляцией севофлурана 2–4 об.% и болюсным введением фентанила 0,001–0,002 мг/кг каждые 20 мин. На этапе искусственного крово- обращения анестезию поддерживали инфузией пропофола 4–6 мг/кг/ч и болюсным введением фентанила 0,001–0,002 мг/кг каждые 20 мин. В бедренную вену устанавливали центральный венозный катетер для мониторинга центрального венозного давления и внутривенной инфузии. Для мониторинга инвазивного артериального давления и забора артериальной крови для контроля газового и электролитного состава секционно выделяли подкожную артерию внутренней поверхности бедра и устанавливали артериальную линию.
Антибактериальная профилактика включала внутривенное введение 2 г цефазолина (1 г за 30 мин до кожного разреза и 1 г через 4 ч после начала операции). На этапе окончания вмешательства после наложения кожных швов прекращали подачу севофлу-рана в дыхательную смесь. На фоне восстановления самостоятельного дыхания, стабильной гемодинамики, при отсутствии признаков сердечной недостаточности, удовлетворительной оксигенации (оценивали по показателям газового состава артериальной крови: сатурация не менее 90 %, парциальное давление кислорода в артериальной крови не менее 70 мм рт. ст., парциальное давление углекислого газа в артериальной крови 33–45 мм рт. ст.) животное экстубировали. После экстубации проводили мониторинг гемодинамики (артериального давления, центрального венозного давления), электролитного и газового состава крови, электрокардиографический мониторинг в течение 30–60 мин, затем транспортировали животное в виварий.
В качестве модели самораскрывающего-ся искусственного клапана использовали разработанный ФГБУ «ННИИПК им. акад. Е.Н. Ме-шалкина» Минздрава России (ныне ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России)
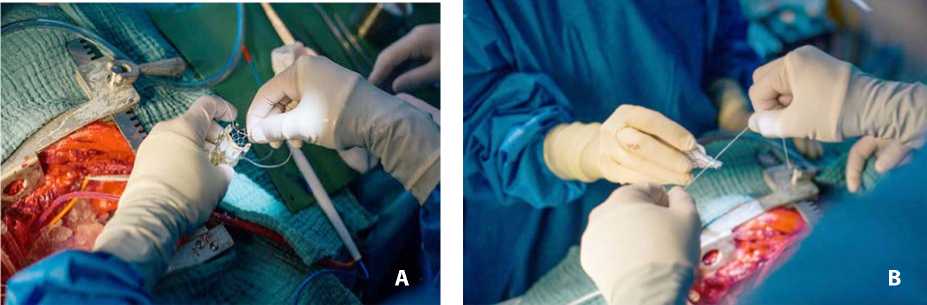
Рис. 2. Подготовка протеза к имплантации: проведение фиксирующей лигатуры через верхний ряд ячеек короны стента (A); охлаждение и сжатие фиксирующей лигатурой (B)
совместно с ООО «Ангиолайн» (Новосибирск, Россия) прототип самораскрывающегося протеза аортального клапана. Каркас протеза выполнен из никелида титана, обладающего эффектом памяти формы. Створчатый аппарат клапана изготовлен из свиного перикарда, обработанного эпоксидным компаундом по стандартной технологии (рис. 1). Во всех экспериментах использовали каркас с размерами, указанными на рис. 1.
Животное укладывали на спину и выполняли срединную стернотомию. После системной гепаринизации (3 мг/кг) подключали аппарат искусственного кровообращения. Работу с корнем аорты свиней затрудняет короткий восходящий отдел. Чтобы сохранить место для размещения поперечного зажима, кардиоплегической канюли и выполнения аортото-мии, артериальную канюлю (16 Fr) аппарата искусственного кровообращения устанавливали в правую общую сонную артерию. В правое предсердие устанавливали двухэтапную венозную канюлю. После инициации искусственного кровообращения сердце вертикализировали и прошивали полунепарную вену для предотвращения вымывания кардиоплегического раствора из заднебоковой стенки сердца. Дренаж левого желудочка устанавливали через ушко левого предсердия. Для уменьшения продолжительности искусственного кровообращения и ишемии миокарда заранее подготавливали искусственный аортальный клапан. Для этого через верхние ячейки проводили лавсановую нить, с помощью которой после охлаждения нитинолового каркаса сжимали на бужах и фиксировали верхнюю часть короны (рис. 2).
После выполнения кардиоплегии аорту вскрывали поперечным разрезом на 0,5 см выше синотубулярного соединения, продолжая разрез по направлению к некоронарному синусу. Нативные створки удаляли с оставлением небольшого края основания. Этот прием позволил укрепить линию будущих швов и дополнительно «пломбировал» пространство между дакроновым протезом и аортальным кольцом, чтобы предотвратить риск окклюзии устьев коронарных артерий. На 9 П-образных швах с фетровыми прокладками нитью Ethibond 2/0 имплантировали дакроновый сосудистый протез диаметром 22 мм и длиной 15 мм в субкоронарную позицию (рис. 3). Фетровые прокладки располагали как можно ближе друг к другу
Рис. 3. Этап укрепления аортального фиброзного кольца: имплантация дакронового протеза (А); положение протеза в субкоронарной позиции (B)
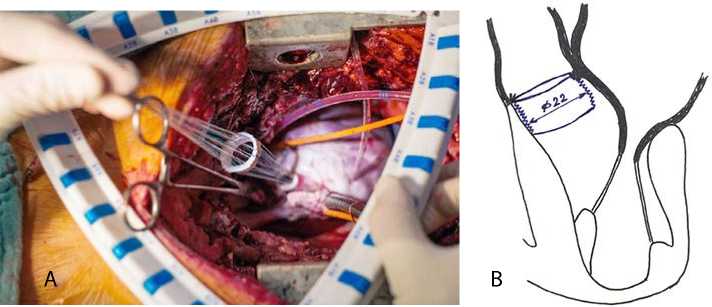
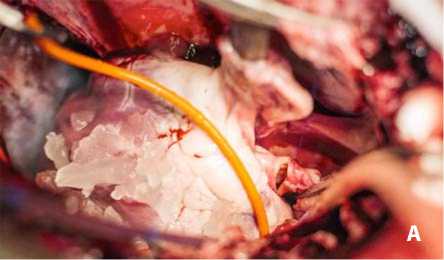
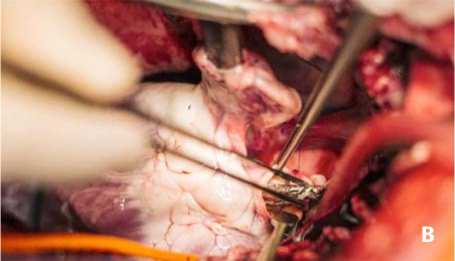
Рис. 4. Окончательный этап имплантации: вид аортотомического отверстия после формирования матрацного шва (А); имплантация сжатого протеза аортального клапана (B)
для предотвращения парааортальных аорто-левожелудочковых фистул.
После погружения и фиксации дакронового протеза в выходном отделе левого желудочка прошивали матрацным швом заднебоковые полуокружности аортотомического доступа (рис. 4А). Сжатый и фиксированный в верхней части протез аортального клапана размещали внутри имплантированного дакронового протеза (рис. 4B) и орошали теплым (36 °С) физиологическим раствором. После расширения и самофиксации протеза нижней частью внутри дакронового протеза нитиноловый каркас снова охлаждали ледяным (4 °С) физиологическим раствором, чтобы предупредить преждевременное раскрытие короны протеза и облегчить восстановление целостности аорты. Удаляли фиксирующую лигатуру и заканчивали второй ряд швов. После деаэрации через прокол в восходящем отделе аорты снимали поперечный зажим с аорты и восстанавливали сердечную деятельность. Рану послойно ушивали стальными швами с оставлением дренажей в плевральных полостях и полости перикарда. Экстубацию трахеи проводили по показаниям после восстановления полноценного самостоятельного дыхания, ориентируясь на величины парциального давления кислорода и углекислого газа, насы- щения крови кислородом в артериальной крови. В раннем послеоперационном периоде проводили мониторинг параметров гомеостаза: артериального давления, центрального венозного давления, частоты сердечных сокращений; сатурации крови; гематокрита; показателей кислотно-щелочного состояния; газового состава артериальной и венозной крови; диуреза.
Наблюдали животных в течение 6 мес. Далее выполняли контрольное чреспищеводное эхокардиографическое исследование. Эвтаназию и па-томорфологическое исследование осуществляли после согласования с руководителем исследования в условиях общей комбинированной анестезии (пропофол 4–7 мг/кг, фентанил 0,006–0,008 мг/кг и ингаляции севофлураном 2–4 об.%).
Исследуемые данные представляли как среднее значение (M) ± стандартное отклонение (SD). Статистический анализ и значимость оценивали с помощью одностороннего дисперсионного анализа (англ. ANalysis Of VAriance, ANOVA) с последующим апостериорным тестом Тьюки. Все анализы выполняли с использованием программы Statistica 13 (TIBCO Software, Пало-Альто, США). Различия между контрольными и обработанными образцами считали значимыми при p < 0,05.
Основные параметры гемодинамики в послеоперационном периоде
|
Параметр |
До операции |
Через 6 мес. |
p |
|
Фракция выброса левого желудочка, % |
61,23 ± 5,00 |
52 ± 4 |
0,0004 |
|
Конечный диастолический объем левого желудочка, мл |
70,23 ± 11,00 |
69,18 ± 12,00 |
0,75 |
|
Аортальная недостаточность, ст. |
0 [0; 0] |
0 [0; 1] |
0,0075 |
|
Градиент средний, мм рт. ст. |
4,69 ± 1,89 |
10,45 ± 2,81 |
0,0004 |
|
Vena contracta, см |
0,12 ± 0,04 |
0,13 ± 0,06 |
0,94 |
Примечание. Достоверность различий рассчитана с использованием критерия Уилкоксона. Данные представлены как M ± SD или Me [Q1; Q3].
Результаты
В серии хронических экспериментов выполнили 18 «открытых» имплантаций самораскрывающихся протезов аортального клапана. Во всех случаях достигли оптимального позиционирования каркаса протеза. В раннем послеоперационном периоде погибло 5 животных (27 %), главная причина смерти — острая сердечная недостаточность. Спустя 3 мес. наблюдения было живо 13 свиней (72 %), через 6 мес. выживаемость составила 61 % (11 животных). По данным чреспищеводной эхокардиографии не зафиксировали случаев дисфункции аортального клапана (таблица) в раннем и отдаленном послеоперационных периодах.
В 13 случаях (72 %) ранний послеоперационный период протекал без осложнений, спустя 3–4 сут. животные вернулись к обычному рациону с полным восстановлением двигательной активности. В 4 экспериментах утром после дня операции животных обнаружили мертвыми. На вскрытии во всех случаях клапан был расположен правильно, при осмотре зоны посадки не выявили парааортальных фистул или нарушения замыкательной функции протеза, устья коронарных артерий были интактны, в плевральных полостях определялось незначительное количество серозно-геморрагической жидкости в объеме не более 200–300 мл. Наиболее вероятные причины смерти — нарастающие сердечная и дыхательная недостаточности. Ни в одном случае не отметили митральной регургитации или пара-аортальных фистул после имплантации.
По результатам патоморфологических исследований через 6 мес. не зафиксировали миграции клапанного протеза. Во всех случаях нижняя юбка каркаса была самофиксирована в просвете имплантированного дакронового протеза, створочный аппарат протеза не был изменен, створки были подвижны и работали правильно, форма каркаса была сохранена и диаметры совпадали с исходными. В 12 случаях (66 %) в области сегмента А2 митрального клапана отметили фиброзное уплотнение, по-видимому, вызванное прилеганием дакронового протеза.
Обсуждение
Главные причины высокого риска неудач транскатетерной имплантации протезов аортальных клапанов — отсутствие достаточной нативной жесткости корня аорты здоровых животных и короткая посадочная зона, часто приводящая к миграции клапанного протеза даже при оптимальном позиционировании [16; 19]. Отсутствие жесткой опоры в области аорто-левожелудочкового контакта вызывает грубые изменения геометрии зоны митрально-аортального контакта, острую митральную регургитацию сразу после раскрытия нижней юбки нитинолового каркаса. Поэтому мы стремились придать фиброзному кольцу аортального клапана достаточную каркасную жесткость для того, чтобы удержать самораскрывающийся нитиноло-вый каркас.
Выбор модели экспериментального животного определяет успех эксперимента. Несмотря на описанные в литературе преимущества аортального корня барана (хрящевой компонент в области митрально-аортального контакта потенциально уменьшает риск миграции имплантированного протеза), размер корня взрослых особей недостаточен для безопасного размещения тела стента. Использовать молодых телят также затруднительно, несмотря на наличие зон оссификации фиброзных треугольников аортального корня, из-за очень быстрого роста этого вида животных. Максимальная относительная скорость роста телят черно-пестрой породы отмечается в период от рождения до 6 мес. — 364,6 % [20]. Затем она значительно замедляется: от 6 до 10 мес. 54,2 %, от 10 до 12 мес. 17 %. Однако к этому возрасту диаметр аортального кольца может достигать 50–60 мм [20]. Анализ исследований акселерационных, морфометрических и поведенческих особенностей крупных лабораторных животных показал, что наиболее подходящая модель — свиньи породы ландрас с массой тела 120–140 кг [21–24].
Ранее сообщалось, что замена клапанов сердца у свиней требует мер, в которых не нуждаются другие животные: использования кристаллоидного прайма при заполнении аппарата искусственного кровообращения, исключения коллоидных растворов, особенно на базе крахмала, профилактического применения фармакологической защиты от желудочковых аритмий, введения ударных доз кортикостероидов непосредственно перед реперфузией [25]. Однако наш опыт позволил заключить избыточность перечисленных мер.
При традиционной технике транскатетерной имплантации самораскрывающегося протеза аортального клапана количество постимплантационных осложнений в эксперименте остается крайне высоким. По данным T.M. Dewey и соавт., частота миграции протезов после удачного позиционирования в аортальную позицию свиней составляет 31 %, частота развития парааортальных фистул — 77,8 % [25]. Еще одна особенность хирургической анатомии сердца свиньи — низкое отхождение коронарных артерий: устье левой коронарной артерии берет начало в основании аортального синуса,
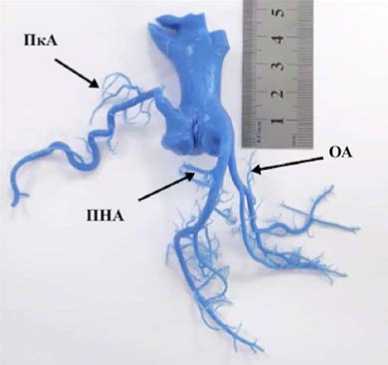
Рис. 5. Слепок корня аорты и коронарных артерий свиньи
Примечание. ПкА — правая коронарная артерия;
ПНА — передняя нисходящая артерия;
ОА — огибающая артерия.
что создает предпосылки нарушения коронарного кровообращения при высоком позиционировании нижней юбки нитинолового каркаса (рис. 5).
Помимо этого, требуется тщательный анализ размеров корня аорты для прогнозирования качества фиксации, а также степени раскрытия протеза и его размера. Предлагаемая нами методика позволяет минимизировать риск ошибки в выборе размера протеза аортального клапана благодаря удлинению выходного отдела левого желудочка за счет туннелирования дакроновым протезом.
Разработанная методика удлинения выходного отдела левого желудочка и изоляции границ допустимого расширения клапанного протеза позволяет избежать сразу нескольких жизнеугрожающих осложнений: миграции клапанного протеза, нарушения коронарного кровообращения, атриовентрикулярной блокады, аорто-левожелудочковых фистул и митральной регургитации, — и может быть рекомендована для рутинного применения в доклинических исследованиях. Однако, несмотря на надежность метода и минимальный риск механических осложнений имплантации, долгосрочная выживаемость, вероятно, обусловленная тяжестью вмешательства, не превысила 61 %.
Заключение
Серия хронических экспериментов позволила разработать подробный протокол «открытой» имплантации транскатетерного самораскрывающего-ся протеза аортального клапана в ортотопическую позицию свиньи и оценить отдаленные результаты вмешательства. Замена транскатетерной методики имплантации «открытой» существенно не влияет на условия испытания новых моделей протезов аортальных клапанов для транскатетерной имплантации в эксперименте, однако значительно упрощает ход эксперимента и минимизирует риск жизнеугрожающих осложнений и смерти животных. Протокол можно использовать в доклинических испытаниях искусственных клапанов сердца с минимальным риском интраоперационной смерти.
Список литературы Результаты применения новой методики «открытой» имплантации самораскрывающегося транскатетерного протеза аортального клапана в эксперименте
- Otto C.M., Kumbhani D.J., Alexander K.P., Calhoon J.H., Desai M.Y., Kaul S., Lee J.C., Ruiz C.E., Vassileva C.M. 2017 ACC expert consensus decision pathway for transcatheter aortic valve replacement in the management of adults with aortic stenosis: a report of the American College of Cardiology Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol. 2017;69(10):1313-1346. PMID: 28063810. https://doi.org/10.1016/j.jacc.2016.12.006
- Артющик В.В., Пристром М.С., Семененков И.И., Олихвер Ю.А., Чечко Р.Ю., Курсевич В.В. Сенильный кальцинированный аортальный стеноз: современный взгляд на проблему. Лечебное дело. 2015;43(3):54-58.
- Artyushchik V.V., Pristrom M.S., Semenenkov I.I., Olikhver Yu.A., Chechko R.Yu., Kursevich V.V. Senile calcified aortic stenosis: a modern view of the problem. Lechebnoe Delo. 2015;43(3):54-58. (In Russ.)
- Кранин Д.Л., Стец В.В., Пестовская О.Р., Дунаев Э.П., Назаров Д.А., Гайдуков А.В., Маштанов Г.В., Замский К.С., Федоров А.Ю., Варочкин К.А., Курносов С.А. Контраст-индуцированная нефропатия после выполнения транскатетерной имплантации аортального клапана. Альманах клинической медицины. 2017;45(3):242-246. https://doi.org/10.18786/2072-0505-2017-45-3-242-246
- Kranin D.L., Stets V.V., Pestovskaya O.R., Dunaev E.P., Nazarov D.A., Gaydukov A.V., Mashtanov G.V., Zamskiy K.S., Fedorov A.Yu., Varochkin K.A., Kurnosov S.A. Contrast induced nephropathy after transcatheter aortic valve implantation. Almanac of Clinical Medicine. 2017;45(3):242-246. (In Russ.) https://doi.org/10.18786/2072-0505-2017-45-3-242-246
- Cribier A., Eltchaninoff H., Bash A., Borenstein N., Tron C., Bauer F., Derumeaux G., Anselme F., Laborde F., Leon M.B. Percutaneous transcatheter implantation of an aortic valve prosthesis for calcific aortic stenosis: first human case description. Circulation. 2002;106(24):3006-3008. PMID: 12473543. https://doi.org/10.1161/01.cir.0000047200.36165.b8
- Карпова Н.Ю., Рашид М.А., Казакова Т.В., Шостак Н.А. Аортальный стеноз. Русский медицинский журнал. 2014;22(2):162-165.
- Karpova N.Yu., Rashid M.A., Kazakova T.V., Shostak N.A. Aortic stenosis. Russkii meditsinskii zhurnal = Russian Medical Journal. 2014;22(2):162-165. (In Russ.)
- Бокерия Л.А., Скопин И.И., Муратов Р.М., Олофинская И.Е., Нерсисян М.М. Изучение результатов хирургического лечения критического аортального стеноза в условиях искусственного кровообращения у больных старше 80 лет. Грудная и сердечно-сосудистая хирургия. 2016;58(1):41-47.
- Boсkeria L.A., Skopin I.I., Muratov R.M., Olofinskaya I.E., Nersisyan M.M. The results of open heart surgery in very elderly patients aged 80 years and older with severe aortic stenosis. Russian Journal of Thoracic and Cardiovascular Surgery. 2016;58(1):41-47. (In Russ.)
- Котовская Ю.В., Курашев Д.Х., Темненко Н.А., Гароян В.О., Хабибуллои Н.Н., Щербакова В.Л., Рунихина Н.К., Ткачева О.Н. Стеноз аортального клапана у пациентов пожилого и старческого возраста. Русский медицинский журнал. 2017;25(25):1833-1836.
- Kotovskaya Yu.V., Kurashev D.Kh., Temnenko N.A., Garoyan V.O., Khabibulloi N.N., Shcherbakova V.L., Runikhina N.K., Tkacheva O.N. Stenosis of the aortic valve in patients of elderly and senile age. Russkii meditsinskii zhurnal = Russian Medical Journal. 2017;25(25):1833-1836. (In Russ.)
- Синьков А.В. Современные подходы к диагностике аортального стеноза. Сибирский медицинский журнал. 2017;151(4):53-57.
- Sinkov A.V. Modern approaches to aortic stenosis diagnostics. Sibirskij Medicinskij Zurnal (Irkutsk) = Siberian Medical Journal (Irkutsk). 2017;151(4):53-57. (In Russ.)
- Cribier A., Litzler P.-Y., Eltchaninoff H., Godin M., Tron C., Bauer F., Bessou J.-P. Technique of transcatheter aortic valve implantation with the Edwards–Sapien heart valve using the transfemoral approach. Herz. 2009;34(5):347-356. PMID: 19711030. https://doi.org/10.1007/s00059-009-3264-z
- Кретов Е.И., Козырь К.В., Таркова А.Р., Сергеевичев Д.С., Коробейников А.А., Тимченко Т.П., Зубарев Д.Д., Зыков И.С., Байструков В.И. Первый опыт транскатетерной имплантации прототипа нового самораскрывающегося протеза аортального клапана в эксперименте. Патология кровообращения и кардиохирургия. 2016;20(4):83-87. https://dx.doi.org/10.21688/1681-3472-2016-4-83-87
- Kretov E.I., Kozyr K.V., Tarkova A.R., Sergeevichev D.S., Korobeynikov A.A., Timchenko T.P., Zubarev D.D., Zykov I.S., Baystrukov V.I. Transcatheter implantation of a new prototype of self-expanding aortic valve prosthesis: first experience. Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2016;20(4):83-87. (In Russ.) https://dx.doi.org/10.21688/1681-3472-2016-4-83-87
- Toggweiler S., Humphries K.H., Lee M., Binder R.K., Moss R.R., Freeman M., Ye J., Cheung A., Wood D.A., Webb J.G. 5-year outcome after transcatheter aortic valve implantation. J Am Coll Cardiol. 2013;61(4):413-419. PMID: 23265333. https://doi.org/10.1016/j.jacc.2012.11.010
- Achenbach S., Delgado V., Hausleiter J., Schoenhagen P., Min J.K., Leipsic J.A. SCCT expert consensus document on computed tomography imaging before transcatheter aortic valve implantation (TAVI)/transcatheter aortic valve replacement (TAVR). J Cardiovasc Comput Tomogr. 2012;6(6):366-380. PMID: 23217460. https://doi.org/10.1016/j.jcct.2012.11.002
- Имаев Т.Э., Комлев А.Е., Акчурин Р.С. Прогноз при транскатетерной имплантации аортального клапана. Рациональная фармакотерапия в кардиологии. 2016;12(6):718-724. https://doi.org/10.20996/1819-6446-2016-12-6-718-724
- Imaev T.E., Komlev A.E., Akchurin R.S. The prognosis in transcatheter aortic valve implantation. Ratsional'naya farmakoterapiya v kardiologii = Rational Pharmacotherapy in Cardiology. 2016;12(6):718-724. (In Russ.) https://doi.org/10.20996/1819-6446-2016-12-6-718-724
- Carney J.P., Schappa Faustich J., Lahti M.T., Ashworth P.E., Dalmasso A.P., Moklyak Y., Bianco R.W. New model for the assessment of transcatheter aortic valve replacement devices in sheep. J Invest Surg. 2020;35(2):371-377. https://doi.org/10.1080/08941939.2020.1864796
- Carney J.P., Zhang L.M., Larson J.J., Lahti M.T., Robinson N.A., Dalmasso A.P., Bianco R.W. The Hancock® valved conduit for right ventricular outflow tract reconstruction in sheep for assessing new devices. J Heart Valve Dis. 2017;26(4):472-480. PMID: 29302948.
- Dewey T.M., Walther T., Doss M., Brown D., Ryan W.H., Svensson L., Mihaljevic T., Hambrecht R., Schuler G., Wimmer-Greinecker G., Mohr F.W., Mack M.J. Transapical aortic valve implantation: an animal feasibility study. Ann Thorac Surg. 2006;82(1):110-116. PMID: 16798200. https://doi.org/10.1016/j.athoracsur.2006.02.035
- Wendt D., Pasa S., Kahlert P., Delaloye S., Al-Rashid F., Price V., Jánosi R.-A., Borenstein N., Behr L., Konorza T., Erbel R., Jakob H., Thielmann M. A new self-expandable transcatheter aortic valve for transapical implantation: feasibility in acute and chronic animal experiments. Scand Cardiovasc J. 2013;47(3):145-153. PMID: 23098267. https://doi.org/10.3109/14017431.2012.743675
- Nakatsuma K., Saito N., Watanabe H., Bao B., Yamamoto E., Watanabe S., Kimura T., Inoue K. Antegrade transcatheter aortic valve implantation using the looped Inoue balloon technique: a pilot study in a swine model. J Cardiol. 2017;69(1):260-263. PMID: 27169357. https://doi.org/10.1016/j.jjcc.2016.04.008
- Kappetein A.-P., Piazza N., Laborde J.-C., de Jaegere P.P., Serruys P.W. Transapical implantation of a self-expanding aortic valve bioprosthesis — animal feasibility study. Eur J Cardiothorac Surg. 2009;36(5):813-817. PMID: 19682918. https://doi.org/10.1016/j.ejcts.2009.04.064
- Бургомистрова О.Н., Абрамова Н.И., Хромова О.Л. Оптимальные параметры развития высокопродуктивных коров черно-пестрой породы. Генетика и разведение животных. 2018;(3):57-63.
- Burgomistrova O.N., Abramova N.I., Khromova O.L. The optimal parameters of development highly productive cows of black-and-white breed. Genetics and breeding of animals. 2018;(3):57-63. (In Russ.)
- Piermattei D.L., Swan 2nd H. Techniques for general anesthesia in miniature pigs. J Surg Res. 1970;10(12):587-592. PMID: 4924212. https://doi.org/10.1016/0022-4804(70)90085-5
- Swan H., Piermattei D.L. Technical aspects of cardiac transplantation in the pig. J Thorac Cardiovasc Surg. 1971;61(5):710-723. PMID: 4931084.
- Hasenkam J.M., Pedesen E.M., Ostergaard J.H., Nygaard H., Paulsen P.K., Johannsen G., Schurizek B.A. Velocity fields and turbulent stresses downstream of biological and mechanical aortic valve prostheses implanted in pigs. Cardiovasc Res. 1988;22(7):472-483. PMID: 3252971. https://doi.org/10.1093/cvr/22.7.472
- Grehan J.F., Hilbert S.L., Ferrans V.J., Droel J.S., Salerno C.T., Bianco R.W. Development and evaluation of a swine model to assess the preclinical safety of mechanical heart valves. J Heart Valve Dis. 2000;9(5):710-719; discussion 719-720. PMID: 11041189.
- Dewey T.M., Brown D., Ryan W.H., Herbert M.A., Prince S.L., Mack M.J. Reliability of risk algorithms in predicting early and late operative outcomes in high-risk patients undergoing aortic valve replacement. J Thorac Cardiovasc Surg. 2008;135(1):180-187. PMID: 18179938. https://doi.org/10.1016/j.jtcvs.2007.09.011


