Результаты применения противоспаечного геля после моделирования контузионного повреждения спинного мозга у крыс
Автор: Кубрак Надежда Владимировна, Варсегова Татьяна Николаевна, Краснов Виталий Викторович, Рябых Сергей Олегович
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 6 т.27, 2021 года.
Бесплатный доступ
Цель. Изучить влияние противоспаечного гиалуроносодержащего рассасывающегося геля на течение травматической болезни спинного мозга в условиях моделирования его контузионного повреждения у крыс. Материалы и методы. Эксперимент по моделированию контузионного повреждения спинного мозга средней степени тяжести на уровне Th9 провели на 40 самках крыс линии Вистар, случайным образом распределенных на 2 группы: крысам опытной группы интраоперационно на твердую мозговую оболочку наносили гиалуроносодержащий рассасывающийся противоспаечный гель «Антиадгезин»®; у крыс контрольной группы гель не применяли. Степень восстановления функций тазовых конечностей оценивали по стандартизированной шкале ВВВ. Животных выводили из эксперимента на 5, 15, 30, 60 и 90 сутки. Для морфологического исследования спинного мозга на светооптическом уровне использовали парафиновые и эпоксидные полутонкие (1 мкм) срезы. Результаты. Использование геля после контузионного повреждения спинного мозга у крыс не вызвало существенных изменений течения послеоперационного периода и местных инфекционно-воспалительных осложнений, а также не оказало негативного влияния на функциональные результаты. Морфологическое исследование выявило идентичные для обеих групп и характерные для контузионной травмы спинного мозга патоморфологические изменения: размягчение, некроз нервной ткани с образованием тканевого, клеточного детрита серого и белого вещества, формирование мелких кист на ранних сроках опыта; прогрессирование сирингомиелии с формированием крупных кист преимущественно в сером веществе и началом регенераторных процессов в белом веществе через 60 и 90 суток опыта. Заключение. Отсутствие негативного влияния противоспаечного гиалуроносодержащего рассасывающегося геля на функциональные результаты и морфологические характеристики спинного мозга открывает перспективу его дальнейшего использования в экспериментах по моделированию контузионной травмы спинного мозга в качестве носителя композиции веществ метаболического и нейропротекторного действия для трансдуральной доставки с возможным получением положительного эффекта.
Гель «антиадгезин», крыса, контузионная травма спинного мозга, функциональная оценка активности тазовых конечностей по шкале ввв, морфологические исследования
Короткий адрес: https://sciup.org/142231575
IDR: 142231575 | УДК: 616.832-001.5:616.711.18-007.274:615.454.1]-092.9 | DOI: 10.18019/1028-4427-2021-27-6-782-788
Текст научной статьи Результаты применения противоспаечного геля после моделирования контузионного повреждения спинного мозга у крыс
Нервная система имеет ограниченную способность к регенерации, что делает последствия нейротравмы, ишемии, кровоизлияния или нейродегенеративного заболевания разрушительными и, часто, необратимы- ми [1–3]. Современные технологии применения факторов роста и стволовых клеток для усиления эндогенных механизмов восстановления центральной нервной системы оказываются неэффективными [3, 4].
Последние достижения в области неврологии свидетельствуют о появлении многообещающей стратегии усиления терапевтического действия клеток и лекарственных препаратов при заболеваниях мозга посредством применения натуральных и синтетических биоматериалов. Перспективным направлением считается использование гидрогелей, образованных гидрофильными полимерами, содержащими до 90 % воды [1, 3, 5–7]. Полимерные материалы могут служить каркасом, обеспечивающим механическую поддержку и защиту, субстратом для адгезии, обмена веществ и кислорода, выполнять роль локальных транспортных систем для доставки лекарств и сигнальных молекул непосредственно к месту повреждения [3, 6, 8], а также обеспечивать контролируемое высвобождение веществ в зоне патологии.
В настоящее время широко обсуждается применение гидрогелей в регенерации спинного мозга [9–14], так как позвоночно-спинномозговые травмы являются особенно сложными вследствие особенностей анатомии, а эффективные методы лечения отсутствуют [11]. Однако чаще всего гидрогели используются в качестве физических барьеров для профилактики эпидурального фиброза после выполнения ляминэктомии [15].
Клинические исследования показали положительный эффект применения гиалуроносодержащего рассасывающегося противоспаечного гидрогеля «Антиадгезин»® после декомпрессивных операций при остеохондрозе поясничного отдела позвоночника, выражающийся в уменьшении вероятности развития рубцово-спаечного процесса в позвоночном канале на 35 %, снижении болевого синдрома и выраженности осложнений [16]. Сведения о влиянии данного геля на сохранность ткани спинного мозга и на анатомо-функциональную регенерацию после контузионных травм спинного мозга отсутствуют, что и стало предметом данного исследования.
Цель исследования – изучить влияние противо-спаечного гиалуроносодержащего рассасывающегося геля на течение травматической болезни спинного мозга в условиях моделирования контузионного повреждения спинного мозга у крыс.
Дизайн исследования . Уровень доказательности – 3b (Отдельные исследования типа случай-контроль) по UK Oxford, версия 2009.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперименты проведены на 40 самках крыс линии Вистар (возраст 9–12 месяцев, масса тела 270–320 г), случайным образом разделенных на 2 группы – опытную и контрольную.
Крысам опытной группы (n = 20) под общим обезболиванием (Рометар 2 % – 1–2 мг/кг, Биовета, Чехия; Золетил 100 – 10–15 мг/кг, «Virbac Sante Animale», Франция) выполняли ляминэктомию на уровне Th9. Позвоночник жестко фиксировали за остистые отростки Th8 и Th10 позвонков и осуществляли контузию спинного мозга средней степени тяжести [17–19] без повреждения твердой мозговой оболочки. После произведенной контузии происходило рефлекторное вытягивание тазовых конечностей, и визуализировалась субдуральная гематома, в редких случаях наблюдалось непроизвольное мочеиспускание. После надлежащего гомеостаза в операционной ране на твердую мозговую оболочку наносили 0,2 мл геля «Антиадгезин»®. Время экспозиции препарата в открытой ране составляло 2 минуты, что является достаточным для распределения геля по поверхности спинного мозга. Затем операционную рану ушивали послойно наглухо. Крысам контрольной группы (n = 20) выполняли моделирование аналогичной травмы без применения противоспаечного геля.
Для контроля уровня ляминэктомии после операции выполняли рентгенографию (Premium Vet, Sedecal, Испания) в латеральной проекции.
Все исследования одобрены этическим комитетом ФГБУ «РНЦ «ВТО» им. академика Г.А. Илизарова» (протокол № 2 (57) от 17.05.2018) и проведены при соблюдении принципов гуманного обращения с лабораторными животными в соответствии с требованиями Европейской Конвенции по защите позвоночных животных, используемых для экспериментов или в иных научных целях, и Директивой 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, используемых в научных целях. Содержание и уход за животными осуществляли в соответствии с ГОСТ 33216-2014.
Методы и критерии оценки . На протяжении всего эксперимента животных содержали в индивидуальных клетках, доступ к корму и воде не ограничивали. Послеоперационный уход состоял в дополнительном обогреве в течение 1–2 суток, купировании гематурии и профилактике инфекционных осложнений мочевыделительной системы [20–21].
С первых суток после операции крысам обеих групп проводили оценку локомоторной активности тазовых конечностей с использованием теста «Открытое поле»: в течение 30 дней – ежедневно, с 31 по 60 сутки – 2 раза в неделю, затем 1 раз в неделю до окончания эксперимента. Степень восстановления функций оценивали по стандартной Шкале оценки подвижности ВВВ [18] (0 баллов – отсутствие движения в тазовых конечностях, 21 балл – нормальная ходьба) с заполнением модифицированного оценочного листа и использованием ключа балльной дешифровки данных оценочного листа [22].
Животных выводили из эксперимента на 5, 15, 30, 60 и 90 сутки.
Для морфологического исследования спинной мозг забирали единым блоком с позвоночником на несколько сегментов выше и ниже его травмы и помещали в 10 % нейтральный формалин, через неделю осторожно освобождали от костных структур, резецировали фрагмент длиной 1,5 см, включающий зону контузии. Часть материала по стандартной схеме заливали в парафин, срезы окрашивали трихромным методом по Маcсону, тионином по Нисслю, гематоксилином и эозином. Остальной материал дополнительно фиксировали раствором оксида осмия (IV), заливали в Araldite, поперечные полутонкие срезы (1,0 мкм) изготавливали на уль-тратоме «LKB Bromma Ultrotome Nova» (Швеция), окрашивали метиленовым синим и основным фуксином. Для оцифровки и светооптического исследования препаратов использовали стереомикроскоп
«AxioScope A1» с цифровой камерой «AxioCam» (Carl Zeiss MicroImaging GmbH, Германия). В программе «ВидеоТесТ Мастер-Морфология 4.0» (Россия) определяли площадь поперечного сечения спинного мозга (medulla spinalis – Ams) и суммарную площадь кистозных полостей (сирингомиелии, As)
в поперечном сечении спинного мозга. В качестве нормы исследовали 10 интактных крыс.
Статистический анализ : для показателей рассчитывали среднее арифметическое значение и стандартное отклонение (M ± σ ); статистическую значимость различий определяли парным двухвыборочным t-тестом.
РЕЗУЛЬТАТЫ
Течение послеоперационного периода у животных опытной группы происходило без особенностей. У одной крысы на 8 сутки после операции в области операционного шва отмечено образование флюктуирующей припухлости. Выполнено вскрытие полости, её опорожнение и дренирование. Объем эвакуированного геморрагического содержимого вязкой консистенции составил 3 мл, отток по дренажу фиксировался в течение 3 суток и был купирован антибиотикотерапией.
Неврологический статус животных обеих групп на момент выхода из наркоза не имел достоверных различий (р = 0,33) и соответствовал 0 баллов (рис. 1). Первые признаки самопроизвольного восстановления двигательной активности тазовых конечностей у крыс контрольной группы регистрировались на 2–5 сутки после операции, у крыс опытной группы – на 2–7 сутки. Значительное восстановление функций тазовых конечностей у крыс обеих групп отмечалось в течение 4 недель после операции. После этого кривая восстановления контрольной группы, достигнув максимума к 5 неделе после операции (9,5 ± 0,28 балла), выходила на плато, а в опытной группе происходил дальнейший плавный регресс неврологического дефицита, достигая максимума показателей по шкале ВВВ к 11 неделе (11,8 ± 0,45 балла). При дальнейшем тестировании до конца эксперимента в обеих группах достигнутый уровень восстановления оставался устойчивым.
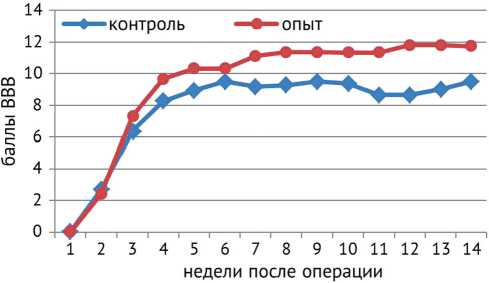
Рис. 1 Динамика восстановления локомоторной активности у крыс после моделирования контузионной травмы спинного мозга средней степени тяжести на уровне Th9
По итогам проведенного анализа отмечено отличие течения процесса восстановления двигательной активности у крыс этих групп. В опытной группе на ранних сроках наблюдения у большинства животных первые признаки восстановления функций появлялись несколько позднее, чем у крыс контрольной группы. На 1–2 неделях после операции статистически значимой разницы между уровнем восстановления функций у крыс опытной и контрольной не наблюдалось (р > 0,05).
На 3–4 неделях после операции степень функционального восстановления у крыс опытной группы была достоверно выше (р < 0,05), чем у крыс контрольной группы.
На 5 неделе значения показателей восстановления функций крыс опытной группы были выше аналогичных показателей крыс контрольной группы, однако достоверных отличий между группами выявлено не было (р = 0,15).
С 6 недели наблюдений выявлена статистически значимая разница (р < 0,05) между достигнутым уровнем восстановления функций тазовых конечностей у крыс сравниваемых групп, которая сохранялась до конца эксперимента.
Морфологическое исследование показало, что в контрольной и опытной группе через 5 суток эксперимента спинной мозг в поперечном сечении на уровне травмы деформирован, выглядит слегка сплюснутым, отечным. Твердая мозговая оболочка сохраняет целостность. В части задних спинномозговых артерий и вен выявляются разрывы сосудистых стенок. Нейроны единичны (рис. 2, а, г), плотность волокон белого вещества снижена, большинство аксонов отечные, часть окружена вакуолеподобными структурами, миелиновые оболочки истончены, слабо окрашены (рис. 2, б, в, д, е).
Через 15 суток в обеих группах на уровне контузии в спинном мозге обнаруживаются кисты, не имеющие четких границ, тканевой детрит, глиоз (рис. 2, а, д). Центральный канал сохраняется, наблюдается избыточное количество микрососудов, часто присутствуют картины диапедезных кровоизлияний. Просветы задних и передних спинномозговых артерий и вен расширены, у части животных заполнены эритроцитами. Деструктивные изменения охватывают как серое, так и белое вещество спинного мозга. В белом веществе обнаруживаются преимущественно продукты распада миелинизированных волокон и немногочисленные сохранившиеся волокна с признаками демиелинизации, аксональной и валлеровской дегенерации, лимфоциты, макрофаги, плазматические клетки и клетки гиперплазированной глии. В сером веществе немногочисленные нейроны демонстрируют картины гиперхроматоза либо хроматолиза, нейронофагии, встречаются – «тени».
Через 30 суток эксперимента морфологическая картина в обеих группах также схожа. В контрольной группе центральный канал не обнаруживается ни в одном образце спинного мозга, в опытной группе – сохраняется у части животных, имеет облитерированный просвет. Спинномозговые артерии и вены остаются расширенными и полнокровными, сосудистые стенки гипертрофированными. В тотальных поперечных и продольных парафиновых препаратах обнаруживаются более крупные и более четко визуализирующиеся, чем через 15 суток эксперимента, кистозоподобные полости (рис. 3, б, е). В отдельных полостях начинают формироваться стенки, отграничивающие их от окружающих тканей. Некробиотические изменения серого и белого вещества прогрессируют. Миелинизированные волокна и нейроны единичны.
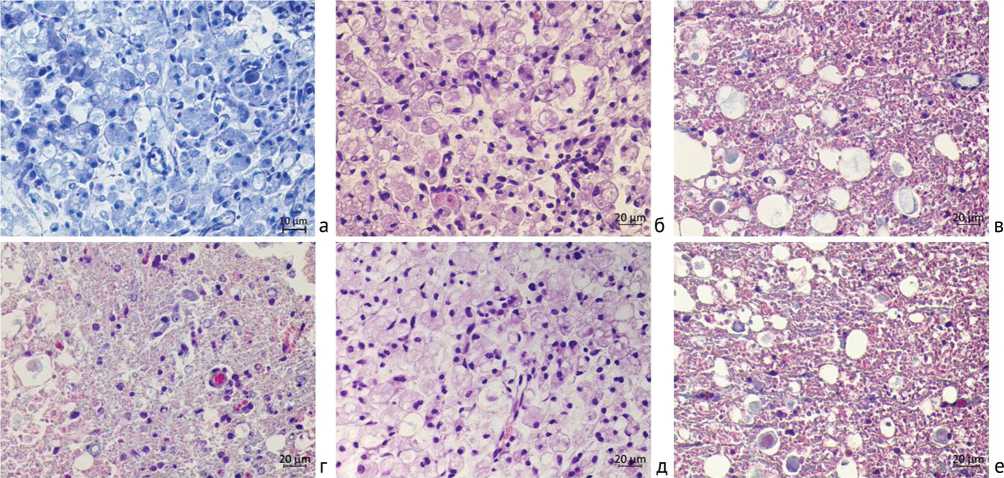
Рис. 2. Фрагменты поперечных парафиновых срезов спинного мозга крыс на уровне Th9. Серое вещество, задние рога: а – контрольная, г – опытная группа. Клиновидный пучок Бурдаха: б – контрольная, д – опытная группа. Боковые столбы: в – контрольная, е – опытная группа. Окраска по Нисслю (а), гематоксилином и эозином (б, д), по Масону (в, г, е), об. 40, ок. 10
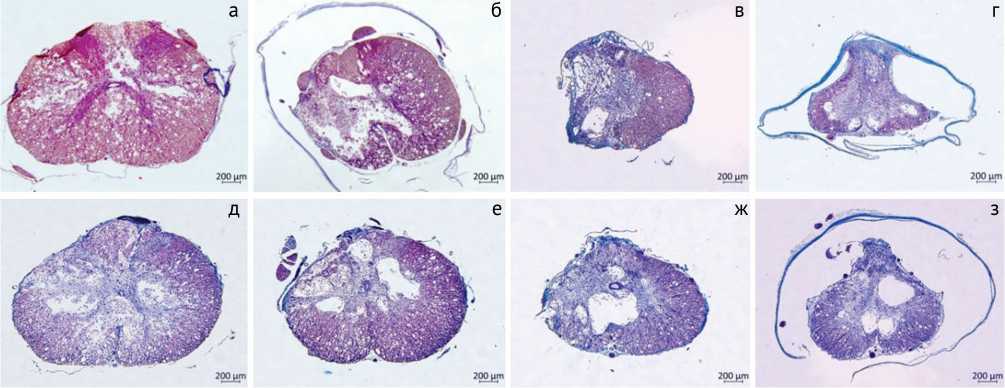
Рис. 3. Тотальные поперечные парафиновые срезы спинного мозга крыс на уровне Th9 контрольной группы через: а – 15, б – 30, в – 60, г – 90 суток эксперимента и опытной группы через: д – 15, е – 30, ж – 60, з – 90 суток эксперимента. Окраска по Масону, об. 4, ок. 10
Через 60 и 90 суток эксперимента в обеих группах наблюдается схожая морфологическая картина. Выявляются признаки выраженной сирингомиелии: видны четкие сформировавшиеся крупные одно-, двух- и многокамерные кистозоподобные полости (рис. 4, в, г, ж, з), стенки которых четкие, образованы эпендимоподобными клетками. Кисты локализуются преимущественно в сером веществе. В контрольной группе центральный канал не прослеживается, в опытной группе через 60 суток у части животных он сохраняется, через 90 суток у большинства не обнаруживается. Сохраняется артерио-венозный застой – просветы спинномозговых артерий и вен в образцах обеих групп расширены и у большинства полнокровны, стенки гипертрофированы. В белом веществе на фоне продолжающихся деструктивных процессов обнаруживаются регенерирующие мие- линизирующиеся аксоны (рис. 4, а, б, г, д). В сером веществе на уровне контузии нейроциты единичны либо не обнаруживаются (рис. 4, в, е).
Количественные исследования показали, что вследствие контузионной травмы в обеих группах происходит постепенное уменьшение площади поперечного сечения спинного мозга, которое через 30 суток становится более выраженным (p < 0,05) в контрольной группе (табл. 1). Через 90 суток разница по площадям усиливается между группами практически на треть (табл. 1).
Суммарная площадь кистозных полостей через 90 суток не отличается между группами, но, учитывая возникшую разницу в площадях поперечного сечения спинного мозга, сирингомиелия более выражена в контрольной группе и занимает 16 % площади, в опытной – 14 % (табл. 2).
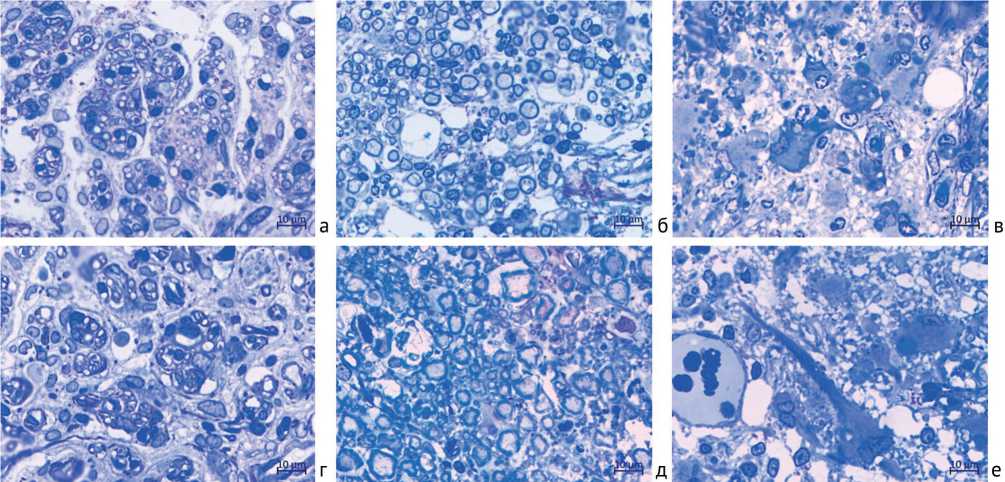
Рис. 4. Фрагменты тотальных полутонких срезов спинного мозга крыс на уровне Th9. Клиновидный пучок Бурдаха: а – контрольная, г – опытная группа. Белое вещество, боковые столбы: б – контрольная, д – опытная группа. Серое вещество, передние рога: в – контрольная, е – опытная группа. Окраска метиленовым синим и основным фуксином, об. 100, ок. 10
Таблица 1
Площадь поперечного сечения спинного мозга (medulla spinalis) – Ams
|
Срок опыта (сутки) |
Ams (103 мкм2) (М ± σ ) |
||||
|
Контрольная группа (k) |
Опытная группа (о) |
ΔAmskn/ΔAmsn |
ΔA mson /ΔA ms n |
ΔAmsko/Amso |
|
|
15 |
2891 ± 37 |
2895 ± 17 |
-22,18 * |
-22,07 * |
-0,14 % |
|
30 |
2005 ± 16 |
2281 ± 24 |
-46,03 * |
-38,60 * |
-12,10 % * |
|
60 |
1284 ± 79 |
1645 ± 17 |
-65,44 * |
-55,72 * |
-21,95 % * |
|
90 |
1145 ± 35 |
1616 ± 215 |
-69,18 * |
-56,50 * |
-29,15 % * |
ΔAmskn/ΔAmsn – разница (в %) между площадью поперечного сечения спинного мозга крыс контрольной и интактной группы (норма – n, Ams составила 3715 ± 76 мкм2); ΔAmson/ ΔAmsn – разница между площадью спинного мозга крыс опытной и интактной группы, ΔAmsko/Amso – разница между площадью спинного мозга контрольной и опытной групп; * – разница достоверна по результатам парного двухвыборочного t-теста при p < 0,05
Таблица 2
Суммарная площадь кистозных полостей (сирингомиелии, As) в поперечном сечении спинного мозга (Ams)
|
Срок опыта (сутки) |
As (103 мкм2) (М ± σ ) |
|||
|
Контрольная группа (k) |
Ask /Amsk (%) |
Опытная группа (о) |
Asо /Amsо (%) |
|
|
60 |
253 ± 86 |
19,39 |
315 ± 25 |
19,99 |
|
90 |
199 ± 87 |
16,27 |
200 ± 91 |
14,09 |
Ask /Amsk – доля площади сирингомиелии в поперечном сечении спинного мозга крыс контрольной группы, Asо /Amsо – опытной группы (в %)
ОБСУЖДЕНИЕ
Результаты тестирования, полученные в ходе восстановления локомоторных функций тазовых конечностей у крыс контрольной группы, были идентичны данным, наблюдаемым разработчиками Шкалы оценки подвижности ВВВ в группах животных со средней степенью тяжести поражения спинного мозга [18]. У животных опытной группы аналогичные показатели имели достоверные отличия.
Сравнительный анализ уровня восстановления двигательной активности крыс обеих групп показал более высокую оценку поведенческих характеристик у животных опытной группы, у которых применяли гель «Антиадгезин»®.
Морфологическое исследование выявило характерные для контузионной травмы патоморфологическое изменения спинного мозга [23, 24], идентичные для обеих групп. Через 5–15 суток после травмы в пара-контузионной области вследствие механической травмы и микроциркуляторных расстройств наблюдались размягчение и некроз нервной ткани с образованием тканевого и клеточного детрита серого и белого вещества, формирование мелких кист. Через 30 суток картина усугублялась развитием сирингомиелии с формированием крупных кистозоподобных полостей, прогрессированием процессов деструкции серого и белого вещества на фоне нарушения микроциркуля-торных процессов, а в контрольной группе – ликворо-обмена вследствие деструкции центрального канала. Через 60 и 90 суток гемодинамические расстройства сохранялись, нарушение ликворообмена в контрольной группе сохранялось, а также наблюдалось у отдельных животных опытной группы, сирингомиелия усиливалась, нейроциты были единичны, а в белом веществе начинались регенераторные процессы – обнаруживались мелкие регенерирующие, миелинизирующиеся аксоны.
Отсутствие воспалительных реакций спинного мозга в зоне контакта с противоспаечным гиалуроносо-держащим рассасывающимся гелем «Антиадгезин»®, более высокая степень восстановления локомоторной активности у крыс опытной группы вследствие менее выраженных сирингомиелии и уменьшения поперечного сечения нервных стволов на уровне травмы, ука- зывают на возможность применения данного препарата при контузионных повреждениях спинного мозга с вероятностью улучшения регресса неврологического дефицита.
Полученные результаты открывают перспективу дальнейших экспериментов по тестированию возможности локальной доставки гелем «Антиадгезин» ® лекарственных препаратов и клеток в ткани спинного мозга после контузионной травмы с целью оптимизации использования данного геля с получением возможного положительного эффекта.
ЗАКЛЮЧЕНИЕ
Таким образом, применение противоспаечного ги-алуроносодержащего рассасывающегося геля после моделирования контузионной травмы спинного мозга средней степени тяжести у крыс не вызывает существенных изменений течения послеоперационного периода и местных инфекционно-воспалительных ос- ложнений, не оказывает негативного влияния на функциональные результаты и морфологические характеристики спинного мозга, что указывает на возможность его использования в качестве носителя композиции веществ метаболического и нейропротекторного действия для трансдуральной доставки.
Список литературы Результаты применения противоспаечного геля после моделирования контузионного повреждения спинного мозга у крыс
- Hydrogels for neuroprotection and functional rewiring: a new era for brain engineering / R. Fernandez-Serra, R. Gallego, P. Lozano, D. González-Nieto // Neural Regen. Res. 2020. Vol. 15, No 5. P. 783-789. DOI: 10.4103/1673-5374.268891.
- Struzyna L.A., Katiyar K., Cullen D.K. Living scaffolds for neuroregeneration // Curr. Opin. Solid State Mater. Sci. 2014. Vol. 18, No 6. P. 308-318. DOI: 10.1016/j.cossms.2014.07.004.
- Hydrogel-assisted neuroregeneration approaches towards brain injury therapy: A state-of-the-art review / V.A. Kornev, E.A. Grebenik, A.B. Solovieva, R.I. Dmitriev, P.S. Timashev // Comput. Struct. Biotechnol. J. 2018. Vol. 16. P. 488-502. DOI: 10.1016/j.csbj.2018.10.011.
- Human hippocampal neurogenesis drops sharply in children to undetectable levels in adults / S.F. Sorrells, M.F. Paredes, A. Cebrian-Silla, K. Sandoval, D. Qi, K.W. Kelley, D. James, S. Mayer, J. Chang, K.I. Auguste, E.F. Chang, A.J. Gutierrez, A.R. Kriegstein, G.W. Mathern, M.C. Oldham, E.J. Huang, J.M. Garcia-Verdugo, Z. Yang, A. Alvarez-Buylla // Nature. 2018. Vol. 555, No 7696. P. 377-381. DOI: 10.1038/nature25975.
- The Application of Hydrogels Based on Natural Polymers for Tissue Engineering / Y.D. Taghipour, V.R. Hokmabad, A.R. Del Bakhshayesh, N. Asadi, R. Salehi, H.T. Nasrabadi // Curr. Med. Chem. 2020. Vol. 27, No 16. P. 2658-2680. DOI: 10.2174/0929867326666190711103956.
- 3D neural tissue models: From spheroids to bioprinting / P. Zhuang, A.X. Sun, J. An, C.K. Chua, S.Y. Chew // Biomaterials. 2018. Vol. 154. P. 113133. DOI: 10.1016/j.biomaterials.2017.10.002.
- Overview of natural hydrogels for regenerative medicine applications / M.C. Catoira, L. Fusaro, D. Di Francesco, M. Ramella, F. Boccafoschi // J. Mater. Sci. Mater. Med. 2019. Vol. 30, No 10. P. 115. DOI: 10.1007/s10856-019-6318-7.
- Carballo-Molina O.A., Velasco I. Hydrogels as scaffolds and delivery systems to enhance axonal regeneration after injuries // Front. Cell. Neurosci. 2015. Vol. 9. P. 13. DOI: 10.3389/fncel.2015.00013.
- Kubinová S. Biomaterials and Magnetic Stem Cell Delivery in the Treatment of Spinal Cord Injury // Neurochem. Res. 2020. Vol. 45, No 1. P. 171179. DOI: 10.1007/s11064-019-02808-2.
- Photosensitive Hydrogel Creates Favorable Biologic Niches to Promote Spinal Cord Injury Repair / Z. Cai, Y. Gan, C. Bao, W. Wu, X. Wang, Z. Zhang, Q. Zhou, Q. Lin, Y. Yang, L. Zhu // Adv. Healthc. Mater. 2019. Vol. 8, No 13. e1900013. DOI: 10.1002/adhm.201900013.
- Alginate Hydrogels as Scaffolds and Delivery Systems to Repair the Damaged Spinal Cord / S. Grijalvo, M. Nieto-Díaz, R.M. Maza, R. Eritja, D.D. Díaz // Biotechnol. J. 2019. Vol. 14, No 12. e1900275. DOI: 10.1002/biot.201900275.
- Soft Conducting Polymer Hydrogels Cross-Linked and Doped by Tannic Acid for Spinal Cord Injury Repair / L. Zhou, L. Fan, X. Yi, Z. Zhou, C. Liu, R. Fu, C. Dai, Z. Wang, X. Chen, P. Yu, D. Chen, G. Tan, Q. Wang, C. Ning // ACS Nano. 2018. Vol. 12, No 11. P. 10957-10967. DOI: 10.1021/acsnano.8b04609.
- Liu S., Blesch A. Targeted tissue engineering: hydrogels with linear capillary channels for axonal regeneration after spinal cord injury // Neural Regen. Res. 2018. Vol. 13, No 4. P. 641-642. DOI: 10.4103/1673-5374.230286.
- Kumar P. Future biomaterials for enhanced cell-substrate communication in spinal cord injury intervention // Future Sci. OA. 2017. Vol. 4, No 2. FSO268. DOI: 10.4155/fsoa-2017-0130.
- Животенко А.П., Кошкарева З.В., Сороковиков В.А. Профилактика послеоперационного рубцово-спаечного эпидурита: современное состояние вопроса // Хирургия позвоночника. 2019. Т. 16, № 3. С. 74-81. DOI: http://dx.doi.org/10.14531/ss2019.3.74-81.
- Противоспаечный гель «Антиадгезин» при дегенеративных заболеваниях поясничного отдела позвоночника / В.В. Швец, С.В. Колесов, И.Н. Карпов, А.А. Пантелеев, И.В. Скорина, Д.С. Горбатюк // Хирургия позвоночника. 2018. Т. 15, № 2. С. 39-50. DOI: http://dx.doi. org/10.14531/ss2018.2.39-50.
- Кубрак Н.В., Краснов В.В. Осложнения после моделирования контузионной травмы спинного мозга у крыс // Успехи современного естествознания. 2015. № 9-3. С. 439-441.
- Basso D.M., Beattie M.S., Bresnahan J.C. A sensitive and reliable locomotor rating scale for open field testing in rats // J. Neurotrauma. 1995. Vol. 12, No 1. P. 1-21. DOI: 10.1089/neu.1995.12.1.
- Experimental modeling of spinal cord injury: characterization of a force-defined injury device / S.W. Scheff, A.G. Rabchevsky, I. Fugaccia, J.A. Main, J.E. Lumpp Jr. // J. Neurotrauma. 2003. Vol. 20, No 2. P. 179-193. DOI: 10.1089/08977150360547099.
- Inman D.M., Steward O. Ascending sensory, but not other long-tract axons, regenerate into the connective tissue matrix that forms at the site of a spinal cord injury in mice // J. Comp. Neurol. 2003. Vol. 462, No 4. P. 431-449. DOI: 10.1002/cne.10768.
- Spinal cord injury experimental model and motion evaluation protocol in Wistar rats / G.B. dos Santos, A.F. Cristante, R. Marcon, F.I. de Souza, T.E.P. de Barros Filho, M.L. Damasceno // Acta Ortop. Bras. 2011. Vol. 19, No 2. P. 87-91. DOI: 10.1590/S1413-78522011000200005.
- Набор страниц бланка для анализа выраженности неврологического дефицита у животных после травмы спинного мозга : пат. 112738 Рос. Федерация ; МКПО 19-08 / Кубрак Н.В., Краснов В.В.; заявитель и патентообладатель ФГБУ «РНЦ «ВТО» им. акад. Г.А. Илизарова» Минздрава России. № 2018500165 ; заявл. 16.01.2018 ; опубл. 25.12.2018, Бюл. № 1.
- Динамика морфологических изменений спинного мозга крысы после контузионной травмы различной степени тяжести / Г.А. Масгутова, Ю.А. Челышев, А.В. Жарков, С.В. Лебедев, В.П. Чехонин // Морфологические ведомости. 2008. № 1-2. С. 80-83.
- А consistent, quantifiable, and graded rat lumbosacral spinal cord injury model / J. Wen, D. Sun, J. Tan, W. Young // J. Neurotrauma. 2015. Vol. 32, No 12. P. 875-892. DOI: 10.1089/neu.2013.3321.


