Результаты применения различных методов хирургического лечения у пациентов с закрытыми тракционными повреждениями плечевого сплетения
Автор: Бажанов С.П., Шувалов С.Д., Коршунова Г.А., Айтемиров Ш.М., Островский В.В.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4 т.29, 2023 года.
Бесплатный доступ
Введение. Изучение проблемы травматического повреждения плечевого сплетения и сравнение результатов различных методов хирургического лечения пациентов с указанной патологией является актуальным вопросом нейрохирургии, неврологии, травматологии, ортопедии и реабилитологии в связи с высокой социально-экономической значимостью, широкой распространенностью и неудовлетворительными ближайшими и отдаленными результатами лечения подобной категории пациентов.Цель. Сравнить результаты применения различных методов хирургического лечения пациентов с закрытыми повреждениями плечевого сплетения.Материалы и методы. Объектом исследования явились 96 пациентов с закрытыми повреждениями плечевого сплетения, которых разделили на три группы. Критерием разделения на группы явился способ хирургического лечения: пациентам I группы (n = 33) осуществляли микрохирургический невролиз стволов плечевого сплетения; пациентам II группы (n = 28) выполняли микрохирургический невролиз стволов плечевого сплетения и установку стимулирующих многоканальных электродов на стволы плечевого сплетения; пациентам III группы (n = 35) выполняли микрохирургический невролиз, а также установку стимулирующих многоканальных электродов на стволы плечевого сплетения и сегментарный аппарат спинного мозга на уровне шейного утолщения. Оценку клинико-функционального статуса верхней конечности проводили через 6 месяцев с использованием клинико- неврологического тестирования, шкальных методик, а также электрофизиологического мониторинга.Результаты. В представленном исследовании сравнительный анализ результатов применения различных методов хирургического лечения пациентов с закрытыми повреждениями плечевого сплетения продемонстрировал значительное улучшение результатов хирургического лечения в III группе пациентов, что проявилось более быстрым темпом регресса болевого синдрома в заинтересованной верхней конечности, а также достоверно положительной динамикой клинико-неврологических и электрофизиологических показателей.Обсуждение. Более выраженное снижение комплексного регионарного болевого синдрома и восстановление функции пораженной конечности было отмечено у пациентов III группы, что говорит в пользу выбора метода микрохирургического невролиза в сочетании с двухуровневой электростимуляцией при закрытых повреждениях плечевого сплетения.Заключение. При сравнении различных методов хирургического лечения пациентов с закрытыми повреждениями плечевого сплетения показана достоверная эффективность методики микрохирургического невролиза в сочетании с электростимуляцией ствола поврежденного нерва и сегментарного аппарата спинного мозга (III группа), которая позволяет улучшить результаты лечения подобных пациентов.
Плечевое сплетение, закрытые повреждения, хирургическое лечение, электростимуляция
Короткий адрес: https://sciup.org/142239011
IDR: 142239011 | УДК: 616.833.34-089.8-035 | DOI: 10.18019/1028-4427-2023-29-4-351-356
Текст научной статьи Результаты применения различных методов хирургического лечения у пациентов с закрытыми тракционными повреждениями плечевого сплетения
В структуре всех травм нервной системы от 1 до 6 % составляют повреждения её периферической части, из числа которых на долю травм плечевого сплете- ния (ПС) и его ветвей приходится от 60 до 81 % [1-3]. Данная проблема имеет высокое медицинское и социальное значение, поскольку необратимая утрата трудо-
способности вследствие травматических нейропатий ПС достигает 26-70 % случаев, при этом стойкий неврологический дефицит в заинтересованной конечности наблюдается у 84 % пострадавших, а в 24 % у пациентов отмечается комплексный регионарный болевой синдром (КРБС) [4-7].
Особую когорту составляют пациенты с травмой стволов ПС по типу аксонотмезиса [8], при котором сохранена анатомическая целостность ствола нерва, однако страдает его функция. В таких случаях применение только микрохирургического невролиза (МН) как основного метода лечения в сочетании с полноценным комплексом лечебных мероприятий может оказаться недостаточным и не привести к восстановлению полезной функции верхней конечности [9-12].
Анализ литературных данных показал, что использование методик электростимуляции (ЭС) спинного мозга (СМ) и стволов ПС широко встречается в кли- нической практике и приводит к улучшению результатов комплексного лечения пациентов с повреждениями периферических нервных структур и болевым синдромом различной этиологии [13-17]. Однако остаются до конца нерешенными вопросы, касающиеся как определения четких показаний к применению различных методик ЭС, сроков выполнения хирургического вмешательства, выбора оптимальных параметров импульсного тока, длительности проведения процедур, так и разработки новых хирургических методик и их сочетаний. Это диктует необходимость поиска новых способов комплексного лечения, способствующих улучшению исходов у пациентов с закрытыми повреждениями ПС, что определяет актуальность настоящего исследования [18-21].
Цель – сравнить результаты применения различных методов хирургического лечения пациентов с закрытыми повреждениями плечевого сплетения (ЗППС).
МАТЕРИАЛЫ И МЕТОДЫ
Исследование является моноцентровым, продольным, открытым, проспективным с исторической группой, проведено с соблюдением Женевской конвенции и одобрено локальным этическим комитетом ФГБОУ ВО Саратовский ГМУ им. В.И. Разумовского Минздрава России (протокол № 4 от 01.11.2022 г.). Критериями включения пациентов в исследование явились трудоспособный возраст, изолированный характер травмы ПС, постганглионарный уровень его поражения, степень повреждения нервных стволов, соответствующая II, III, IV по классификации Sunderland [8], КРБС в заинтересованной конечности, предшествующее неэффективное консервативное лечение в сроке не менее 3 месяцев с момента получения травмы, подписанное добровольное информированное согласие пациента на участие в исследовании.
Для каждого пациента заводили индивидуальный регистрационный документ – карту кодирования, сведения из которых составили электронную базу данных [26].
Статистический анализ полученных результатов осуществляли с применением программ Statistica 13.0, Microsoft Office Excel 2019. Обработку данных выполняли с использованием непараметрических методов статистики, также вычисляли медиану и межквартильный интервал. Для оценки значимости различия динамики исследуемого параметра внутри групп использовали критерий Вилкоксона. Для доказательства различий эффекта от вида операции при сравнении трех независимых групп применяли критерий Кра-скелла-Уоллиса, критерий сравнения средних рангов, вычисляли статистическую значимость (p) с учетом множественных сравнений. Различия между группами считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
В дооперационном периоде у большинства пациентов всех групп (I-III) отмечали нейропатический болевой синдром высокой степени интенсивности (по шкале ВАШ медиана его интенсивности составила 8,0 (7,0; 8,0)), при этом статистически значимого различия между исследуемыми группами отмечено не было (p = 0,849).
При анализе показателей чувствительности и мышечной силы в дооперационном периоде у большин- ства пациентов был отмечен парез мышц в заинтересованной конечности и снижение чувствительности, показатели которых представлены в таблице 1.
Таблица 1
Показатели чувствительности и мышечной силы до операции
|
Группы |
Мышечная сила |
Чувствительность |
|
I |
2,0 (1; 2) |
1,0 (1; 2) |
|
II |
1,0 (0; 2) |
1,0 (0; 2) |
|
III |
1,0 (1; 2) |
1,0 (1; 2) |
Примечание: Me – медиана (25 и 75 процентиль)
Оценка однородности трех исследуемых групп не выявила их различий как по показателям чувствительности (p = 0,372), так и по мышечной силе (p = 0,353).
При оценке функциональной недостаточности по шкале DASH был отмечен высокий и умеренный дефицит, более вероятно за счет выраженности КРБС, Me (Q1; Q3) которого в I группе составила 76,0 (66,0; 82,0) баллов, во II группе –78,0 (69,0; 84,0) баллов, в III группе – 74,0 (64,0; 83,0). Различий между группами до операции по показателям DASH выявлено не было (p = 0,596).
По данным ЭНМГ в дооперационном периоде у всех пациентов с ЗППС было зарегистрировано повреждение длинных или коротких стволов ПС, наряду с этим наиболее выраженные изменения были отмечены у срединного и лучевого нервов, величины которых приведены в таблице 2.
Во всех случаях (n = 96) показатели ЭНМГ характеризовались снижением амплитуд с увеличением латентности М-ответа (табл. 2).
Таблица 2
Показатели ЭНМГ верхней конечности у пациентов с закрытым повреждением плечевого сплетения в дооперационном периоде
|
Нерв |
Показатели ЭНМГ |
Группа 1 |
Группа 2 |
Группа 3 |
|
Me (Q1; Q3) |
Me (Q1; Q3) |
Me (Q1; Q3) |
||
|
Подкрыльцовый |
М-ответ (мА) |
0,9 (0,8; 1,0) |
1,0 (0,7; 1,3) |
1,0 (0,9; 1,2) |
|
Латентный период (ЛП) (мс) |
3,8 (3,5; 4,4) |
4,3 (3,5; 4,7) |
3,7 (3,2; 4,5) |
|
|
Кожномышечный |
М-ответ (мА) |
0,7 (0,4; 1,1) |
0,6 (0,3; 1,2) |
0,9 (0,3; 1,4) |
|
ЛП (мс) |
2,7 (2,0; 3,3) |
3,0 (2,4; 3,5) |
2,7 (1,9; 3,0) |
|
|
Локтевой |
М-ответ (мА) |
1,2 (0,8; 1,5) |
0,9 (0,4; 1,4) |
4,2 (2,0; 7,1) |
|
ЛП (мс) |
4,2 (3,8; 5,0) |
4,1 (3,6; 4,6) |
3,2 (2,0; 5,1) |
|
|
Срединный |
М-ответ (мА) |
1,0 (0,7; 1,4) |
1,1 (0,6; 1,5) |
4,4 (1,9; 6,2) |
|
ЛП (мс) |
8,2 (7,1; 9,0) |
7,5 (6,5; 8,3) |
5,4 (3,5; 6,2) |
|
|
Лучевой |
М-ответ (мА) |
1,0 (0,6; 1,3) |
1,1 (0,7; 1,5) |
4,8 (2,7; 6,4) |
|
ЛП (мс) |
6,6 (5,5; 7,8) |
6,5 (5,9; 7,2) |
6,0 (4,3; 6,7) |
Примечание: Me – медиана (25 и 75 процентиль), р > 0,05.
Таким образом, у пациентов всех исследуемых групп (I-III) отмечали синдром нарушения проводимости нервов верхней конечности, причем превалировали тяжелые аксональные повреждения как в длинных, так и в коротких стволах ПС.
В послеоперационном периоде у всех пациентов (n = 96) было отмечено снижение степени интенсивности КРБС, при этом полного его регресса не было отме- чено ни в одном случае. Наряду с этим, при сравнении темпов регресса болевого синдрома более выраженное его снижение было зарегистрировано в III группе (р < 0,05) (рис. 1).
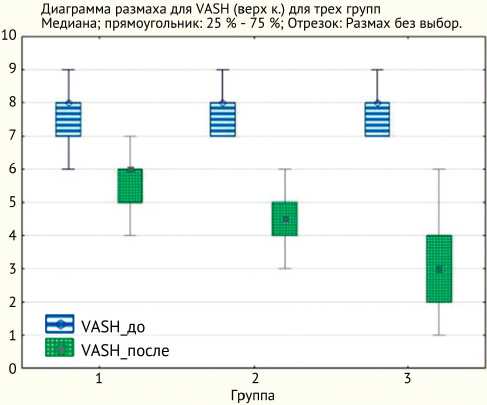
Рис. 1. Динамика болевого синдрома в I, II, III группах у пациентов с закрытым повреждением плечевого сплетения
Динамика показателей чувствительности и мышечной силы во всех исследуемых группах была выражена слабо, и статистически значимых различий вышеуказанных показателей в период наблюдения до 6 месяцев выявлено не было (p > 0,05).
При оценке функциональной недостаточности верхней конечности по шкале DASH в послеоперационном периоде у всех пациентов (n = 96) отмечали положительную динамику в виде улучшения функции, при этом в I и II группах пациентов она была менее выражена по сравнению с пациентами III группы, что связано с наиболее быстрым темпом снижения КРБС (рис. 2)
При исследовании длинных стволов ПС во всех случаях восстановление электрофизиологических показателей коррелировало с клиническими данными, при этом наиболее выраженную динамику отмечали при исследовании срединного нерва, которая заключалась в увеличении амплитуды М-ответа и снижении латентного периода как в дистальной, так и в проксимальной точках стимуляции. Медианные показатели амплитуд М-ответа в дистальной точке стимуляции соответствовали: в I группе – 2,2 (2,0; 2,6), во II группе – 3,8 (3,3; 3,9), в III группе – 3,9 (3,3; 4,4). В проксимальной точке стимуляции: в I группе – 2,4 (2,1; 2,8), во II группе – 3,7 (3,3; 4,1), в III группе – 3,9 (3,6; 4,3) (p < 0,01) (рис. 3). При этом также отмечали улучшение показателей ЛП срединного нерва как в дистальной точке стимуляции: в I группе – 5,3 (4,6; 6,2), во II группе – 5,1 (4,3; 5,9), в III группе – 5,4 (4,6; 6,0), так и в проксимальной: в I группе – 9,9 (9,1; 10,8), во II группе – 9,7 (9,4; 10,6), в III группе – 9,3 (8,8; 9,7) (p < 0,01).
Показатели амплитуды М-ответа (mV) для локтевого нерва в послеоперационном периоде составили в I группе – 2,0 (1,8; 2,2), во II группе – 3,0 (1,9; 3,5), в III группе – 3,8 (3,2; 4,2) (p < 0,01); для лучевого нерва в I группе – 2,2 (2,0; 2,6), во II группе – 3,8 (3,3; 3,9), в III группе – 4,4 (3,6; 4,8) (p < 0,01) (рис. 4 и 5).
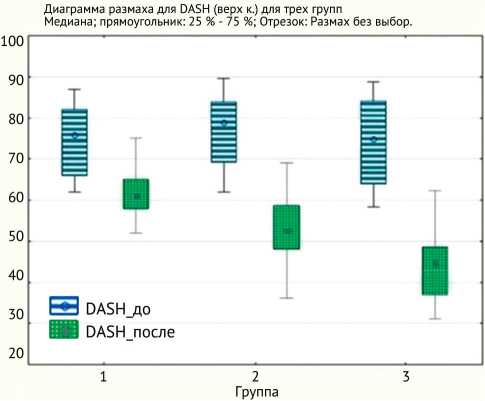
Рис. 2. Динамика функциональной недостаточности по шкале DASH
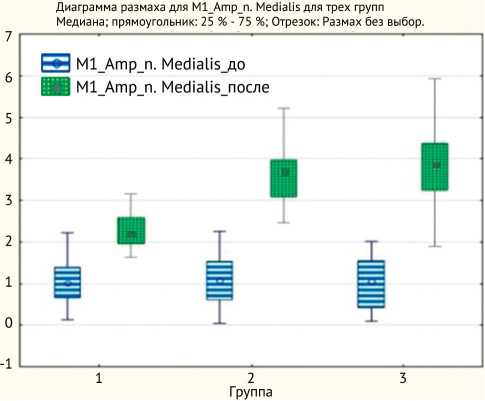
Рис. 3. Динамика показателей М-ответа срединного нерва
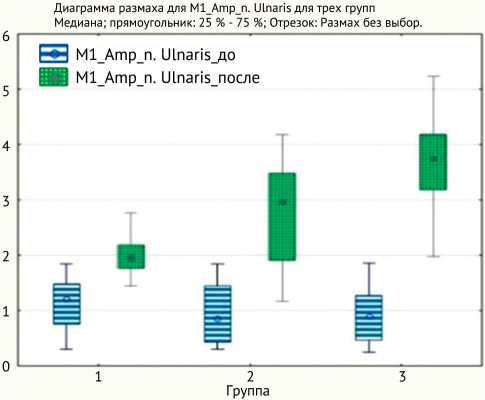
Рис. 4. Динамика показателей М-ответа локтевого нерва
Диаграмма размаха для Ml_Amp_n. Radialis для трех групп Медиана; прямоугольник: 25 % - 75 %; Отрезок: Размах без выбор.
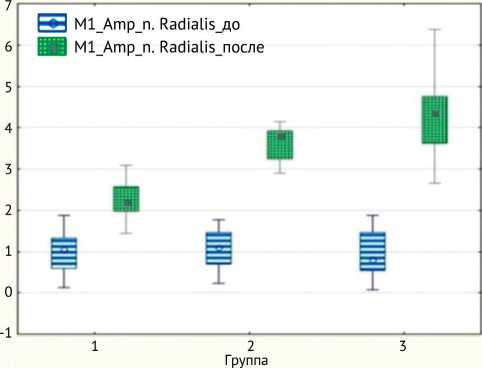
Рис. 5. Динамика показателей М-ответа лучевого нерва
Таким образом, во всех группах отмечали восстановление проводимости длинных стволов ПС, однако более выраженным оно было в III группе (n = 35), что свидетельствовало о достоверной эффективности (p < 0,05) методики МН в сочетании с двухуровневой ЭС по сравнению с выполнением только МН (I группа) либо МН в сочетании с одноуровневой ЭС (II группа).
При исследовании коротких стволов ПС положительная динамика показателей ЭНМГ также была более значимой в III группе по сравнению с I и II группами. В послеоперационном периоде количественные показатели амплитуд М-ответа кожно-мышечного нерва соответствовали в I группе – 1,5 (1,2; 2,1), во II группе – 3,1 (2,0; 3,3), в III группе – 3,4 (2,8; 3,9). Показатели латентного периода в I группе составили 2,4 (2,0; 3,1), во II группе – 2,3 (2,1; 3,2), в III группе – 2,0 (1,4; 2,5) (p < 0,01).
Количественные показатели амплитуд М-ответа подкрыльцового нерва составили в I группе 1,3 (1,2; 2,1), во II группе – 2,6 (1,7; 3,0), III группе – 3,4 (3,0; 4,0). Показатели ЛП в I группе составили 3,3 (3,0; 3,9), во II группе – 3,3 (2,8; 4,0), в III группе – 2,7 (2,2; 3,2). При сравнении данных ЭНМГ подкрыльцового нерва у пациентов всех исследуемых групп, с учетом критерия Краскела – Уоллиса, более значимая положительная динамика была отмечена у пациентов III группы (n = 35).
Таким образом, по данным ЭНМГ длинных и коротких стволов ПС было выявлено, что при ЗППС более эффективной методикой является МН в сочетании с двухуровневой ЭС (III группа).
При сравнении результатов лечения в зависимости от пола статистически значимых различий не выявлено (p = 0,061).
ОБСУЖДЕНИЕ
В настоящем исследовании эффективность методики МН в сочетании с двухуровневой ЭС проявилась значительным снижением КРБС в пораженной конечности, что было связано с одновременным воз- действием на центральные механизмы регуляции боли (установка электродов в эпидуральное пространство СМ на уровне шейного утолщения) и на стволы ПС. Это было подтверждено динамическими клинически- ми и электрофизиологическими данными у всех пациентов III группы (n = 35), где отмечали увеличение амплитуды и снижение латентности М-ответа, которое статистически значимо отличалось от пациентов I и II групп. Наиболее вероятно это было связано с активизацией образования нейротрофических факторов за счет взаимоусиливающего воздействия как на сегментарный аппарат СМ, так и на стволы периферических нервов [27-30].
Полученные результаты коррелируют с литературными данными. Так, в своем исследовании И.А. Ме- щерягина и А.А. Скрипников [31], которые применяли схожие технологии хирургического лечения пациентов с закрытыми повреждениями нервов, отмечали полный регресс болевого синдрома у 92 из 94 пациентов. А.Т. Худяев и соавт. [32] при применении микрохирургического невролиза и курсов эпиневральной электростимуляции более чем в 76,53 % указали на снижение чувствительных расстройств, восстановление двигательной функции пораженной конечности, регресс болевого синдрома и возвращение пациентов к своей профессиональной деятельности.
ЗАКЛЮЧЕНИЕ
Сравнительный анализ применения различных методов хирургического лечения пациентов с ЗППС продемонстрировал достоверную эффективность методики МН в сочетании с ЭС стволов ПС и сегментарного аппарата СМ на уровне шейного утол- щения, что позволило улучшить результаты лечения и проявилось более быстрым темпом снижения болевого синдрома в заинтересованной верхней конечности и улучшением электрофизиологических показателей.
Список литературы Результаты применения различных методов хирургического лечения у пациентов с закрытыми тракционными повреждениями плечевого сплетения
- Яриков А.В., Туткин А.В., Леонов В.А. и др. Травматическое повреждение плечевого сплетения. Сибирский медицинский журнал. 2019;159(4):14-18. doi: 10.34673/ismu.2019.43.31.003
- Зоркова А.В., Григорьева В.Н., Гликин С.Е. Хирургическое лечение закрытых внутриствольных травматических повреждений периферических нервов. Медицинский альманах. 2018;5(56):134-137. doi: 10.21145/2499-9954-2018-5-134-137
- Gutkowska O, Martynkiewicz J, Urban M, Gosk J. Brachial plexus injury after shoulder dislocation: a literature review. Neurosurg Rev. 2020;43(2): 407-423. doi: 10.1007/s10143-018-1001-x
- Булатов А.Р. Клинико-инструментальные характеристики и метаболическая терапия травматических невропатий конечностей: дис... канд. мед. наук. СПб, 2019.
- Литвиненко И.В., Одинак М.М., Живолупов С.А. и др. Клинико-инструментальные характеристики травматических поражений периферических нервов конечностей. Вестник Российской Военно-медицинской академии. 2018;20(3):50-56. doi: 10.17816/brmma12231
- Берснев В.П., Кокин Г.С., Извекова Т.С. Практическое руководство по хирургии нервов. СПб: Умный Доктор, 2017. 568 с.
- Noland SS, Bishop AT, Spinner RJ, Shin AY. Adult traumatic brachial plexus injuries. J Am Acad Orthop Surg. 2019;27(19):705-716. doi: 10.5435/ JAAOS-D-18-00433
- Sunderland S. A classification of peripheral nerve injuries producing loss of function. Brain. 1951;74(4):491-516. doi: 10.1093/brain/74.4.491
- Халимов А.Р., Дюсембеков Е.К., Юнусов Р.Ю. и др. Актуальные аспекты хирургического лечения повреждений периферических нервов. Нейрохирургия и неврология Казахстана. 2020;3(60):3-10.
- Gordon T. Peripheral nerve regeneration and muscle reinnervation. Int J Mol Sci. 2020;21(22):8652. doi: 10.3390/ijms21228652
- Midha R, Grochmal J. Surgery for nerve injury: current and future perspectives. J Neurosurg. 2019;130(3):675-685. doi: 10.3171/2018.11.JNS181520
- Rich JA, Newell A, Williams T. Traumatic brachial plexus injury rehabilitation using neuromuscular electrical muscle stimulation in a polytrauma patient. BMJ Case Rep. 2019;12(12):e232107. doi: 10.1136/bcr-2019-232107
- Carvalho CR, Reis RL, Oliveira JM. Fundamentals and current strategies for peripheral nerve repair and regeneration. Adv Exp Med Biol. 2020;(1249):173-201. doi: 10.1007/978-981-15-3258-0_12
- Мещерягина И.А., Скрипников А.А. Применение комбинированной электростимуляции при изолированных и сочетанных повреждениях периферических нервов верхних и нижних конечностей. Российский медицинский журнал. 2015;21(3):14-19. doi: 10.17816/rmj38240
- Mendez A, Hopkins A, Biron VL, Seikaly H, Zhu LF, Cote DWJ. Brief electrical stimulation and synkinesis after facial nerve crush injury: a randomized prospective animal study. J Otolaryngol Head Neck Surg. 2018;47(1):20. doi: 10.1186/s40463-018-0264-0
- Deer TR, Levy RM, Verrills P, Mackey S, Abejon D. Perspective: Peripheral nerve stimulation and peripheral nerve field stimulation birds of a different feather. Pain Med. 2015;16(3):411-412. doi: 10.1111/pme.12662
- Hageman S, Kovalchuk MO, Sleutjes BTHM, van Schelven LJ, van den Berg LH, Franssen H. Sodium-potassium pump assessment by submaximal electrical nerve stimulation. Clin Neurophysiol. 2018;129(4):809-814. doi: 10.1016/j.clinph.2018.01.016
- Musselman ED, Cariello JE, Grill WM, Pelot NA. ASCENT (Automated Simulations to Characterize Electrical Nerve Thresholds): A pipeline for sample-specific computational modeling of electrical stimulation of peripheral nerves. PLoS Comput Biol. 2021;17(9):e1009285. doi: 10.1371/ journal.pcbi.1009285
- Panagopoulos GN, Megaloikonomos PD, Mavrogenis AF. The present and future for peripheral nerve regeneration. Orthopedics. 2017;40(1):e141-156. doi: 10.3928/01477447-20161019-01
- Chakravarthy K, Kent AR, Raza A, Xing F, Kinfe TM. Burst spinal cord stimulation: review of preclinical studies and comments on clinical outcomes. Neuromodulation. 2018;21(5):431-439. doi: 10.1111/ner.12756
- Deer T, Slavin KV, Amirdelfan K, North RB, Burton AW, Yearwood TL, Tavel E, Staats P, Falowski S, Pope J, Justiz R, Fabi AY, Taghva A, Paicius R, Houden T, Wilson D. Success using neuromodulation with BURST (SUNBURST) study: results from a prospective, randomized controlled trial using a novel burst waveform. Neuromodulation. 2018;21(1):pp. 56-66. doi: 10.1111/ner.12698
- Huskisson EC. Measurement of pain. Lancet. 1974;2(7889):1127-31. doi: 10.1016/s0140-6736(74)90884-8
- Paternostro-Sluga T, Grim-Stieger M, Posch M, Schuhfried O, Vacariu G, Mittermaier C, Bittner C, Fialka-Moser V. Reliability and validity of the Medical Research Council (MRC) scale and a modified scale for testing muscle strength in patients with radial palsy. J Rehabil Med. 2008;40(8):665-71. doi: 10.2340/16501977-0235
- Govenko FS, Kokn GS. Clinical examination of patients after the suture of median and ulnar nerves: guideline. Leningrad, 1983. 32 p.
- Disabilities of the arm, shoulder and hand. Available at: https://www.myoptumhealthphysicalhealth.com/Documents/Forms/DASH.pdf. Accessed 15 June, 2023.
- Бажанов С.П., Шувалов С.Д., Коршунова Г.А., Островский В.В. База данных клинических и электрофизиологинеских параметров оценки состояния периферических нервов у пациентов с закрытыми тракционными повреждениями плечевого сплетения. Св-во о гос. регистрации базы данных № 2021621417 РФ. № 2021621328; заявл. 30.06.2021; опубл. 01.07.2021. Бюл. № 7.
- Bolivar S, Navarro X, Udina E. Schwann Cell Role in Selectivity of Nerve Regeneration. Cells. 2020;9(9):2131. doi: 10.3390/cells9092131
- Cobianchi S, Casals-Diaz L, Jaramillo J, Navarro X. Differential effects of activity dependent treatments on axonal regeneration and neuropathic pain after peripheral nerve injury. Exp Neurol. 2013;240:157-67. doi: 10.1016/j.expneurol.2012.11.023
- Asensio-Pinilla E, Udina E, Jaramillo J, Navarro X. Electrical stimulation combined with exercise increase axonal regeneration after peripheral nerve injury. Exp Neurol. 2009;219(1):258-65. doi: 10.1016/j.expneurol.2009.05.034
- Alrashdan MS, Sung MA, Kwon YK, Chung HJ, Kim SJ, Lee JH. Effects of combining electrical stimulation with BDNF gene transfer on the regeneration of crushed rat sciatic nerve. Acta Neurochir (Wien). 2011;153(10):2021-9. doi: 10.1007/s00701-011-1054-x
- Мещерягина И.А., Скрипников А.А. Применение комбинированной электростимуляции при изолированных и сочетанных повреждениях периферических нервов верхних и нижних конечностей. Российский медицинский журнал. 2015;21(3):14-19.
- Худяев А.Т., Мартель И.И., Самылов В.В., Мещерягина О.С., Россик О.С. Малоинвазивные методы лечения повреждений периферических нервов. Гений ортопедии. 2012;(1):85-88.


