Результаты протезирования трикуспидального клапана механическими и биологическими протезами у детей
Автор: Горбатых Ю.Н., Наберухин Ю.Л., Жалнина Е.В., Токарев А.В., Хапаев Т.С.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Врожденные пороки сердца
Статья в выпуске: 2 т.12, 2008 года.
Бесплатный доступ
При необходимости протезирования трикуспидального клапана (ТК) у детей возникает вопрос о выборе протеза, наиболее пригодного для имплантации. Известно, что идеального протеза в настоящее время не существует: механические протезы при погрешностях в применении антикоагулянтов имеют относительно высокий риск тромбоза [2, 8, 9], биологические протезы у детей быстро кальцифицируются, что приводит к их дисфункции [1, 3-7]. Целью нашего исследования стала оценка результатов протезирования ТК различными видами протезов у группы пациентов детского возраста.
Протезирование трикуспидального клапана, аномалия эбштеина, механические протезы, биологические протезы
Короткий адрес: https://sciup.org/142233196
IDR: 142233196
Текст научной статьи Результаты протезирования трикуспидального клапана механическими и биологическими протезами у детей
При необходимости протезирования трикуспидального клапана (ТК) у детей возникает вопрос о выборе протеза, наиболее пригодного для имплантации. Известно, что идеального протеза в настоящее время не существует: механические протезы при погрешностях в применении антикоагулянтов имеют относительно высокий риск тромбоза [2, 8, 9], биологические протезы у детей быстро кальцифицируются, что приводит к их дисфункции [1,3-7]. Целью нашего исследования стала оценка результатов протезирования ТК различными видами протезов у группы пациентов детского возраста.
МАТЕРИАЛ И МЕТОДЫ
В исследование включены 88 пациентов в возрасте от 5 мес. до 15 лет, которым в период с 1991 по 2006 г. выполнено протезирование ТК в ННИИПК им. акад. Е.Н. Мешалкина. Все больные разделены на две группы в зависимости от типа примененного протеза. Механический протез был имплантирован 26 пациентам, 62 выполнено биопротезирование. В исследуемых группах несколько преобладали мальчики - 47 пациентов, в группе биопротезирования пациенты были старше, у них большая масса и поверхность тела (табл. 1).
Причиной для протезирования клапана послужили различные виды патологии. Большинство случаев представлено аномалией Эбштейна - 59 (67%) пациентов. К другим патологическим состояниям относились: врожденная трикуспидальная недостаточность - 11 (12,5%) пациентов, атриовентрикулярная коммуникация - 10 (11,4%) пациентов, приобретенные пороки ТК - 8 (9,1%) пациентов. Остальные трое пациентов относятся к редким случаям патологии ТК (опухоли правого желудочка, травматическое поражение ТК). Протезирование у всех пациентов с атриовентрикулярной коммуникацией было повторной операцией.
Большинство пациентов (46 чел.) до операции состояло в III функциональном классе (ФК)
по NYHA, 16 пациентов относились к более тяжелому IV ФК, 26 пациентов - ко II ФК. Различий между двумя группами по тяжести исходного состояния практически не было.
Всем пациентам до операции выполнялось рутинное обследование, включающее рентгено-и эхокардиографию (табл. 2). Сократительная способность левого желудочка (ЛЖ) достоверно не отличалась в обеих группах пациентов и составила 68 и 69%, соответственно.
В качестве протезов использовались различные виды искусственных клапанов. В группе механических - МИКС (9), МедИнж (3), ЛИКС (2), Sorin Bicarbon (6), ATS (3), ON-X (3). Среди биологических преобладали клапаны КемКор (51), ПериКор (8), в трех случаях использова-
Таблица 1
Характеристика групп пациентов с различными видами протезов
Протезы
|
Показатель |
механические (п=26) |
биологические (п=62) |
|
Возраст, годы |
7,5±0,8 |
10,3±0,5 |
|
Рост, см |
122,4±5,3 |
146,8±3,5 |
|
Масса тела, кг |
24,3±2,3 |
42,3±2,7 |
|
S поверхности тела, м2 |
0,9±0,07 |
1,24±0,05 |
Таблица 2
Размеры сердца по данным рентгено-иэхокардиографии
Протезы
В обеих группах пациентов размер используемого протеза превышал расчетный размер фиброзного кольца ТК, но был меньше истинного размера фиброзного кольца, измеренного на операции. Коррекция сопутствующей патологии осуществлялась одновременно с заменой клапана (закрытие открытого овального окна или вторичного дефекта межпредсердной перегородки - у 18 пациентов, закрытие дефекта межжелудочковой перегородки - у двоих, радиочастотная деструкция (аблация) дополнительных путей проведения - у 14 больных). В трех случаях протезирование ТК было дополнено двунаправленным кавапульмональ-ным анастомозом.
РЕЗУЛЬТАТЫ
Госпитальная летальность была незначительно выше в группе пациентов с механическими протезами - 2 (7,7%), по сравнению с группой пациентов, которым имплантировались биопротезы - 4 (6,5%). Все погибшие пациенты были со значительным нарушением развития анатомических структур правого желудочка при аномалии Эбштейна (типы D, E по классификации A. Carpentier и соавт., 1988). Причинами летальных исходов во всех случаях была прогрессирующая сердечная недостаточность.
Из осложнений послеоперационного периода следует отметить нарушения ритма (11,5% в группе механического протезирования и 14,5% у пациентов с имплантацией биопротезов), которые были представлены как нарушениями проводимости, так и возбудимости, для коррекции которых потребовалась дополнительная медикаментозная терапия, а у пятерых пациентов была выполнена имплантация электрокардиостимулятора. Достаточно часто в послеоперационном периоде наблюдалась выраженная провожелудочковая недостаточность (в 15,4% случаев при имплантации механического протеза и в 11,3% случаев при биопротезировании). Еще одним осложнением, которое встречалось в 15,4% случаев при механическом протезировании и у 9,7% пациентов с биопротезами, являлась повышенная экссудация в полость перикарда. Тромбозов протезов, пара-аннулярных фистул в раннем послеоперационном периоде не отмечалось в обеих группах.
С целью сравнения выраженности сердечной и дыхательной недостаточности в раннем послеоперационном периоде в двух группах мы оценили длительность нахождения больных на искусственной вентиляции легких и кумулятивную дозу введенных кардиотонических препаратов. Выявлено, что в группе пациентов с имплантированными механическими протезами длительность ИВЛ на 36% превышала таковую в группе биопротезирования; дозы допмина и адреналина оказались значительно ниже при биопротезировании (в среднем на 59%).
В раннем послеоперационном периоде у всех пациентов среднее значение транспротезного градиента на клапане было в пределах нормы, незначительно различалось в группах механических (6,85±3,12 мм рт. ст.) и биологических (4,5±2,74 мм рт. ст.) протезов. Регургитации с протеза более 0-I ст. не выявлено ни в одном случае.
Отдаленные результаты протезирования ТК удалось оценить у 56 пациентов в сроки от 1 года до 11 лет (при повторном обследовании в ННИИПК).
Еще у 12 пациентов данные были собраны методом анкетирования, клинические обследования проведены по месту жительства, но эти пациенты в группы наблюдения не включались. Динамика изменения размеров сердца в раннем и отдаленном послеоперационном периоде оценивалась по данным обзорной рентгенографии органов грудной клетки (сердечно-легочный коэффициент (СЁК)), и эхокардиографии (размеры правых отделов сердца, сократительная способность ЁЖ), по которым отмечена положительная динамика у всех обследованных пациентов. Достоверной разницы в динамике вышеуказанных показателей между группами в ближайший послеоперационный период и в течение первого года не отмечено.
Среднее значение СЁК в группе больных с механическим протезированием снизилось через год после операции по сравнению с до-операционными данными на 6,5%, в группе биопротезирования - на 3,4%. Уменьшение абсолютных размеров ПП в те же сроки после операции произошло на 12,5 и 17,3%, соответственно в группах механического и биологического протезирования, уменьшение КДР ПЖ на 9,4 и 9,9%.
Однако отмечены особенности изменения размеров сердца в группах в более отдаленные сроки. т. е. изменения размеров сердца с течением времени отличаются в группах механического и биопротезирования. Если в ранние сроки после операции СПК при механическом протезировании в среднем составил 60%, а при биопротезировании 58%, то примерно через полтора года значения СПК при протезировании механическими клапанами и биопротезировании выравниваются (по 57,4%), а затем СЛК у пациентов с биологическими протезами становится выше (59%), чем у группы пациентов с механическими протезами (58%).
Те же закономерности в отдаленных послеоперационных результатах можно наблюдать при сравнении размеров правого желудочка и правого предсердия. Из графика видно, что, начиная со второго года после операции абсолютные размеры правого предсердия в группе биопротезирования нарастают по сравнению с группой пациентов с механическими клапанами (рис. 1). Размеры правого желудочка в группе биопротезов также постепенно увеличиваются, но становятся больше, чем в группе механического протезирования, только с 45-го года после операции (рис. 2).
Фракция выброса ЛЖ имеет сопоставимые значения при различных видах протезирования. Отмечено, что фракция выброса, первоначально более высокая в группе биопротезирования (на 6,8% выше чем у пациентов с механическими протезами) постепенно, начиная с 3-го года после операции равномерно снижается в обеих группах и достигает 63%.
После операции отмечается снижение ФК пациентов в обеих группах. Большинство пациентов (79,8% в группе с механическими клапанами и 81,1% в группе с биопротезами) перешло в I-II ФК. Но через 3 года в группе биопротезирования отмечается увеличение ФК за счет значительного количества пациентов с ранним появлением дисфункции протеза, в основном представленной кальцинозом и/или фиброзом створок (рис. 3).
В группе протезирования механическими протезами дисфункции возникают позже и в основном представлены тромбозами протезов при погрешностях антикоагулянтной терапии и изменениями по типу паннуса на запирательном элементе протеза, снижающем его подвижность или полностью блокирующем створку.
Этим можно объяснить также быстрое нарастание транспротезного градиента(через 2 года) после биопротезирования, в среднем с 6,9 до 12,4 мм рт. ст. по сравнению с более поздним (через 4 года) нарастанием диастолического транспротезного градиента в группе пациентов с механическим протезом: с 4,5 до 8,8 мм рт. ст.
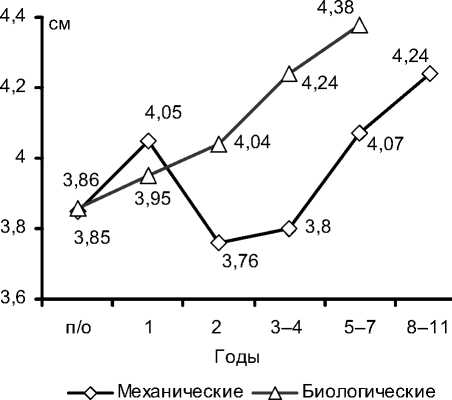
Рис. 1. Динамика абсолютных размеров правого предсердия - в отдаленные сроки после операции.
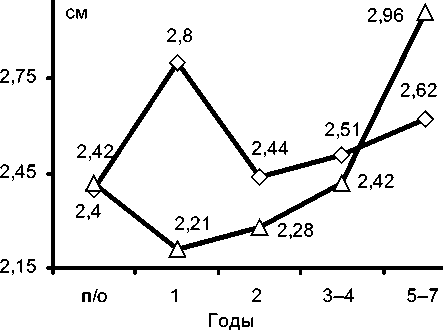
^^— Механические -^— Биологические
Рис. 2. Динамика КДР ПЖ в отдаленные сроки после операции.
Также отмечено постепенное нарастание степени недостаточности на клапане в группе биопротезирования, в то время как в группе механических протезов средняя степень недостаточности возрастает за счет резкой дисфункции протезов у отдельных пациентов (рис. 4).
При появлении выраженной дисфункции клапанов производились повторные вмешательства (репротезирования ТК) (табл. 3). У двоих пациентов биологические протезы заменялись дважды. При механическом протезе сроки репротезирования практически вдвое превышали таковые при биологическом протезировании. В среднем реоперации в группе механического протезирования (4 пациента) проводились через 5,9 лет после первичного вмешательства,
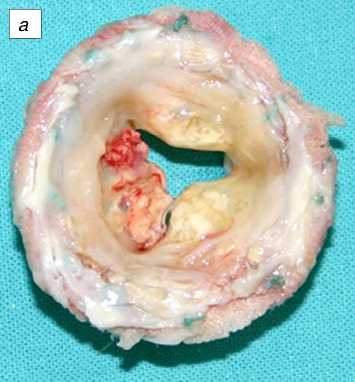
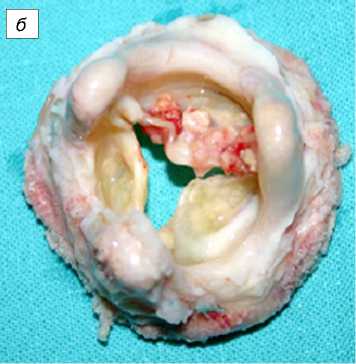
Рис. 3. Эксплантированный протез Кемкор (трикуспидальная позиция). Видны очаги кальциноза и фиброзное изменение створок: Поверхность протеза: а - предсердная; б - желудочковая.
средний возраст пациентов при этом составил 13,8 года. В группе биопротезирования (16 пациентов) показатели были 3,3 года и 14,3 года, соответственно.
Таблица 3
Частота репротезирования по группам пациентов
|
Сроки репроте- - |
Протезы |
|
|
биологические |
||
|
зирования, годы |
механические |
|
|
(п=26) |
(п=62) |
|
|
Через 1 |
- |
- |
|
2 |
1 (1,7%) |
|
|
3-4 |
1 (4,2%) |
8(13,8%) |
|
5-7 |
1 (4,2%) |
6 (10,3%) |
|
8-11 |
2 (8,3%) |
1 (1,7%) |
|
Всего |
4(16,7%) |
16(27,6%) |
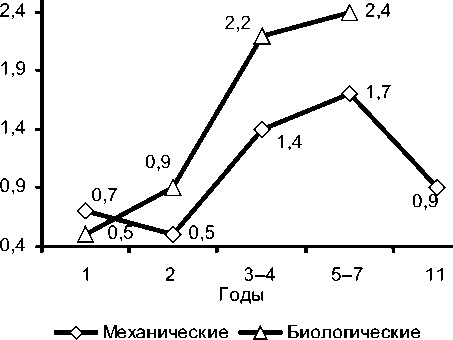
Рис. 4. Усредненная степень недостаточности на протезированных клапанах по годам (для обследованных пациентов).
При анализе групп пациентов, подвергнутых репротезированию, выяснилось, что в группе механических протезов нет различия по полу и возрасту, а в группе биоклапанов большинство пациентов, которым мы были вынуждены менять протез, - были мужского пола - 12 (75%).
При сравнении возраста оказалось, что репротезирование биологических протезов у девочек чаще всего наблюдается в возрасте 89 лет, а у лиц мужского пола пик репротезирований приходится на возраст 14-16 лет.
Причины, непосредственно вызвавшие необходимость репротезирования, различны. У пациентов, которым выполнялась имплантация механического протеза, причиной повторного вмешательства в трех случаях был тромбоз протеза и в одном - появление паннуса, уменьшающего площадь эффективного отверстия протеза и блокирующего запирательный элемент. У пациентов с биопротезами к репротезированию привели: кальциноз клапана - в 11 случаях, фиброз створок искусственного клапана -у 4 пациентов и в 1 случае - появление пара-аннулярной фистулы.
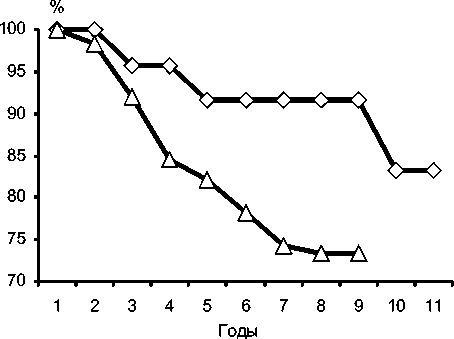
Свобода от репротезирования (рис. 5.) в исследуемых группах к девятому году после операции составила 91,7% в группе с механическими клапанами, 73,3% в группе биопротезирования.
ВЫВОДЫ
-
1. Механические и биологические протезы в трикуспидальной позиции имеют сопоставимые гемодинамические показатели в ближайшем и среднеотдаленном послеоперационных периодах.
-
2. Протезирование механическими клапанами при тщательно подобранной и соблюдаемой антикоагулянтной терапии имеет удовлетворительные отдаленные результаты. В репротезировании нуждаются 16,7% пациентов к одиннадцатому году после первичной операции.
-
3. Наибольшее количество репротезирований в группе биопротезирования происходит через 35 лет после первой операции. Репротезирования требуют 26,7% пациентов с биопротезами к девятому году после первичной операции.
^^ Механические ^^ Биологические
Рис. 5. Динамика свободы от репротезирования.
Список литературы Результаты протезирования трикуспидального клапана механическими и биологическими протезами у детей
- Atik F.A., Dias A.R., Pomerantzeff P.M. et al. // Arq. Bras. Cardiol. 1999. V. 73 (5). P. 419-428.
- Kaplan M., Kut M.S., Demirtas M.M. //Ann. Thorac. Surg. 2002. V. 73 (2). P. 467-473.
- Kawahira Y., Yagihara T., Uemura H. et al. // J. Heart. Valve Dis. 2000. V. 9 (5). P. 636-640.
- Kiziltan H. T, Theodoro D.A., Warnes A. С //Ann. Thorac. Surg. 1998. V. 66. P. 1539-1545.
- EDN: ACYTFJ
- Kuwaki K., Komatsu K., Morishita К // Surg. Today. 1998. V. 28 (6). P. 599.
- EDN: AWYRNX
- Nakano K., Ishibashi-Ueda H., Kobayashi J. // Ann. Thorac. Surg. 2001. V. 71. P. 105-109.
- Pasque M., Williams W. G., Coles J. G. et al. //Ann. Thoracic Surgery. 1987. V. 44. P. 164-168.
- Rizzoli G., De Perini L., Bottio T. //Ann. Thorac. Surg. 1998. V. 66 (6 Suppl.). P. 62-67.
- Solomon N.A.G., Lim R.C.H. //Asian Cardiovasc. Thorac. Ann. 2004. V. 12. P. 143-148.


