Результаты сочетанной лучевой терапии рака пищевода с применением брахитерапии высокой мощности
Автор: Ложков Алексей Александрович, Важенин Андрей Владимирович, Шарабура Татьяна Михайловна, Кулаев Константин Иванович, Зуйков Константин Сергеевич, Юсупов Ильдар Махмудович, Мозерова Екатерина Яковлевна, Давыдова Ольга Николаевна, Пименова Марина Михайловна, Сыролева Ксения Николаевна, Максимовская Алена Юрьевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 1 т.16, 2017 года.
Бесплатный доступ
Проведено сравнительное исследование с включением 82 пациентов, страдающих раком пищевода, получивших самостоятельный курс лучевой терапии. В первую группу вошли 30 пациентов, получивших сочетанную лучевую терапию с брахитерапией, во 2-ю группу - 30 пациентов, получивших дистанционную лучевую терапию (ДЛТ) до суммарной дозы 60-70 Гр, у 22 пациентов 3-й группы суммарная доза ДЛТ была ограничена 40-50 Гр. Результаты лечения оказались лучше в группе сочетанной лучевой терапии, в то время как значение суммарной дозы ДЛТ не повлияло на показатели выживаемости. Двухлетняя общая выживаемость в сравниваемых группах составила 36, 12 и 12 %, медиана общей выживаемости - 15,7; 9,7 и 6,6 мес соответственно.
Рак пищевода, брахитерапия, лучевая терапия
Короткий адрес: https://sciup.org/140254096
IDR: 140254096 | УДК: 616.329-006.6-08:615.849.1 | DOI: 10.21294/1814-4861-2017-16-1-71-75
Текст научной статьи Результаты сочетанной лучевой терапии рака пищевода с применением брахитерапии высокой мощности
Рак пищевода (РП) является одним из наиболее прогностически неблагоприятных онкологических заболеваний. В течение одного года с момента постановки диагноза погибает до 60 % пациентов [1], пятилетняя выживаемость не превышает 10–15 % [2]. К моменту выявления заболевания 40–60 % больных РП пациентов не подлежат хирургическому лечению [3]. Среди оперированных пациентов лишь в 50–60 %, что составляет не более 15 % от всех вновь диагностированных случаев, имеется микроскопически подтвержденный «чистый» край резекции, в 70–80 % случаев выявляются метастазы в регионарных лимфатических узлах [4].
Эффективность самостоятельной дистанционной лучевой терапии (ДЛТ) невысока, местный ответ удается получить не более чем у 40 % пациентов, двухлетняя общая выживаемость не превышает 29 % [5]. Проведение одновременной химиолучевой терапии (ХЛТ) позволяет увеличить показатели 2-летней общей выживаемости до 35–40 %. Более агрессивная ХЛТ характеризу- ется высокой токсичностью, лучевые реакции III степени развиваются у 44 %, IV степени – у 20 % пациентов [6].
Попытки улучшить результаты лечения за счет увеличения суммарной очаговой дозы сопряжены с увеличением риска лучевых осложнений из-за близости критических органов с низкой толерантностью к ионизирующему излучению [7]. Современные технологии ДЛТ, такие как 3D конформная и модулированная по интенсивности лучевая терапия (IMRT), позволили повысить безопасность лечения в диапазоне доз от 50 Гр до 60 Гр, что недостаточно для обеспечения стойкого локального контроля при лучевом лечении рака пищевода. Внутрипросветная (или эндолюминальная) брахитерапия с использованием источников высокой мощности дозы (HDR) находит все большее применение в лечении рака пищевода благодаря таким преимуществам, как локальное воздействие на опухоль без значительной лучевой нагрузки на окружающие ткани [8].
Материал и методы
В период с 2008 по 2015 г. 82 больных плоскоклеточным раком грудного отдела пищевода T3- 4 N0- i M0 стадии в связи с отказом от хирургического лечения получили самостоятельный курс лучевой терапии. Основную группу составили 30 пациентов, получивших курс сочетанной лучевой терапии, включавшей ДЛТ и брахитерапию высокой мощности дозы, за период с 2011 по 2015 г. Вторую группу составили 30 пациентов, получивших самостоятельный курс дистанционной лучевой терапии до суммарной очаговой дозы 60–70 Гр за период с 2008 по 2011 г. В 3-ю группу вошли 22 пациента, у которых дистанционная лучевая терапия была ограничена дозой 40–50 Гр. Во всех группах преобладали мужчины, средний возраст составил 64 ± 1 год.
Всем пациентам на первом этапе проводилась дистанционная лучевая терапия до суммарной дозы 40-50 Гр за 18-25 фракций. В объем облучения включалась опухоль пищевода, определяемая при рентгенографии, с отступом до 5 см в кранио-каудальном направлении и до 2 см в латеральных направлениях. Суммарная доза 30 Гр подводилась с 2 встречных противолежащих полей с последующим трехпольным облучением. После купирования лучевых реакций в течение 2–3 нед пациентам первой группы выполнялся этап внутриполостной брахитерапии, пациенты второй группы получали 2-й этап ДЛТ до суммарной дозы 60-70 Гр. Пациентам 3-й группы дополнительное облучение не проводилось.
Подготовка к брахитерапии проводилась на рентгеновском симуляторе. На кожу передней грудной стенки выводились границы области сужения пищевода, определяемые рентгеноскопически при контрастировании пищевода сульфатом бария. Установка гибкого пластикового эндостата производилась под местным обезболиванием с визуальным контролем в процессе ФГС. Основным условием являлось проведение эндостата дистальнее опухоли на 2–3 см. При невозможности эндоскопической визуализации дистального края опухоли вследствие стеноза эндостат устанавли- вался при помощи металлического проводника с учетом длины согласно данным рентгеноскопии. Эндостат фиксировался при помощи специального загубника. На следующем этапе выполнялся рентгенологический контроль положения эндостата в двух проекциях. Предварительно в эндостат вводился проводник с рентгеноконтрастными метками, имитирующими положение радиоактивного источника, на коже пациента закрепляли рентгеноконтрастные метки на уровне границ области сужения пищевода. Полученные данные в электронном виде передавались в планирующую систему, где производилась трехмерная реконструкция эндостата. Расчет дозы выполнялся на расстоянии 0,5 мм от стенки эндостата (диаметр эндостата составлял 1,2 см) и на 20 мм от границ опухоли по длине (рис.1). Внутриполостное облучение осуществлялось на аппарате Multisourse с источником излучения 60Co.
Схема внутриполостной брахитерапии включала подведение 14 Гр за 2 фракции по 7 Гр 1 раз в неделю или 15 Гр за 3 фракции по 5,0 Гр 2 раза в неделю, что соответствовало по изоэффекту 24 Гр традиционного фракционирования. Общая суммарная доза сочетанной лучевой терапии с учетом дистанционного этапа соответствовала 64–70 изоГр традиционного фракционирования.
Результаты и обсуждение
В процессе проведения внутриполостной брахитерапии осложнений не было. При контрольном осмотре через 1 мес уменьшение выраженности дисфагии в первой группе отметили 70 % пациентов, во второй группе – 54 %, в третьей – 23 %. При рентгеноскопии положительный эффект зафиксирован в 80, 52 и 38 % случаев соответственно, в том числе у 5 пациентов из 1-й группы и 2 пациентов из 2-й группы достигнута полная регрессия (таблица).
Наиболее серьезными осложнениями прогрессирования опухолевого процесса являлось формирование пищеводного свища и эрозия крупных сосудов с массивным кровотечением. Пищеводный свищ диагностирован в первой группе - у 4, во вто-
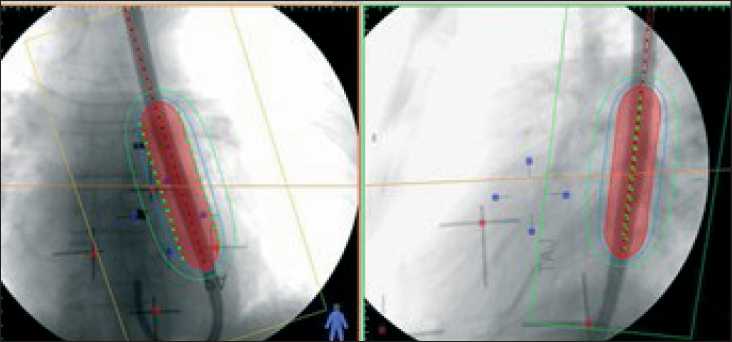
Рис. 1. Пример дозного распределения при проведении брахитерапии
В первой и второй группах подведенная доза по изоэффекту была сопоставима и составляла 60–70 изоГр. Несмотря на это, локальный контроль оказался выше у пациентов, получивших брахитерапию. Аналогичные результаты получили E. Rosenblatt et al. [9], которые наблюдали уменьшение выраженности дисфагии в 82,7 % против 66,7 % за счет добавления брахитерапии к дистанционной лучевой терапии.
В ранних исследованиях, посвященных брахитерапии рака пищевода, сообщалось о высокой токсичности лечения при применении высоких разовых доз. Так, пациенты, получившие 10 Гр от высокодозной брахитерапии за 1 фракцию в качестве буста к ДЛТ, имели большую медиану выживаемости (21 мес) по сравнению с пациентами, получившими 15 Гр (11 мес) [10]. В представленном исследовании суммарная доза брахитерапии 14–15 Гр за 2–3 фракции не привела к увеличению риска осложнений в сравнении с одной только дистанционной лучевой терапией. В то же время увеличение суммарной дозы от 40–50 Гр до 60–70 Гр
Список литературы Результаты сочетанной лучевой терапии рака пищевода с применением брахитерапии высокой мощности
- Чиссов В.И., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2010 году. М., 2011; 188.
- Мерабишвили В.М. Заболеваемость, смертность и анализ эффективности организации онкологической помощи больным раком пищевода. Вопросы онкологии 2013; 59 (1): 30-40.
- Давыдов М.И., Стилиди И.С., Тер-Ованесов М.Д., Полоцкий Б.Е. Рак пищевода: современные подходы к диагностике и лечению. Русский медицинский журнал. 2006; 14: 1006-1015.
- Iyer R., Wilkinson N., Demmy T., Javle M. Controversies in the multimodality management of locally advanced esophageal cancer: Evidencebased review of surgery alone and combined-modality therapy. Ann Surg Oncol. 2004 Jul; 11 (7): 665-73. DOI: 10.1245/ASO.2004.10.026
- Канаев С.В., Щербаков А.М., Тюряева Е.И., Аванесян А.А. Консервативное лечение местно-распространенного и неоперабельного рака пищевода: возможности и перспективы. Вопросы онкологии. 2012; 58 (2): 199-202.


