Результаты терапии 225АС-ПСМА-617 больных метастатическим кастрационно-резистентным раком предстательной железы
Автор: Кочетова Т.Ю., Крылов В.В., Иванов С.А., Каприн А.Д.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 6 т.23, 2024 года.
Бесплатный доступ
177Lu-ПСМА-617 - новая опция терапии ПСМА позитивного метастатического кастрационн-резистентного рака предстательной железы (мКРРПЖ) с доказанной эффективностью. 225Ас-ПСМА-617 является альфа-эмиттером, что делает этот препарат потенциально более мощным. Несмотря на активное применение 225Ас-ПСМА-617-617 по всему миру, рандомизированных исследований III фазы до сих пор не проведено. В настоящем проспективном когортном исследовании представлен опыт применения 225Ас-ПСМА-617 в МРНЦ им. А.Ф. Цыба. Материал и методы. В исследование включены пациенты с мКРРПЖ с гиперэкспрессией простатспецифического мембранного антигена (ПСМА), подтвержденной данными.
Радиолигандная терапия, 225ас-псма-617, кастрационно-резистентный рак предстательной железы, радия хлорид [223ra], общая выживаемость
Короткий адрес: https://sciup.org/140308259
IDR: 140308259 | УДК: 616.65-006.55-08 | DOI: 10.21294/1814-4861-2024-23-6-32-40
Текст научной статьи Результаты терапии 225АС-ПСМА-617 больных метастатическим кастрационно-резистентным раком предстательной железы
Радиолигандная терапия (РЛТ) с использованием радиофармацевтических лекарственных препаратов (РФЛП), тропных к простатспецифи-ческому мембранному антигену (ПСМА), является новой опцией терапии больных метастатическим кастрационно-резистентным раком предстательной железы (мКРРПЖ). Наиболее изученным препаратом для РЛТ является 177Lu-ПСМА-617. В исследовании III фазы VISION доказано преимущество использования 177Lu-ПСМА-617 в комбинации со стандартной противоопухолевой терапией (за исключением химиотерапии и PARP-ингибиторов) по сравнению со стандартной противоопухолевой терапией у пациентов с мКРРПЖ с высоким накоплением 68Ga-ПСМА в метастатических очагах, получивших хотя бы одну линию химиотерапии и одну линию терапии антиандрогенами нового поколения (ААНП) до включения в исследование [1]. Несмотря на успехи применения 177Lu-ПСМА-617, остается вопрос о тактике лечения в отношении больных, не ответивших на терапию этим препаратом. Результаты первого применения 225Ас-ПСМА-617, опубликованные в 2016 г., показали впечатляющие результаты у пациента с прогрессированием после терапии 177Lu-ПСМА. [2]. Альфа-эмиттер 225Ас-ПСМА-617 потенциально является более эффективным РФЛП в отношении больных мКРРПЖ с гиперэкспрессией ПСМА, но данные о его эффективности на сегодняшний момент ограничиваются клиническими исследованиями II фазы и ретроспективными исследованиями. Мировой опыт применения 225Ас-ПСМА-617 собран в ретроспективном исследовании WARMTH Act, в которое было включено 488 пациентов с мКРРПЖ, которым проводилась терапия 225Ас-ПСМА-617 в период с 2016 по 2023 г. Исследователи выявили такие факторы неблагоприятного прогноза, как наличие анемии, предшествующая терапия ААНП, предшествующая терапия таксанами и наличие метастатического поражения печени и брюшины. Снижение уровня ПСА на 50 % в процессе лечения было связано с увеличением общей выживаемости пациентов [3]. Метаанализ эффективности и безопасности РЛТ препаратами 177Lu-ПСМА-617 и 225Ас-ПСМА-617 показал противоречивые результаты. С одной стороны, выявлена связь между снижением уровня ПСА более 50 % и снижением риска смерти пациентов, а также преимущество 225Ас-ПСМА-617 в отношении биохимического ответа, однако медиана ОВ для 177Lu-ПСМА-617 и 225Ас-ПСМА-617 составила 14 и 13,5 мес соответственно. К факторам неблагоприятного прогноза РЛТ, по данным этого исследования, относятcя низкий статус по шкале ECOG (2 и ниже), наличие висцеральных метастазов и метастазов в печень, предшествующая химиотерапия [4].
Впервые 225Ас-ПСМА-617 в России применили в 2021 г. в РНРХТ им. Гранова [5]. В МРНЦ им. А.Ф. Цыба 225Ас-ПСМА-617 используется в клинической практике с 2023 г., опубликованы первые данные по безопасности применения этого РФЛП в различных терапевтических дозировках [6].
Целью исследования явился анализ результатов терапии больных мКРРПЖ, получивших первый курс терапии 225Ас-ПСМА-617 в 2023 г.
Материал и методы
-
225Ас-ПСМА-617 представляет собой водный раствор для внутривенного введения на основе химического прекурсора, транспортной молекулы ПСМА-617, меченной радионуклидом актиний-225. Препарат готовили в условиях производственной аптеки с правом изготовления РФЛП («ядерной аптеки») незадолго до введения пациенту, путем последовательного смешивания радионуклидного предшественника – хлорида актиний-225 – с требуемым количеством лиганда ПСМА-617 и вспомогательными реагентами. Изготовление и контроль качества готового препарата проводились в условиях ядерной аптеки МРНЦ им. А.Ф. Цыба в соответствии с приказом Минздрава России 1218н от 12.11.20 «Об утверждении Порядка изготовления радиофармацевтических лекарственных препаратов непосредственно в медицинских организациях». Введение готового препарата пациентам осуществлялось сразу же после контроля качества и получения заключения о соответствии требуемым параметрам, в том числе радиохимической чистоте более 95 %.
Исследование является проспективным, в него были включены все пациенты с прогрессирующим мКРРПЖ с гиперэкспрессией ПСМА на мембранах опухолевых клеток, подтвержденной данными ПЭТ-КТ с 18F-ПСМА, 68Ga-ПСМА или ОФЭКТ-КТ с 177Lu-ПСМА-617 (посттерапевтическое сканирование), которые получили первое введение 225Ас-ПСМА-617 в отделении радиохирургического лечения открытыми радионукли- дами МРНЦ им. А.Ф. Цыба в 2023 г. Критериями невключения были анемия, тромбоцитопения III степени по шкале NCI-CTCAE v 5.0, лейкопения менее 2,5 тыс/мкл, нейтропения менее 1,5 тыс/мкл. Первые 9 пациентов получили 225Ас-ПСМА-617 в рамках исследования безопасности возрастающих активностей, 6, 9 и 12 МБк, по три пациента в каждой группе. В дальнейшем дозировка РФЛП определялась врачом индивидуально на основании факторов риска токсичности, таких как наличие анемии, хронической почечной недостаточности и других. Интервалы между курсами в большинстве случаев составляли 8 нед, в единичных случаях 6 или 10 нед. Критериями прекращения лечения были: непереносимая токсичность, в том числе гематологическая токсичность III степени по шкале NCI-CTCAE v 5.0, снижение количества лейкоцитов менее 2,5 тыс/мкл, нейтрофилов менее 1,5 тыс/мкл; клинически выраженное прогрессирование, рост уровня ПСА в сочетании с ухудшением общего состояния пациента; необходимость перехода на следующую линию терапии (при возможности таковой) в связи с ростом уровня ПСА; достижение стойкого снижения уровня ПСА в 2 нг/мл и ниже; отказ пациента от продолжения участия в исследовании.
Всем пациентам проводился контроль уровня ПСА перед каждым введением 225Ас-ПСМА-617 и через 4 нед после каждого введения. Для поиска различий общей выживаемости между двумя группами использованы тест Уилкоксона–Гехана, F-тест Кокса, тест Кокса–Мантела, тест Пето и Пето–Уилкоксона, статистическая обработка данных осуществлялась с использованием программы STATISTICA 10.
Результаты
В исследование включено 43 пациента в возрасте от 49 до 83 лет (медиана – 67 лет). 26 (60 %) пациентов имели в анамнезе терапию 177Lu-ПСМА-617, 17 (40 %) – ПСМА-наивные, 10 (23 %) пациентов не имели химиотерапии в анамнезе, 15 (35 %) больных имели в анамнезе только химиотерапию доцетакселом, 18 (42 %) пациентов – химиотерапию доцетакселом и кабазитакселом, 13 (30 %) пациентов – терапию радия хлоридом [223Ra], 7 (16 %) – терапию олапарибом, 3 (7 %) пациента – терапию препаратом самария, 153Sm оксабифор (табл. 1). Часть пациентов, несмотря на выявленное ранее прогрессирование, продолжали принимать ААНП (n=11, 26 %) или олапариб (n=2, 5 %), один пациент продолжал принимать абиратерона ацетат и олапариб. На протяжении исследования и после завершения терапии все пациенты получали стандартную андроген-депривационную терапию, а также в анамнезе у них была терапия ААНП.
У всех пациентов были множественные отдаленные метастазы, из них 33 (77 %) – имели метастазы в лимфатические узлы, 40 (93 %) – метастазы
Таблица 1/table 1
Характеристика пациентов, включенных в исследование, по подгруппам Characterization of patients included in the study by subgroups
|
Параметры/ Parameteres |
Все пациенты/ All patients |
А1 |
А2 |
Радия хлорид [223Ra] в анамнезе/ Radium chloride [223Ra] history |
Нет Радия хлорида [223Ra] в анамнезе/ No Radium chloride [223Ra] history |
|
Всего пациентов/ Number of patients |
43 (100 %) |
17 (40 %) |
26 (60 %) |
13 (30 %) |
30 (70 %) |
|
Возраст лет (медиана)/ Age, years (median) |
49–83 (67) |
57–83 (67) |
49–72 (68) |
62–72 (66) |
49–83 (68) |
|
ПСА нг/мл (медиана)/ PSA ng/mL (median) |
5,93–3607 (274) |
15,1–2156 (230) |
5,93–3607 (304) |
8,56–2000 (268) |
5,93–3607 (293) |
|
Только доцетаксел в анамнезе/ History of docetaxel alone |
15 (35 %) |
7 (41 %) |
8 (31 %) |
4 (31 %) |
11(37 %) |
|
Кабазитаксел в анамнезе/ History of cabazitaxel |
18 (42 %) |
6 (35 %) |
12 (46 %) |
6 (46 %) |
12 (40 %) |
|
Самария, 153Sm оксабифор в анамнезе/ 153Sm-EDTMP history |
3 (7 %) |
2 (12 %) |
1 (4 %) |
— |
3 (10 %) |
|
ААНП/ Continued therapy with androgen receptor targeted agents |
11 (26 %) |
8 (47 %) |
3 (12 %) |
5 (38 %) |
6 (20 %) |
|
Метастазы в печень/ Metastases to the liver |
5 (12 %) |
3 (18 %) |
2 (8 %) |
1 (8 %) |
4 (13 %) |
Примечание: таблица составлена авторами.
Note: created by the authors.
Лишь у 4 (9 %) пациентов к моменту включения в исследование уровень гемоглобина соответствовал норме, у 12 (28 %) пациентов на этапе скрининга была анемия II степени по шкале NCI-CTCAE v 5.0, из них двое получили переливание эритроцитарной взвеси перед включением в исследование. Тромбоцитопения отмечена у 15 (35 %) пациентов, у 1 (2 %) была тромбоцитопения II степени (63 тыс. тромбоцитов в мкл). У 6 (14 %) больных перед началом терапии была зафиксирована лейкопения, из них у 1 (2 %) – лейкопения II степени (2,73 тыс. лейкоцитов в мкл).
Пациенты получили от 1 до 6 введений 225Ас-ПСМА-617, медиана – 2 введения. На основании данных периодического контроля уровня ПСА зарегистрирован наилучший ответ на терапию в виде наименьшего после начала лечения показателя уровня ПСА. На рис. 1 представлены данные
42 пациентов, не включены данные пациента с исходно низким уровнем ПСА.
Два пациента, включенных в исследование, сдали анализ на ПСА только один раз (перед первым введением), клинически эффект в этих случаях расценен как прогрессирование из-за ухудшения общего состояния и усиления симптомов заболевания. У 23 (55 %) пациентов зарегистрировано снижение уровня ПСА более чем на 50 % от исходного, у 5 (12 %) пациентов зарегистрировано биохимическое прогрессирование заболевания (рост уровня ПСА на 25 % и более) или клиническое прогрессирование, снижение уровня ПСА
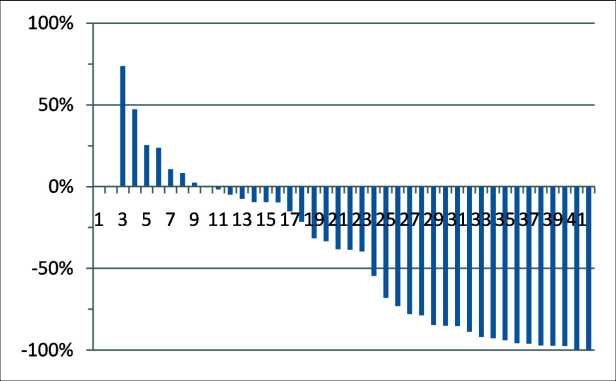
Рис. 1. Наилучший ПСА ответ на терапию 225Ас-ПСМА-617. Примечание: рисунок выполнен авторами
Fig. 1. Best PSA response to 225Ас-PSMA-617 therapy.
Note: created by the authors
Таблица 2/table 2
Исходы терапии 225Ас-ПСМА-617 в зависимости от наличия терапии 177lu-ПСМА-617 в анамнезе Outcomes of 225ac-PsMa-617 therapy depending on the presence of a history of 177lu-PsMa-617 therapy
|
Параметры/Parameteres |
А1 |
А2 |
Все/All |
|
Всего человек/Total persons |
17 (40 %) |
26 (60 %) |
43 (100 %) |
|
Динамическое наблюдение/Follow-up |
5 (29 %) |
1 (4 %) |
6 (12 %) |
|
Стабилизация/Stabilization |
1 (6 %) |
– |
1(2 %) |
|
Анемия, тромбоцитопения/Anemia, thrombocytopenia |
– |
8 (31 %) |
8 (19 %) |
|
Прогрессирование/Progression |
11 (65 %) |
17 (65 %) |
28 (65 %) |
|
Химиотерапия/Chemotherapy |
3 (12 %) |
1 (6 %) |
4 (9 %) |
|
Радия хлорид [223Ra]/Radium chloride [223Ra] |
1 (6 %) |
1 (4 %) |
2 (5 %) |
Примечание: таблица составлена авторами.
Note: created by the authors.
любой степени зарегистрировано у 33 (79 %) больных. Выявлено существенное различие между пациентами, у которых ранее была РЛТ препаратом 177Lu-ПСМА-617 (группа А2), и теми, у которых не было РЛТ в анамнезе (группа А1). В группе А1 снижение уровня ПСА более 50 % зарегистрировано у 10 (63 %) пациентов, прогрессирование (клинически) – у 1 (6 %) пациента. В группе А2 биохимический ответ наблюдался только у 9 (35 %) пациентов, рост уровня ПСА на 25 % и более, а также клиническое прогрессирование – у 4 (15 %) пациентов.
Для более полной оценки нами проанализированы отдаленные результаты терапии 225Ас-ПСМА-617. В табл. 2 обобщены результаты терапии 43 пациентов с мКРРПЖ, которые начали лечение в
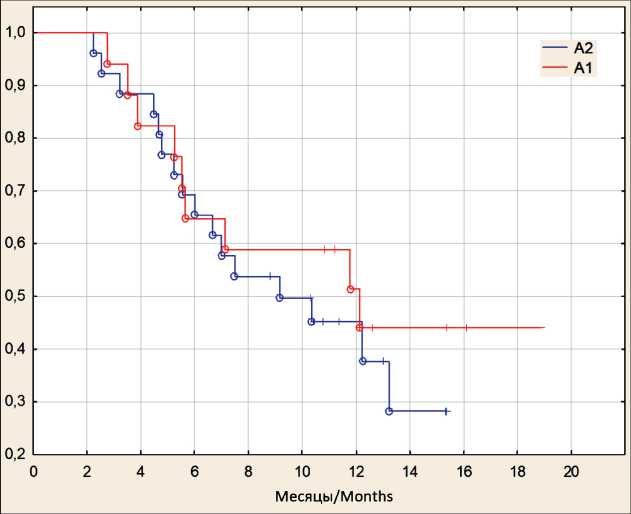
Рис. 2. ОВ пациентов в зависимости от наличия терапии 177Lu-ПСМА-617 в анамнезе. Примечания:
А1 – ПСМА-наивные пациенты; А2 – пациенты с РЛТ 177Lu-ПСМА в анамнезе (○ – завершенные события, + – цензурированные события); рисунок выполнен авторами Fig. 2. OS of patients according to the presence of 177Lu-PSMA-617 therapy history. Notes: A1 – PSMA naive patients, A2 – patients with a history of 177Lu-PSMA RLT (○ – complete responders, + – censored events); created by the authors
2023 г. и получили от 1 до 6 введений 225Ас-ПСМА-617. Количество благоприятных ответов в виде стойкого снижения уровня ПСА (более 3 мес) до 2 нг/мл и менее значимо выше в группе ПСМА-наивных пациентов – 29 vs 4 %. Во всех случаях для достижения стойкого ответа понадобилось от двух до четырех введений 225Ас-ПСМА-617 (в группе А1 – 2–4 введения, в группе А2 – 4 введения). По нашим наблюдениям, в случае, если целевой уровень ПСА не был достигнут после 4-го введения, то в дальнейшем у всех пациентов регистрировалось прогрессирование заболевания после 5-го или 6-го введения. Таким образом, вопрос о необходимости 7-го введения не обсуждался. Пациент с исходно низким уровнем ПСА получил 2 введения 225Ас-ПСМА-617 без какого-либо структурного или клинического ответа, несмотря на проводимую терапию у него сохранялся выраженный болевой синдром на фоне приема наркотических анальгетиков. Так как после РЛТ улучшения не было, пациент перешел на терапию радия хлоридом [223Ra], от которой ранее отказывался, и получил все 6 введений без гематологических нежелательных явлений, но и без существенного ответа на терапию. Данный случай расценен как стабилизация.
К негативным исходам РЛТ относятся развитие панцитопении и прогрессирование, важно, что в результате прогрессирования у большинства пациентов в терминальной стадии заболевания развиваются анемия и тромбоцитопения, требующие переливания компонентов крови и резистентные к какой-либо терапии. Дифференцировать анемию и тромбоцитопению, возникшую вследствие облучения и цитотоксического воздействия на костный мозг, и панцитопению, возникшую вследствие прогрессирования основного заболевания, затруднительно. В нашем исследовании к анемии и тромбоцитопении мы относили те случаи, при которых отказ от продолжения терапии был связан с неудовлетворительными показателями крови. Это состояние было зафиксировано у 8 (19 %) из 43 пациентов, все они были в группе А2 (31 %).
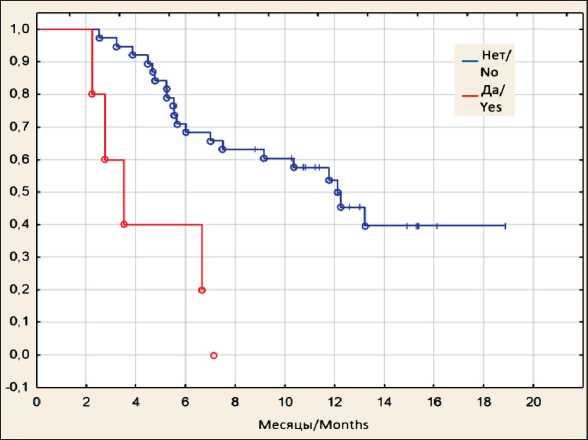
Рис. 3. ОВ пациентов, получивших терапию 225Ас-ПСМА-617, в зависимости от наличия метастатического поражения печени (○ – завершенные события, + – цензурированные события). Примечание: рисунок выполнен авторами Fig. 3. OS of patients treated with 225Ас-PSMA-617 depending on the presence of metastatic liver lesions (○ – complete responders, + – censored events). Note: created by the authors
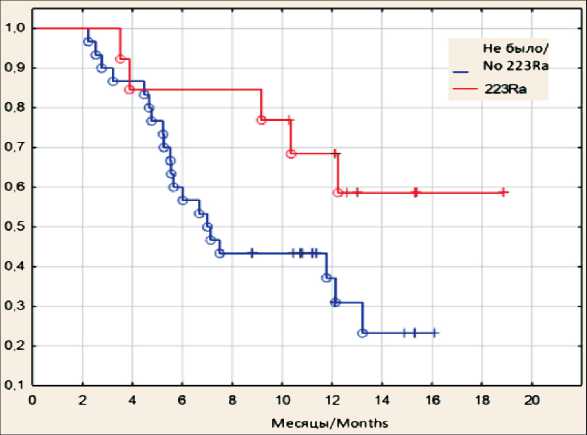
Рис. 4. ОВ пациентов, получивших терапию 225Ас-ПСМА-617, в зависимости от наличия терапии радия хлоридом [223Ra] в анамнезе (○ – завершенные события, + – цензурированные события). Примечание: рисунок выполнен авторами
Fig. 4. OS of patients who received 225Ас-PCMA-617 therapy depending on the presence of a history of radium chloride [223Ra] therapy (○ – complete responders, + – censored events).
Note: created by the authors
Прогрессирование заболевания в исходе РЛТ зафиксировано у 11 пациентов из группы А1 и у 17 пациентов из группы А2, что составляет 65 % в обеих группах.
Нами проанализирована общая выживаемость (ОВ) пациентов, получивших 225Ас-ПСМА-617 в 2023 г. (рис. 2). К сентябрю 2024 г. умерло 25 (58 %), 25 перцентиль – 5,25 мес, медиана выживаемости – 10,7 мес, в группе А1 умерло 9 (53 %), в группе А2 – 16 (62 %) больных. К настоящему времени, несмотря на впечатляющие различия в количестве биохимических ответов и количестве пациентов, достигших стойкого снижения уровня ПСА, статистической разницы по ОВ между этими группами не выявлено. Также не выявлено значимых различий между ОВ пациентов в зависимости от наличия предшествующей химиотерапии в анамнезе и наличия продолжающейся терапии антиандрогенами нового поколения на фоне РЛТ.
Метастатическое поражение печени оказалось мощным фактором неблагоприятного прогноза, к моменту анализа данных все пациенты с метастазами в печень умерли, при этом у них медиана выживаемости оказалась менее 4 мес от начала терапии. Показатели ОВ больных с метастазами в печень представлены на рис. 3.
Показано, что наличие терапии радия хлоридом [223Ra] в анамнезе является фактором благоприятного прогноза, медиана выживаемости в этой подгруппе пациентов не достигнута, 62 % пациентов живы к моменту проведения анализа (рис. 4). При этом у 1 (8 %) из 13 пациентов с терапией радия хлоридом [223Ra] в анамнезе на момент включения в исследование было метастатическое поражение печени.
Обсуждение
Данные, полученные в процессе наблюдения за относительно небольшой когортой пациентов, получивших лечение препаратом 225Ас-ПСМА-617 в 2023 г. в МРНЦ им. Цыба, во многих аспектах подтверждают результаты международных исследований [3, 4]. Мы увидели существенную разницу в соотношении количества биохимических ответов у пациентов, у которых была терапия 177Lu-ПСМА-617 в анамнезе, и ПСМА-наивных пациентов, но значимого увеличения ОВ в группе ПСМА-наивных пациентов не выявлено. Возможно, такие результаты связаны с особенностями отбора пациентов в группу для лечения 225Ас-ПСМА-617 в первой линии терапии. В эту группу пациенты могли попасть случайно, по причине недоступности 177Lu-ПСМА, а также в результате решения врача о целесообразности назначения более мощного РФЛП в первой линии терапии в связи с сомнениями по поводу эффективности 177Lu-ПСМА-617 и/или наличия относительных противопоказаний к терапии 177Lu-ПСМА, таких как массивное диффузное поражение скелета, наличие неконтролируемой анемии и др. Исследование выявило потребность прямого сравнения эффективности 177Lu-ПСМА-617 и 225Ас-ПСМА-617, которое можно реализовать в рамках проспективного рандомизированного исследования.
В нашей работе не было подтверждено преимущество в общей выживаемости пациентов, не получавших ранее химиотерапию таксанами, что может быть связано с тем, что большая часть этих пациентов на момент включения в исследование имела противопоказания к химиотерапии. Также нами не установлено преимуществ от продолже- ния терапии ААНП после старта терапии 225Ас-ПСМА-617, что дает основания для их отмены. Неудовлетворительные результаты РЛТ больных с метастатическим поражением печени, в целом, совпадают с данными международных исследований [3, 4]. Известно, что метастатическое поражение печени является наиболее агрессивной формой прогрессирования рака предстательной железы [7]. С другой стороны, подобные результаты требуют совершенствования критериев отбора пациентов для РЛТ, разработки других прогностических критериев, что возможно только при увеличении выборки.
Наиболее впечатляющие результаты получены в отношении наличия терапии радия хлоридом [223Ra] в анамнезе. С одной стороны, это может быть связано с неблагоприятным течением заболевания у пациентов, которые изначально не могли подходить для терапии радия хлоридом [223Ra], с другой стороны, нельзя исключать аддитивное действие двух методов радионуклидной терапии альфа-эмиттерами. Следует с осторожностью относиться к этим выводам, наши данные свидетельствуют лишь о том, что предшествующая терапия радия хлоридом [223Ra] является фактором благо- приятного прогноза, но данных о преимуществе того или иного РФЛП для пациента, который имеет показания и для терапии радия хлоридом [223Ra], и для РЛТ, нет. На данный момент достоверно известно, что предшествующая терапия радия хлоридом [223Ra] не увеличивает количество нежелательных явлений последующей РЛТ [8], а в условиях дефицита РЛТ и доступности радия хлорида [223Ra] в настоящее время адекватной тактикой является назначение радия хлорида [223Ra] до РЛТ.
Заключение
На сегодняшний момент терапия 225Ас-ПСМА-617 может быть рассмотрена как терапия второй линии РЛТ после терапии 177Lu-ПСМА, а также в случаях, когда терапия 177Lu-ПСМА-617 недоступна или противопоказана. В случаях, когда пациент подходит одновременно и для терапии радия хлоридом [223Ra], и для РЛТ, препаратом выбора остается радия хлорид [223Ra], так как это препарат с доказанной эффективностью, зарегистрирован в РФ. Он не ухудшает переносимость РЛТ в последующем, а также может явиться фактором благоприятного прогноза при последующей терапии 225Ас-ПСМА-617.
Список литературы Результаты терапии 225АС-ПСМА-617 больных метастатическим кастрационно-резистентным раком предстательной железы
- Sartor O., de Bono J., Chi K.N., Fizazi K., Herrmann K., Rahbar K., Tagawa S.T., Nordquist L.T., Vaishampayan N., El-Haddad G., Park C.H., Beer T.M., Armour A., Pérez-Contreras W.J., DeSilvio M., Kpamegan E., Gericke G., Messmann R.A., Morris M.J., Krause B.J.; VISION Investigators. Lutetium-177-PSMA-617 for Metastatic Castration-Resistant Prostate Cancer. N Engl J Med. 2021; 385(12): 1091-1103. DOI: 10.1056/NEJMoa2107322 EDN: LXVQCR
- Kratochwil C., Bruchertseifer F., Rathke H., Bronzel M., Apostolidis C., Weichert W., Haberkorn U., Giesel F.L., Morgenstern A. Targeted α-Therapy of Metastatic Castration-Resistant Prostate Cancer with 225AcPSMA-617: Dosimetry Estimate and Empiric Dose Finding. J Nucl Med. 2017; 58(10): 1624-31. DOI: 10.2967/jnumed.117.191395
- Sathekge M.M., Lawal I.O., Bal C., Bruchertseifer F., Ballal S., Cardaci G., Davis C., Eiber M., Hekimsoy T., Knoesen O., Kratochwil C., Lenzo N.P., Mahapane J., Maserumule L.C., Mdlophane A.H., Mokoala K.M.G., Ndlovu H., Pant V., Rathke H., Reed J., Sen I.B., Singh A., Sood A., Tauber R., Thakral P., Yadav M.P., Morgenstern A. Actinium225-PSMA radioligand therapy of metastatic castration-resistant prostate cancer (WARMTH Act): a multicentre, retrospective study. Lancet Oncol. 2024; 25(2): 175-83. DOI: 10.1016/S1470-2045(23)00638-1 EDN: YSDIXM
- Dai Y.H., Chen P.H., Lee D.J., Andrade G., Vallis K.A. A MetaAnalysis and Meta-Regression of the Efficacy, Toxicity, and Quality of Life Outcomes Following Prostate-Specific Membrane Antigen Radioligand Therapy Utilising Lutetium-177 and Actinium-225 in Metastatic Prostate Cancer. Eur Urol. 2024. DOI: 10.1016/j.eururo.2024.09.020
- Майстренко Д.Н., Станжевский А.А., Важенина Д.А., Одинцова М.В., Попов С.А., Номоконова В.Б., Чипига Л.А., Сапрыкин К.А., Громов А.В., Васильев С.К. Радиолигандная терапия препаратами на основе радионуклида 225Ас: опыт Российского научного центра радиологии и хирургических технологий имени академика А.М. Гранова. Лучевая диагностика и терапия. 2022; 13(4): 86-94. DOI: 10.22328/2079-5343-2022-13-4-86-94
- Кочетова Т.Ю., Крылов В.В., Сигов М.А., Рипп В.О., Шуринов А.Ю., Васильев К.Г., Легкодимова Н.С., Иванов С.А., Каприн А.Д. Пилотное исследование безопасности трех возрастающих активностей 225АсПСМА для лечения метастатического кастрационно-резистентного рака предстательной железы. Онкологический журнал: лучевая диагностика, лучевая терапия. 2024; 7(1): 30-40. DOI: 10.37174/2587-7593-2024-7-1-30-40 EDN: PCDSSE
- Shiner A., Sperandio R.C., Naimi M., Emmenegger U. Prostate Cancer Liver Metastasis: An Ominous Metastatic Site in Need of Distinct Management Strategies. J Clin Med. 2024; 13(3): 734. 10.3390/ jcm13030734. DOI: 10.3390/jcm13030734 EDN: ACTHLY
- Rahbar K., Essler M., Eiber M., la Fougère C., Prasad V., Fendler W.P., Rassek P., Hasa E., Dittmann H., Bundschuh R.A., Pabst K.M., Kurtinecz M., Schmall A., Verholen F., Sartor O. 177Lu-Prostate-Specific Membrane Antigen Therapy in Patients with Metastatic Castration Resistant Prostate Cancer and Prior 223Ra (RALU Study). J Nucl Med. 2023; 64(12): 1925-31. DOI: 10.2967/jnumed.123.266125 EDN: XBTAWQ


