Результаты управляемой регенерации тканей в хирургии синдрома диабетической стопы
Автор: Корейба К.А., Минабутдинов А.Р., Кривощеков Е.П., Лысов Н.А., Рахимов Б.М., Хорошилов М.Ю.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 4 т.14, 2024 года.
Бесплатный доступ
Актуальность. Проблема регенерации тканей при синдроме диабетической стопы приобрела в настоящее время особую актуальность в связи с многополярностью механизмов возникновения трофических расстройств, их склонностью к рецидивам, расширению зон поражения при применении традиционных методов лечения, устойчивости к медикаментозным методам лечения, ухудшению уровня жизни пациентов, а также из-за значительной затраты времени и усилий, необходимых для лечения. Все эти факторы приводят к значительным экономическим расходам в курации пациентов данной когорты.Цель исследования: разработка новых комбинированных методов хирургического лечения дефектов тканей у пациентов с осложненными формами синдрома диабетической стопы.Материалы и методы. В работе представлен оригинальный подход к решению одной из актуальных проблем современной хирургии осложнений сахарного диабета, к лечению патологических процессов мягких тканей нижних конечностей.Выводы. На этапах всего периода исследования зарегистрировано быстрое заживление ран независимо от исходных клинических данных и анамнеза болезни пациентов. Также наблюдалось уменьшение воспалительной реакции и активное восстановление повреждённых тканей.
Синдром диабетической стопы, диабет, раны, биопластические материалы
Короткий адрес: https://sciup.org/143183538
IDR: 143183538 | УДК: 617.586-002.4-06:616.379-008.64]-089.844 | DOI: 10.20340/vmi-rvz.2024.4.CLIN.5
Текст научной статьи Результаты управляемой регенерации тканей в хирургии синдрома диабетической стопы
Keywors: diabetic foot syndrome, diabetes, wounds, bioplastic materials.
Competing interests. The authors declare no competing interests. Lysov N.A. is the deputy editor-in-chief of the journal and did not participate in the decision to publish the work.
Funding. This research received no external funding.
Compliance with ethical principles. The authors confirm that they respect the rights of the people participated in the study, including obtaining informed consent when it is necessary.
Cite as: Koreyba K.A., Minabutdinov A.R., Krivoshchekov E.P., Lysov N.A., Rakhimov B.M., Khoroshilov M.Yu. Results of Controlled tissue regeneration in surgery for diabetic foot syndrome. Bulletin of the Medical Institute “REAVIZ”: Rehabilitation, Doctor and Health. 2024;14(4):51–59.

Актуальность
Отличительные признаки сахарного диабета (СД) в настоящее время – это широкое распространение, продолжительное течение и частое развитие осложнений [1]. Одним из серьёзных осложнений сахарного диабета является синдром диабетической стопы (СДС). У больных сахарным диабетом заживление гнойных ран характеризуется вялым течением раневого процесса, что связано с нарушением всех видов обмена. Стенотический характер поражения сосудов у этих пациентов и патологическое тромбообразование в микроциркуляторном русле также приводят к увеличению зоны некрозов на стопе. Визуальные границы повреждения тканей в области стопы, как правило, не соответствуют истинному распространению гнойного процесса. Неэффективное удаление раневого экссудата в послеоперационном периоде и дальнейшее отсутствие благоприятных условий в ране стопы не даёт ожидаемого положительного результата [2]. Хирургическое лечение гнойно-некротических осложнений синдрома диабетической стопы остаётся очень трудоёмким и затратным процессом. И, несмотря на успехи развития современной медицины, по-прежнему, на пациентов с синдромом диабетической стопы приходится 40–60% всех ампутаций нижних конечностей нетравматического характера. Летальность от гнойных осложнений при синдроме диабетической стопы составляет от 6 до 22% [3]. Поэтому хирургам приходится искать новые и эффективные подходы к лечению данной категории пациентов.
Одной из основных причин утраты трудоспособности, а зачастую и смертности среди пациентов с сахарным диабетом являются поздние осложнения этого заболевания [1]. Одним из наиболее сложных с позиции курации и купирование клинических проявлений поздних проявлений сахарного диабета, особенно 2 типа, является синдром диабетической стопы с развитием язвенных дефектов [2, 3, 4].
Язвенные процессы на нижних конечностях возникают примерно у четверти пациентов с синдромом диабетической стопы [5–7]. Более чем в 80% проявлений язвенный дефект стоп при синдроме диабетической стопы приводит к ампутации. При этом состояние пациентов после метатарзальной ампутации стопы (при условии активизации пациента и использовании специальной обуви) оценивается выше, чем у пациентов с открытыми раневыми и/или язвенными дефектами.
Раневой процесс при сахарном диабете отличается хроническим течением, трудностью верификации стадий, полиморфизмом дефектов, и, как следствие, высокой стоимостью лечения [2, 3, 8, 9].
Фактор, который является ключевым и определяющим в исходе леченияот появления язвы до её адекватного закрытия – это время. Чем меньше времени затрачено на купирование воспалительных процессов и регенеративно-пролиферативные процессы с исходом в заживление дефекта, тем меньшей опасности мы подвергаем жизнь пациента.
Как известно, стандартные методы лечения синдрома диабетической стопы зачастую не всегда позволяют добиться желаемого результата и предотвратить ампутацию поражённой конечности. Поэтому продолжается поиск «новых» подходов к лечению, в том числе и с использованием современных биопла-стических материалов/биоинженерных конструкций в составе комбинированного хирургического лечения на фоне медикаментозной поддержки.
Материалы и методы
Исследование включало 98 человек с гнойнонекротическими осложнениями СДС и проводилось на клинических базах кафедры хирургических болезней Казанского ГМУ и кафедры хирургии с курсом сердечно-сосудистой хирургии ИПО Самарского ГМУ. Большинство анализируемых пациентов были с III-V стадией гнойно-некротического процесса по Wagner F.W. (1981 г.). Пациенты во всех группах были сопоставимы по полу, возрасту, объёму гнойно-некротического процесса и сопутствующей патологии. Женщин было большинство – 86 (87,8%), мужчин – 12 (12,2%). Средний возраст пациентов составил 58 ± 2,5 года.
Всем пациентам было проведено УЗДГ сосудов нижних конечностей, а при выявлении критической ишемии выполнялась рентгено-контрастная ангиография.
После выполнения адекватного оперативного вмешательства на стопе с тщательной некрэктоми-ей, вскрытием и санацией гнойного очага по поводу гнойно-некротического процесса пациентам назначалось базисное медикаментозное лечение: антибактериальная терапия, коррекция гипергликемии путём перевода пациентов на инсулины, применение пентоксифиллина, препаратов α -липоевой кислоты, витаминов группы В, сеансы гипербарической оксигенации [4, 5].
Рациональная антибактериальная терапия – это одно из основных звеньев в цепочке успешного лечения гнойного процесса любой локализации [6]. Она включала: цефотаксим или цефтриаксон, метронидазол и моксифлоксацин. Для закрытия дефектов и стимуляции репаративно-пролиферативных процессов нами применялись биопластические материалы. Характеристики биопластических конструкций, которые используются в клинической практике и влияющие на их выбор должны соответствовать следующим требованиям:
-
1. Иметь макромолекулярную структуру с заданным периодом биодеградации, осуществляемым
-
2. Включать конечные и промежуточно-этапные элементы деструкции в естественные циклы биохимических обменных процессов.
-
3. Соответствовать по временной составляющей определенному периоду биодеградации материала и длительности собственнорепаративного процесса.
естественными метаболическими путями, без возникновения иммуновоспалительных процессов.
На основе сочетания определённых морфологических, функциональных и технологических признаков все биопластические материалы разделяются на две группы: матрично-пластические и матрично-целлюлярные [10]. Представляющие первую группу материалы наиболее распространены при применении в практической хирургии. Они обладают свойствами «биодеградируемых раневых покрытий с функциональными свойствами».
Используемый нами биопластический материал представляет собой полимер, состоящий на 90% из гиалуроновой кислоты и на 10% — из коллагена, имеет форму пластины с перфорационными отверстиями, нанесёнными при его производстве. Форма пластины овальная. Легко моделируется по форме раневого дефекта и имеет высокую степень адгезии [10–12]. Гиалуроновая кислота способствует восстановлению клеточных слоёв дефекта тканей и придаёт материалу оптимальные гидрофильные свойства.
Составляющая структура материала обеспечивает его поэтапный управляемый лизис тканевыми биологическими катализаторами. Это позволяет биоматериалу управляемо-длительно находиться на поверхности дефекта, создавая оптимальную внеклеточную микросреду для целенаправленной миграции клеток (фибробластов) и пролиферации покровных тканей. Под покровом биопластического материала происходит формирование регенерата и эпителизация раны.
Всем пациентам проводилось идентичное общее консервативное лечение, которое включало: ангиопротекторы; антиоксиданты, препараты производные янтарной кислоты; НПВС при болевом синдроме в сочетании с миорелаксантами центрального действия и/или габапентинами при судорожном синдроме; витамины группы В; дезагреганты; антикоагулянты; антибактериальная терапия назначалась с учётом бактериологической оценки дефектов с первоначальными ультракороткими ударными курсами [13, 14].
Интраоперационно производился дебридмент раневого дефекта путём ультразвуковой гидрохирургической обработки до состояния «кровяной росы» дна и стенок раневого дефекта. После этого производилась аппликация описанного выше биоматериала на раневую поверхность по существующей методике с учётом плотного прилегания к эле- ментам дефекта тканей [7, 10, 15]. Введение аутологичных факторов роста по разработанной нами оригинальной методике производилась трансбиоматериально точечно в так называемом шахматном порядке. При введение обязательно избегали вспучивания биоматериала. Материал с заданным периодом биодеградации остаётся на ране до полной биодеструкции на фоне применения интерактивных повязок.
Одним из основных свойств данного биоматериала, как было указано, является его управляемая биологическая деструкция. Надо отметить, что она напрямую коррелирует с условиями кровообращения и иннервацией тканей при наличии условий «moistwoundhealing» (заживления раны во влажной среде/влажного заживления ран).
Результаты
При оценке изменений объёма/площади дефектов при визитах контроля наблюдения (0, 7, 14, 28 и 40 сутки) было отмечено статистически значимое снижение показателя на каждом этапе (p < 0,001). Во время 2-го и 3–го визитов после наложения биоматериала и введения АФР (аутологические факторы роста) объём раны визуально сократился у всех пациентов.
Во время 4-го визита уменьшение показателя отмечалось у 24 (92,3%) человек. У одного пациента динамика отсутствовала в связи с регенерацией ран ещё на 14-й день наблюдения. У одного пациента объём раны увеличился с 1,4 см³ до 1,41 см³ (на 3,8%).
Относительная скорости заживления раны (RSH) определялась по формуле: RSH = (1 – S1/S0)·100%, где S1 – площадь язвы на день контроля (визита) после имплантации биоматериала, S0 – первоначальная площадь дефекта, определённая для каждого этапа наблюдения. Результаты анализа показали следующее: наименьшее значение медианы RSH отмечалось в первую неделю – 24,13%; наибольшее её значение определено на этапе 4-го визита – 28,32%.
За весь период наблюдения (40 дней) была установлена медиана показателя RSH, равная 63,03 %.
Кроме оценки скорости заживления раны нами было проведено изучение выраженности болевого синдрома в области стоп при каждом визите наблюдения согласно визуальной аналоговой шкале боли (ВАШ). Отмечено следующее изменение показателей:
-
«0 –1 балл» на начало исследования – 19,2 %, к 28 дню наблюдения – 84,6 %;
-
«2 –3 балла» на начало исследования – 46,2 %, к 28 дню наблюдения – 15,4 %;
-
«4 –5 балла» на начало исследования – 34,6 %, к 28 дню наблюдения – 0 %.
Для демонстрации эффективности использованного метода приведём следующие клинические примеры.
Клинический пример 1
Пациент Ш., 1970 г.р., мужчина, госпитализирован с жалобами на боли в нижних конечностях, усиливающиеся по ночам, судороги, онемение, жжение; безболевая ходьба до 200 м. Дефект тканей правой стопы, отёк правой стопы.
Anamnesis vitae: СД 2 типа 5 лет. Инсулин «+» с 2022 года (инсулинотерапия: инсулин пролонгированного действия 14-14 ед., инсулин короткого действия 8-6-6). Ретинопатия (офтальмолог 2023).
Операции в анамнезе: Некрэктомия правой стопы (2023).
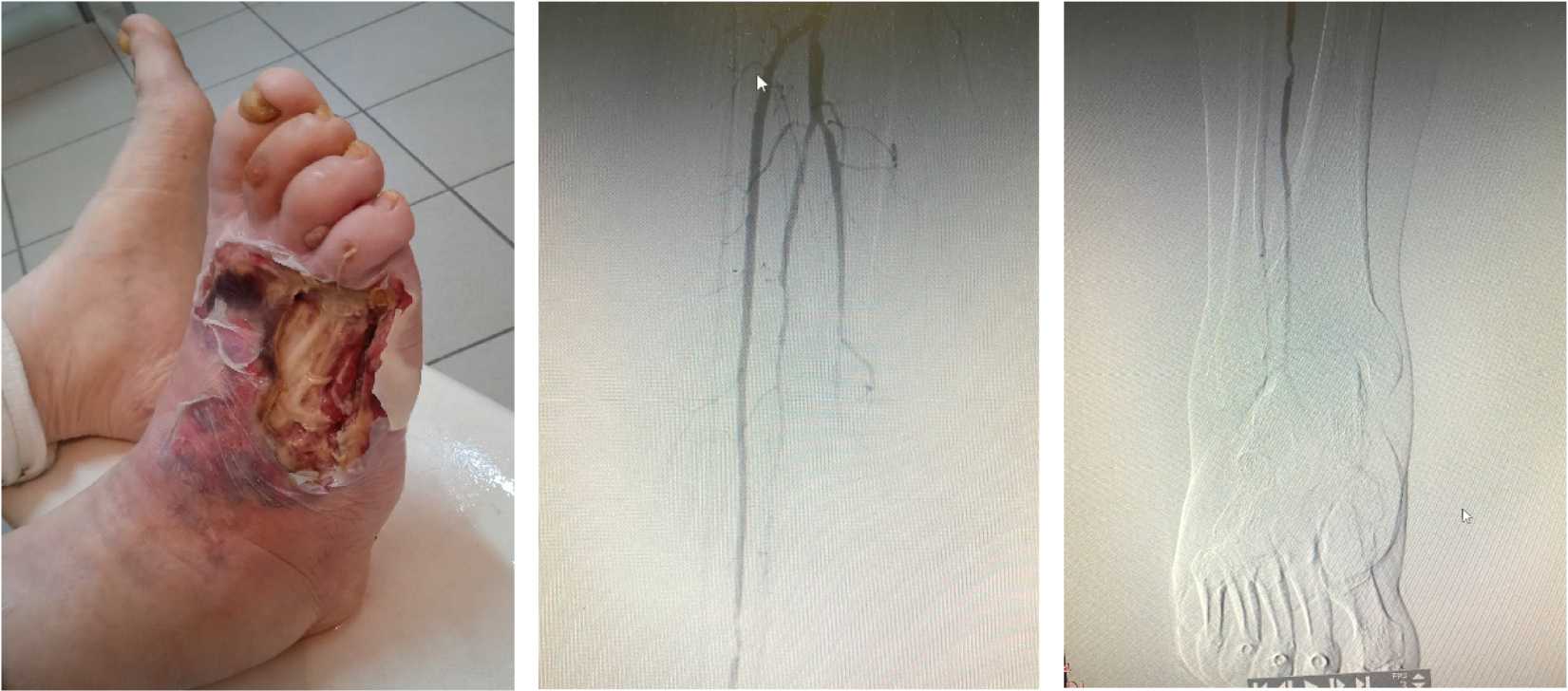
Анамнез заболевания: Отмечает обострение заболевания в течение 2 месяцев. Лечился амбулаторно и стационарно по месту жительства. Эффект отрицательный – усиление болевого синдрома, увеличение зоны дефекта на правой стопе (рис. 1).
Пациенту был выставлен следующий диагноз.
Основной диагноз: СДС (W3) справа, нейроише-мическая форма. Состояние после некрэктомии правой стопы. ДПН, сенсомоторная и вегетативная форма, выраженная. Диабетическая ангиопатия. ХАН 4 справа и 2Б слева. ДНОАП, неактивная стадия, фаза 1. Склероз Менкеберга. Вторичная ХЛВН 2 (С4).
Сопутствующий диагноз: Диабетическая ретинопатия. Нефропатия, ХБП С2 (СКФ по CKD-EPI 74,1 мл/мин/1,73 м2). Сахарный диабет 2 типа, инсулин-потребный, субкомпенсированный, средней тяжести. HbA1c <7,05. ГБ 2 ст. Риск 4. ХСН 1. ФК 2.
Пациенту был начат курс консервативной терапии. Консультирован рентгенэндоваскулярным хирургом. Переведён в отделение сосудистой хирургии. Результаты ангиографии представлены на рисунке 2.
Произведена артериальная реконструкция артерий правой нижней конечности – рентгенэндоваску-лярная вазодилятация (рис. 3).
В послеоперационном периоде развился реперфузионный синдром. Пациент был повторно госпитализирован в гнойное хирургическое отделение для продолжения лечения.
А Б
Рисунок 2. Ангиография артерий правой голени (А) и стопы (Б) пациента Ш. Тотально-субтотальная окклюзия артерий голени. Артерии стопы не визуализируются
Figure 2. Angiography of the right lower leg (A) and foot (B) arteries of patient Sh. Totalsubtotal occlusion of the lower leg arteries. The arteries of the foot are not visualized
Рисунок 1. Состояние правой стопы пациента Ш. при поступлении. Дефект тканей правой стопы с поражением глубоких структур. Отечный синдром. Полиморфизм тканей дефекта
Figure 1. The condition of the right foot of patient Sh. upon admission. Tissue defect of the right foot with damage to deep structures. Edema syndrome. Polymorphism of defect tissues
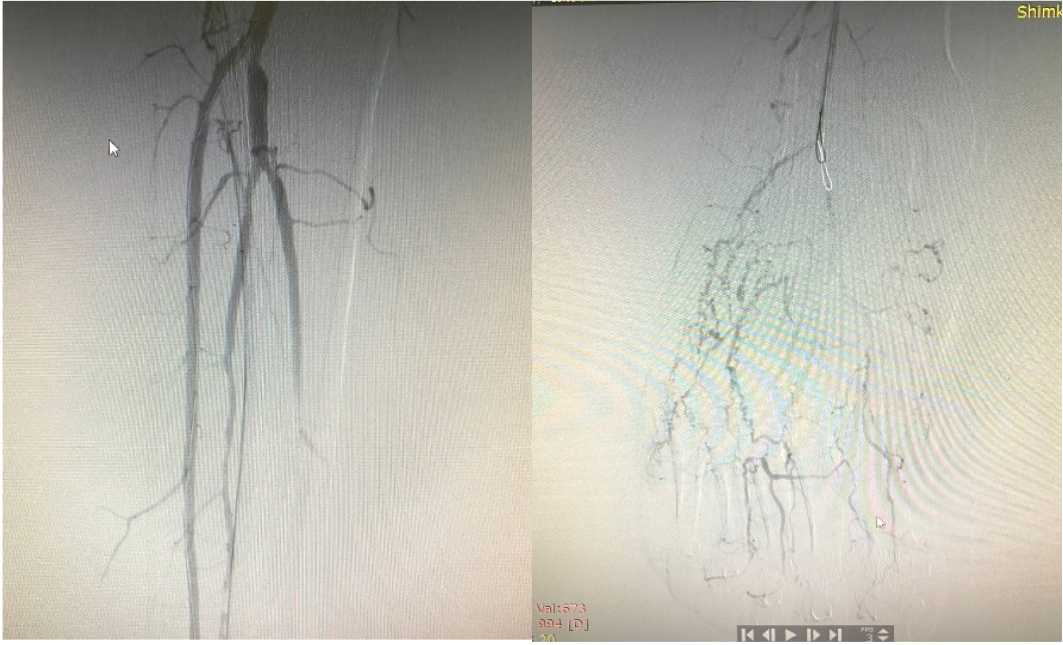
А
Б
Рисунок 3. Ангиография артерий правой голени (А) и стопы (Б) пациента Ш. после артериальной реконструкции. Определяется кровоток в артериях правой стопы
Figure 3. Angiography of the right lower leg (A) and foot (Б) arteries of patient Sh. after arterial reconstruction. Blood flow in the arteries of the right foot is determined
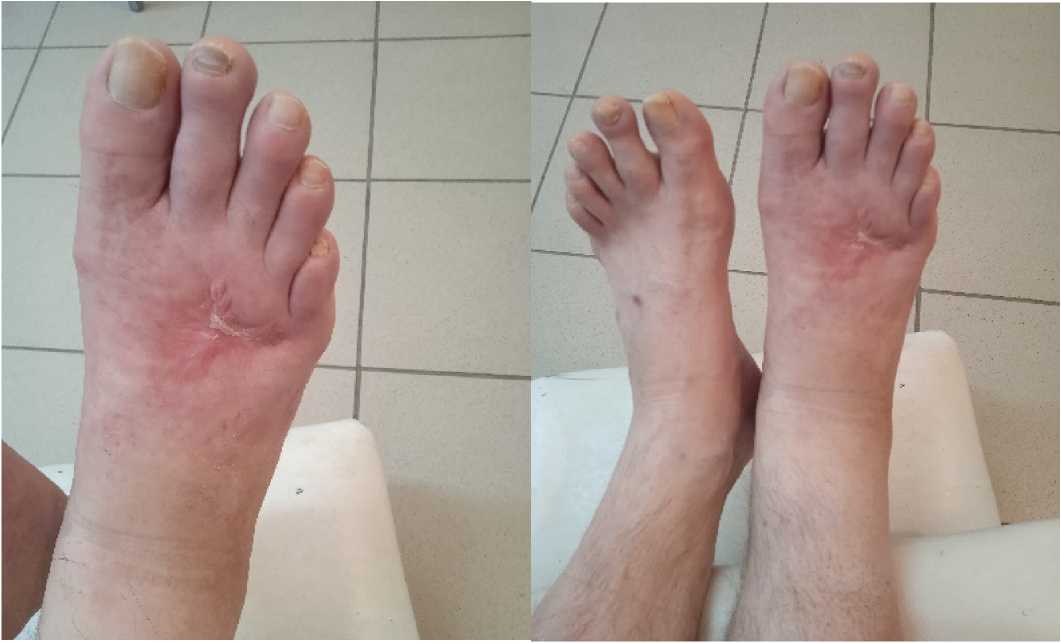
Рисунок 4. Состояние правой стопы пациента Ш. через 28 дней от начала лечения. Отмечается эпителизация дефекта правой стопы
Figure 4. The condition of the right foot of patient Sh. 28 days after the start of treatment. Epithelialization of the defect of the right foot is noted
При поступлении в гнойное хирургическое отделение был выставлен следующий диагноз.
Основной диагноз: СДС (W3) справа, нейроишемическая форма. Состояние после некрэктомии правой стопы. ДПН, сенсомоторная и вегетативная форма, умеренно выраженная. Диабетическая ангиопатия. ХАН 4 справа и 2Б слева. Состояние после РЭД справа. Реперфузионный синдром. ДНОАП, неактивная стадия, фаза 1. Склероз Менкеберга. Вторичная ХЛВН 2 (С4).
Сопутствующий диагноз: Диабетическая ретинопатия. Нефропатия, ХБП С2 (СКФ по CKD-EPI 74,1 мл/мин/1,73 м2). Сахарный диабет 2 типа, инсулинпотребный, субкомпенсированный, средней тяжести. HbA1c < 7,05. ГБ 2 ст. Риск 4. ХСН 1. ФК 2.
Произведено: Ультразвуковая гидрохирургическая некрэктомия. Санация. Аппликация биоматериалов. Введение АФР.
В послеоперационном периоде – курация пациента по описанной выше методике. Осмотр через 28 дней (рис. 4).
Контрольный осмотр пациента был произведён через 6 месяцев. Рецидива выявлено не было.
Для детализации состояния тканей дефектов и верификации клеточных структур нами был применён метод цитогистологического и иммуногистохимического исследования с использованием набора моноклональных антител – МКАТ (табл. 1) [8, 11, 13, 14].
Таблица 1. Характеристика используемых моноклональных антител
Table 1. Characteristics of the used monoclonal antibodies
|
Антиген |
Клон |
Специфичность |
Рабочее разведение |
Фирма-производитель |
|
Миелопероксидаза |
поликлональные, код RB-373-A |
нейтрофильные лейкоциты |
1:800 |
Dako |
|
Виментин |
V9 |
фибробласты |
1:300 |
Lab Vision |
|
Панцитокератины |
AE1/AE3 |
эпителий |
1:300 |
Lab Vision |
|
CD 31 |
9611 |
эндотелий сосудов |
1:20 |
BioGenex |
Связывание МКАТ с клеточными элементами определяли при помощи стандартного биотин-стрептавидин-пероксидазного метода (DAKO:LSAB® + System-HRP, код K0690) с диаминобензидином в качестве хромогена. Препараты дополнительно окрашивали гематоксилином Майера и заключали в канадский бальзам или в специальные среды фирмы DAKO (Ultramount, Faramount, код S302580-2).
Первоначально (0 день) данные методы показал, что биоматериал был интактен во время аппликации и представлял собой аморфный ячеистый эозинофильный матрикс без посторонних включений. В подлежащих тканях наблюдалась очаговая или диффузная воспалительная клеточная инфильтрация, обусловленная операционной травмой, а также единичные очаги кровоизлияний.
Во второй визит наблюдения (7 сутки) определялась выраженная клеточная инфильтрация биоматериала в виде нейтрофилов, лимфоцитов, макрофагов и фибробластов. Коллагенсодержащий материал плотно прилегал к дну и стенкам язвенного дефекта. Данные получены с использованием антител к ви-ментину. Тест на пан-цитокератины дал отрицательный результат. Но, в отличие от предыдущего наблюдения, определено скопление мезенхимальных клеток на границе тканей и с биоматериалом.
Третий визит наблюдения (14 сутки) – на границе соединения тканей и биоматериала наблюдалось активное размножение фибробластов, рост коллагеновых волокон (рис. 5).
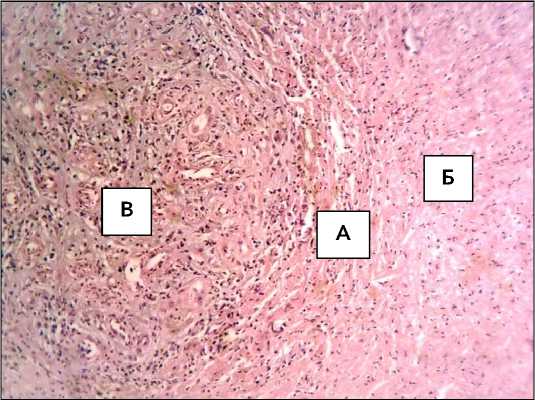
Рисунок 5. Пролиферация фибробластов и разрастание коллагеновых волокон на границе (А) биоматериала (Б) с подлежащими тканями (В). 14 сутки наблюдения. Окраска гематоксилином и эозином. Ув.х200
Figure 5. Proliferation of fibroblasts and growth of collagen fibers at the border (A) of the biomaterial (B) with the underlying tissues (C). 14 days of observation. Staining with hematoxylin and eosin. Magnification ×200
Отмечена плотная связь биопластической пленки с тканями. В пробе биоматериала (пукционная биопсия) обнаружено скудное количество нейтрофилов, единичное присутствие макрофагов и лимфоцитов; основные клетки представлены фибробластами. Реакция МКАТ на виментин положительная. Выявлены отдельные эпителиальные клетки – кератиноциты.
Клинический пример 2
Пациент Г., 65 лет, госпитализирован с жалобами на обширный дефект правой стопы и голени.
Anamnesis vitae: СД 2 типа 8 лет. Инсулин «+» 2 года (инсулин пролонгированный 26-28 ед., инсулин короткий 12-8-8).
Операции в анамнезе: Некрэктомия левой стопы.
Анамнез заболевания: около 1 месяца до обращения холодовая травма в быту правой стопы и голени. Лечился амбулаторно и стационарно по месту жительства. Результат неудовлетворительный. Местный статус: Обширный циркулярный трофический дефект правой голени, некротические изменения в тканях правой стопы, мумификация пальцев правой стопы (рис. 6).
Пациенту был выставлен диагноз: СДС (W5) справа, нейроишемическая форма. Глубокая инфицированная язва с обширной зоной поражения. ДПН, сенсомоторная и вегетативная форма, выраженная. Диабетическая ангиопатия. ХАН 2Б. ДНОАП, неактивная стадия, фаза 1. Склероз Менкеберга. ХЛВН 2 (С4). Диабетическая ретинопатия. Сахарный диабет 2 типа, инсулинпотребный, суб-компенсированный, средней тяжести. HbA1c <8,0%. ИБС. Стенокардия напряжения. ФК 2. ГБ 3 ст. Риск 4. ХСН 1. ФК 2.
Первым этапом пациенту была выполнена метатарзальная ампутация правой стопы, частичная некрэктомия, ультразвуковая гидрохирургическая обработка раневого дефекта, частичная аппликация биоматериала, введение АФР. Отмечалась положительная динамика раневого процесса на правой голени и стопе (рис. 7).
Пациенту была произведена остеонекрэктомия культи правой стопы, этапная аппаратная ультразвуковая гидрохирургическиая обработка с введением АФР, наложение системы VAC (Vacuum-assisted closure) – терапии по принципу Topical negative pressure (TNP).
На 14-е сутки был произведён демонтаж системы VAC, продолжалось ведение пациента по описанной выше методике. На 28-е сутки от начала лечения отмечалась положительная динамика раневого процесса на правой голени и стопе (рис. 8).
В дальнейшем выполнялись аппликации гистоэк-вивалентного биоматериала с имплантацией аутологических факторов роста до полной биодеструк- ции материала с последующим повторным наложением пластин. На 40-й день наблюдения за пациентом зафиксировано частичное заживление и эпите- лизация дефекта (рис. 9, 10). Следующий контрольный осмотр пациента был произведен через 6 месяцев (рис. 11). Рецидива нет.
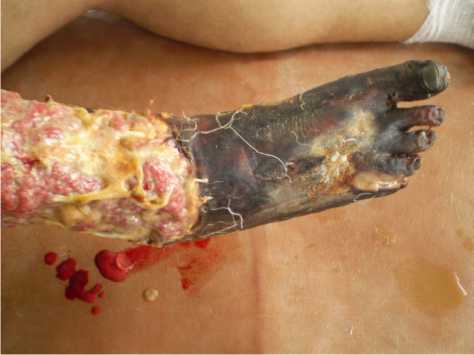
Рисунок 6. Состояние правой нижней конечности пациента Г. при поступлении. Отмечается мумификация пальцев стопы, некроз кожных покровов и мягких тканей стопы, обширная инфицированная трофическая язва правой голени
Figure 6. The condition of the right lower limb of patient G. upon admission. Mummification of the toes, necrosis of the skin and soft tissues of the foot, an extensive infected trophic ulcer of the right lower leg are noted
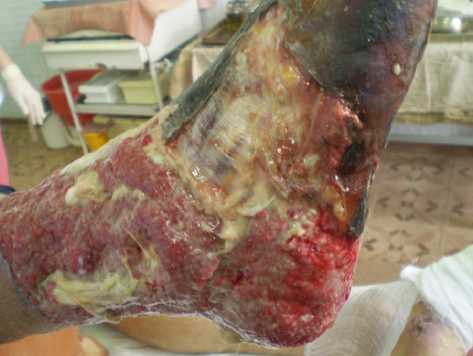
Рисунок 7. Правая нижняя конечность пациента Г. на 7-е сутки от начала лечения (2-й визит). Состояние после метатарзальной ампутации стопы, некрэктомии, ультразвуковой гидрохирургической обработки дефекта, введения АФР № 4, аппликации биоматериала № 2
Figure 7. The right lower limb of patient G. on the 7th day from the start of treatment (2nd visit). Condition after metatarsal amputation of the foot, necrectomy, ultrasonic hydrosurgical treatment of the defect, administration of AFR No. 4, application of biomaterial No. 2
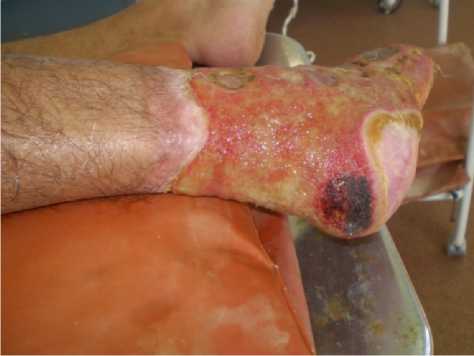
Рисунок 8. Правая нижняя конечность пациента Г. на 28-ые сутки от начала лечения (4-й визит). Вид стопы после VAC (Vacuum-assisted closure) – терапии по принципу Topical negative pressure. этапных аппаратных ультразвуковых гидрохирургических обработок, введений АФР и наложения VAC-системы
Figure 8. The right lower limb of patient G. on the 28th day from the start of treatment (4th visit). View of the foot after VAC (Vacuum-assisted closure) therapy according to the principle of Topical negative pressure. staged apparatus ultrasonic hydrosurgical treatments, AFR injections and application of the VAC system
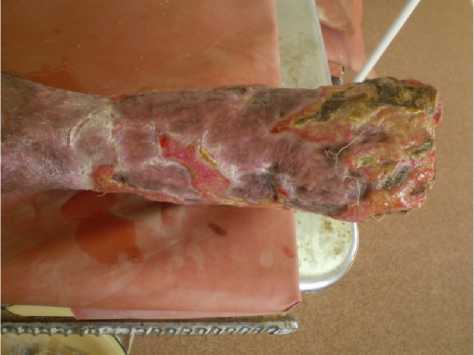
Рисунок 9. Правая нижняя конечность пациента Г. на 40-е сутки от начала лечения (5-й визит). Вид спереди. Частичное заживление и эпителизация ран
Figure 9. The right lower limb of patient G. on the 40th day from the start of treatment (5th visit). Front view. Partial healing and epithelialization of wounds
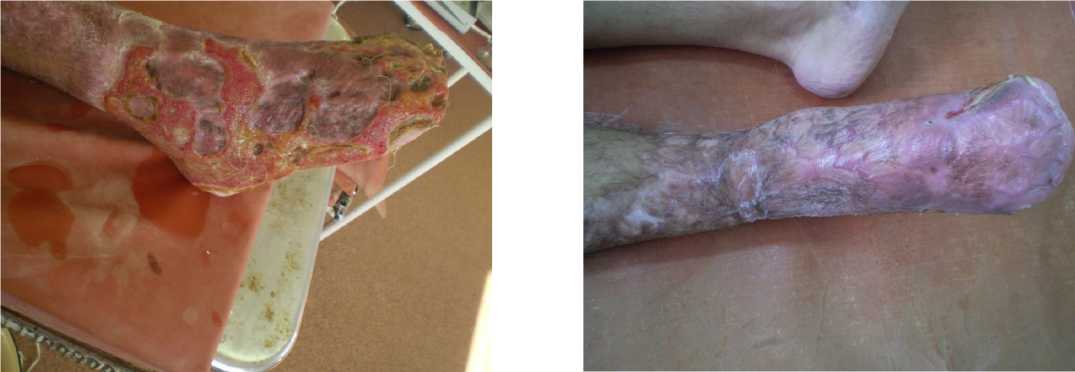
Рисунок 10. Правая нижняя конечность пациента Г. на 40-е сутки от начала лечения (5-й визит). Вид с латеральной стороны. Частичное заживление и эпителизация ран
Figure 10. The right lower limb of patient G. on the 40th day from the start of treatment (5th visit). View from the lateral side. Partial healing and epithelialization of wounds
Рисунок 11. Правая нижняя конечность пациента Г. на 60-ые сутки от начала лечения (6-й визит). Контрольный осмотр. Заживление и эпителизация ран
Figure 11. The right lower limb of patient G. on the 60th day from the start of treatment (6th visit). Follow-up examination. Healing and epithelialization of wounds
Выводы
Применение данной технологии позволило получить положительный результат у пациентов с дефектами кожи и мягких тканей при СДС. Что определялось относительной скоростью заживления и снижением интенсивности боли.
Согласно данным цитологического и иммуногистохимического исследования отмечено уменьшение воспалительной реакции и восстановление поврежденных тканей.
Наибольшее значение относительной скорости заживления при данной методике определено с 14 по 28 день наблюдения с установленной медианой данного показателя в 63,03% за весь период наблюдения (40 дней).
Таким образом, использование биоматериалов и аутологических факторов роста у пациентов с трофическими дефектами мягких тканей при синдроме диабетической стопы приводит к оптимизации течения репаративно-пролиферативных процессов и заметному снижению воспалительной реакции в поражённых тканях.
Список литературы Результаты управляемой регенерации тканей в хирургии синдрома диабетической стопы
- Дедов И.И., Шестакова М.В., Викулова О.К., Железнякова А.В., Исаков М.А., Сазонова Д.В., Мокрышева Н.Г. Сахарный диабет в Российской Федерации: динамика эпидемиологических показателей по данным Федерального регистра сахарного диабета за период 2010–2022 гг. Сахарный диабет. 2023;26(2):104-123. Dedov I.I., Shestakova M.V., Vikulova O.K., Zheleznyakova A.V., Isakov M.A., Sazonova D.V., Mokrysheva N.G. Di-abetes mellitus in the Russian Federation: dynamics of epidemiological indicators according to the Federal Register of Diabetes Mellitus for the peri-od 2010–2022. Diabetes mellitus. 2023;26(2):104–123. (In Russ). https://doi.org/10.14341/DM13035
- Ступин В.А. и др. Синдром диабетической стопы (эпидемиология, патофизиология, диагностика и лечение). М.: Литтерра, 2019:200. Stupin V.A. et al. Diabetic foot syndrome (epidemiology, pathophysiology, diagnostics and treatment). Moscow: Litterra, 2019:200. (In Russ).
- Горюнов С.В., Привиденцев А.И., Мантурова Н.Е., Ступин В.А. Факторы, влияющие на выбор органосохраняющих реконструктивно-восстановительных вмешательств у больных с синдромом диабетической стопы. Пластическая хирургия и эстетическая медицина. 2021;(2):48–55. Goryunov S.V., Prividentsev A.I., Manturova N.E., Stupin V.A. Factors influencing the choice of organ-preserving reconstructive inter-ventions in patients with diabetic foot syndrome. Plastic surgery and aesthetic medicine. 2021;(2):48–55. (In Russ). https://doi.org/10.17116/plast.hirurgia202102148
- Кузнецов А.Г., Ославский А.И. Применение регенеративных технологий в комплексном лечении синдрома диабетической стопы. Материалы республиканской с международным участием научно-практической конференции, посвященной 60-летию Гродненского государственного медицинского университета, Гродно, 28 сентября 2018 г. Гродно, 2018:445-448. Kuznetsov A.G., Oslavskiy A.I. Application of regenerative tech-nologies in the complex treatment of diabetic foot syndrome. Proceedings of the republican scientific and practical conference with international par-ticipation dedicated to the 60th anniversary of the Grodno State Medical University, Grodno, September 28, 2018. Grodno, 2018:445-448. (In Russ).
- Amin N, Doupis J. Diabetic foot disease: From the evaluation of the “foot at risk” to the novel diabetic ulcer treatment modalities. World J Diabetes. 2016;7:153. https://doi.org/10.4239/wjd.v7.i7.153
- Jeffcoate WJ, Harding KG. Diabetic foot ulcers. Lancet. 2003;361:1545–1551. https://doi.org/10.1016/S0140-6736(03)13169-8
- Кривощеков Е.П., Ельшин Е.Б., Аляпышев Г.С., Посеряев А.В. Применение биопластического материала при хронических ранах стопы на фоне сахарного диабета. Вестник медицинского института «РЕАВИЗ» (Реабилитация, Врач и Здоровье). 2021;6:61-70. Krivoshchekov E.P., Elshin E.B., Alyapyshev G.S., Poseryaev A.V. The use of histoequivalent-bioplastic material for chronic foot ulcers on patients with diabetes. Bulletin of the Medical Institute "REAVIZ" (Rehabilitation, Doctor and Health). 2021;(6):61-70. (In Russ). https://doi.org/10.20340/vmi-rvz.2021.6.CLIN.2
- Кривощеков Е.П., Пушкин С.Ю., Ельшин Е.Б., Романов В.Е., Губанова Т.А. Влияниестационарзамещающей помощи на сохранность пораженной конечности в лечении осложнений синдрома диабетической стопы. Сахарный диабет, его осложнения и хирургическая инфекция: 4 международный научно-практический конгресс. Москва, 2019:46-48. Krivoshchekov E.P., Pushkin S.Yu., Elshin E.B., Romanov V.E., Gubanova T.A. The influence of hospital-replacing care on the preservation of the affected limb in the treatment of complications of diabetic foot syndrome. Diabetes mellitus, its complications and surgical infection: 4th international scientific and practical congress. Moscow, 2019:46-48. (In Russ).
- Кривощеков Е.П., Ельшин Е.Б., Романов В.Е., Аляпышев Г.С. Выживаемость пациентов в раннем послеоперационном периоде в зависимости от причины и уровня высокой ампутации нижних конечностей. Международная научно-практическая конферекция «Высокие ампутации нижних конечностей у детей и взрослых». Сборник научных турдов международной научно-практической конференци. Москва, 2019:61. Krivoshchekov E.P., Elshin E.B., Romanov V.E., Alyapyshev G.S. Survival of patients in the early postoperative period depending on the cause and level of high amputation of the lower extremities. International scientific and practical conference "High amputations of the lower extremities in children and adults". Collection of scientific tours of the international scientific and practical conference. Moscow, 2019:61. (In Russ).
- Корейба К.А., Комаров А.Н., Минабутдинов А.Р. Современные отечественные биоматериалы «G-derm» (Джидерм) в хирургии дефектов кожи и мягких тканей. Санкт-Петербург, 2018:38. Koreyba K.A., Komarov A.N., Minabutdinov A.R. Modern domestic biomaterials "G-derm" (Dzhiderm) in surgery of skin and soft tissue defects. St. Petersburg, 2018:38. (In Russ).
- Корейба К.А., Цыплаков Д.Э. Биопластические материалы в хирургии дефектов тканей при синдроме диабетической стопы (морфологические аспекты). Инфекции в хирургии. 2018;1-2(16):78-79. Koreyba K.A., Tsyplakov D.E. Bioplastic materials in surgery of tissue defects in diabetic foot syndrome (morphological aspects). Infections in surgery. 2018;1-2(16):78-79. (In Russ).
- Кривощеков Е.П., Ельшин Е.Б., Романов В.Е., Аляпышев Г.С. Тактика лечения трофических язв при нейропатической форма синдрома диабетической стопы с применением перорального фибринолитика и биопластических материалов. Сахарный диабет, его осложнения и хирургическая инфекция: 4 международный научно-практический конгресс. Москва, 2019:44–46. Krivoshchekov E.P., Elshin E.B., Romanov V.E., Al-yapyshev G.S. Tactics of treatment of trophic ulcers in neuropathic form of diabetic foot syndrome using oral fibrinolytic and bioplastic materials. Dia-betes mellitus, its complications and surgical infection: 4th international scientific and practical congress. Moscow, 2019:44–46. (In Russ).
- Способ лечения дефектов мягких тканей у больных с синдромом диабетической стопы: пат. 2619257 Рос. Федерация: МПК51 А 61 К38/39/ К.А. Корейба, Е.А. Корейба, В.К. Корейба, Н.Ю. Башкирцева, заявитель и патентообладатель К.А. Корейба. 2016136925, 14.09.2016; опубл. 12.05.2017 Бюл. № 14. Method for treating soft tissue defects in patients with diabetic foot syndrome: patent 2619257 Russian Federation: IPC51 A 61 K38/39/ K.A. Koreyba, E.A. Koreyba, V.K. Koreyba, N.Yu. Bashkirtseva, applicant and patent holder K.A. Koreyba. 2016136925, 14.09.2016; pub-lished 12.05.2017 Bulletin No. 14. (In Russ).
- Корейба К.А., Минабутдинов А.Р. Оценка клинических исходов регенерации тканей в хи¬рургии дефектов тканей при синдроме диабетиче-ской стопы. Московский хирургический журнал. 2018;4(62):31-34. Koreyba K.A., Minabutdinov A.R. Evaluation of clinical outcomes of tissue regen-eration in surgery of tissue defects in diabetic foot syndrome. Moscow surgical journal. 2018;4(62):31-34. (In Russ).
- Taylor C.R., Cote R.J. Immunomicroscopy: A Diagnostic Tool For The Surgical Pathologist.. Philadelphia, 1994:236.


