Результаты выявления поливирулентных штаммов бактерий Lactobacillus spp. при ассоциативном взаимодействии с простейшими Blastocystis hominis in vivo
Автор: Красноперова Юлия Юрьевна, Мехманова Севиндж Шахмирзаевна, Хуснатдинова Екатерина Александровна
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2022 года.
Бесплатный доступ
Выявлены поливирулентные штаммы бактерий Lactobacillus spp. при ассоциативном взаимодействии с простейшими Blastocystis hominis in vivо. Штаммы Lactobacillus spp. и B. hominis выделяли из фекалий 396 пациентов, проходивших анализ на кишечный дисбиоз. Идентификацию бактерий проводили с использованием микроскопического, бактериологического и паразитологического методов. В качестве контрольных использовали 112 эталонных штаммов лактобактерий NK1 и К3Ш24, депонированных в ВНИИ генетики и селекции промышленных микроорганизмов. Степень вирулентности простейших бластоцист определяли путем внутрибрюшинного введения белым мышам (массой 17.4+1.5 г) 0.5 мл взвеси культуры изучаемых микроорганизмов, полученной на питательной среде Suresh. В работе использовали праймеры к нескольким генам, определяющим способность к образованию фимбрий 1-го типа, S и Р типа, бактериального адгезина интимина и гемолизина. Тестирование 396 штаммов Lactobacillus spp., изолированных из микросимбиоценозов с Blastocystis hominis различной степени вирулентности показало, что динамика выявления генов патогенности у лактобактерий возрастала с усилением степени вирулентности простейших. Чаще всего в общем пуле штаммов лактобактерий искомые ампликоны выявлялись при использовании праймеров к fimA гену (до 67.9%). При ассоциативном взаимодействии с умеренно- и высоковирулентными бластоцистами выявлено усиление гетерогенности популяции лактобактерий, проявляющееся увеличением частоты обнаружения всех изученных генетических детерминант патогенности, по сравнению со штаммами Lactobacillus spp., выделенными из ассоциаций с авирулентными B. hominis и в контрольной группе.
Генетические детерминанты патогенности, вирулентная экспрессия, blastocystis hominis, ассоциативное взаимодействие, lactobacillus spp, кишечный микросимбиоценоз
Короткий адрес: https://sciup.org/147239679
IDR: 147239679 | УДК: 579 | DOI: 10.17072/1994-9952-2022-4-288-293
Текст научной статьи Результаты выявления поливирулентных штаммов бактерий Lactobacillus spp. при ассоциативном взаимодействии с простейшими Blastocystis hominis in vivo
1® Ульяновский государственный педагогический университет им. И.Н. Ульянова, Ульяновск, Россия, ,
Литературные данные и результаты собственных исследований показали необходимость расширения границ понимания медико-биологической роли простейших, в том числе Blastocystis hominis [Бондаренко, Мавзютов, Голкочева, 2002]. Выявлена общая закономерность внутриклеточного существования бактерий в простейших, которая нашла отражение как в динамике численности бактериальной популяции, так и уровне их вирулентности [Литвин, 2003; Литвин, Пушкарева, Емельяненко, 2004].
В последние годы растет количество работ, регистрирующих участие лактобацилл в возникновении таких заболеваний человека, как кариес, ревматическое поражение сосудов, септицемия и инфекционный эндокардит [Зеленова и др., 2004; Соловьев, Большаков, Галецкий, 2016]. К нежелательным свойствам этих бактерий относят их способность вызывать агрегацию тромбоцитов человека и связываться с коллагеном, фибриногеном и фибронектином [Точилина и др., 2015]. Кроме того, нет объяснения и биологического значения способности этих микроорганизмов становиться грамотрицательными с возрастом и в условиях повышения кислотности среды [Яруллина, Фахруллин, 2014].
Многими авторами показана возможность горизонтального переноса плазмидных генов между популяциями разных видов и родов, однако вклад данных механизмов в развитие адаптивных способностей систематически неродственных бактерий остается до сих пор не изученным.
Интенсивное изучение на молекулярном уровне механизмов формирования новых генетических вариантов микроорганизмов при их ассоциативном взаимодействии, как части естественного отбора внутри микробных популяций, позволит объективно оценить значение различных микроорганизмов в поддержание гомеостаза, а также степень их вовлечения в патогенез заболеваний.
Цель настоящего исследования - анализ выявления поливирулентных штаммов бактерий Lactobacillus spp. при ассоциативном взаимодействии с простейшими Blastocystis hominis in vivо.
Материалы и методы исследований
В работе использованы микроскопический, культуральный и биологический методы, технология постановки полимеразной цепной реакции (ПЦР), а также корреляционный анализ полученных сведений по методу Пирсона и статистическая обработка данных. Штаммы бактерии Lactobacillus spp. и простейших Blastocystis hominis получали из фекалий 396 пациентов в возрасте от 20 до 60 лет, проходивших обследование на кишечный дисбиоз в условиях дневного стационара муниципального учреждения здравоохранения городской поликлиники № 5 г. Ульяновска.
В качестве контрольных использовали 112 эталонных штаммов лактобактерий NK1 и К3Ш24, депонированных в ВНИИ генетики и селекции промышленных микроорганизмов.
Степень вирулентности простейших бластоцист определяли путем внутрибрюшинного введения белым мышам (массой 17.4 + 1.5 г) 0.5 мл взвеси культуры изучаемых микроорганизмов, выращенной на питательной среде Suresh [Suresh et al., 1993].
В работе применяли праймеры к нескольким генам, определяющим способность к образованию фимбрий 1-го типа, S и Р типа, бактериального адгезина интимина и гемолизина. Праймеры синтезированы в НПФ “ДНКтехнология” (Россия). Выделение бактериальной ДНК проводили по методу [Boom et al., 1988]. Подбор праймеров и температуры отжига осуществляли при использовании пакета программ “Lasergene” (США). Регистрацию результатов ПЦР выполняли путем электрофоретического разделения продуктов амплификации на окрашенном бромистым этидием агарозном геле. Компьютерный анализ нуклеотидных последовательностей проводили с помощью компьютерной программы Vector NTI Suite (США).
Результаты и их обсуждение
Из микросимбиоценоза обследованных пациентов выделены бластоцисты, которые в результате использования метода внутрибрюшинного заражения мышей были разделены на три группы – авирулентные (73 штамма), умеренно- (189 штаммов) и высоковирулентные (134 штамма). По нашим данным, показатель LD 50 /lg варьировал: у умеренновирулентных штаммов – в пределах от 3.1±0.6 до 4.3±0.5, высоковирулентных – 4.9±0.2 до 5.7±0.2. Авирулентные бластоцисты (73 культуры) гибель животных не вызывали.
Проведенный анализ на кишечный дисбиоз бактериоскопическим и бактериологическим методами показал, что при усилении вирулентности выявляемых бластоцист статистически достоверно снижалось количество лактобактерий со значения lg 9.3±0.5 КОЕ/г до lg 3.8±0.8 КОЕ/г ( р = 0.001). Коэффициент корреляции составил r = –0.8. Противоположную направленность имела зависимость, демонстрирующая обсемененность кишечника микробами родов Enterococcus , Clostridium , Staphylococcus и Candida при увеличении вирулентности изолированных бластоцист B. hominis . Так, обсемененность кишечника микробами родов Enterococcus , Clostridium , Staphylococcus и Candida увеличилась до значений lg 8.1±0.3, 9.2±.1, 6.2±0.3 и 5.7±0.2 КОЕ/г соответственно ( р = 0.001). Коэффициенты корреляции составили r = 0.7, r = 0.9, r = 0.8 и r = 0.8 соответственно. При усилении вирулентности бластоцист статистически достоверно увеличивалось количество представителей Proteus и Klebsiella - до lg 5.1±0.1, 5.2±0.2 КОЕ/г соответственно ( р = 0.05). Коэффициенты корреляции составили r = 0.5 и r = 0.7 соответственно. Изменение численности различных фенотипических групп бактерий Escherichia coli под влиянием бластоцист проходило в следующих направлениях. Количество лактозонегативных и гемолитических форм эшерихий увеличилось с 0 до lg 3.8±0.3, 5.4±0.1 КОЕ/г соответственно ( р = 0.001). Коэффициент корреляции составил r = 0.8 и r = 0.9 соответственно.
По итогам тестирования штаммов Lactobacillus spp., выделенных из ассоциации с авирулентыми бластоцистами, оказалось, что искомые ампликоны выявлялись только при использовании праймеров к fimА -гену (таблица). Частота встречаемости данного ампликона составила 19.1% (у эталонных штаммов - 0 %, р = 0.001). В данной фенотипической группе ни в одном случае не выявлены генетические детерминанты к другим генам.
В дальнейших исследованиях нами была изучена частота встречаемости нуклеотидных последовательностей генов, контролирующих синтез фимбрий P, S и 1-го типа, интимина и гемолизина у бактерий Lactobacillus spp . , выделенных из ассоциации с умеренновирулентными бластоцистами (таблица). В общем пуле исследованных штаммов лактобацилл регистрировали наличие искомых ампликонов ко всем изучаемым генам. Достоверно чаще других регистрировались генетические детерминанты, обеспечивающие синтез фимбрий 1- и S-типов: fimA – 59.8; sfаА – 21.5, sfaG – 19.6% соответственно ( р = 0.001). Положительные результаты были зафиксированы и в отношении других изучаемых детерминант. Из 189 протестированных штаммов с праймерами к hlyB гену положительный сигнал получен только с 7 культурами (3.7%). В общем пуле контрольных штаммов положительные сигналы не выявлены.
Частота встречаемости нуклеотидных последовательностей генов вирулентности Lactobacillus spp . при ассоциативном взаимодействии с бластоцистами B. hominis
|
[Frequency of occurrence of nucleotide sequences of Lactobacillus spp . virulence genes in association with B. hominis ] |
|||||||
|
Количество ассоциирующих бактерий |
1 Частота встречаемости ампликонов, абс./% |
||||||
|
рарН |
рарС |
sfaG |
sfaA |
fimA |
Eae |
hlyB |
|
|
С авирулентными бластоцистами (n=73) |
0 |
0 |
0 |
0 |
14/19.1 * |
0 |
0 |
|
С умеренновирулентными бластоцистами (n=189) |
12/6.3* |
13/6.9* |
37/19.6* |
40/21.5* |
113/59.8* |
2/1.1 |
7/3.7* |
|
С высоковирулентными бластоцистами (n=134) |
15/11.2 |
17/12.7* |
46/34.3* |
43/32.1* |
91/67.9* |
14/7.4* |
31/23.1* |
|
Контрольные эталонные штаммы (n=112) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
Примечание. * - р = 0.001.
При ассоциативном взаимодействии in vivo лактобактерий с высоковирулентными бластоцистами наблюдается увеличение частоты образования ампликонов генетических детерминант пилеобразования по сравнению с предыдущими группами в среднем в 2 раза, что можно рассматривать как стресс-индукцию адаптационных механизмов к выеданию хищниками-простейшими. Так, генетические детерминанты fimA выявлены у 91 штамма (67.9%); sfаА – 43 штаммов (32.1%), sfaG – 46 штаммов (34.3%); papС – 17 штаммов (12.7%); papH – 15 штаммов (12.7%) ( р= 0.001). Положительные результаты зафиксированы и в отношении других изучаемых детерминант. Из 134 протестированных штаммов с праймерами к eaeA гену положительный сигнал получен только с 14 культурами (7.4%). Динамика регистрации hlyB гена токсинообразования увеличилась в 4.4 раза (с 7 до 31 штамма).
Исследование формирования генетических комбинаций в геноме микроассоциантов Lactobacillus spp. (рисунок) во всех микросимбиоценозах показало статистически достоверное доминирование штаммов с геном fimA (218 штаммов).
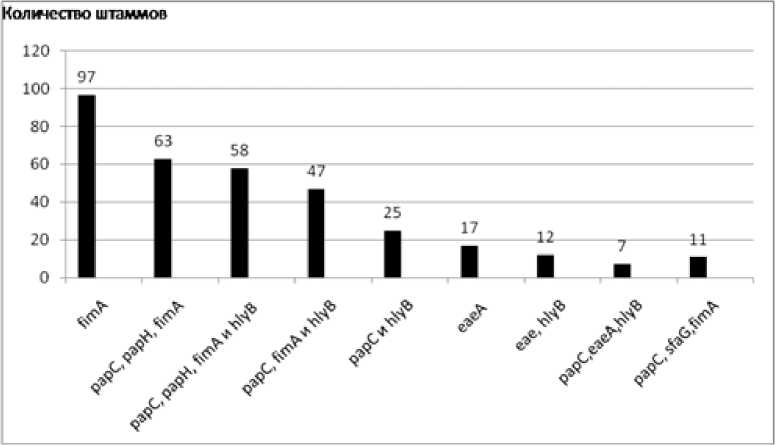
Встречаемость комбинаций генов патогенности при формировании поливирулентных штаммов Lactobacillus spp. в ассоциативном микросимбиоценозе с простейшими B. hominis in vivо
[The occurrence of combinations of pathogenicity genes in the formation of polyvirulent strains of Lactobacillus spp. in associative microsymbiocenosis with protozoa B. hominis in vivo ]
В общем пуле штаммов лактобактерий у 97 (24.5%) был выявлен только фрагмент fimA гена. Совместное выявление фрагментов генетических детерминант патогенности отмечено с такими генами: papC , papH , fimA – 63 (15.0%), рарС , рарН , fimA и hlyB – 58 (14.6%), рарС , fimA и hlyB – 47 (11.9%), рарС и hlyB – 25 (6.3%), eaeA – 17 (4.3%), eaeA , hlyB – 12 (3%), рарС , eaeA , hlyB – 7 (1.8%), рарС , sfaG и fimA – 11 (2.8%) штаммов соответственно. Меньше всего отмечено присутствие в генотипе лактобактерий фрагментов, контролирующих экспрессию интимина – 36 штаммов.
Выводы
-
1. Простейшие бластоцисты выступают в роли экологического стрессового фактора внутри ассоциативной микросистемы. Происходящая под их влиянием селекция по признаку вирулентности и последующее размножение более устойчивых к перевариванию бактерий подтверждается увеличением частоты встречаемости генетических детерминант факторов патогенности papC , papH , sfaG , sfaA , fimA , eae , hlyB у представителей Lactobacillus spp.
-
2. Присутствие в кишечном консорциуме пациентов простейших определяет направление селективного отбора микроассоциантов в сторону усиления степени адгезивности, колонизации и токсинообразо-вания, что подтверждается положительной динамикой выявления генетических детерминант, ответственных за экспрессию данных факторов вирулентности.
-
3. Исследование формирования генетических комбинаций в геноме микроассоциантов Lactobacillus spp. во всех микросимбиоценозах показало статистически достоверное доминирование штаммов с геном fimA , кодирующим субъединицу фимбрий FimA. Наименьшее адаптивное значение имеют генетические детерминанты eaeА гена, контролирующие выработку интимина.
Список литературы Результаты выявления поливирулентных штаммов бактерий Lactobacillus spp. при ассоциативном взаимодействии с простейшими Blastocystis hominis in vivo
- Бондаренко В.М., Мавзютов А.Р., Голкочева Э. Секретируемые факторы патогенности энтеробак-терий // Журнал микробиологии, эпидемиологии и иммунобиологии. 2002. № 1. С. 84-90.
- Грицюк О.В., Кузнецова К.Ю., Загайнова А.В. Об актуальности определения Blastocystis spp. в объектах окружающей среды как потенциальных факторов риска возникновения протозойной инфекции человека // Гигиена и санитария. 2018. Т. 97, № 11. С. 1043-1045. DOI: 10.18821/0016-9900-2018-97-111043-45.
- Егорова Т.П., Аршба И.М., Демерчян А.В. Протозойно-бактериальные ассоциации кишечника у макаков резусов // Ветеринария. 2021. № 1. С. 33-35. DOI: 10.30896/0042-4846.2021.24.1.33-36.
- Ефимов Б.А. Характеристика микроорганизмов, колонизирующих кишечник // Журнал микробиологии, эпидемиологии и иммунобиологии. 2002. № 5. С. 98-104.
- Зеленова Е.Г. и др. Микрофлора полости рта: норма и патология: учеб. пособие. Нижний Новгород: Изд-во НГМА, 2004. 158 с.
- Литвин В.Ю. Сапронозные аспекты энзоотии чумы // Успехи современной биологии. 2003. Т. 123, № 6. С. 543-551.
- Литвин В.Ю., Пушкарева В.И., Емельяненко Е.Н. Биоценотические основы природной очаговости сапронозов // Журнал микробиологии, эпидемиологии и иммунобиологии. 2004. № 4. С. 102-108.
- Мавзютов А.Р. и др. Факторы патогенности оппортунистических энтеробактерий и их роль в развитии диареи // Журнал микробиологии, эпидемиологии и иммунобиологии. 2007. № 1. С. 89-96.
- Немова И.С. и др. Микроэкология организма человека: учеб. пособие. Ульяновск: Изд-во УлГПУ, 2012. 101 с.
- Пушкарева В.И. Паразитизм в простейших как стратегия существования патогенных бактерий в почвах и водоемах // Успехи современной биологии. 2006. Т. 126, № 4. С. 323-333.
- Соловьёв М.М., Большаков О.П., Галецкий Д.В. Гнойно-воспалительные заболевания головы и шеи: этиология, патогенез, клиника, лечение. М.: Умный доктор, 2016. 192 с.
- Степанских А.С. Общая экология. М.: ЮНИТИ-ДАНА, 2000. 688 с.
- Точилина А.Г. и др. Изучение биологических свойств штаммов рода Lactobacillus // Современные проблемы науки и образования. 2015. № 5. URL: https://science-education.ru/ru/article/view?Id=21579.
- Яруллина Д.Р., Фахруллин Р.Ф. Бактерии рода Lactobacillus: общая характеристика и методы работы с ними: учеб.-метод. пособие. Казань, 2014. 51 с.
- Abd Н. et al. Survival and growth of Francisella tularensis in Acanthamoeba castellanii // Applied and Environmental Microbiology. 2003. Vol. 69(1). Р. 600-606. DOI: 10.1128/AEM.69.1.600-606.2003.
- Boom R. et al. Rapid and simple method for purification of nucleic acids // Journal of Clinical Microbiology. 1988. Vol. 28. Р. 495-503. DOI: 10.1128/jcm.28.3.495-503.1990.
- Brunder W., Karh H. Genome plasticity in Enterobacteriaceae // Journal of Medical Microbiology. 2000. Vol. 290. Р. 153-165.
- Caprioli A., Morabito S., Brugere H. Enterohaemor-rhagic Escherichia coli: emerging issues on virulence and modes of transmission // Veterinary Research. 2005. Vol. 36. P. 289-311.
- Clarke S.C. et al. Virulence of enteropathogenic Escherichia coli, a global pathogen // Clinical Microbiology Reviews. 2003. Vol. 16, № 3. P. 365-378.
- Suresh K. et al. In vitro encystment and experimental infections of Blastocystis hominis // Parasitology Research. 1993. Vol. 79. P. 456-460.


