Результаты забрюшинной лимфаденэктомии у больных распространенными несеминомными герминогенными опухолями яичка с неполным радиологическим и серологическим ответом на химиотерапию
Автор: Матвеев Всеволод Б., Волкова Мария И., Аракелян Геворг А., Файнштейн Игорь А., Сергеев Юрий С., Федянин Михаил Ю., Румянцев Алексей А., Трякин Алексей А., Тюляндин Сергей А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 2 т.11, 2021 года.
Бесплатный доступ
Цель: Оценить результаты забрюшинных лимфаденэктомий (ЗЛАЭ), выполненных больным распространенными несеминомными герминогенными опухолями яичка (НГОЯ) с неполным серологическим и радиологическим ответом на химиотерапию (ХТ). Материал и методы: В исследование отобраны данные 96 больных распространенными НГОЯ, подвергнутых ЗЛАЭ в НМИЦ онкологии им. Н. Н. Блохина с 1983 по 2020 гг. Медиана возраста - 27 (15-57) лет. Первую линию ХТ, основанной на цисплатине, получили все 96 (100,0%), 2 линию ХТ - 58 (60,4%) пациентов. После завершения ХТ у всех пациентов сохранялись повышенные уровни АФП и/или ХГ и радиологически определяемые опухолевые очаги (только забрюшинные метастазы - 77 (80,2%), забрюшинные метастазы и очаги других локализаций - 19 (19,8%)). Всем пациентам после завершения ХТ проводилось хирургическое лечение: ЗЛАЭ - 96 (100,0%), ЗЛАЭ и удаление экстраретроперитонеальных очагов - 8 (8,3%). ХТ после хирургического вмешательства проводилась 29 (30,2%) из 96 пациентов. Медиана наблюдения составила 39,4 (1-284) месяца. Результаты: Послеоперационные осложнения зарегистрированы у 10 (10,6%) пациентов (3-4 степеней тяжести - 3 (3,1%)). Летальность составила 1,1%. Радикальное удаление забрюшинных масс выполнено у 80 (83,3%) пациентов, всех определяемых опухолевых очагов-у 69 (71,9%) больных. Полных ответов на послеоперационную ХТ не было. Гистологически забрюшинные массы были представлены некрозом и фиброзом в 25 (26,0%), тератомой - в 29 (30,2%), злокачественной несеминомой - в 42 (43,8%) случаях. Отдаленная ОВ всех 96 больных составила 60,9%, специфическая выживаемость - 61,7%. Безрецидивная выживаемость радикально оперированных пациентов достигла 65,2%, беспрогрессивная выживаемость больных, подвергнутых нерадикальной операции - 35,9%. В многофакторном анализе независимыми факторами неблагоприятного прогноза ОВ являлись выполнение ЗЛАЭ после ХТ 2 линии (отношение шансов (ОШ) 4,667 (95% доверительные интервалы (ДИ): 1,987-10,961)), наличие злокачественной несеминомы в резидуальных забрюшинных опухолевых массах (ОШ 3,081 (95% ДИ: 1,178-8,055)) и неполное удаление всех резидуальных опухолей после ХТ (ОШ 4,445 (95% ДИ:1,813-10,899)). Выводы: ЗЛАЭ после ХТ может рассматриваться как допустимая опция у отобранных больных распространенными НГОЯ с неполным серологическим ответом на ХТ, у которых имеется техническая возможность полного удаления всех радиологически определяемых опухолевых очагов.
Забрюшинная лимфаденэктомия, несеминомные герминогенные опухоли яичка, положительные опухолевые маркеры
Короткий адрес: https://sciup.org/140290741
IDR: 140290741 | DOI: 10.18027/2224-5057-2021-11-2-27-37
Текст научной статьи Результаты забрюшинной лимфаденэктомии у больных распространенными несеминомными герминогенными опухолями яичка с неполным радиологическим и серологическим ответом на химиотерапию
Несеминомные герминогенные опухоли яичка (НГОЯ) — злокачественные новообразования, развивающиеся у молодых мужчин и характеризующиеся способностью к метастазированию с преимущественным поражением забрюшинных лимфоузлов. Большинство НГОЯ сопровождается повышением сывороточных концентраций опухолевых маркеров — альфа-фетопротеина (АФП) и β-единицы хорионического гонадотропина (ХГ). Проведение индукционной химиотерапии (ХТ), основанной на цисплатине, позволяет излечить около 70% больных. Пациенты, не достигшие полного ответа, нуждаются в последующем лечении. Хирургическое удаление остаточных опухолевых масс после цитотоксической терапии дает возможность излечить большинство больных с нормализовавшимися опухолевыми маркерами
Собственные исследования и неполной регрессией метастатических очагов на фоне ХТ. Неполный серологический ответ на индукцию принято считать противопоказанием к оперативному вмешательству, так как повышение уровней АФП и ХГ после ХТ свидетельствует о сохранении жизнеспособной злокачественной несеминомы, ассоциированной с низкой вероятностью излечения путем локального воздействия на радиологически определяемые остаточные опухолевые массы. Больные с неполным маркерным эффектом, как правило, получают спасительную ХТ. Однако данная группа пациентов крайне гетерогенна, как в отношении динамики уровней онкомаркеров, так и прогностически. Позитивный опыт нескольких клиник позволяет предположить, что хирургическое удаление резидуальных очагов может привести к излечению некоторых больных с сохранением положительных опухолевых маркеров после ХТ [1-9].
В данной статье приведены результаты забрюшинных лимфаденэктомий (ЗЛАЭ), выполненных больным распространенными НГОЯ с неполным серологическим и радиологическим ответом на ХТ, выполненных в НМИЦ онкологии им. Н. Н. Блохина.
Материал и методы
Критериями включения в исследование являлись: воз-раст≥18 лет, верифицированная распространенная НГОЯ с повышением концентраций АФП и/или ХГ на момент начала ХТ, завершение не менее 3 курсов платино-содер-жащей ХТ 1 или 2 линии, независимо от прогноза по классификации IGCCCG, сохранение радиологически определяемых опухолевых очагов после ХТ, АФП через 3 недели с момента начала последнего курса ХТ более 7,29 МЕ/мл и/или ХГ более 5 мМЕ/мл независимо от динамики концентраций маркеров, отсутствие появления новых метастазов до операции, выполнение ЗЛАЭ после ХТ.
Основной целью исследования являлась оценка общей выживаемости (ОВ), ко вторичным целям относились непосредственные и отдаленные функциональные результаты хирургического лечения. Также планировалось изучение гистологического строения удаленных опухолей, частоты рецидивов и их локализации, специфической (СВ), безре-цидивной (БРВ) и беспрогрессивной (БПВ) выживаемости.
С 1983 г. по 2020 г. в НМИЦ онкологии им. Н. Н. Блохина ЗЛАЭ была выполнена 703 больным распространенными НГОЯ, не достигшим полного радиологического ответа на ХТ. В исследование ретроспективно и проспективно отобраны данные 96 пациентов, соответствующих критериям включения.
Медиана возраста больных составила 27 (15–57) лет. Подробная характеристика пациентов приведена в табл. 1. Во всех случаях была выполнена орхфуникул-эктомия (в 5 (5,2%) — после завершения ХТ). Гистологическое строение первичной опухоли известно у 91 (95,8%) больного. Чистая семинома верифицирована в 5 (5,2%) препаратах пациентов с повышенным уровнем АФП, не- семинома — в 84 (87,5%), некроз, индуцированный ХТ, — в 2 (2,1 %) случаях. Среди несеминомных опухолей только тератома была выявлена у11 (11,5%) больных, у63 (65,7%) пациентов имели место злокачественные несеминомы. Элементы хориокарциномы выявлены в 23 (23,9%), эмбрионального рака — в 45 (46,9%), желточного мешка — в 18 (18,8%) препаратах.
После орхфуникулэктомии всем больным проводилась ХТ первой линии, основанная на цисплатине, после которой ни в одном наблюдении не было отмечено нормализации уровней АФП и/или ХГ. В 58 (60,4%) случаях проводилась ХТ второй линии.
После завершения ХТу87 (90,6%) пациентов имел место неполный маркерный и радиологический ответ, у9 (9,4%) — прогрессирование опухолевого процесса. Детальная информация о динамике концентраций АФП и ХГ была доступна у26 (27,1%) больных: снижение уровней опухолевых маркеров было зарегистрировано у 22 (22,8%), стабилизация — у 1 (1,1%), рост — у 3 (3,2%) пациентов. Средняя предоперационная концентрация АФП в группе составила 117,4 (1,2–1122,0) МЕ/мл, ХГ— 615,6 (0,0–13770,0) мМЕ/мл, ЛДГ — 401,7 (178–906) ЕД/л. Изолированное повышение уровня ХГ имело место у 2 (2,1%), АФП — у 16 (16,7%), ХГ и АФП — у 8 (8,3%) больных. В 70 (72,9%) случаях детализированные данные об уровнях маркеров отсутствуют.
У всех пациентов сохранялись радиологически определяемые проявления болезни после завершения ХТ. Одна локализация резидуальных метастазов имела место у 77 (80,2%), более одной — у19 (19,8%) (две — у14 (14,5%), три — у 4 (4,2%), четыре — у 1 (1,1%)) больных. У всех 96 (100,0%) пациентов определялись резидуальные ретроперитонеальные, у21 (21,9%) — эктраретроперитонеальные опухолевые очаги (висцеральные — у 10 (10,4%), в нерегионарных лимфоузлах — у 10 (10,4%), местный рецидив в области культи семенного канатика — у 1 (1,1%)).
На фоне проводимого лечения динамика размеров забрюшинных метастазов была зарегистрирована у 63 (65,6%) пациентов. Уменьшение опухолевых очагов отмечено в 46 (47,9%), стабилизация — в 7 (7,3%), увеличение — в 10 (10,4%) случаях. Медиана предоперационных размеров резидуальных очагов составила 69,8 (13–220) мм. В 58 (60,4%) наблюдениях опухолевые массы охватывали аорту и нижнюю полую вену (НПВ). У28 (29,2%) пациентов метастазы локализовались преимущественно парааортально, у 8 (8,3%) — паракавально, у2 (2,1%) — аортокавально. В 34 (35,4%) случаях метастазы распространялись на область почечной ножки, вовлекая почечные сосуды. У28 (29,2%) больных опухоль инвазировала магистральные сосуды или их ветви, включая 1 (1,1%) пациента с формированием опухолевого венозного тромбоза НПВ. В 1 (1,1%) случае опухоль подрастала к 12-перстной кишке. У26 (27,1%) больных мочеточник проходил через опухолевый инфильтрат.
Всем пациентам после завершения ХТ выполнено хирургическое удаление резидуальных опухолевых очагов: из забрюшинного пространства — 96 (100,0%), экстра-
РЕЗУЛЬТАТЫ ЗАБРЮШИННОЙ ЛИМФАДЕНЭКТОМИИ У БОЛЬНЫХ РАСПРОСТРАНЕННЫМИ НЕСЕМИНОМНЫМИ ГЕРМИНОГЕННЫМИ ОПУХОЛЯМИ ЯИЧКА С НЕПОЛНЫМ РАДИОЛОГИЧЕСКИМ И СЕРОЛОГИЧЕСКИМ ОТВЕТОМ НА ХИМИОТЕРАПИЮ
Собственные исследования
Таблица 1. Характеристика больных
|
Характеристика |
Число больных |
|
|
N |
% |
|
|
Категория Т |
||
|
рТ1 |
17 |
17,7 |
|
рТ2 |
19 |
19,8 |
|
рТ3 |
6 |
6,3 |
|
рТ4 |
3 |
3,1 |
|
Тх |
51 |
53,1 |
|
Категория N |
||
|
N0 |
6 |
6,3 |
|
N1 |
7 |
7,3 |
|
N2 |
14 |
14,6 |
|
N3 |
51 |
53,1 |
|
N +, без уточнений |
18 |
18,7 |
|
Категория M |
||
|
M0 |
57 |
59,3 |
|
M1 |
28 |
29,2 |
|
Mx |
11 |
11,5 |
|
Повышение концентрации в сыворотке крови до ОФЭ |
||
|
Только АФП |
13 |
13,5 |
|
Только ХГ |
4 |
4,2 |
|
АФП и ХГ |
50 |
52,1 |
|
Нет |
2 |
2,1 |
|
Нет данных |
27 |
28,1 |
|
Категория S |
||
|
S0 |
0 |
0,0 |
|
S1 |
11 |
11,5 |
|
S2 |
41 |
42,7 |
|
S3 |
17 |
17,7 |
|
Sx |
27 |
28,1 |
|
Группа прогноза IGCCCG |
||
|
Благоприятный |
11 |
11,5 |
|
Промежуточный |
41 |
42,7 |
|
Неблагоприятный |
17 |
17,7 |
|
Не может быть определен |
27 |
28,1 |
|
Характеристика |
Число больных |
|
|
N |
% |
|
|
Количество линий ХТ |
||
|
1 |
96 |
100,0 |
|
2 |
58 |
60,4 |
|
Динамика концентраций опухолевых маркеров |
||
|
Снижение |
22 |
22,8 |
|
Стабилизация |
1 |
1,1 |
|
Рост |
3 |
3,2 |
|
Оценка невозможна |
70 |
72,9 |
|
Сохранение повышенных уровней маркеров |
||
|
ХГ |
2 |
2,1 |
|
АФП |
16 |
16,7 |
|
ХГ и АФП |
8 |
8,3 |
|
Оценка невозможна |
70 |
72,9 |
|
Динамика размеров опухолевых узлов |
||
|
Уменьшение |
46 |
47,9 |
|
Стабилизация |
7 |
7,3 |
|
Рост |
10 |
10,4 |
|
Оценка невозможна |
29 |
34,4 |
|
Забрюшинные метастазы инвазируют окружающие структуры |
||
|
Да |
28 |
29,1 |
|
Нет |
68 |
70,9 |
|
Экстраретроперитонеальные метастазы до операции |
||
|
Да |
21 |
21,9 |
|
Нет |
75 |
78,1 |
ОФЭ— орхфуникулэктомия;
АФП — альфа-фетопротеин;
ХГ— хорионический гонадотропин;
IGCCCG — International Germ Cell Cancer Collaborative Group.
ретроперитонеальных — 8 (8,3%). Симультанно выполнено 2 (2,1%), последовательно — 6 (6,2%) операций. ЗЛАЭ производилась всем больным. Объем операции включал удаление опухолевых масс, ипсилатеральной гонадной вены, а также забрюшинной клетчатки от уровней ножек диафрагмы сверху до пересечения мочеточников с общими подвздошными артериями снизу; латеральными границами ЗЛАЭ являлись мочеточники. При распространении опухоли за пределы указанного трафарета границы лимфодиссекции расширяли. Для полного удаления всех опухолевых узлов в 27 (28,1%) случаях потребовалась резекция или перевязка магистральных сосудов и их ветвей, в 9 (9,4%) — резекция смежных органов (табл. 2). ХТ после хирургического вмешательства проводилась 29 (30,2%) из 96 пациентов.
Все медицинские данные включенных в исследование пациентов были внесены в базу данных, основанную на электронных таблицах EXCEL. Статистический анализ проводили при использовании блока программ «IBM SPSS Statistics 19.0 for Windows». Взаимосвязь признаков оценивали путем расчета коэффициента корреляции Пирсона (r). Медиана наблюдения за всеми пациентами составила 39,4 (1–284) месяца. Общую выживаемость (ОВ) рассчитывали от даты хирургического вмешательства до даты смерти от любой причины, специфическую выживаемость (СВ) — от даты хирургического вмешательства до смерти
Собственные исследования от прогрессирования НГОЯ, безрецидивную выживаемость (БРВ) — от даты радикального хирургического вмешательства до даты регистрации рецидива НГОЯ или смерти, беспрогрессивную выживаемость (БПВ) — от даты циторедуктивного хирургического вмешательства до даты регистрации прогрессирования НГОЯ или смерти. Выживаемость оценивали по методу Каплана–Майера, различия выживаемости определяли с помощью log-rank теста, для выделения независимых факторов прогноза проводили регрессионный анализ Cox.
Результаты
Медиана операционного времени составила 210 (70– 560) мин, медиана кровопотери — 800 (20–22000) мл. Послеоперационные осложнения зарегистрированы у 10 (10,6%) пациентов (1–2 степеней тяжести — 6 (6,3%), 3–5 степеней тяжести — 4 (4,3%)). Послеоперационная летальность равнялась 1,1%. В структуре послеоперационных осложнений доминировал парез кишечника (6 (6,2%)), который в 5 (5,1%) случаях был купирован консервативно, а в 1 (1,1%) наблюдении привел к развитию завершенной спаечной тонкокишечной непроходимости и послужил показанием к экстренной операции. У 1 (1,1%) пациента, подвергнутого ЗЛАЭ и панкреатодуоденальной резекции, развилась несостоятельность гепатикоеюноанастомоза, приведшая к развитию перитонита. Больному была выполнена повторная операция. Послеоперационный период осложнился тяжелым сепсисом, приведшим к смерти пациента. У 1 (1,1%) больного в послеоперационном периоде развился хилезный асцит, в связи с чем была выполнена релапаротомия, перевязка лимфатических протоков, дренирование забрюшинного пространства. В 1 (1,1%) случае у пациента, перенесшего массивную кровопотерю, послеоперационный период осложнился развитием полиорган-ной недостаточности. Проводилась интенсивная терапия, с эффектом. У1 (1,1%) больного отмечено нагноение послеоперационной раны. Осложнение купировано консервативно. Частота повторных операций составила 3,1%.
При длительном наблюдении у больных, подвергнутых резекции крупных сосудов, осложнений, ассоциированных с редукцией кровотока, не зарегистрировано. У пациентов, которым выполнялась резекция сосудов с протезированием, протезы функционируют адекватно.
Полное удаление забрюшинных масс удалось выполнить 80 (83,3%) пациентам. Факторами, прямо коррелировавшими с неполным удалением забрюшинных масс, являлись наличие элементов хориокарциномы в первичной опухоли (r= 0,559; р < 0,0001) и ХТ 2 линии в анамнезе (r = 0,248; p = 0,015). Во всех 8 случаях удаление экстраре-троперитонеальных метастазов удалось выполнить радикально. Полное удаление всех определяемых опухолевых проявлений произведено 69 (71,9%) больным.
Резидуальные опухоли после хирургического лечения сохранялись у 27 (28,1%), в том числе — в сочетании
Таблица 2. Особенности хирургического лечения
|
Особенности хирургического лечения |
Количество больных (N 96) |
|
|
N |
% |
|
|
Хирургический доступ для ЗЛАЭ |
||
|
Открытый |
94 |
97,9 |
|
Лапароскопический |
2 |
2,1 |
|
Резекция и перевязка магистральных сосудов и их ветвей во время ЗЛАЭ |
27 |
28,1 |
|
Циркулярная резекция и протезирование аорты |
4 |
4,2 |
|
Резекция почечной артерии |
1 |
1,1 |
|
Резекция общей подвздошной артерии |
3 |
3,2 |
|
Резекция общей подвздошной артерии, краевая |
1 |
1,1 |
|
Резекция и протезирование общей подвздошной артерии |
2 |
2,1 |
|
Перевязка нижней брыжеечной артерии |
15 |
15,6 |
|
Резекция нижней полой вены |
9 |
9,4 |
|
Краевая |
7 |
7,2 |
|
Циркулярная, без протезирования |
1 |
1,1 |
|
Циркулярная, с протезированием |
1 |
1,1 |
|
Резекция почечной вены |
2 |
2,1 |
|
Резекция смежных органов во время ЗЛАЭ |
9 |
9,4 |
|
Панкреатодуоденальная резекция |
1 |
1,1 |
|
Резекция 12-перстной кишки |
1 |
1,1 |
|
Нефрэктомия |
6 |
6,3 |
|
Гемиколэктомия слева |
1 |
1,1 |
|
Резекция мочеточника |
2 |
2,1 |
|
Удаление экстраретроперитонеальных метастазов |
8 |
8,3 |
|
Надключичная и медиастинальная лимфаденэктомия |
1 |
1,1 |
|
Надключичная лимфаденэктомия |
3 |
3,1 |
|
Медиастинальная лимфаденэктомия |
1 |
1,1 |
|
Резекция легкого |
2 |
2,1 |
|
Резекция печени |
1 |
1,1 |
ЗЛАЭ — забрюшинная лимфаденэктомия с повышенным уровнем опухолевых маркеров — у 13 (13,6%) пациентов. Послеоперационную ХТ получали 13 из 27 больных, при этом ни в одном наблюдении полного ответа зарегистрировано не было. Полный эффект комбинированного лечения был достигнут в 69 (71,9%) случаях, неполный — в 27 (28,1%) наблюдениях.
Гистологически забрюшинные массы были представлены некрозом и фиброзом в 25 (26,0%) и содержали элементы герминогенной опухоли — в 71 (74,0%) случае (тератома — 29 (30,2%), злокачественная несеминома — 42 (43,8%)). Удаленные экстраретроперитонеальные резидуальные массы были представлены фиброзом и некрозом в 3 (37,5 %), тератомой — в 1 (12,5%), злокачественной несеминомой — в4 (62,5%) случаях. У больного, подвергнутого удалению очагов двух локализаций, оба метастаза были некротизированы. Конкордантное строение забрюшинных и экстраретроперитонеальных очагов имело место у 4 (50,0%) больных.
РЕЗУЛЬТАТЫ ЗАБРЮШИННОЙ ЛИМФАДЕНЭКТОМИИ У БОЛЬНЫХ РАСПРОСТРАНЕННЫМИ НЕСЕМИНОМНЫМИ ГЕРМИНОГЕННЫМИ ОПУХОЛЯМИ ЯИЧКА С НЕПОЛНЫМ РАДИОЛОГИЧЕСКИМ И СЕРОЛОГИЧЕСКИМ ОТВЕТОМ НА ХИМИОТЕРАПИЮ
Собственные исследования
Таблица 3. Факторы прогноза общей выживаемости
|
Фактор |
Медиана ОВ ± ст. ошибка, месяцы |
Однофакторный анализ |
Многофакторный анализ |
|
|
Р |
ОШ (95% ДИ: НГ-ВГ) |
Значимость |
||
|
Число линий химиотерапии Одна Две |
НД 33,4 ± 11,9 |
< 0,0001 |
4,667 (1,987–10,961) |
0,001 |
|
Повышение уровней маркеров до ЗЛАЭ Только АФП ХГ или АФП и ХГ |
НД 33,4 ± 17,0 |
0,041 |
1,058 (0,086–13,024) |
0,965 |
|
Экстраретроперитонеальные метастазы до ЗЛАЭ Нет Да |
НД 34,4±16,0 |
0,033 |
1,567 (0,660–3,724) |
0,309 |
|
Полное удаление всех опухолевых очагов Да Нет |
НД 15,9±2,6 |
< 0,0001 |
4,445 (1,813–10,899) |
0,001 |
|
Забрюшинные ткани Некроз или тератома Злокачественная несеминома |
НД 25,6 ± 11,1 |
< 0,0001 |
3,081 (1,178–8,055) |
0,022 |
|
Повышение маркеров после операции Нет Да АФП ХГ АФП и ХГ |
44,4±13,8 15,7±1,1 14,0±10,7 14,2±5,7 17,9±0,0 |
0,016а |
7,383 (0,348–156,671) |
0,200 |
|
АХТ* Нет Да |
НД 66,2±26,2 |
0,519 |
– |
– |
|
Послеоперационная ХТ** Нет Да |
33,4 ± 13,9 14,0±7,0 |
0,006 |
–b |
–b |
ХТ— химиотерапия; АФП— альфа-фетопротеин; ХГ— хорионический гонадотропин; ЗЛАЭ — забрюшинная лимфаденэктомия; НД— не достигнута; ОВ — общая выживаемость; ОШ— отношение шансов; ДИ— доверительные интервалы; НГ— нижняя граница; ВГ— верхняя граница.
Рецидивы зарегистрированы у 29 (42,0%) из 69 радикально оперированных пациентов, в среднем, через 21,8 (2– 154) месяца после хирургического вмешательства. Изолированного повышения маркеров не отмечено ни в одном случае. Изолированный радиологически определяемый рецидив, не сопровождавшийся повышением АФП и ХГ, диагностирован в 9 (13,0%), сочетание определяемой опухоли и повышения маркеров — в20 (29,0%) наблюдениях. Рецидив локализовался забрюшинно в области ЗЛАЭ в8 (11,6%), за границами ЗЛАЭ — в7 (10,1%), экстраретро-перитонеально — в14 (20,3%) случаях (включая сочетание незабрюшинного и забрюшинного рецидивов у 6 (8,7%) больных). Трем пациентам с изолированным рецидивом в забрюшинных лимфоузлах выполнена повторная ЗЛАЭ. В 26 случаях назначалась ХТ, при этом полных ответов на лечение не зарегистрировано ни в одном наблюдении.
Прогрессирование имело место у 22 (84,6%) из26 нерадикально оперированных больных, в среднем, — через 10 (1–112) месяцев после ЗЛАЭ. В 4 (15,4%) наблюдениях даль- нейшего прогрессирования отмечено не было при медиане наблюдения 4,3 (1,5–38,3) месяца.
Отдаленная ОВ всех 96 больных составила 60,9%, СВ— 61,7%; БРВ радикально оперированных больных достигла 65,2%, БПВ пациентов, подвергнутых нерадикальной операции, — 35,9%. В однофакторном анализе отмечено неблагоприятное влияние на ОВ таких признаков, как выполнение ЗЛАЭ после ХТ 2 линии (р< 0,0001), сохранение повышенного уровня ХГ до операции (р = 0,041), наличие экстраретроперитонеальных метастазов перед хирургическим вмешательством (р= 0,033), неполное удаление всех остаточных опухолей (р< 0,0001), сохранение жизнеспособной злокачественной несеминомы в забрюшинном пространстве (р = 0,028) и повышенные опухолевые маркеры после операции независимо от вида маркера (р = 0,016). Проведение послеоперационной ХТ нерадикально оперированным пациентам и адъювантной ХТ больным со злокачественной несеминомой в остаточных массах (n — 16) на ОВ не влияло. В многофакторном анализе подтвер-
Собственные исследования ждено независимое влияние наОВ выполнения ЗЛАЭ после ХТ 2 линии (ОШ 4,667 (95% ДИ: 1,987–10,961)), наличия злокачественной несеминомы в резидуальных забрюшинных опухолевых массах (ОШ 3,081 (95% ДИ: 1,178–8,055)) и неполного удаления всех резидуальных опухолей после ХТ (ОШ 4,445 (95% ДИ:1,813–10,899), табл. 3, рис. 1).
В однофакторном анализе выявлено значимое снижение БРВ у пациентов, получавших ХТ 2 линии до хирургического вмешательства (с 80,0% до 48,4% соответственно, р = 0,003), и у больных, имевших элементы злокачественной несеминомы в операционных образцах (с 78,9% до 23,0% соответственно, р < 0,0001). Независимым фактором риска БРВ являлись жизнеспособные клетки рака в ретроперитонеальных метастазах (ОШ 4,620 (95% ДИ: 1,586–13,456); р = 0,005).
Дискуссия
Единственным методом, дающим шанс на излечение пациентам с резистентными распространенными НГОЯ, исчерпавшими возможности ХТ, является попытка радикального удаления всех резидуальных опухолевых очагов. Неудивительно, что Donohue J. P. был предложен термин «ЗЛАЭ отчаяния» в качестве названия для забрюшинных лимфодиссекций, выполняемых после индукционной или спасительной ХТ на фоне повышенных концентраций АФП и/или ХГ [10]. Доля подобных операций достигает 10% от всех ЗЛАЭ, выполняемых в специализированных клиниках [8]. В нашей серии наблюдений этот показатель составил 13,6%.
Основной целью постхимиотерапевтического хирургического лечения больных распространенными НГОЯ с сохранением положительных маркеров после ХТ является полное удаление всех определяемых опухолевых очагов. Наиболее распространенной локализацией метастазов НГОЯ являются забрюшинные лимфоузлы, поэтому самой часто выполняемой операцией у данной категории больных считается ЗЛАЭ, представляющая собой сложное хирургическое вмешательство, требующее детального знания анатомии забрюшинного пространства, а также наличия навыков сосудистой и абдоминальной хирургии.
На наш взгляд, всем пациентам с неполным серологическим эффектом ХТ показана полная двухсторонняя ЗЛАЭ. Обоснованием этому служит высокая частота билатерального поражения забрюшинных лимфоузлов, достигшая в нашей серии наблюдений 60,4%. Резекция сосудов, органов и тканей, вовлеченных в опухолевый инфильтрат, во время ЗЛАЭ является обоснованной. У больных с сохранением положительных уровней опухолевых маркеров опухоль химиорезистентна, и вероятность излечения пациентов путем назначения системной противоопухолевой терапии после нерадикальной операции крайне низка. Так, в нашей серии ни один пациент с остаточной опухолью после хирургического вмешательства не имел полного ответа на послеоперационную ХТ. Большинство авторов
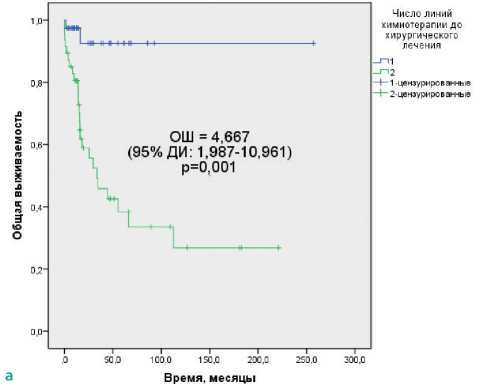
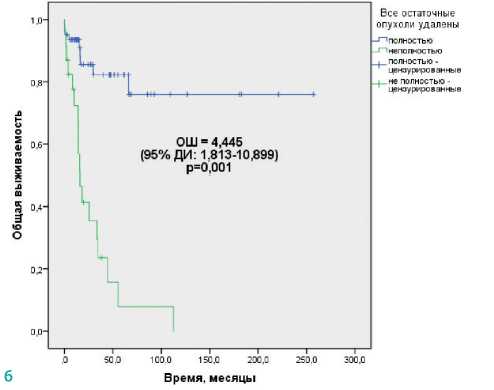
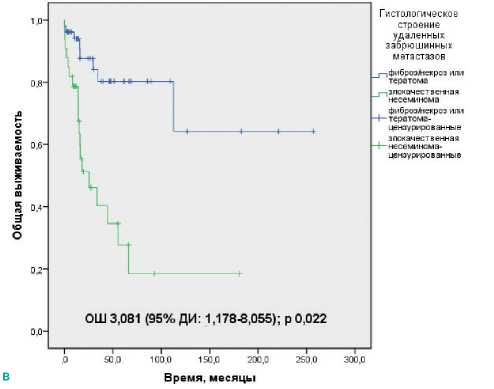
Рисунок 1. Общая выживаемость больных распространенными НГОЯ с неполным маркерным ответом на ХТ, подвергнутых хирургическому удалению резидуальных опухолей, в зависимости от: а) числа линий ХТ; б) радикальности хирургического вмешательства; в) строения удаленных забрюшинных опухолей.
В. Б. Матвеев, М. И. Волкова, Г. А. Аракелян, И. А. Файнштейн, Ю. С. Сергеев, М. Ю. Федянин, А. А. Румянцев, А. А. Трякин, А. С. Тюляндин
РЕЗУЛЬТАТЫ ЗАБРЮШИННОЙ ЛИМФАДЕНЭКТОМИИ У БОЛЬНЫХ РАСПРОСТРАНЕННЫМИ НЕСЕМИНОМНЫМИ ГЕРМИНОГЕННЫМИ ОПУХОЛЯМИ ЯИЧКА С НЕПОЛНЫМ РАДИОЛОГИЧЕСКИМ И СЕРОЛОГИЧЕСКИМ ОТВЕТОМ НА ХИМИОТЕРАПИЮ
Собственные исследования подтверждает целесообразность резекции органов и тканей, вовлеченных в опухолевый процесс для полного удаления оставшейся после ХТ забрюшинной опухоли [11-19]. Еще в 1994 г. Donohue J. P. показал, что результаты лечения радикально оперированных больных распространенными НГОЯ, которым во время ЗЛАЭ была выполнена нефрэктомия, лучше, чем у пациентов с сохраненной в ущерб радикальности операции почкой [12].
Для полного удаления всех забрюшинных масс резекция или перевязка магистральных сосудов и их ветвей потребовались 28,1% наших пациентов. Чаще всего имелись показания для перевязки нижней брыжеечной артерии (15,6%), резекции НПВ (9,4%), аорты (4,2%) и общей подвздошной артерии (4,2%). Резекция смежных органов была выполнена в 9,4% случаях, при этом чаще всего производилась нефрэктомия (6,3%). В современных сериях наблюдений частота резекции магистральных сосудов и органов, вовлеченных в опухолевый инфильтрат, во время ЗЛАЭ составляет около 25% [13,14]. Наиболее распространенным элементом расширенных операций остается нефрэктомия (14,8%) [13]. Резекция аорты и НПВ, инфильтрированных опухолью, требуется в 1,5% и 7–10% случаев, соответственно [14-18].
Несмотря на техническую сложность, частота послеоперационных осложнений постхимиотерапевтической ЗЛАЭ относительно невелика и составляет, по данным разных авторов, около 10%. Чаще всего послеоперационный период осложняется раневыми инфекциями, парезом кишечника, транзиторным повышением амилазы и пневмонитами. Серьезные осложнения, такие как острая почечная недостаточность, хилезный асцит или обструктивная кишечная непроходимость, развиваются менее чем у 2% пациентов [20]. Непосредственные результаты лечения наших больных, оперированных при неполном серологическом эффекте ХТ, соответствуют опубликованным данным, касающимся пациентов, которым ЗЛАЭ выполнялась после нормализации опухолевых маркеров. Послеоперационные осложнения были зарегистрированы у 10,6% больных, включая 4,3% пациентов с осложнениями 3–5 степеней тяжести. В структуре осложнений доминировал парез кишечника (5,1%).
У 19,8% наших пациентов помимо забрюшинных опухолей после завершения ХТ оставались метастазы других локализаций. Технически радикальное удаление всех экс-траретроперитонеальных опухолей удалось осуществить в 8,3% наблюдений, при этом чаще всего требовалось выполнение надключичной лимфодиссекции (4,2%). Резидуальные массы, располагавшиеся за пределами забрюшинного пространства, в большинстве препаратов были представлены несеминомой (злокачественной — 62,5%, тератомой — 12,5%). Строение забрюшинных и экстра-ретроперитонеальных метастазов различалось в 50% наблюдений. Это не противоречит результатам, полученным у больных, оперированных после нормализации опухолевых маркеров, согласно которым дискордантное строение метастазов, удаленных из разных органов, имеет место в 30%
случаев [21]. В нескольких клиниках также накоплен опыт симультанных и последовательных вмешательств у больных с резидуальными опухолевыми массами нескольких локализаций. По некоторым данным, отмечается ухудшение результатов при поражении более 2 органов [5]. Напротив, Beck S. et al. (2007) не выявили влияния числа локализаций метастазов на выживаемость [10]. В нашей серии наблюдений сохранение экстраретроперитонеальных метастазов после ХТ являлось неблагоприятным фактором прогноза ОВ. Однако количество наблюдений невелико, и сделать выводы о показаниях к хирургическому лечению больных диссеминированными НГОЯ с неполным маркерным ответом на ХТ не представляется возможным.
Технически выполнение радикального вмешательства у больных распространенными НГОЯ после ХТ представляет собой непростую задачу: по данным разных авторов, полное удаление всех опухолей при неполном серологическом и радиологическом ответе на цитотоксическое лечение удается произвести 77–90% пациентов [5,9]. Хирургическое лечение, включая ЗЛАЭ, комбинированные, расширенные и последовательные операции по удалению остаточных масс разных локализаций, позволили добиться полного эффекта у 71,2% наших больных. Факторами, прямо коррелировавшими с неполным удалением забрюшинных масс, являлись наличие элементов хориокарциномы в первичной опухоли и выполнение операции после 2 линии ХТ.
Согласно опубликованным результатам, отдаленная ОВ больных, оперированных при неполном серологическом ответе на ХТ, колеблется от 37% до 80% [1-9]. В нашей серии наблюдений 39-месячная ОВ составила 60,9%. В многофакторном анализе нам удалось выделить независимые факторы неблагоприятного прогноза ОВ, включая выполнение операции после 2 линии ХТ, жизнеспособную злокачественную несеминому в остаточной забрюшинной опухоли и неполное удаление всех резидуальных масс после ХТ. Строение остаточных метастазов также оказывало независимое негативное влияние на БРВ.
Наши данные подтверждают ранее опубликованные результаты, полученные в других клиниках. Так, снижение ОВ у больных, получавших спасительную ХТ, и нерадикально оперированных пациентов было отмечено в однофакторном анализе, проведенном в исследовании Indiana University [10]. Habuchi Т. et al. (2003) [7] и Ong T. et al. (2008) [9] зарегистрировали улучшение показателей ОВ после полного удаления всех опухолевых очагов. В работе Ong T. et al. (2008) фактором благоприятного прогноза ОВ оказалась зрелая тератома в удаленных забрюшинных массах [9]. В исследовании Indiana University (n=114) значимое снижение выживаемости было отмечено у больных с жизнеспособной злокачественной несеми-номой в удаленных тканях (31%) по сравнению с тератомой (77%) и некрозом (85%). При подгрупповом анализе гистологическое строение резидуальных опухолевых масс оказалось независимым фактором прогноза ОВ, однако влияние гистологического строения опухоли имело про-
Собственные исследования гностическое значение только для подгруппы пациентов, получавших индукционную ХТ [8].
Помимо перечисленных факторов многие исследователи отметили прогностическую значимость динамики уровней и собственно предоперационных концентраций опухолевых маркеров. В наибольшей серии наблюдений, опубликованной к настоящему времени, была доказана независимая негативная прогностическая значимость растущей концентрации ХГ на фоне ХТ, а также предоперационного уровня АФП [10]. Нам не удалось выявить подобной закономерности, что, вероятнее всего, связано с отсутствием данных о концентрациях маркеров у пациентов, вошедших в наше исследование, начинавших лечение в других учреждениях. Однако в однофакторном анализе мы отметили, что сохранение изолированного повышения АФП до операции ассоциировано с достоверно большим показателями ОВ, чем изолированное или сочетающееся с эскалацией АФП повышение ХГ (р = 0,041), что соответствует результатам, опубликованным Habuchi Т. et al. (2003) [7] и Ong T. et al. (2008) [9].
Стандартная тактика дальнейшего ведения больных диссеминированными НГОЯ, оперированных при неполном маркерном ответе на ХТ, не существует. Опубликованы данные, свидетельствующие о преимуществе БРВ у больных, получавших АХТ при обнаружении злокачественной несеминомы в операционном материале после ХТ 1 линии. Рутинное назначение АХТ после спасительной ХТ и ЗЛАЭ не используется [22]. В нашей серии наблюдений ХТ после операции не оказывала значимого влияния наОВ больных
с неполным серологическим эффектом ХТ, что соответствует результатам Beck S. et al. (2007) [10]. Вероятно, стабильно повышенные сывороточные опухолевые маркеры после системной терапии отражают химиорезистентность злокачественной несеминомы.
Заключение
На основании полученных данных, мы полагаем, что хирургическое лечение после ХТ может рассматриваться как допустимая опция у отобранных больных распространенными НГОЯ с неполным серологическим ответом на ХТ, у которых имеется техническая возможность полного удаления всех радиологически определяемых опухолевых очагов. ЗЛАЭ у данной категории пациентов является технически сложным, но безопасным хирургическим вмешательством. Резекция инфильтрированных опухолью магистральных сосудов и соседних органов для радикального завершения ЗЛАЭ является обоснованной. У больных с экстраретроперитонеальными метастазами должна рассматриваться возможность их удаления даже в случае гистологически подтвержденного некроза забрюшинных очагов. Рутинное назначение ХТ больным распространенными НГОЯ с неполным серологическим ответом на дооперационную ХТ после нерадикального хирургического вмешательства и/или при выявлении злокачественной несеминомы в удаленных тканях не показано.
Список литературы Результаты забрюшинной лимфаденэктомии у больных распространенными несеминомными герминогенными опухолями яичка с неполным радиологическим и серологическим ответом на химиотерапию
- Wood Jr, D. P., Herr, H. W., Motzer, R. J., Reuter, V., Sogani, P. C., Morse, M. J., & Bosl, G. J. (1992). Surgical resection of solitary metastases after chemotherapy in patients with nonseminomatous germ cell tumors and elevated serum tumor markers. Cancer, 70 (9), 2354-2357
- Murphy BR, Breeden ES, Donohue JP, Messemer J, Walsh W, Roth BJ, Einhorn LH. Surgical salvage of chemorefractory germ cell tumors. J Clin Oncol. 1993 Feb;11 (2):324-9. doi: 10.1200/JCO. 1993.11.2.324. PMID: 8381163
- Eastham James A., abM. D. Timothy G. Wilsonab1M. D. ChristyRussellab et al. Surgical resection in patients withnonseminomatous germ cell tumor who fail to normalize serum tumor markers after chemotherapy Urology Volume 43, Issue 1, January 1994, Pages 74-80
- Coogan C L 1, R S Foster, R G Rowland, R Bihrle, E R Smith Jr, L H Einhorn, B J Roth, J P Donohue Postchemotherapy retroperitoneal lymph node dissection is effective therapy in selected patients with elevated tumor markers after primary chemotherapy alone Urology Volume 50, Issue 6, December 1997, Pages 957-962
- Ravi R 1, J Ong, R T Oliver, D F Badenoch, C G Fowler, W F Hendry Surgery as salvage therapy in chemotherapy-resistant nonseminomatous germ cell tumours Br J Urol. 1998 Jun;81 (6):884-8
- Albers P, Ganz A, Hannig E, Miersch WD, Müller SC. Salvage surgery of chemorefractory germ cell tumors with elevated tumor markers. J Urol. 2000 Aug;164 (2):381-4. PMID: 10893590
- Habuchi Tomonori M. D., Toshiyuki Kamoto M. D., Isao Hara M. D., Koji Kawai M. D., Masahiro Nakao M. D., Norio Nonomura M. D., Takashi Kobayashi M. D., Osamu Ogawa M. D. Factors that influence the results of salvage surgery in patients with chemorefractory germ cell carcinomas with elevated tumor markers. Cancer 2003 Volume 98, Issue 8; P. 1635-1642
- Beck SD, Foster RS, Bihrle R, Einhorn LH, Donohue JP. Outcome analysis for patients with elevated serum tumor markers at postchemotherapy retroperitoneal lymph node dissection. J Clin Oncol. 2005 Sep 1;23 (25):6149-56. doi: 10.1200/JCO. 2005.11.684. PMID: 16135481
- Ong TA, Winkler MH, Savage PM, Seckl MJ, Christmas TJ Retroperitoneal lymph node dissection after chemotherapy in patients with elevated tumour markers: indications, histopathology and outcome. BJU Int. 2008 Jul; 102 (2):198-202.
- Beck SD, Foster RS, Bihrle R, Einhorn LH, Donohue JP Post chemotherapy RPLND in patients with elevated markers: current concepts and clinical outcome. Urol Clin North Am. 2007 May; 34 (2):219-25.
- Ehrlich Y, Kedar D, Zelikovski A, Konichezky M, Baniel J. Vena caval reconstruction during postchemotherapy retroperitoneal lymph node dissection for metastatic germ cell tumor. Urology. 2009 Feb; 3 (2):442. e17-9
- Donohue J. P., Foster R. S. Management of retroperitonealrecurrences: Seminoma and Nonseminoma. Urol. Clin. N. Amer. 1994;21:761-772
- Cary KC, Beck SD, Bihrle R, Foster RS. Clinical and pathological features predictive of nephrectomy at post-chemotherapy retroperitoneal lymph node dissection. J Urol. 2013 Mar;189 (3):812-7
- Heidenreich A., Seger M., Schrader A. J., Hofmann R., Engelmann U. H. (2004) Surgical considerations in residual tumor resection following inductive chemotherapy for advanced testicular cancer. Eur Urol 162 (Suppl. 3): 632
- Beck S. D., Lalka S. G. (1998) Long-term results after inferior vena cava resection during retroperitoneal lymphadenectomy for metastatic germ cell cancer. J Vasc Surg 28: 808-814
- Beck S. D., Foster R. S., Bihrle R., Koch M. O., Wahle G. R., Donohue J. P. (2001) Aortic replacement during post-chemotherapy retroperitoneal lymph node dissection. J Urol 165: 1517-1520;
- Christmas T. J., Smith G. L., Kooner R. (1998) Vascular interventions during post-chemotherapy retroperitoneal lymph node dissection for metastatic testis cancer. Eur J Surg Oncol 292-297;
- Heidenreich A., Dieckmann K. P., Schmelz H., Winter C., Pfister D. (2011) Prognostic clinical parameters to predict the necessity of reconstructive vascular surgery for patients who undergo postchemotherapy retroperitoneal lymph node dissection for advanced nonseminomatous germ cell tumours. Results of the German Testicular Cancer Study Group and the Association of Urologic Oncology. J Urol, AUA abstract # 832
- Donohue JP, Thornhill JA, Foster RS, Bihrle R. Vascular considerations in postchemotherapy. Retroperitoneal lymph-node dissection: Part I. Vena cava. World J Urol. 1994;12 (4):182-6
- Krege S., Beyer J., Souchon R., Albers P., Albrecht W., Algaba F., et al. (2008) European consensus conference on diagnosis and treatment of germ cell cancer: a report of the second meeting of the European Germ Cell Cancer Consensus group (EGCCCG): part I. Eur Urol 53: 478-496
- Hartmann JT, Candelaria M, Kuczyk MA, et al. Comparison of histological results from the resection of residual masses at different sites after chemotherapy for metastatic non-seminomatous germ cell tumors. Eur J Cancer 1997;33:843-7
- Fox EP, Weathers TD, Williams SD, et al. Outcome analysis for patients with persistent nonteratomatous germ cell tumor in postchemotherapy retroperitoneal lymph node dissections. J Clin Oncol 1993; 11 (7):1294-9


