Риск венозных тромбоэмболических осложнений у больных злокачественными новообразованиями поджелудочной железы
Автор: Кит О.И., Франциянц Е.М., Кательницкая О.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 3 т.21, 2022 года.
Бесплатный доступ
Венозные тромбоэмболические осложнения (ВТЭО) часто диагностируются у пациентов со злокачественными опухолями поджелудочной железы на этапе диагностики и лечения, увеличивая частоту осложнений на хирургическом и химиотерапевтическом этапах лечения основного заболевания, а также смертность. Цель исследования - изучить взаимосвязь клинических характеристик и нарушений показателей гемостаза у больных со злокачественными опухолями поджелудочной железы и их роль в прогнозировании ВТЭО. Материал и методы. В исследование включены 246 пациентов со злокачественными новообразованиями (ЗНО) поджелудочной железы. У 91,9 % больных диагностирована протоковая аденокарцинома поджелудочной железы. Наиболее часто опухоль локализовалась в головке поджелудочной железы (68,3 %). Исходно у 45,9 % пациентов установлена iV стадия заболевания (t1-4N0-2m1). Желтуха как клиническая манифестация опухоли поджелудочной железы наблюдалась у 31,7 % больных. Небольшая часть (17,5 %) пациентов получали химиотерапевтическое лечение. Хирургическое лечение проведено у 28 % больных. За период наблюдения, равный 12 мес, частота ВТЭО составила 15,4 %. Ретроспективно сравнили клинические характеристики и показатели гемостаза на этапе диагностики ЗНО поджелудочной железы у больных с ВТЭО и без ВТЭО, выявленных за период наблюдения. Результаты. Риск развития ВТЭО у больных ЗНО поджелудочной железы выше при большем размере опухоли и наличии отдаленных метастазов. Исходный высокий уровень d-димеров у больного ЗНО поджелудочной железы увеличивает вероятность развития ВТЭО в первые 12 мес от установки диагноза. Повышенный исходный уровень d-димеров повышал риск возникновения ВТЭО в 1,86 раза. Многофакторный анализ показал, что наиболее значимым фактором риска ВТЭО является размер опухоли. Выводы. У больных ЗНО поджелудочной железы прогностическую значимость в отношении ВТЭО имеют размер опухоли, iV стадия заболевания, повышение уровня d-димера. Исследование показателей гемостаза на этапе диагностики ЗНО поджелудочной железы (d-димер) может помочь выявить пациентов с высоким риском ВТЭО, которым целесообразна антикоагулянтная профилактика.
Злокачественные опухоли поджелудочной железы, венозные тромбоэмболические осложнения, d-димер
Короткий адрес: https://sciup.org/140295076
IDR: 140295076 | УДК: 616.37-006.6:616.151 | DOI: 10.21294/1814-4861-2022-21-3-24-32
Текст научной статьи Риск венозных тромбоэмболических осложнений у больных злокачественными новообразованиями поджелудочной железы
В настоящее время к наиболее тромбогенным злокачественным новообразованиям относят рак поджелудочной железы. Частота венозных тромбоэмболических осложнений (ВТЭО) при данном типе опухолей достигает 12,4 % [1]. В исследовании, включающем 202 пациента, страдающих раком поджелудочной железы, показано, что частота ВТЭО достигает 10,8 %, а риск тромбоза увеличивается в 58 раз по сравнению с общей популяцией с поправкой на возраст и пол [2]. ВТЭО регистрируются как на этапе диагностики, так и в период лечения злокачественного новообразования (ЗНО). Необходимо отметить, что ВТЭО являются лидирующей причиной летальности онкологических больных.
Высокую частоту ВТЭО при раке поджелудочной железы определяет множество факторов риска, которые можно разделить на внутренние и внешние. К первым из них относятся активация тромбоцитов и высвобождение некоторых прокоагулянтных факторов раковыми клетками поджелудочной железы, в т. ч. тканевого фактора и тромбина, которые могут вызывать гиперкоагуляционное состояние. Внешние факторы связаны с методами лечения, включающими химиотерапию, лучевую терапию и хирургическое вмешательство, а также с коморбидностью больного [3].
В корейском исследовании, включающем 121 пациента с резектабельным раком поджелудочной железы, частота тромбоэмболии легочных артерий (ТЭЛА) в 1-й мес после операции составила 5,8 %, а в течение года – 13,2 %. При этом в 83,3 % случаев ВТЭО сопровождал рецидив опухоли в отдаленном периоде. Следовательно, ВТЭО у данной категории пациентов влияют не только на общую, но и на безрецидивную выживаемость [4].
В 2008 г. была предложена модель Khorana для оценки риска ВТЭО с использованием клиниче- ских (локализация опухоли и индекс массы тела) и лабораторных (уровень гемоглобина, количество тромбоцитов и лейкоцитов) показателей для прогнозирования ВТЭО у онкологических больных, получающих химиотерапию на амбулаторном этапе [5]. Позже в метаанализе, включающем 2386 онкологических больных, было показано, что только у четверти пациентов высокой группы риска развились симптомные ВТЭО в течение 6 мес, остальные эпизоды ВТЭО регистрировались у больных среднего и низкого риска [6]. Это указывает на необходимость более детального изучения системы гемостаза у больных ЗНО и использования дополнительных маркеров тромбообразования в оценке риска ВТЭО. Некоторые исследователи предлагают включение показателей системы гемостаза (растворимый P-селектин и D-димер) для более точной оценки прогноза ВТЭО [1].
D. Faille et al. показали, что уровень D-димера и микровезикул тканевого фактора при протоковой аденокарциноме поджелудочной железы (ПАПЖ) связан не с хроническим панкреатитом, а с онкологическим заболеванием и его стадией [7]. Следовательно, необходимы дальнейшие исследования, посвященные взаимосвязи ЗНО поджелудочной железы и ВТЭО. Оценка нарушений в системе гемостаза целесообразна для прогнозирования ВТЭО и своевременного назначения тромбопрофилакти-ки. Мы провели ретроспективное исследование, чтобы в первую очередь определить частоту ВТЭО и одновременно выявить значимость факторов риска ВТЭО у пациентов с ЗНО поджелудочной железы.
Цель исследования – изучить взаимосвязь клинических характеристик и нарушений показателей гемостаза у больных со злокачественными опухолями поджелудочной железы и их роль в прогнозировании ВТЭО.
Таблица 1/table 1
Стадирование больных со ЗНО поджелудочной железы по классификации tnM staging in patients with pancreatic cancer according to the tnM classification
|
Стадия процесса/ Stage of the tumor |
Первичный очаг/ Primary tumor |
Региональные лимфоузлы/ Regional lymph nodes |
Отдаленные метастазы/ Distant metastases |
Количество больных/ Number of patients |
|
IA |
T1 |
N0 |
M0 |
1 (0,4 %) |
|
IB |
T2 |
N0 |
M0 |
8 (3,3 %) |
|
IIA |
T3 |
N0 |
M0 |
38 (15,4 %) |
|
IIB |
T2 |
N1 |
M0 |
6 (2,4 %) |
|
T3 |
N1 |
M0 |
48 (19,5 %) |
|
|
III |
T4 |
N любое |
M0 |
32 (13 %) |
|
IV |
T любое |
N любое |
M1 |
113 (45,9 %) |
Материал и методы
В период с 2016 по 2019 г. в исследование было включено 246 пациентов с ЗНО поджелудочной железы (табл. 1). Во всех случаях диагноз подтвержден морфологическим исследованием (биопсия образования поджелудочной железы или метастаза печени). Стадия заболевания оценена с помощью спиральной компьютерной (СКТ) и/или магнитнорезонансной томографии (МРТ). Средний возраст больных составил 62 ± 10 лет. Значимых различий по гендерному признаку не выявлено (мужчины – 55,3 %, женщины – 44,7 %, р=1). В 68,3 % случаев опухоль располагалась в головке поджелудочной железы. Средний размер опухоли – 52 ± 20,5 мм. На момент обращения IV стадия (TлюбаяNлюбаяM1) заболевания установлена в 45,9 %. Наиболее частым гистологическим типом опухоли была протоковая аденокарцинома поджелудочной железы (91,9 %), из них умереннодифференцированная аденокарцинома – у 107 (43,5 %), низкодифференцированная – у 43 (17,5 %), высокодифференцированная – у 10 (4,1 %) больных, в остальных случаях степень дифференцировки не определена. Манифестация опухоли с желтухи наблюдалась в 31,7 % случаев. Химиотерапевтическое лечение (гемцитабин, гемцитабин и капецитабин) получали 43 (17,5 %) пациента. Неоадъювантная терапия не проводилась. Хирургический этап лечения выполнен у 28 % больных: радикальная операция – у 18,3 %, паллиативная – у 9,3 %. Гастропанкреатодуоденальная резекция – у 27 (11 %) больных, корпорокаудальная резекция поджелудочной железы – у 18 (7,3 %), обходные анастомозы – у 23 (9,3 %) пациентов. Диагностическая лапаротомия произведена в 2 (0,8 %) случаях. Исходные лабораторные показатели представлены в табл. 2.
Период наблюдения начинался от момента включения (установки диагноза) с последующим наблюдением каждые 3 мес в отношении возникновения ВТЭО. Период наблюдения закончился после 12-месячного периода, смерти или потери больного из наблюдения. Все симптоматические ВТЭО были подтверждены с помощью ультразвукового триплексного сканирования (УЗТС) и СКТ с кон- трастированием. Случайно обнаруженные ВТЭО (например, тромбоэмболия легочной артерии или висцеральный тромбоз), диагностированные при УЗИ, СКТ или МРТ, также учитывались.
На этапе установки диагноза ЗНО у пациентов забирали образцы венозной крови, полученные из кубитальной вены, в 3,2 % цитратные вакуумные пробирки. Все образцы были обработаны в течение 2 ч. Образцы цельной крови центрифугировали 1 раз при 2500 g в течение 15 мин при комнатной температуре. Из каждой пробирки отбирали бедную тромбоцитами плазму и затем центрифугировали 2-й раз при 2500 g в течение 15 мин при комнатной температуре, чтобы получить плазму, обедненную тромбоцитами. На коагулометре исследовали уровень фибриногена, РФМК, Д-димера и антитромбина (Diagnostica Stago). Также оценивали АЧТВ, МНО и ТВ. Дополнительно проводили исследование показателей общего анализа крови (ОАК), биохимических показателей крови (билирубин с фракциями, щелочная фосфатаза (ЩФ), аспартатаминотрансфераза (АсТ), аланинаминотрансфераза (АлТ), гамма-глутамилтранспептидаза (ГГТП), креатинин), онкомаркеров (СА 19–9, раковый эмбриональный антиген (РЭА), альфа-фетопротеин (АФП)).
Проверка данных на нормальность распределения выполнена с помощью теста Шапиро–Уилка. В качестве описательных статистик для количественных показателей посчитаны средние ± средние квадратические отклонения; медиана и квартили; минимальные и максимальные значения в выборке. Сравнение количественных показателей в группах проводилось с помощью теста Манна–Уитни, частот – с помощью точного теста Фишера. Различия признавались статистически значимыми на уровне р<0,05. Отношения шансов и отношения рисков для качественных показателей рассчитывались по таблицам сопряженности. Статистическая значимость оценивалась методом точного теста Фишера. Отношения шансов и отношения рисков для количественных показателей и их статистическая значимость рассчитывались путем построения логистической регрессии. Анализировалась статистическая значимость коэффициентов регрессии
Таблица 2/table 2
Лабораторные показатели у больных со ЗНО поджелудочной железы на этапе установки диагноза laboratory indices in patients with pancreatic cancer at diagnosis
Результаты
На этапе установки диагноза ЗНО поджелудочной железы определяется изменением показателей гемостаза, отмечено повышение маркеров тромбинемии – уровня фибриногена, РФМК и D-димера. Исходно выявлены высокие уровни онкомаркеров СА 19–9, РЭА и АФП (табл. 3). В исследуемой группе больных диагностировано повышение печеночных ферментов, как экскреторных – ЩФ, так и индикаторных – ГГТП, АсТ, АлТ, ЛДГ. Также выявлено повышение общего билирубина в 5 раз выше нормы. Однако нарушений секреторной функции печени (синтез антикоагулянтов) в среднем не отмечено – не определялось снижение уровня антитромбина и повышение показателя МНО (табл. 2).
С целью определения взаимосвязи исходных клинических характеристик больных с ЗНО поджелудочной железы, лабораторных показателей и маркеров тромбоза больные разделены на две группы – без ВТЭО и с наличием ВТЭО за период наблюдения (табл. 3). На основании ретроспективного анализа: на риск развития ВТЭО не влияли пол и возраст пациента, гистологический тип и степень дифференцировки опухоли. Не выявлено значимых различий между группами (р>0,05).
Статистически значимо более высокая частота ВТЭО отмечена у пациентов с опухолями тела и хвоста поджелудочной железы, что обусловлено тем, что при опухолях данной локализации менее выражена симптоматика, и зачастую они диагностируются при более распространенном процессе. При ЗНО головки поджелудочной железы при меньшем размере опухоли чаще возникает обструкция желчевыводящих путей, что приводит к развитию желтухи и относительно более раннему обращению больного за помощью. Локализация
Таблица 3/table 3
|
Параметр/Parameter |
Нет ВТЭО (n=207)/ Without VTE (n=207) |
ВТЭО (n=39)/ With VTE (n=39) |
р |
|
Возраст/Age |
62 [56; 67,5] |
65 [56; 70] |
0,4 |
|
Пол/Gender |
|||
|
Мужчины/Males Женщины/Females |
114 (55 %) 93 (44 %) |
22 (56 %) 17 (44 %) |
1,000 |
|
Стадия/Stage |
|||
|
I |
8 (3,9 %) |
1 (3 %) |
1,000 |
|
IIА |
35 (16,9 %) |
3 (8 %) |
0,488 |
|
IIВ |
49 (23,7 %) |
5 (13 %) |
0,097 |
|
III |
28 (13,5 %) |
4 (10 %) |
0,878 |
|
IV |
87 (42 %) |
26 (67 %) |
0,019 |
|
Локализация опухоли/Tumor location |
|||
|
Головка/Head |
149 (72 %) |
19 (48,8 %) |
0,001 |
|
Тело/Body |
33 (16 %) |
10 (25,6 %) |
0,009 |
|
Хвост/Tail |
25 (12 %) |
10 (25,6 %) |
0,078 |
|
Размер опухоли/Tumor size |
43 [34; 57,5] |
61 [42; 75] |
<0,001 |
|
Гистология/Histology |
|||
|
Протоковая аденокарцинома/Ductal adenocarcinoma |
190 (91,7 %) |
36 (92 %) |
|
|
Ацинарноклеточная карцинома/Acinar cell carcinoma |
1 (0,5 %) |
– |
|
|
Недифференцированный рак/Undifferentiated cancer |
3 (1,5 %) |
– |
0,776 |
|
Нейроэндокринная опухоль/Neuroendocrine tumor |
7 (3,4 %) |
1 (3 %) |
|
|
Другое/Others |
6 (2,9 %) |
2 (5 %) |
|
|
СА 19–9 |
148 [67; 388] |
115 [9,48; 1637] |
0,663 |
|
РЭА/CEA |
3,6 [1,95; 7,3] |
7,95 [2; 16,8] |
0,198 |
|
АФП/AFP |
2,09 [1,67; 3,69] |
3,02 [1,03; 3,82] |
1,000 |
|
Общий билирубин/Total bilirubin |
39,9 [16; 204] |
28,3 [15,8; 144] |
0,271 |
|
Фибриноген/Fibrinogen |
4,8 [3,78; 5,44] |
4,11 [3,63; 5,44] |
0,366 |
|
РФМК/SFMC |
5,55 [0; 11] |
6,7 [0; 10] |
0,856 |
|
D-димер/D-dimer |
0,36 [0,3; 0,77] |
1,12 [0,94; 2,11] |
0,047 |
|
Антитромбин/Antithrombin |
115 [101; 124] |
109 [57; 130] |
0,377 |
|
Гемоглобин/Hemoglobin |
130 [120; 143] |
131 [115; 153] |
0,765 |
|
Тромбоциты/Platelets |
237 [192; 308] |
206 [176; 289] |
0,277 |
Таблица 4/table 4
|
Модели/Models |
Однофакторный анализ/ Univariate analysis |
Многофакторный анализ/ Multivariate analysis |
||
|
OR [95 % CI] |
p |
OR [95 % CI] |
p |
|
|
Модель 1/Model 1 |
||||
|
Антитромбин/Antithrombin |
0,97 [0,93; 1,01] |
0,21 |
0,98 [0,92; 1,04] |
0,51 |
|
D-димер/D-dimer |
1,42 [1,32; 3,77] |
0,03 |
1,86 [1,15; 8,12] |
0,04 |
|
Фибриноген/Fibrinogen |
0,84 [0,51; 1,32] |
0,49 |
0,76 [0,28; 1,83] |
0,53 |
|
Модель 2/Model 2 |
||||
|
Стадия IV/Stage IV |
2,41 [1,17; 4,98] |
0,017 |
1,87 [0,65; 5,40] |
0,251 |
|
Локализация опухоли/ Tumor location |
||||
|
Головка/Head |
0,30 [0,15; 0,62] |
0,001 |
0,32 [0,06; 1,81] |
0,196 |
|
Тело/Body |
2,85 [1,33; 6,07] |
0,007 |
0,88 [0,22; 3,50] |
0,863 |
|
Хвост/Tail |
2,31 [1,01; 5,30] |
0,049 |
0,82 [0,15; 4,60] |
0,816 |
|
Размер опухоли/Tumor size |
1,04 [1,02; 1,06] |
<0,001 |
1,03 [1,01; 1,05] |
0,018 |
Характеристики больных со ЗНО поджелудочной железы characteristics of patients with pancreatic cancer
Оценка риска ВТЭО у больных со ЗНО поджелудочной железы assessment of Vte risks in patients with pancreatic cancer
первичной опухоли в теле и хвосте поджелудочной железы более чем в 2 раза увеличивает риск развития ВТЭО.
Обнаружено, что размер опухоли поджелудочной железы также влияет на прогноз ВТЭО. Статистически значимо большая частота ВТЭО отмечена при IV стадии заболевания, риск возникновения ВТЭО при наличии отдаленных метастазов в 2,4 раза выше (табл. 4). По результатам исследования выявлено, что повышение печеночных ферментов, уровня билирубина, онкомаркеров, показателей ОАК не влияет на риск развития ВТЭО у больных ЗНО поджелудочной железы. Не было значимых различий между группами (р>0,05). В отношении прогноза ВТЭО из показателей гемостаза наиболее значимым был исходный высокий уровень D-димера.
С целью оценки совместного влияния факторов риска на развитие ВТЭО проведен многофакторный анализ (табл. 4) путем построения логистической регресcии. Модель 1, основанная на факторах гемостаза, была статистически незначима (р=0,517). Модель 2, построенная на основании факторов локализации и размеров опухоли, показала статистическую значимость (p < 0,001). Значение AUC составило 76,13 %, чувствительность – 78 %, специфичность – 59 % (рис. 1). В результате больший размер опухоли увеличивает вероятность развития ВТЭО. При этом увеличение размера опухоли на 1 мм ассоциировано с повышенным риском развития ВТЭО в среднем на 3 % (OR=1.03, 95 %CI: 1.01-1.05, p = 0,018).
Обсуждение
Рак-ассоциированный тромбоз является сложной клинической проблемой, особенно при раке поджелудочной железы. Тромбоз и фибринолиз являются противоположными сторонами функции гемостаза. Фибриноген играет важную роль в обоих процессах. Исследования взаимосвязи между опухолевыми клетками и прокоагулянтами и фибринолитическими факторами убедительно свидетельствуют о том, что местное образование тромбина и плазмина может играть важную роль в развитии опухоли. Учитывая, что одной из мишеней для обеих этих сериновых протеаз является фибриноген, логическое продолжение этой гипотезы заключается в том, что местное отложение и растворение фибрина могут быть ключевыми детерминантами роста и/или распространения опухоли. Множество ключевых факторов изучаются для объяснения такой высокой частоты тромбозов, включая тканевой фактор, муцины, микровезикулы, внеклеточные ловушки нейтрофилов, лейкоциты и тромбоциты [8]. Однако изменения системы гемостаза, способствующие развитию тромбоза, частота ВТЭО и методы профилактики последних недостаточно изучены.
S.Y. Yoon et al. оценивали заболеваемость ВТЭО
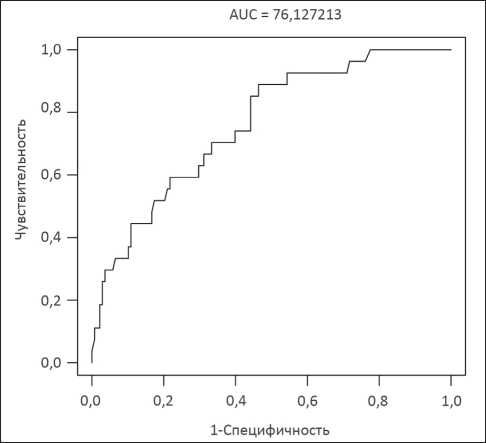
Рис. 1. ROC-анализ.
Оценка чувствительности и специфичности модели 2
Fig. 1. ROC-analysis.
Assessment of sensitivity and specificity of the model 2
у 505 больных с гистологически подтвержденным раком поджелудочной железы. Обнаружено, что частота ВТЭО при данном типе ЗНО достигла 18,6 %. Среднее время от момента установки диагноза рака поджелудочной железы до возникновения ВТЭО составило 3,9 мес. ВТЭО развились у 6,9 % больных с местнораспространенной ПАПЖ и у 13,5 % – с отдаленными метастазами. В 13,3 % случаев венозный тромбоз диагностирован на фоне химиотерапии. При наличии отдаленных метастазов (OR 2,079; 95 % CI 1,112–3,887; p=0,022), рецидиве заболевания (OR 5,014; 95 % CI 1,711– 14,698; р=0,003) и химиотерапии (ОR 2,031; 95 % CI 1,036–3,981; р=0,039) отмечается достоверно более высокая частота ВТЭО. Также отмечены геморрагические осложнения на фоне антикоагулянтной терапии, которые составили 4,2 % [4]. В нашем исследовании выявлена схожая частота ВТЭО за 12-месячный период наблюдения, которая составила 15,4 %. Аналогично данным S.Y. Yoon et al. нами показано, что при наличии отдаленных метастазов у больных с ЗНО поджелудочной железы увеличивается частота ВТЭО.
В исследовании H.K. Chew et al. [9] за 2-летний период наблюдения частота ВТЭО у пациентов с локализованной, местнораспространенной и отдаленной ПАПЖ составила 3,2 %, 3,0 % и 5,4 % соответственно. Согласно нашим результатам, отмечена более высокая частота ВТЭО в целом: при локализованной стадии ЗНО – 8,9 %, местнораспространенной – 12,5 %, при наличии отдаленных метастазов – 23 %. По данным M. Mandalà et al. [10], частота ВТЭО при нерезектабельной ПАПЖ достигла 26,0 %. При этом пациенты с ВТЭО более часто не отвечали на химиотерапию (ОР 2,98; 95 % ДИ 1,42–6,27; p=0,004). Авторы предположи- ли, что у пациентов с ВТЭО может быть биологически более агрессивное заболевание. Согласно нашим результатам, при запущенных стадиях ЗНО поджелудочной железы выявлена высокая частота ВТЭО, достигающая 23 %.
В другом исследовании 41 пациент с ПАПЖ (98 %) проспективно наблюдался в среднем 6 мес. В течение этого периода 38 (93 %) пациентов получали химиотерапию, 3 (7,3 %) – лучевую терапию, 9 (22 %) больных подвергались операции. ВТЭО возникли у 22 % пациентов. Уровни РФМК, D-димеров и CA 19–9 были значительно выше у пациентов с ВТЭО. Риск ВТЭО у пациентов с ПАПЖ и уровнем D-димера ≥ 2,16 мкг/мл выше в 5,8 раза. Кумулятивная вероятность развития ВТЭО через 6 мес у пациентов с повышенным уровнем D-димера составила 56,3 %, у больных с более низким уровнем – 15,6 %. Совокупная вероятность развития ВТЭО у пациентов с СА 19–9 выше ≥2153 Ед/мл по сравнению с пациентами с более низкими уровнями маркеров при многомерном анализе была выше в 7,2 раза. Совокупная вероятность развития ВТЭО через 6 мес у пациентов с повышенными уровнями СА 19–9 составила 78,6 %, у больных с более низкими уровнями этого маркера – 12,5 % [7]. D. Faille et al. показано, что высокие уровни CA 19–9 значимо связаны с развитием ВТЭО у больных с ПАПЖ. При этом отмечено, что эффективность CA 19–9 в прогнозировании ВТЭО была даже выше, чем у D-димеров. На риск развития ВТЭО влияло также наличие отдаленных метастазов. В нашем наблюдении мы не получили значимого влияния исходно высокого уровня СА 19–9 на прогнозирование ВТЭО при ЗНО поджелудочной железы.
D-димеры являются надежными биомаркерами гиперкоагуляционного состояния, так как они являются продуктами распада фибрина, отражая как активацию коагуляции, так и фибринолиз. Доказано, что высокие уровни D-димера связаны с низкой общей выживаемостью и повышенным риском смертности у онкологических больных [11]. У пациентов с ЗНО поджелудочной железы уровни D-димера в плазме были повышены при более распространенной стадии опухоли, метастазировании и низкой степени дифференцировки опухоли и были связаны с неоперабельностью опухоли и снижением общей выживаемости [12]. По данным нашего исследования, исходно высокий уровень D-димеров является прогностически важным в отношении развития ВТЭО у больных с опухолями поджелудочной железы.
Список литературы Риск венозных тромбоэмболических осложнений у больных злокачественными новообразованиями поджелудочной железы
- vanEsN, Franke V.F., Middeldorp S., Wilmink J.W., BullerH.R. The Khorana score for the prediction of venous thromboembolism in patients with pancreatic cancer. Thromb Res. 2017; 150: 30-2. doi: 10.1016/j. thromres.2016.12.013.
- Blom J. W., Osanto S., RosendaalF.R. High risk of venous thrombosis in patients with pancreatic cancer: a cohort study of 202 patients. Eur J Cancer. 2006; 42(3): 410-4. doi: 10.1016/j.ejca.2005.09.013.
- Larsen A.C., Br0ndum Fr0kjaer J., Wishwanath Iyer V., Vincents Fisker R., Sail M., Yilmaz M.K., Kuno M0ller B., Kristensen S.R., Thor-lacius-Ussing O. Venous thrombosis in pancreaticobiliary tract cancer: outcome and prognostic factors. J Thromb Haemost. 2Q15; 13(4): 555-62. doi: 1Q.1111/jth.12843.
- Yoon S.Y., LeeM.Y., Yun J., Yoon J., Kim H.J., Kim K.H., Kim S.H., Lee S.C., Bae S.B., Kim C.K., Lee N., Lee N.S., Lee K.T., Park S.K., Hong D.S., Won J.H. The incidence of venous thromboembolism is not lowin Korean patients with advanced pancreatic cancer [corrected]. Blood Res. 2018; 53(3): 227-32. doi: 10.5045/br.2018.53.3.227.
- KhoranaAA,KudererN.M., CulakovaE.,LymanG.H.,FrancisC.W. Development and validation of a predictive model for chemotherapy-associated thrombosis. Blood. 2008; 111(10): 4902-7. doi: 10.1182/ blood-2007-10-116327.
- Mulder F.I., Candeloro M., Kamphuisen P.W., Di Nisio M., Bos-suytP.M., Guman N., SmitK., ButterH.R., vanEs N.; CAT-prediction collaborators. The Khorana score for prediction of venous thromboembolism in cancer patients: a systematic review and meta-analysis. Haematologica. 2019; 104(6): 1277-87. doi: 10.3324/haematol.2018.209114.
- Faille D., Bourrienne M.C., de Raucourt E., de Chaisemartin L., Granger V., Lacroix R., Panicot-Dubois L., Hammel P., Levy P., Ruszniews-ki P., Ajzenberg N., Rebours V. Biomarkers for the risk of thrombosis in pancreatic adenocarcinoma are related to cancer process. Oncotarget. 2018; 9(41): 26453-65. doi: 10.18632/oncotarget.25458.
- Hisada Y., Geddings J.E., Ay C., Mackman N. Venous thrombosis and cancer: from mouse models to clinical trials. J Thromb Haemost. 2015; 13(8): 1372-82. doi: 10.1111/jth.13009.
- Chew H.K., Wun T., Harvey D., Zhou H., White R.H. Incidence of venous thromboembolism and its effect on survival among patients with common cancers. Arch Intern Med. 2006; 166(4): 458-64. doi: 10.1001/ archinte.166.4.458.
- MandalaM., ReniM., Cascinu S., Barni S., Floriani I., Cereda S., Berardi R., Mosconi S., Torri V., Labianca R. Venous thromboembolism predicts poor prognosis in irresectable pancreatic cancer patients. Ann Oncol. 2007; 18(10): 1660-5. doi: 10.1093/annonc/mdm284.
- Ay C., Dunkler D., PirkerR., Thaler J., Quehenberger P., Wagner O., Zielinski C., Pabinger I. High D-dimer levels are associated with poor prognosis in cancer patients. Haematologica. 2012; 97(8): 1158-64. doi: 10.3324/haematol.2011.054718.
- DurczynskiA., KumorA., HogendorfP., SzymanskiD., GrzelakP., Strzelczyk J. Preoperative high level of D-dimers predicts unresectability of pancreatic head cancer. World J Gastroenterol. 2014; 20(36): 13167-71. doi: 10.3748/wjg.v20.i36.13167.
- Woei-A-Jin F.J., Tesselaar M.E., Garcia Rodriguez P., Romijn F.P., BertinaR.M., OsantoS. Tissue factor-bearing microparticles and CA19.9: two players in pancreatic cancer-associated thrombosis? Br J Cancer. 2016; 115(3): 332-8. doi: 10.1038/bjc.2016.170.
- Mier-HicksA., RajM., DoR.K., YuK.H., LoweryM.A., VargheseA., O'Reilly E.M. Incidence, Management, and Implications of Visceral Thrombosis in Pancreatic Ductal Adenocarcinoma. Clin Colorectal Cancer. 2018; 17(2): 121-8. doi: 10.1016/j.clcc.2018.01.008.
- Wang H.Y., Xiu D.R., Li Z.F., Wang G. Coagulation function in patients with pancreatic carcinoma. Chin Med J (Engl). 2009; 122(6): 697-700.


