Роботизированная магнитная навигация в сравнении с мануальной радиочастотной аблацией при интервенционном лечении пациентов с фибрилляцией предсердий и увеличенным левым предсердием: результаты propensity score matching анализа
Автор: Романов А.Б., Белобородов В.В., Шабанов В.В., Филиппенко А.Г., Елесин Д.А., Бобошко В.А., Хрущев С.Е., Рузанкин П.С.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Нарушения ритма сердца
Статья в выпуске: 1 т.28, 2024 года.
Бесплатный доступ
Актуальность. Катетерная изоляция устьев легочных вен — основной метод интервенционного лечения пациентов с фибрилляцией предсердий, рефрактерных к антиаритмической терапии. Существуют ограниченные данные о сравнении роботизированной магнитной навигации и мануальной радиочастотной аблации у пациентов с фибрилляцией предсердий и увеличенным левым предсердием. Цель. Сравнить безопасность и отдаленную эффективность радиочастотной катетерной аблации с применением роботизированной магнитной навигации и мануального подхода у пациентов с фибрилляцией предсердий и увеличенным левым предсердием. Методы. В ретроспективное исследование включили 534 пациента (средний возраст 59,2 ± 8,7 года, 41,6 % женщины) с различными формами фибрилляции предсердий и увеличенным левым предсердием (> 4,5 см), которым выполнили радиочастотную изоляцию устьев легочных вен в период с 2016 по 2019 г. Пациентов разделили на две группы в зависимости от метода катетерной аблации: роботизированная магнитная навигация (n = 267) и мануальная радиочастотная аблация (n = 267). Первичная конечная точка по безопасности включала периоперационные осложнения, по эффективности — отсутствие пароксизмов фибрилляции предсердий / трепетания предсердий / предсердной тахикардии > 30 с через 3 мес. после первичной процедуры аблации без приема антиаритмической терапии. Для сравнения результатов лечения в обеих группах применяли псевдорандомизацию 1:1 (англ. propensity score matching, PSM) на основе 11 ковариат. После PSM-анализа в каждой группе отобрали по 235 пациентов. Для дополнительной оценки эффективности исходную когорту разделили на две группы в зависимости от формы фибрилляции предсердий: пароксизмальная (n = 355) и непароксизмальная (n = 179). После PSM-анализа количество больных в группах составило 310 и 136 для пароксизмальной и непароксизмальной форм соответственно. Результаты. В общей когорте после PSM (n = 470) пациенты были полностью сбалансированы по формам фибрилляции предсердий. Средний размер левого предсердия составил 4,98 ± 0,61 и 4,94 ± 0,58 см в группах роботизированной магнитной навигации и мануальной радиочастотной аблации соответственно. С 22 (4,7 %) пациентами из обеих групп не удалось связаться для оценки отдаленной эффективности лечения; ее оценивали по данным 448 больных в обеих группах. Медиана периода наблюдения составила 24 мес. (минимум 3, максимум 72 мес.). В сопоставленной когорте в группе мануальной радиочастотной аблации у 11 (4,7 %) пациентов развились периоперационные осложнения по сравнению с 2 (0,9 %) пациентами в группе роботизированной магнитной навигации (р = 0,021, отношение шансов 5,7 [95% доверительный интервал: 1,22, 53,5]). В общей когорте отсутствие фибрилляции предсердий / трепетания предсердий / предсердной тахикардии через 36 мес. составило 62,6 и 47,9 % в группах роботизированной магнитной навигации и мануальной радиочастотной аблации соответственно (р = 0,005 для всего периода наблюдения; отношение рисков 1,54 [95% доверительный интервал: 1,14, 2,08]). При пароксизмальной фибрилляции предсердий (n = 310) отсутствие фибрилляции предсердий / трепетания предсердий / предсердной тахикардии через 36 мес. в группах роботизированной магнитной навигации и мануальной радиочастотной аблации составило 67,1 и 60,6 % соответственно (p = 0,15 для всего периода наблюдения; отношение рисков 1,34 [95% доверительный интервал: 0,90, 1,98]). При непароксизмальной фибрилляции предсердий (n = 136) сохранение синусового ритма было статистически значимо выше в группе роботизированной магнитной навигации по сравнению с группой мануальной радиочастотной аблации (59,6 и 30,4 % через 36 мес. соответственно, p = 0,005 для всего периода наблюдения; отношение рисков 2,01 [95% доверительный интервал: 1,23, 3,29]) за счет персистирующей фибрилляции предсердий. Заключение. По данным ретроспективного исследования с помощью PSM-анализа, применение роботизированной магнитной навигации для интервенционного лечения пациентов с фибрилляцией предсердий и увеличенным левым предсердием связано с меньшим количеством периоперационных осложнений и большей вероятностью сохранения синусового ритма по сравнению с мануальной радиочастотной аблацией за счет непароксизмальных форм фибрилляции предсердий. Необходимо проведение проспективных рандомизированных исследований для сравнения этих подходов к аблации у пациентов с фибрилляцией предсердий и увеличенным левым предсердием.
Изоляция устьев легочных вен, катетерная аблация, роботизированная магнитная навигация, фибрилляция предсердий
Короткий адрес: https://sciup.org/142240304
IDR: 142240304 | DOI: 10.21688/1681-3472-2024-1-59-72
Текст научной статьи Роботизированная магнитная навигация в сравнении с мануальной радиочастотной аблацией при интервенционном лечении пациентов с фибрилляцией предсердий и увеличенным левым предсердием: результаты propensity score matching анализа
Фибрилляция предсердий (ФП) занимает лидирующую позицию среди всех нарушений ритма сердца в мировой клинической практике. По данным Framingham Heart Study, распространенность ФП в мировой популяции увеличилась в 3 раза за последние 50 лет и продолжает расти [1; 2]. ФП увеличивает риск смерти в 1,5–3,5 раза, риск сердечной недостаточности и инсульта в 5 раз, в 20–30 % случаев является причиной ишемических инсультов, повышает риск когнитивных расстройств и деменции в 1,4–1,6 раза, снижает качество жизни у более чем 60 % пациентов и составляет 10–40 % госпитализаций в стационар ежегодно [3–5]. Катетерная аблация ФП путем изоляции легочных вен (ЛВ) — метод выбора у больных симптоматической ФП, рефрактерной к антиаритмической терапии, а в ряде случаев — первая линия терапии [5]. Тем не менее эффективность первичной процедуры аблации в течение 12-месячного периода наблюдения варьирует от 60 до 80 % для пароксизмальной ФП и от 40 до 70 % для непароксизмальной, несмотря на альтернативные подходы к аблации [4–6]. Снижение эффективности процедуры аблации, особенно в увеличенном левом предсердии (ЛП), может зависеть от маневренности аблационного катетера и его стабильности в труднодоступных анатомических областях.
За последние два десятилетия роботизированная магнитная навигация (РМН) была широко внедрена в клиническую практику для лечения пациентов с различными нарушениями ритма сердца. Техника показала преимущества перед мануальным подходом, высокую безопасность и эффективность при лечении сложных нарушений ритма, в том числе ФП [7–10]. В Российской Федерации также накоплен опыт применения РМН при лечении пациентов с нарушениями ритма сердца [11–14]. Существует ряд публикаций, сравнивающих РМН и мануальную радиочастотную аблацию при лечении ФП [7; 15–17]. Однако представленные данные гетерогенны, а результаты в популяции больных ФП с увеличенным ЛП и длительным периодом послеоперационного наблюдения ограничены, а в отечественной литературе отсутствуют.
Цель исследования — сравнить безопасность и отдаленную эффективность катетерной аблации с применением РМН и мануального подхода у пациентов с различными формами ФП и увеличенным левым предсердием.
Методы
В ретроспективное исследование первоначально отобрали 569 пациентов с различными формами ФП и увеличенным ЛП, которые были направлены на первичную процедуру катетерной аблации в период с 2016 по 2019 г. в ФГБУ «НМИЦ им. ак. Е.Н. Мешал-кина» Минздрава России. Отсеяли 35 (6,1 %) больных, перенесших дополнительные воздействия в ЛП кроме изоляции ЛВ. Критерии включения: пациенты от 18 до 80 лет с различными формами ФП; размер ЛП по данным эхокардиографии > 4,5 cм; показания к катетерной аблации согласно рекомендациям Российского кардиологического общества и Европейского общества кардиологов [3; 4]; документированные данные о ритме и клиническом статусе в отдаленном периоде наблюдения. Критерии исключения: аблация ФП / трепетания предсердий (ТП) / предсердной тахикардии (ПТ) в анамнезе; тромбы в полостях сердца; показания к открытому кардиохирургическому вмешательству или эндоваскулярному вмешательству по сердечно-сосудистой патологии, кроме ФП; фракция выброса левого желудочка < 35 %.
Пациентов разделили на две группы в зависимости от метода катетерной аблации: группа РМН (n = 267) и группа мануальной радиочастотной аблации (n = 267). Первичная конечная точка по безопасности включала периоперационные осложнения, связанные с процедурой аблации (смерть, гемоперикард / тампонада, инсульт / транзиторная ишемическая атака, инфаркт, предсердно-пищеводная фистула, пневмоторакс, сосудистые осложнения в месте доступа). Первичная конечная точка по эффективности определялась как любой документированный пароксизм ФП /ТП / ПТ > 30 с через 3 мес. после первичной процедуры аблации без приема антиаритмической терапии. Для сравнения результатов лечения в обеих группах применяли метод псевдорандомизации 1:1 (англ. propensity score matching, PSM) на основе 11 ковариат. После проведения PSM-анализа в каждой группе отобрали по 235 пациентов (рис. 1). Для дополнительной оценки эффективности общую когорту разделили на две группы в зависимости от формы ФП: пароксизмальная (n = 355) и непароксизмальная (n = 179). После PSM-анализа количество больных в группах составило 310 и 136 для пароксизмальной и непароксизмальной ФП соответственно (рис. 2).
Вторичные конечные точки исследования: время радиочастотного воздействия и продолжительность процедуры, время флюороскопии, предикторы рецидива ФП / ТП / ПТ в отдаленном периоде.
Рис. 1. Дизайн исследования
Примечание.
ФП — фибрилляция предсердий;
ЛП — левое предсердие;
ИЛВ — изоляция легочных вен;
МАН — мануальная радиочастотная аблация;
РМН — роботизированная магнитная навигация;
PSM — propensity score matching analysis, псевдорандомизация.
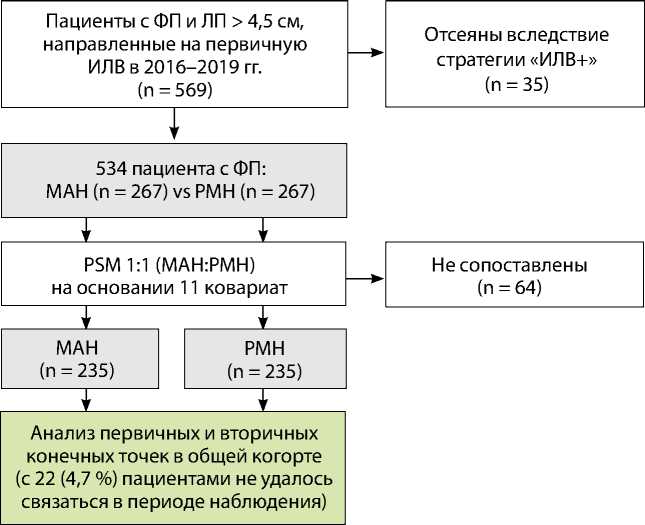
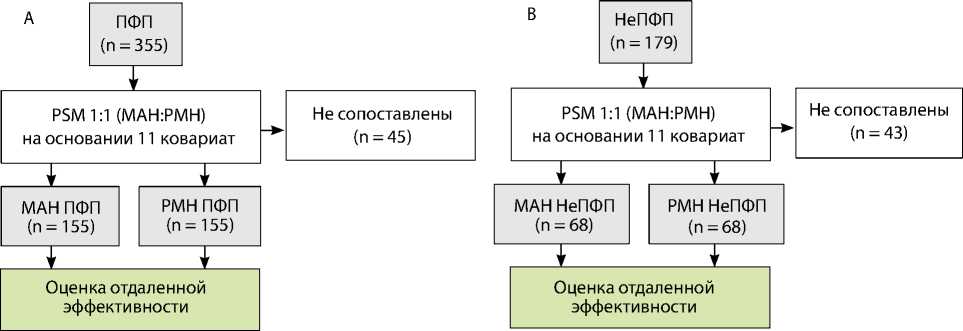
Рис. 2. Дополнительная оценка эффективности для пароксизмальной (A) и непароксизмальной фибрилляции предсердий (B) Примечание. МАН — мануальная радиочастотная аблация; РМН — роботизированная магнитная навигация; ПФП — пароксизмальная фибрилляция предсердий; НеПФП — непароксизмальная фибрилляция предсердий (персистирующая и длительно персистирующая); PSM — propensity score matching analysis, псевдорандомизация.
Техника мануальной радиочастотной аблации
Мануальную радиочастотную катетерную аблацию выполняли по стандартной методике в условиях рентгеноперационной [17; 18] с помощью нефлюороскопической системы навигации CARTO 3 (Biosense Webster, Inc., Даймонд-Бар, США). Катетеры в камеры сердца устанавливали применяя бедренный, подключичный или яремный доступы. Транссептальную пункцию осуществляли стандартным способом под рентгенологическим контролем в правой и левой косых проекциях с введением гепарина и контролем активированного времени свертывания согласно рекомендациям [3–5]. С помощью системы нефлюороскопической навигации и аблационного катетера выполняли построение 3D-модели ЛП и устьев ЛВ. Далее аблационным катетером при скорости орошения 30 мл/мин наносили радиочастотные воздействия с созданием циркулярной замкнутой линии вокруг правых / левых ЛВ по стандартной методике [17; 18]. Блок входа и выхода подтверждали с помощью циркулярного катетера. При наличии ФП после завершения изоляции ЛВ проводили электроимпульсную терапию. В случае возникновения или документированного в анамнезе типичного ТП выполняли аблацию каво-трикуспидального перешейка.
Техника роботизированной катетерной аблации
Система роботизированной магнитной навигации Niobe (Stereotaxis, Inc., Сент-Луис, США) состоит из двух постоянных магнитов, которые расположены по обе стороны от пациента. Магниты создают по- стоянное магнитное поле напряженностью 0,08 или 0,1 Тл, в котором движется аблационный катетер. Подробно устройство и принцип работы системы РМН описывали ранее [8; 12–14; 17]. На подготовительном этапе дважды выполняли транссептальную пункцию для позиционирования аблационного и диагностического катетеров в ЛП. Для построения 3D-электроанатомической реконструкции ЛП в ряде случаев применяли циркулярный катетер (Lasso 2515 Nav; Biosense Webster, Inc., Даймонд-Бар, США). Для стабильности аблационного катетера использовали управляемый интродьюсер, повышающий эффективность прижатия катетера в увеличенной полости ЛП. Техника выполнения и основные этапы катетерной аблации с применением РМН схожи с мануальной, однако имеют отличия. Так, после этапа установки катетеров в ЛП хирург перемещается в пультовую. Дистанционное управление абла-ционным катетером осуществляется компьютерной мышью или специальным пультом с помощью системы Cardiodrive (Stereotaxis, Inc., Сент-Луис, США). Аблационные воздействия наносятся специальным катетером (NaviStar RMT Thermocool; Biosense Webster, Inc., Даймонд-Бар, США) при скорости орошения 17 мл/мин с ограничением по мощности до 55 Вт по передней стенке ЛП и до 50 Вт по задней стенке. Прижатие аблационного катетера оценивали по шкале контакта, являющейся частью модуля ablation history (функция, позволяющая оценить повреждение в конкретной точке с учетом мощности воздействия и времени стабильного нахождения в месте аблации), при этом показатель ablation history (мощность/время) находился в диапазоне 250–400 для каждого воздействия (рис. 3).
A
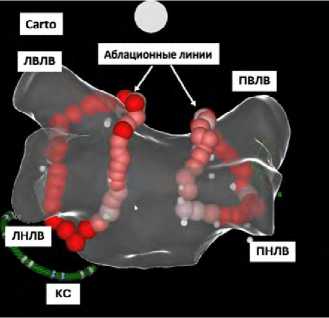
Рис. 3. Техника катетерной аблации фибрилляции предсердий в группах мануальной и роботизированной магнитной навигации: мануальная радиочастотная изоляция устьев легочных вен c помощью системы нефлюороскопической навигации CARTO (A); радиочастотная изоляция устьев легочных вен с применением роботизированной магнитной навигации, система Stereotaxis Niobe (B)
В
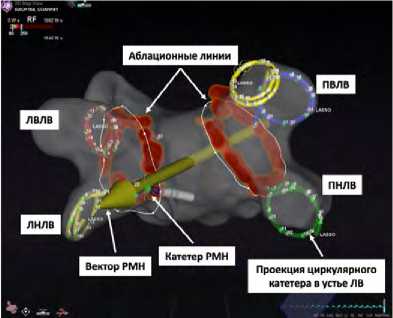
Примечание. РМН — роботизированная магнитная навигация; ЛВЛВ — левая верхняя легочная вена; ЛНЛВ — левая нижняя легочная вена; ПВЛВ — правая верхняя легочная вена; ПНЛВ — правая нижняя легочная вена; ЛВ — легочная вена; КС — коронарный синус. Белые циркулярные линии — планируемая область аблационного воздействия. Красными линиями обозначены аблационные воздействия вокруг устьев легочных вен.
Контрольное наблюдение
Оценку отдаленной эффективности проводили по анализу данных 24-часового холтеровского мониторирования электрокардиограммы через 3 мес. после процедуры аблации (или данных ЭКГ с зафиксированным эпизодом ФП / ТП / ПТ) с интервалом каждые 3 мес. до года после операции и далее каждые 6 мес. в зависимости от длительности периода наблюдения. Антикоагулянтную и антиаритми-ческую терапию в течение периода наблюдения назначал и корректировал лечащий кардиолог.
Статистический анализ
Оценку необходимого размера выборки не производили, в исследование включили пациентов, перенесших первичную аблацию по поводу ФП в период с 2016 по 2019 г. Оценка мощности по методу Фридмана с учетом наблюдаемой (во всей выборке) частоты ФП / ТП / ПТ для сравнения двух групп по 235 пациентов составила 87 % для определения отношения рисков 1,5. Для оценки первичных конечных точек по безопасности и эффективности между группами РМН и мануальной радиочастотной аблации провели PSM-анализ. Вероятность лечения (propensity score) оценивали с помощью логистической регрессии с объясняющими переменными: возраст, пол, индекс массы тела, артериальная гипертензия, сахарный диабет, инсульт / транзи- торная ишемическая атака, ишемическая болезнь сердца, форма ФП (как категориальная переменная с категориями: пароксизмальная, персистирующая, длительно персистирующая), длительность ФП, размер ЛП, фракция выброса левого желудочка. Проводили сопоставление (matching) 1:1 без возвращения, использовали алгоритм выбора ближайшего соседа для линейных вероятностей. Сопоставление было точным по форме ФП (пароксизмальная, персистирующая, длительно персистирующая). Использовали «охват циркуля» (caliper) 0,03. «Охват циркуля» выбрали как наименьшее из чисел от 0,001 до 0,1 с шагом 0,001, дающее допустимое сопоставление (matching) и сопоставляющее наибольшее возможное количество пар для допустимых сопоставлений. Сопоставление считали допустимым, если абсолютные стандартизированные разности для всех ковариат, перечисленных выше, были < 0,1, и отношения дисперсий для всех непрерывных ковариат (возраст, индекс массы тела, длительность ФП, размер ЛП, фракция выброса левого желудочка) были < 2 и > 0,5. Стандартизированные разности вычисляли как стандартизированные разности средних с общим (pooled) стандартным отклонением для непрерывных переменных и как разности пропорций для бинарных переменных. После сопоставления бинарные конечные точки (осложнения и эффективность) между группами мануальной радиочастотной аблации и РМН сравнивали при помощи условной логистической регрессии. Также провели анализ рецидива ФП / ТП / ПТ в отдаленном периоде наблюдения отдельно для двух групп: с пароксизмальной и непароксизмальной ФП. В каждой из групп провели PSM-анализ так же, как при анализе первичного исхода. В группе пароксизмальной ФП выбрали caliper = 0,051, в группе непароксизмальной ФП — caliper = 0,024. В каждой из этих групп (пароксизмальная и непароксизмальная ФП) для сопоставленных данных (matched data) сравнивали появление ФП в долгосрочном послеоперационном периоде между группами мануальной радиочастотной аблации и РМН при помощи регрессии Кокса с одной ковариатой: группа мануальной радиочастотной аблации / РМН. Кроме того, группу с непароксизмальной ФП разделили на персистирующую и длительно персистирующую для оценки отдаленной эффективности с аналогичным анализом, что графически выразили в построении кривых Каплана – Мейера.
На основании визуальной проверки гистограмм все непрерывные переменные оценивали на нормальность. При нормальном распределении непрерывные переменные представлены как среднее ± стандартное отклонение. При распределении, отличном от нормального, непрерывные переменные представлены в виде: медиана (интерквартильный интервал). Время аблации, флюороскопии и общую продолжительность оперативного лечения сравнивали между сопоставленными группами с помощью квантильной регрессии. Для срав- нения отдаленных исходов после сопоставления использовали однофакторную регрессию Кокса. Бинарные переменные для несопоставленных данных сравнивали критерием хи-квадрат. Сравнение бинарных сопоставленных переменных осуществляли однофакторной условной логистической регрессией. Кроме того, провели расчет многофакторной регрессии Кокса для изучения переменных, связанных с отсутствием рецидива ФП / ТП / ПТ. Значение р < 0,05 считали статистически достоверным. Статистические расчеты производили с помощью пакетов R version 4.3.3 (R Foundation for Statistical Computing, Вена, Австрия, и Stata 12.2 (StataCorp LP, Колледж-Стейшен, США).
Результаты
Согласно критериям отобрали 534 пациента (по 267 в каждой группе) для проведения PSM-анализа на основании 11 ковариат. После PSM 64 (12 %) больных не были сопоставлены. В общей сопоставленной когорте (n = 470) 67,7 % (n = 318) пациентов имели пароксизмальную ФП, 32,3 % (n = 152) — непароксизмальную, из которой 57,9 % (n = 88) составила персистирующая ФП, 42,1 % (n = 64) — длительно персистирующая. Средний возраст пациентов — 59,0 ± 8,8 года. Группы были полностью сбалансированы по формам ФП. В табл. 1–2 представлены дооперационные характеристики пациентов до и после PSM для анализа первичных конечных точек по безопасности и эффективности.
Табл. 1. Дооперационные характеристики пациентов до псевдорандомизации
Несопоставленная когорта (unmatched), n = 534
|
Группа |
МАН |
РМН |
АСР |
|
Количество пациентов, n (%) |
267 (100) |
267 (100) |
|
|
Возраст, лет |
59,1 ± 9,1 |
59,3 ± 8,4 |
0,025 |
|
Мужской пол, n (%) |
147 (55,1) |
165 (61,8) |
0,067 |
|
Индекс массы тела, кг/м2 |
30,8 ± 4,8 |
30,6 ± 4,5 |
0,036 |
|
Артериальная гипертензия, n (%) |
239 (89,5) |
229 (85,8) |
0,037 |
|
Сахарный диабет, n (%) |
24 (9) |
33 (12,4) |
0,034 |
|
Инсульт / транзиторная ишемическая атака, n (%) |
10 (3,7) |
19 (7,1) |
0,034 |
|
Ишемическая болезнь сердца, n (%) |
66 (24,7) |
87 (32,6) |
0,079 |
|
Пароксизмальная ФП, n (%) |
186 (69,7) |
169 (63,3) |
0,064 |
|
Персистирующая ФП, n (%) |
49 (18,4) |
55 (20,6) |
0,022 |
|
Длительно персистирующая ФП, n (%) |
32 (12) |
43 (16,1) |
0,041 |
|
Длительность ФП, мес. |
67,8 ± 52,8 |
64,5 ± 43,2 |
0,069 |
|
Размер левого предсердия, см |
4,9 ± 0,6 |
5 ± 0,6 |
0,138 |
|
Фракция выброса левого желудочка, % |
62,4 ± 6,3 |
62,3 ± 5,9 |
0,008 |
Примечание. ФП — фибрилляция предсердий; МАН — группа мануальной радиочастотной аблации; РМН — группа роботизированной магнитной навигации; АСР — абсолютные стандартизированные разности; PSM — propensity score matching, псевдорандомизация.
Табл. 2. Дооперационные характеристики пациентов после псевдорандомизации
|
Сопоставленная когорта (matched), n = 470 |
|||
|
Группа |
МАН |
РМН |
АСР |
|
Количество пациентов, n (%) |
235 (100) |
235 (100) |
|
|
Возраст, лет |
58,9 ± 9,1 |
59,3 ± 8,5 |
0,012 |
|
Мужской пол, n (%) |
140 (59,6) |
146 (62,1) |
0,026 |
|
Индекс массы тела, кг/м2 |
30,5 ± 4,5 |
30,5 ± 4,4 |
0,007 |
|
Артериальная гипертензия, n (%) |
209 (88,9) |
200 (85,1) |
0,038 |
|
Сахарный диабет, n (%) |
21 (8,9) |
24 (10,2) |
0,013 |
|
Инсульт / транзиторная ишемическая атака, n (%) |
9 (3,8) |
11 (4,7) |
0,009 |
|
Ишемическая болезнь сердца, n (%) |
61 (26) |
71 (30,2) |
0,043 |
|
Пароксизмальная ФП, n (%) |
159 (67,7) |
159 (67,7) |
0 |
|
Персистирующая ФП, n (%) |
44 (18,7) |
44 (18,7) |
0 |
|
Длительно персистирующая ФП, n (%) |
32 (13,6) |
32 (13,6) |
0 |
|
Длительность ФП, мес. |
64,6 ± 52 |
64,4 ± 42,9 |
0,003 |
|
Размер левого предсердия, см |
4,9 ± 0,6 |
5 ± 0,6 |
0,063 |
|
Фракция выброса левого желудочка, % |
62,4 ± 6,3 |
62,5 ± 5,9 |
0,022 |
Примечание. ФП — фибрилляция предсердий; МАН — группа мануальной радиочастотной аблации; РМН — группа роботизированной магнитной навигации; АСР — абсолютные стандартизированные разности; PSM — propensity score matching, псевдорандомизация.
Первичная конечная точка по безопасности. Периоперационные осложнения
В группе мануальной радиочастотной аблации у 11 (4,7 %) пациентов развились периоперационные осложнения по сравнению с 2 (0,9 %) в группе РМН (р = 0,021, отношение шансов 5,7 [95% доверительный интервал: 1,22, 53,5]) (табл. 3). В группе РМН у 1 (0,4 %) больного выявили гематому в области пункции бедренной вены, также у 1 (0,4 %) развился левосторонний пневмоторакс вследствие пункции левой подключичной вены, который успешно разрешился до выписки из стационара. В группе мануальной радиочастотной аблации в раннем послеоперационном периоде имели место один случай транзиторной ишемической атаки и один случай ишемического инсульта. Во всех случаях проявления события разрешились до выписки пациентов из стационара. У 2 (0,9 %) пациентов в группе мануальной радиочастотной аблации интраоперационно развился гемоперикард и у 2 (0,9 %) тампонада сердца. Данные неблагоприятные события развились вследствие транссептальной пункции (n = 2) и во время аблационных воздействий в ЛП (n = 2). Интраоперационно выполнили пункцию перикарда и установили дренаж в перикардиальную полость. Осложнения были успешно разрешены до выписки пациентов. Сосудистые осложнения в виде постпункционных гематом наблюдались у 3 (1,3 %) пациентов и также были успешно разрешены к моменту выписки.
Табл. 3. Интраоперационные осложнения
|
Осложнение |
МАН, n = 235 |
РМН, n = 235 |
р |
|
Смерть, n (%) |
0 (0) |
0 (0) |
> 0,99 |
|
Гемоперикард, n (%) |
2 (0,9) |
0 (0) |
0,5 |
|
Тампонада, n (%) |
2 (0,9) |
0 (0) |
0,5 |
|
Инсульт, n (%) |
1 (0,4) |
0 (0) |
> 0,99 |
|
Транзиторная ишемическая атака, n (%) |
1 (0,4) |
0 (0) |
> 0,99 |
|
Инфаркт, n (%) |
0 (0) |
0 (0) |
> 0,99 |
|
Предсердно-пищеводная фистула, n (%) |
0 (0) |
0 (0) |
> 0,99 |
|
Сосудистые осложнения, n (%) |
3 (1,3) |
1 (0,4) |
0,62 |
|
Пневмоторакс, n (%) |
2 (0,9) |
1 (0,4) |
> 0,99 |
|
Всего, n (%) |
11 (4,7) |
2 (0,9) |
0,021 |
Примечание. МАН — группа мануальной радиочастотной аблации; РМН — группа роботизированной магнитной навигации.
Первичная конечная точка по эффективности (отсутствие фибрилляции предсердий / трепетания предсердий / предсердной тахикардии в отдаленном периоде наблюдения)
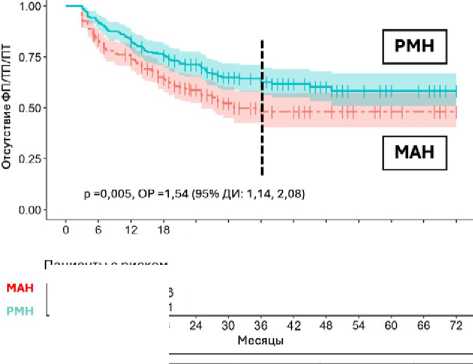
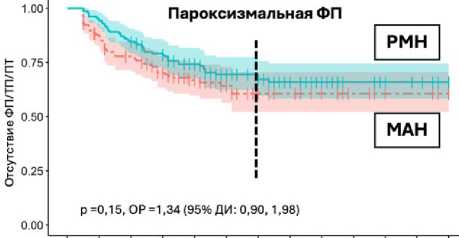
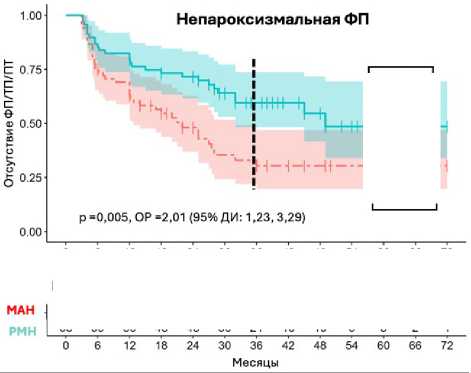
В сопоставленной когорте (n = 470) не удалось связаться c 22 (4,7 %) пациентами из обеих групп для оценки отдаленной эффективности, поэтому использовали данные 448 больных (по 224 в каждой группе). Медиана периода наблюдения составила 24 мес. (минимум 3, максимум 72 мес.). В общей когорте (n = 448) отсутствие ФП / ТП / ПТ через 36 мес. составило 62,6 и 47,9 % в группах РМН и мануальной радиочастотной аблации соответственно (р = 0,005 для всего периода наблюдения). После PSM в сопоставленной когорте в зависимости от формы ФП при пароксизмальной ФП (n = 310) отсутствие ФП / ТП / ПТ через 36 мес. в группах РМН и мануальной радиочастотной аблации составило 67,1 и 60,6 % соответственно (p = 0,15 для всего периода наблюдения). При непароксизмальной ФП (n = 136) сохранение синусового ритма было статистически значимо выше в группе РМН по сравнению с группой мануальной радиочастотной аблации (59,6 и 30,4 % через 36 мес. соответственно, p = 0,005 для всего периода наблюдения) за счет персистирующей ФП.
Пациенты с риском
|
24 |
30 36 42 Месяцы |
48 |
54 |
60 |
66 |
72 |
|
80 |
46 29 20 |
16 |
11 |
8 |
6 |
2 |
|
139 |
102 76 49 |
35 |
19 |
14 |
11 |
2 |
224 185 164 126
224 207 188 161
0 6 12 18
|
Месяцы после операции |
12 |
24 |
36 |
|
Эффективность РМН |
82,6% |
71,2% |
62,6% |
|
Эффективность МАИ |
73,8% |
58,6% |
47,9% |
|
Р-значение |
0,017 |
0,005 |
0,003 |
A
B
|
6 |
6 |
12 |
18 |
24 |
30 36 |
42 |
48 |
54 |
60 |
66 |
72 |
|
|
Пациенты с риском |
Месяць |
|||||||||||
|
МАН |
155 |
133 |
116 |
96 |
66 |
38 21 |
14 |
11 |
7 |
5 |
4 |
2 |
|
РМН |
155 |
147 |
131 |
115 |
100 |
78 60 |
39 |
27 |
14 |
10 |
8 |
1 |
|
6 |
6 |
12 |
18 |
24 |
30 36 Месяцы |
42 |
48 |
54 |
60 |
66 |
72 |
|

Рис. 4. Отсутствие фибрилляции предсердий / трепетания предсердий / предсердной тахикардии в общей сопоставленной когорте (n = 448) в течение периода наблюдения Примечание. МАН — группа мануальной радиочастотной аблации; РМН — группа роботизированной магнитной навигации; ФП — фибрилляция предсердий;
ТП — трепетание предсердий; ПТ — предсердная тахикардия; ОР — отношение рисков; ДИ — доверительный интервал.
|
6 6 12 18 Пациенты с риском |
24 |
30 36 42 Месяцы |
48 |
54 |
60 66 |
72 |
|
68 51 46 31 |
20 |
14 13 9 |
7 |
5 |
4 3 |
1 |
|
68 59 56 48 |
45 |
30 21 13 |
10 |
6 |
3 2 |
1 |
|
Месяцы после операции |
12 |
24 |
36 |
|
Эффективность РМН |
84,5% |
74,2% |
67,1% |
|
Эффективность МАН |
77,1% |
66,9% |
60,6% |
|
Р-значение |
0,073 |
0,11 |
0,13 |
|
Месяцы после операции |
12 |
24 |
36 |
|
Эффективность РМН |
79,4% |
71,6% |
59,6% |
|
Эффективность МАН |
63% |
48,1% |
30,4 % |
|
Р-значение |
0,041 |
0,011 |
0,003 |
Рис. 5. Отсутствие фибрилляции предсердий / трепетания предсердий / предсердной тахикардии в течение периода наблюдения: у пациентов с пароксизмальной фибрилляцией предсердий (n = 310) (A); у пациентов с непароксизмальной фибрилляцией предсердий (n = 136) (B)
Примечание. МАН — группа мануальной радиочастотной аблации; РМН — группа роботизированной магнитной навигации;
ФП — фибрилляция предсердий; ТП — трепетание предсердий; ПТ — предсердная тахикардия; ОР — отношение рисков;
ДИ — доверительный интервал.
A
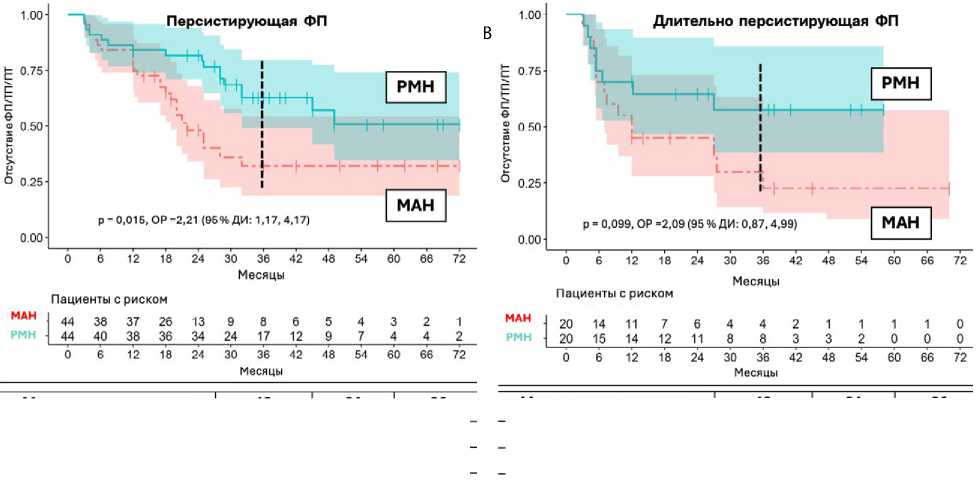
Рис. 6. Отсутствие фибрилляции предсердий / трепетания предсердий / предсердной тахикардии в течение периода наблюдения: у пациентов с персистирующей фибрилляцией предсердий (n = 88) (A); у пациентов с длительно персистирующей фибрилляцией предсердий (n = 40) (B)
Примечание. МАН — группа мануальной радиочастотной аблации; РМН — группа роботизированной магнитной навигации;
ФП — фибрилляция предсердий; ТП — трепетание предсердий; ПТ — предсердная тахикардия; ОР — отношение рисков;
ДИ — доверительный интервал.
|
Месяцы после операции |
12 |
24 |
36 |
|
Эффективность РМН |
84,1% |
81,8% |
62,6% |
|
Эффективность МАН |
77,3% |
48% |
32% |
|
Р^значение |
0,44 |
0,008 |
0,007 |
|
Месяцы после операции |
12 |
24 |
36 |
|
Эффективность РМН |
70% |
64,6% |
57,4% |
|
Эффективность МАН |
45% |
45% |
22.5% |
|
Р-значение |
0,18 |
0,26 |
0,099 |
Динамика рецидива ФП / ТП / ПТ в группах мануальной радиочастотной аблации и РМН представлена на рис. 4–6.
Вторичные конечные точки
Время аблации, флюороскопии, продолжительность оперативного лечения и интраоперационный объем ЛП по данным 3D-реконструкции ЛП приведены в табл. 4. Время флюороскопии в группе РМН было значимо меньше, чем в группе мануальной радиочастотной аблации, и составило 9 (7; 12) против 14 (12; 15) мин соответственно (р < 0,001).
По данным многофакторной регрессии Кокса, предикторами рецидива ФП / ТП / ПТ являлись: мануальная радиочастотная аблация (ОР 1,75, 95% ДИ: 1,30, 2,35, р < 0,001), мужской пол (ОР 1,63, 95% ДИ:
1,17, 2,28, р = 0,003), сахарный диабет (ОР 1,67, 95% ДИ: 1,08, 2,59, р = 0,021), размер ЛП (ОР 1,34, 95% ДИ: 1,04, 1,75, р = 0,025) и длительно персистирующая ФП (ОР 1,75, 95% ДИ: 1,17, 2,63, р = 0,007).
Обсуждение
В данном ретроспективном исследовании на основе PSM-анализа мы сравнили результаты применения мануального и роботизированного подходов к аблации у пациентов с ФП и увеличенным ЛП. Основные результаты: 1) РМН связана с меньшим процентом интраоперационных осложнений по сравнению с мануальной радиочастотной аблацией (0,9 и 4,7 % соответственно, р = 0,021); 2) отсутствие ФП / ТП / ПТ в периоде наблюдения 36 мес.
Табл. 4. Интраоперационные данные
|
Показатель |
МАН, n = 235 |
РМН, n = 235 |
Разница РМН-МАН [95% ДИ] |
р |
|
Объем ЛП, мл |
120 (120, 120) |
120 (110, 141) |
0 [0, 9] |
0,034 |
|
Время аблации, мин |
45 (36,5, 45) |
50 (42, 64,5) |
10 [7, 13] |
< 0,001 |
|
Время процедуры, мин |
105 (90, 120) |
140 (120, 162,5) |
35 [30, 40] |
< 0,001 |
|
Время флюороскопии, мин |
14 (12, 15) |
9 (7, 12) |
-4 [-5, -3] |
< 0,001 |
Примечание. МАН — группа мануальной радиочастотной аблации; РМН — группа роботизированной магнитной навигации; ЛП — левое предсердие; ДИ — доверительный интервал.
статистически значимо выше в группе РМН по сравнению с группой мануальной радиочастотной аблации, преимущественно за счет непароксизмальных форм ФП (62,6 по сравнению с 47,9 % соответственно, р = 0,005 для всего периода наблюдения); 3) при пароксизмальной ФП в периоде наблюдения 36 мес. отсутствует статистическая значимость в превосходстве РМН над мануальной радиочастотной аблацией (67,1 по сравнению с 60,6 % соответственно, р = 0,13), в то время как при непароксизмальной ФП роботизированный подход имеет преимущества в эффективности над мануальным (59,6 по сравнению с 30,4 % соответственно, р = 0,003); 4) при непароксизмальных формах ФП РМН в 2,21 раза увеличивает вероятность сохранения синусового ритма по сравнению с мануальной радиочастотной аблацией при персистирующей ФП (р = 0,015, 95% ДИ: 1,17, 4,17), с отсутствием различий при длительно персистирующей ФП (р = 0,099, ОР 2,09, 95% ДИ: 0,87, 4,99); 5) РМН связана с меньшим временем использования флюороскопии по сравнению с мануальной радиочастотной аблацией (9 и 14 мин соответственно, р < 0,001), но большими временем аблации и продолжительностью процедуры (50 и 40 мин соответственно, р < 0,001 и 140 и 105 мин соответственно, р < 0,001); 6) предикторами рецидива ФП / ТП / ПТ являлись мануальная радиочастотная аблация, мужской пол, сахарный диабет, размер ЛП и длительно персистирующая фибрилляция предсердий.
В последние два десятилетия РМН широко применяется для лечения различных видов нарушений ритма сердца благодаря высокой эффективности и безопасности [7–14]. Кроме того, по мере развития роботизированных технологий в них были внесены значительные технические усовершенствования. Так, система РМН третьего поколения (Niobe ES) значительно сократила время процедуры по сравнению с предыдущими поколениями благодаря улучшенному времени отклика системы на изменение вектора магнитного поля [19]. Функция ablation history обеспечивает визуальное отображение параметров воздействия (мощность / время в точке аблации) на 3D-реконструкцию камер сердца [20]. Кроме того, при изоляции ЛВ с применением РМН используется подход высокой мощности с относительно коротким временем воздействия (задняя стенка ЛП до 50 Вт, передняя стенка до 55 Вт), что сопоставимо с современными тенденциями и параметрами воздействия при мануальном подходе [21].
Существуют ограниченные данные по сравнению эффективности РМН и мануальной радиочастотной аблации ФП при увеличенном размере ЛП, а проспективные рандомизированные исследования отсутствуют. Результаты имеющихся работ в ряде аспектов противоречивы и обусловлены гетерогенностью популяции пациентов с ФП, отсутствием анализа подгрупп, ранними модификациями применения РМН с анализом данных более 15 лет назад, различными параметрами аблации при использовании роботизированной магнитной навигации.
Так, P.P. Adragão и соавт. в ретроспективном исследовании (PSM-анализ) при сравнении РМН и мануального подхода показали (на основании анализа данных 574 пациентов), что методы сопоставимы по эффективности и безопасности с меньшим временем флюороскопии в группе РМН, но большей продолжительностью процедуры [16]. Следует отметить, что данные пациентов анализировались с 2008 г., когда использовалось первое поколение системы роботизированной магнитной навигации.
В недавно опубликованном проспективном сравнительном исследовании A.M.E. Noten и со-авт. оценили эффективность лечения пациентов с пароксизмальной ФП (n = 221) с помощью РМН, радиочастотного и криобаллонного мануальных подходов к аблации [17]. РМН имела статистически значимые преимущества над мануальными радиочастотным и криобаллонным подходами в отношении сохранения синусового ритма в течение 12 мес. с сопоставимыми процентом осложнений и длительностью процедуры.
В нашем исследовании мы предположили, что РМН будет иметь преимущества над мануальной радиочастотной аблацией по безопасности и отдаленной эффективности у пациентов с ФП и увеличенным ЛП, особенно при непароксизмальных формах, а также снизит время использования флюороскопии. Полученные нами результаты схожи с данными исследования A.M.E. Noten и соавт. по эффективности, а также данными метаанализа по оценке безопасности, времени флюороскопии и продолжительности оперативного лечения [15; 17]. Предположения относительно преимуществ по эффективности РМН над мануальным подходом кроме модификации самой системы РМН можно отчасти объяснить гибкостью и маневренностью аблаци-онного катетера РМН в увеличенном ЛП, а также постоянным магнитным полем, что позволяет достигать анатомически трудных областей и увеличить стабильность катетера, а тем самым трансмураль-ность аблационного воздействия, что повышает эффективность процедуры.
В проведенной работе максимальный период наблюдения составил 72 мес. Учитывая, что основной массив доступных данных по оценке эффективности приходился на 12, 24, 36 мес., мы решили сфокусироваться на трехлетнем периоде наблюдения для оценки отдаленных результатов.
Ограничения
Исследование имеет ряд ограничений: 1) ретроспективный дизайн и выполнение оперативных вмешательств в одном центре. Тем не менее детальный PSM-анализ позволил добиться баланса по всем заданным ковариатам; 2) оперативные вмешательства выполняли разные хирурги, особенно в группе мануальной радиочастотной аблации, что могло повлиять на результаты. Однако каждый хирург имел опыт выполнения катетерной аблации ФП не менее 300 процедур при мануальной методике; 3) с 4,7 % пациентов не удалось связаться для получения данных об отдаленной эффективности; 4) анализ отдаленной эффективности основывался на данных 24-часового холтеровского мониторирования электрокардиограммы или данных ЭКГ в определенные временные промежутки, что не исключает возможность рецидивов ФП / ТП / ПТ вне этих временных рамок, что могло быть нивелировано устройствами непрерывного мониторинга сердечного ритма; 5) дооперационную оценку размеров ЛП проводили по данным эхокардиографии как рутинного метода обследования данной категории пациентов. Применение методов компьютерной томографии могло бы более точно определить степень увеличения левого предсердия.
Заключение
По данным ретроспективного исследования с помощью PSM, применение РМН для интервенционного лечения пациентов с ФП и увеличенным ЛП свя- 5. зано с меньшим количеством периоперационных осложнений и большей вероятностью сохранения синусового ритма по сравнению с мануальной радиочастотной аблацией за счет непароксизмальных форм ФП. Необходимо проведение проспективных рандомизированных исследований для сравнения РМН и мануальной радиочастотной аблации у пациентов с ФП и увеличенным левым предсердием.
Список литературы Роботизированная магнитная навигация в сравнении с мануальной радиочастотной аблацией при интервенционном лечении пациентов с фибрилляцией предсердий и увеличенным левым предсердием: результаты propensity score matching анализа
- Schnabel R.B., Yin X., Gona P., Larson M.G., Beiser A.S., McManus D.D., Newton-Cheh C., Lubitz S.A., Magnani J.W., Ellinor P.T., Seshadri S., Wolf P.A., Vasan R.S., Benjamin E.J., Levy D. 50 year trends in atrial fibrillation prevalence, incidence, risk factors, and mortality in the Framingham Heart Study: a cohort study. Lancet. 2015;386(9989):154-162. PMID: 25960110; PMCID: PMC4553037. https://doi.org/10.1016/S0140-6736(14)61774-8
- Kornej J., Börschel C.S., Benjamin E.J., Schnabel R.B. Epidemiology of atrial fibrillation in the 21st century: novel methods and new insights. Circ Res. 2020;127(1):4-20. PMID: 32716709; PMCID: PMC7577553. https://doi.org/10.1161/CIRCRESAHA.120.316340
- Аракелян М.Г., Бокерия Л.А., Васильева Е.Ю., Голицын С.П., Голухова Е.З., Горев М.В., Давтян К.В., Драпкина О.М., Кропачева Е.С., Кучинская Е.А., Лайович Л.Ю., Миронов Н.Ю., Мишина И.Е., Панченко Е.П., Ревишвили А.Ш., Рзаев Ф.Г., Татарский Б.А., Уцумуева М.Д., Шахматова О.О., Шлевков Н.Б., Шпектор А.В., Андреев Д.А., Артюхина Е.А., Барбараш О.Л., Галявич А.С., Дупляков Д.В., Зенин С.А., Лебедев Д.С., Михайлов Е.Н., Новикова Н.А., Попов С.В., Филатов А.Г., Шляхто Е.В., Шубик Ю.В. Фибрилляция и трепетание предсердий. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4594. https://doi.org/10.15829/1560-4071-2021-4594 Arakelyan M.G., Bockeria L.A., Vasilieva E.Yu., Golitsyn S.P., Golukhova E.Z., Gorev M.V., Davtyan K.V., Drapkina O.M., Kropacheva E.S., Kuchinskaya E.A., Lajovich L.Yu., Mironov N.Yu., Mishina I.E., Panchenko E.P., Revishvili A.Sh., Rzayev F.G., Tatarsky B.A., Utsumueva M.D., Shakhmatova O.O., Shlevkov N.B., Shpektor A.V., Andreev D.A., Artyukhina E.A., Barbarash O.L., Galyavich A.S., Duplyakov D.V., Zenin S.A., Lebedev D.S., Mikhailov E.N., Novikova N.A., Popov S.V., Filatov A.G., Shlyakhto E.V., Shubik Yu.V. 2020 Clinical guidelines for atrial fibrillation and atrial flutter. Russian Journal of Cardiology. 2021;26(7):4594. (In Russ.) https://doi.org/10.15829/1560-4071-2021-4594
- Hindricks G., Potpara T., Dagres N., Arbelo E., Bax J.J., Blomström-Lundqvist C., Boriani G., Castella M., Dan G.-A., Dilaveris P.E., Fauchier L., Filippatos G., Kalman J.M., La Meir M., Lane D.A., Lebeau J.-P., Lettino M., Lip G.Y.H., Pinto F.J., Thomas G.N., Valgimigli M., Van Gelder I.C., Van Putte B.P., Watkins C.L.; ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021;42(5):373-498. PMID: 32860505. https://doi.org/10.1093/eurheartj/ehaa612
- Joglar J.A., Chung M.K., Armbruster A.L., Benjamin E.J., Chyou J.Y., Cronin E.M., Deswal A., Eckhardt L.L., Goldberger Z.D., Gopinathannair R., Gorenek B., Hess P.L., Hlatky M., Hogan G., Ibeh C., Indik J.H., Kido K., Kusumoto F., Link M.S., Linta K.T., Marcus G.M., McCarthy P.M., Patel N., Patton K.K., Perez M.V., Piccini J.P., Russo A.M., Sanders P., Streur M.M., Thomas K.L., Times S., Tisdale J.E., Valente A.M., Van Wagoner D.R. 2023 ACC/AHA/ACCP/HRS Guideline for the Diagnosis and Management of Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2024;149(1):e1-e156. PMID: 38033089. https://doi.org/10.1161/CIR.0000000000001193
- Pokushalov E., Romanov A., Artyomenko S., Shirokova N., Turov A., Karaskov A., Katritsis D.G., Po S.S. Ganglionated plexi ablation directed by high-frequency stimulation and complex fractionated atrial electrograms for paroxysmal atrial fibrillation. Pacing Clin Electrophysiol. 2012;35(7):776-784. PMID: 22486215. https://doi.org/10.1111/j.1540-8159.2012.03392.x
- Kataria V., Berte B., Vandekerckhove Y., Tavernier R., Duytschaever M. Remote magnetic versus manual navigation for radiofrequency ablation of paroxysmal atrial fibrillation: long-term, controlled data in a large cohort. Biomed Res Int. 2017;2017:6323729. PMID: 28386560; PMCID: PMC5366771. https://doi.org/10.1155/2017/6323729
- Jin Q.I., Pehrson S., Jacobsen P.K., Chen X.U. Efficacy and safety of atrial fibrillation ablation using remote magnetic navigation: experience from 1,006 procedures. J Cardiovasc Electrophysiol. 2016;27 Suppl 1:S23-S28. PMID: 26969219. https://doi.org/10.1111/jce.12929
- Ueda A., Suman-Horduna I., Mantziari L., Gujic M., Marchese P., Ho S.Y., Babu-Narayan S.V., Ernst S. Contemporary outcomes of supraventricular tachycardia ablation in congenital heart disease: a single-center experience in 116 patients. Circ Arrhythm Electrophysiol. 2013;6(3):606-613. PMID: 23685536. https://doi.org/10.1161/CIRCEP.113.000415
- Blandino A., Bianchi F., Sibona Masi A., Mazzanti A., D'Ascenzo F., Grossi S., Musumeci G. Outcomes of manual versus remote magnetic navigation for catheter ablation of ventricular tachycardia: a systematic review and updated meta-analysis. Pacing Clin Electrophysiol. 2021;44(6):1102-1114. PMID: 33825206. https://doi.org/10.1111/pace.14231
- Romanov A., Filippenko A., Elesin D., Losik D., Grishkov A., Shabanov V. Remote magnetic navigation ablation via the right jugular vein approach in patient with interruption of the inferior vena cava and incessant left atrial flutter. Pacing Clin Electrophysiol. 2021;44(2):385-388. PMID: 32969523. https://doi.org/10.1111/pace.14078
- Белобородов В.В., Елемесов Н.А., Пономаренко А.В., Моржанаев Е.А., Филиппенко А.Г., Михеенко И.Л., Чернявский А.М., Романов А.Б. Роботизированная магнитная навигация при лечении сложных нарушений ритма сердца у пациентов после хирургической коррекции врожденных пороков сердца. Патология кровообращения и кардиохирургия. 2021;25(1):32-39. https://doi.org/10.21688/1681-3472-2021-1-32-39 Beloborodov V.V., Elemesov N.A., Ponomarenko A.V., Morzhanaev E.A., Filippenko A.G., Mikheenko I.L., Chernyavskiy A.M., Romanov A.B. Remote magnetic navigation for heart rhythm disturbances treatment in patients after surgical correction of congenital heart disease. Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2021;25(1):32-39. (In Russ.) https://doi.org/10.21688/1681-3472-2021-1-32-39
- Белобородов В.В., Шабанов В.В., Елемесов Н.А., Филиппенко А.Г., Михеенко И.Л., Фишер Е.В., Романов А.Б. Роботизированная магнитная навигация при лечении пациентов с фибрилляцией предсердий. Патология кровообращения и кардиохирургия. 2022;26(1):24-31. https://doi.org/10.21688/1681-3472-2022-1-24-31 Beloborodov V.V., Shabanov V.V., Yelemessov N.A., Filippenko A.G., Mikheenko I.L., Fisher E.V., Romanov A.B. Remote magnetic navigation for treatment of patients with atrial fibrillation. Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2022;26(1):24-31. (In Russ.) https://doi.org/10.21688/1681-3472-2022-1-24-31
- Романов А.Б., Филиппенко А.Г., Шабанов В.В., Белобородов В.В., Бобошко В.А., Хрущев С.Е., Рузанкин П.С. Сравнение роботизированной магнитной навигации и мануального подхода к аблации у пациентов с корригированными врожденными пороками сердца и инцизионными предсердными тахикардиями: отдаленные результаты propensity score анализа. Вестник аритмологии. 2023;30(4):42-50. https://doi.org/10.35336/VA-1214 Romanov A.B., Filippenko A.G., Shabanov V.V., Beloborodov V.V., Boboshko V.A., Khrushchev S.E., Ruzankin P.S. Remote magnetic-guided catheter ablation versus manual ablation in patients with repaired congenital heart disease and atrial tachyarrhythmias: propensity-matched observational study of long-term results. Journal of Arrhythmology. 2023;30(4):42-50. (In Russ.) https://doi.org/10.35336/VA-1214
- Jia K., Jin Q., Liu A., Wu L. Remote magnetic navigation versus manual control navigation for atrial fibrillation ablation: A systematic review and meta-analysis. J Electrocardiol. 2019;55:78-86. PMID: 31152995. https://doi.org/10.1016/j.jelectrocard.2019.05.001
- Adragão P.P., Cavaco D., Ferreira A.M., Costa F.M., Parreira L., Carmo P., Morgado F.B., Santos K.R., Santos P.G., Carvalho M.S., Durazzo A., Marques H., Gonçalves P.A., Raposo L., Mendes M. Safety and long-term outcomes of catheter ablation of atrial fibrillation using magnetic navigation versus manual conventional ablation: a propensity-score analysis. J Cardiovasc Electrophysiol. 2016;27 Suppl 1:S11-S16. PMID: 26969217. https://doi.org/10.1111/jce.12900
- Noten A.M.E., Romanov A., De Schouwer K., Beloborodov V., Bhagwandien R., Hoogendijk M.G., Mikheenko I., Wijchers S., Yap S.-C., Schwagten B., Szili-Torok T. Robotic magnetic navigation-guided catheter ablation establishes highly effective pulmonary vein isolation in patients with paroxysmal atrial fibrillation when compared to conventional ablation techniques. J Cardiovasc Electrophysiol. 2023;34(12):2472-2483. PMID: 37767745. https://doi.org/10.1111/jce.16081
- Taghji P., El Haddad M., Phlips T., Wolf M., Knecht S., Vandekerckhove Y., Tavernier R., Nakagawa H., Duytschaever M. Evaluation of a strategy aiming to enclose the pulmonary veins with contiguous and optimized radiofrequency lesions in paroxysmal atrial fibrillation: a pilot study. JACC: Clin Electrophysiol. 2018;4(1):99-108. PMID: 29600792. https://doi.org/10.1016/j.jacep.2017.06.023
- Maurer T., Sohns C., Deiss S., Rottner L., Wohlmuth P., Reißmann B., Heeger C.H., Lemes C., Riedl J., Santoro F., Mathew S., Metzner A., Ouyang F., Kuck K.H., Wissner E. Significant reduction in procedure duration in remote magnetic-guided catheter ablation of atrial fibrillation using the third-generation magnetic navigation system. J Interv Card Electrophysiol. 2017;49(3):219-226. PMID: 28600672. https://doi.org/10.1007/s10840-017-0261-7
- Noten A.M.E., Géczy T., Yap S.C., Kis Z., Szili-Torok T. Introducing a novel catheter-tissue contact feedback feature in robotic navigated catheter ablation: Utility, feasibility, and safety. Heart Rhythm O2. 2020;1(2):103-110. PMID: 34113864; PMCID: PMC8183953. https://doi.org/10.1016/j.hroo.2020.04.003
- Noten A.M.E., Hendriks A.A., Yap S.-C., Mol D., Bhagwandien R., Wijchers S., Kardys I., Khan M., Szili-Torok T. Contact feedback improves 1-year outcomes of remote magnetic navigation-guided ischemic ventricular tachycardia ablation. Int J Cardiol. 2020;315:36-44. PMID: 32413467. https://doi.org/10.1016/j.ijcard.2020.05.028


