Роль артериоло-венулярных анастомозов в циркуляции нейтрофильных гранулоцитов
Автор: Марков Игорь Иванович, Маркова Валерия Игоревна, Малыхина Татьяна Викторовна, Антонян Янис Эдуардович, Софонов Матвей Витальевич, Рассолов Владимир Николаевич
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.25, 2017 года.
Бесплатный доступ
Эмиграция нейтрофильных гранулоцитов (далее - НГ), основной функцией которых является фагоцитоз, происходит исключительно из просвета венул. Между тем, НГ «обвиняются» в том, что они могут блокировать микроциркуляцию в большом круге кровообращения и, тем самым способствовать развитию феномена no - reflow в головном мозге и миокарде. Вероятно, а priori считается, что НГ поступают в венозное русло транскапиллярно, хотя их морфологические параметры должны этому препятствовать. Возможна ли циркуляция НГ в венулы через артериоло-венулярные анастомозы (далее - АВА)? Целью работы явилось выяснение роли АВА в циркуляции нейтрофильных гранулоцитов. Были изучены препараты кишечника, скелетных мышц, миокарда, головного мозга, брюшины и селезенки кошек (n=7) и белых крыс (n=17). Методы - внутрисосудистая импрегнация по Ранвье, универсальный метод импрегнации различными солями серебра, рутинные гистологические методы окраски парафиновых срезов. У интактных животных нейтрофильные гранулоциты поступают в венулы только через АВА. В миокарде и головном мозге, где нет АВА, НГ за счет феномена гемосепарации поступают исключительно в эпикард, в первом случае, и в мягкие ткани лицевой области и твердую мозговую оболочку - во втором.
Нейтрофильные гранулоциты, артериоло-венулярные анастомозы, транскапиллярная миграция клеток
Короткий адрес: https://sciup.org/143177156
IDR: 143177156 | DOI: 10.20340/mv-mn.17(25).01.02
Текст научной статьи Роль артериоло-венулярных анастомозов в циркуляции нейтрофильных гранулоцитов
Введение. Вопрос о механизмах блокады микрососудистого русла различных органов и, прежде всего, головного мозга и сердца, при различных экстремальных состояниях – вопрос первостепенной важности. От его решения зависит ответ: возможна ли ликвидация в клинических условиях феномена не восстановления кровотока (no-reflov)? В настоящее время многие авторы признают участие нейтрофильных гранулоцитов (НГ) не только в регуляции кровотока, но и в блокаде микроциркуляции [1-6]. По образному выражению [7], «лейкоциты подобно пастухам разгоняют эритроциты по своим капиллярам» [с. 173]. Феномен «no-reflov» был обнаружен в большинстве органов и тканей, испытавших острую ишемию, поскольку он имеет универсальный механизм возникновения и однотипный характер развития. Так, в работе [2] указано, что феномен «no-reflov» «состоит в массовой блокаде лейкоцитами венозных микрососудов» [с. 615] сосудистой оболочки головного мозга крыс, после перевязки у них обеих общих сонных артерий. Но каким образом НГ, имеющие жесткую конструкцию цитоскелета, вязкую цитоплазму и диаметр 12-15 мкм [8], проходят через капилляры в венулы? Ведь только из венул НГ способны эмигрировать в интерстициальное пространство [8, 9]. Этот вопрос в литературе не только не обсуждался, но даже и не ставился. Очевидно, что a priori признается транскапиллярная циркуляция НГ. Однако, вероятнее всего, НГ поступают в венозное русло органов через артериоло-венулярные анастомозы (АВА).
Цель работы – выяснить роль артериоло-венулярных анастомозов в циркуляции нейтрофильных гранулоцитов.
Материал и методы. Изучены препараты кишечника, сердца, головного мозга, брюшины, десны, языка, селезенки кошек (n=7) и белых крыс (n=17). В суправитальных условиях, под общей анестезией [Золетил (Virbac, Франция) в дозировке 125 мкг/кг] проводилась интрасосудистая импрегнация по Ранвье. Фрагменты органов импрегнировались по универсальному методу [10], а парафиновые срезы окрашивались гематоксилином и эозином, по Ван-Ризону, Романовскому - Гимзе. Все манипуляции с животными осуществились в соответствии с российскими этическими нормативами.
Результаты исследования и обсуждение. Типичные артериоло-венулярные анастомозы (АВА) с постоянным кровотоком обнаружены в эпикарде (рис. 1а), в твердой мозговой оболочке (рис. 1б), в подслизистой основе кишечника (рис. 1в). В миокарде, в мягкой мозговой оболочке, в коре головного мозга, в селезенке АВА обнаружить не удалось. Более того, в 10
просвете артериом и венул этих тканевых структур определялась высокая концентрация эритроцитов при полном отсутствии НГ (рис. 2). И тем не менее, в просвете «синусоидов» миокарда, отличающихся от типичных венул миокарда отсутствием в сосудистой стечке перицитов, небольшое количество НГ выявлялось у интактных кошек постоянно (рис. 3). У интактных же крыс, у которых отсутствуют межтрабекулярные пространства, НГ в просвете синусоидов отсутствовали. Эти данные свидетельствуют о том, что «синусоиды» могут сообщаться с камерами сердца [11] и НГ могут поступать в них во время диастолы. Циркуляции НГ в типичном микрососудистом русле миокарда препятствует процесс преорганной гемосепарации [12]. Он происходит последовательно, поэтапно по мере продвижения крови от сердца к месту назначения. Эффективность гемосепарации, разделение потоков крови, зависит от соотношения между углами отхождения магистральных артерий от аорты, перепадом диаметров материнских и дочерних ветвей и скорости кровотока в них [13]. Так, углы отхождения обеих венечных артерий от аорты равны ≈70°, а перепады диаметров – 1:15-17. Углы отхождения обеих общих сонных артерий близки к 90°, а соотношения диаметров – 1:2,5. В чем же биологическая целесообразность феномена преорганной гемосепарации? Очевидно, что в процессе гемосепарации в микрососудистое русло каждого органа и даже в микрососудистое русло каждой ткани органа поступает кровь различная по гематологическим показателям. Закономерно, что наиболее эффективная гемосепарация происходит в экстраорганном русле органов с высоким уровнем дифференцировки рабочих структур [14]. Так, после гемосепарации на уровне бифуркации левой общей сонной артерии и на уровне бифуркации плечеголовного ствола и бифуркации правой общей сонной артерии, в головной мозг поступает кровь с высоким гематокритом (0,584-0,712) и с выраженной лейкопенией [(2.5-3.0) х 109/л]. В наружные же сонные артерии поступает кровь с низким гематокритом (0,258-0,324) и с высоким лейкоцитозом [15]. Высокая эффективность гемосепарации в системе экстракраниальных артерий обусловлена так же значительной объемной скоростью кровотока во внутренних сонных артериях, в 2 раза превышающей этот показатель в наружных сонных артериях [16]. Такая разница в объемной скорости кровотока в артериях с практически одинаковым внутренним диаметром связана с несколькими факторами [17]. Во-первых, не смотря на ригидность черепа, несжимаемость мозга и ликвора в микрососудах мягкой мозговой оболочки возможно 20% увеличение объема крови. Во-вторых, в интракраниальных отделах внутренних сонных артерий происходит резкое снижение пульсового давления и значительное уменьшение сосудистого сопротивления [18]. В-третьих, функционированием «церебрального сердца», основным условием эффективности которого является синхронизация ритмических сокращений пиальных вен с артериальной пульсовой волной. В-четвертых, обе волны и артериальная волна расширения, и волна активного сокращения пиальных вен, возникающая синхронно и рефлекторно, управляются из единого центра – сердечного пейсмекера [18]. В-пятых, в кровоснабжении твердой мозговой оболочки участвует средняя оболочечная артерия. В связи с этим, именно в её микрососудистом русле существует большое число типичных АВА, через которые в венулы поступают НГ из наружной сонной артерии, низкий гематокрит и высокое осмотическое давление.
Напротив, в микрососудистом русле мягкой мозговой оболочки – высокая концентрация эритроцитов, но нет НГ и АВА. Таким образом, при отсутствии в твердой мозговой оболочке лимфатических микрососудов, резорбция ликвора из субарахноидального пространства осуществляется, очевидно, венозными микрососудами. Необычайно высокое содержание НГ наблюдается в микрососудах слизистой оболочки полости рта и, особенное, в микрососудах зубодесневых соединений. Высока и скорость миграции НГ в ротовую полость: около 30000 НГ в минуту и 4,3 х 10/у – за сутки [19].
Этому способствуют своеобразные сосудистые конструкции, подобные «шпилькам для волос», расположенные на уровне десневых сосочков и функционирующие как противоточные обменники, а также многочисленные АВА, обнаруженные на стыке прикрепленной десны и переходной складки и в области эпителиального прикрепления десны к зубу (рис. 4). При общем количестве циркулирующих в крови НГ идеального мужчины (масса – 70,0 кг, рост – 170 см) = 3,5 х10/10 за сутки в его полости рта погибает 1/800 их часть. Такая значительная потеря НГ происходит на площади слизистой оболочки полости рта, составляющей всего =137см² или менее 1/10000 площади слизистой оболочки желудочно-кишечного тракта [20]. 2/3 многочисленных физиологических функций НГ необходимо отметить их значительную роль в связывании и элиминации эндотоксина [21]. Ранее считалось [22], что весь эндотоксин, поступающий из кишечника, элиминируется клетками Купфера печени. В настоящее время установлено, что в норме до 6% объем крови, оттекающей от кишечника через портокавальные анастомозы, поступает, минуя печень, в общую циркуляцию. В связи с этим в периферической крови здоровых людей определяется до 13% активированных эндотоксином НГ [23]. При различных экстремальных ситуациях пропускная способность портокавальных анастомозов может увеличиваться, соответственно увеличивается и количество поступающего в общую циркуляцию эндотоксина. В ходе эволюции выработан ряд механизмов, обеспечивающих защиту организма от вредного действия эндотоксина [24].
К таким механизмам авторы относят различные виды взаимодействия эндотоксина с НГ:
-
1. Неспецифическое взаимодействие гидрофобных структур НГ с эндотоксином;
-
2. Связывание эндотоксина рецепторным белком СД18;
-
3. Формирование комплекса эндотоксина LВР- белком плазмы, а затем взаимодействие комплекса с поверхностным клеточным рецептором СД14;
-
4. Fc-зависимое связывание комплекса эндотоксин – антитело класса IgE с Fc–рецептором НГ [25].
Последний вид взаимодействия эндотоксина и НГ приводит к фагоцитозу и не активации эндотоксина, т.е. носит выраженный протективный характер [23]. Однако приходиться сомневаться в том, что только НГ защищают организм от эндотоксиновой агрессии. Полученные нами данные свидетельствуют о том, что поступление плазмы крови, содержащей не только эндотоксин, но и другие антигены, в микрососудистое русло органов, имеющих гистогематические барьеры, лимитируется преорганной гемосепарацией. Это, в первую очередь, касается головного мозга и миокарда. Более того, в микрососудистом русле и головного мозга, и миокарда отсутствуют АВА, через которые циркулируют НГ. С этих позиций морфофункциональные механизмы, осуществляющие преорганную гемосепарацию, должны рассматриваться как неотъемлемые части гистогематических барьеров, в том числе, и гематоэнцефалического. Отсутствие АВА в миокарде и в головном мозге исключает возможность блокады их микрососудистых русел НГ. Кроме того, на микрофотографиях [2], де-
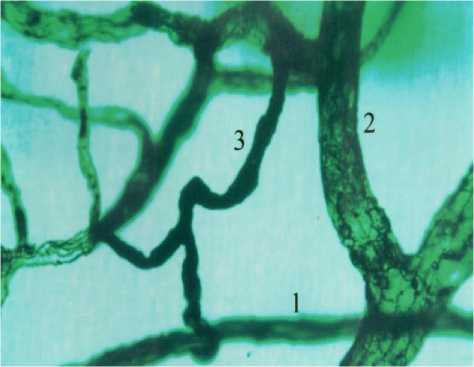
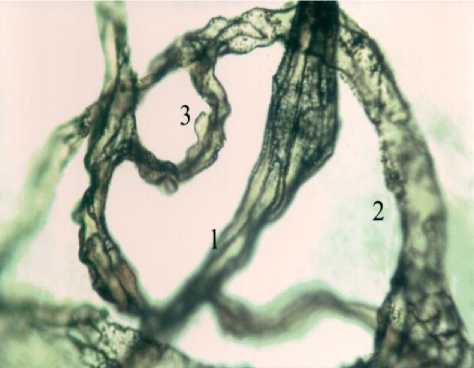
Рис. 1-Б
Рис. 1-A
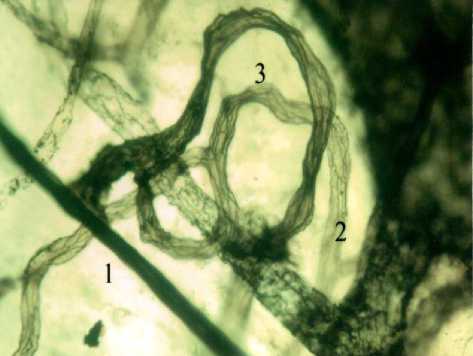
Рис. 1. Артериоло-венулярные анастомозы с постоянным кровотоком: в эпикарде (1-А), в подслизистой основе кишечника (1-Б), в большом сальнике (1-В) кошки. Обозначения: 1 - артериола, 2- венула, 3 - артериоловенулярный анастомоз. Внутрисосудистая импрегнация по Ранвье. Ув. 900.
Рис. 1-В
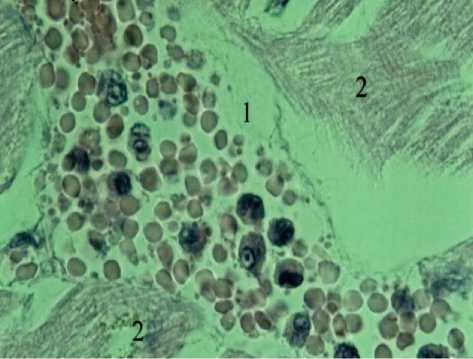
Рис. 2. Нейтрофильные гранулоциты в просвете синусоида (1) миокарда (2) кошки. Окраска гематоксилином и эозином. Ув. 900.
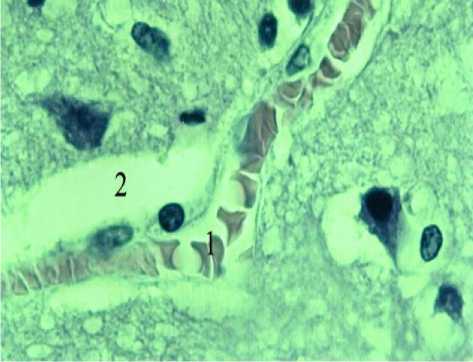
Рис. 3. Венула (1) коры головного мозга (3) кошки. 2 -перивазальное пространство. Окраска по Ван Гизону. Ув. 900.
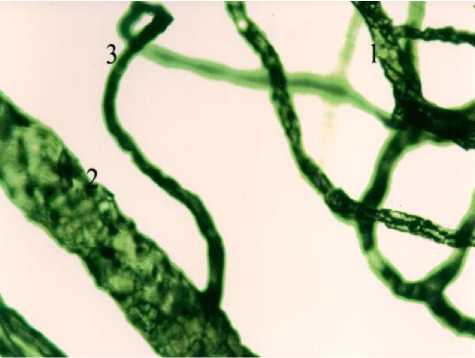
Рис. 4. Артериоло-венулярный анастомоз (3) в области эпителиального прикрепления десны к зубу кошки. 1) артериола, 2) венула. Внутрисосудистая импрегнация по Ранвье. Ув. 900.
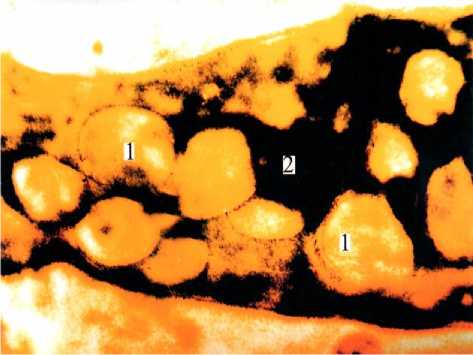
Рис. 5. Блокада лимфатического капилляра (2) набухшими и десквамированными эндотелиоцитами (1). Универсальный метод импрегнации. Ув. 900.
монстрирующих блокаду пиальных венул НГ, видны не НГ, а набухшие эндотелиоциты. Позже блокада кровеносных и лимфатических микрососудов набухшими и десквамированными эндотелиоцитами была проиллюстрирована (рис. 5) в работах [26, 27].
Список литературы Роль артериоло-венулярных анастомозов в циркуляции нейтрофильных гранулоцитов
- Иванов К.П. Изменение микроциркуляции при лейкоцитозе/К.П. Иванов, Ю.И. Левкович//физиол. журн. Им. И.М. Сеченова, 1992, № 6, с. 86 -90
- Иванов К.П. Лейкоциты как причина дисфункции микроциркуляции/К.П. Иванов, Н.Н. Мельникова//Бюлл. экспер. биол., 2006, № 6, с. 631 -634
- Маянский Д.Н. Роль нейтрофилов в ишемическом и реперфузионном повреждении миокарда/Д.Н. Маянский, С.Д. Маянская//Тер. арх., 2001, № 12, с.84 -88
- Редчиц Е.Г. Участие полиморфноядерных лейкоцитов в ишемической болезни сердца/Е.Г. Редчиц//Кардиология, 1989, № 12, с. 119 -124
- МиIIапе K. Neutrophyles and endothelial changes in reperfusion injury/Mullane//Trends Cardiovascul. Med. 1991, № 1, р. 282 -289
- Inoue T. Expresion of PMN leukocyte adnesion molecules and its clinical significance in patients treated with percutaneous transluminal coronary angioplasty/T. Inone, J. Sakal et al.//1. Amer. Coll. Cardiol., 1996, v. 28, p. 1127 -1133
- Гончаренко А.И. Компьютерное исследование минисердец/А.И. Гончаренко, Е.Е. Пастухова//Лесн. вестн., 2004, № 3, с. 159 -186
- Хэм А., Кормак Д. Гистология: Пер. с анг. М. Мир. 1983, т.2, с.254
- Воспаление, иммунитет и гиперчувствительность. Пер. с анг. Под ред. Я.Л. Рапопорта. -М. Медицина, 1975, с. 560
- Марков И.И. универсальный метод элективного выявления аргирофильных структур/И.И. Марков и др.//Морфологические ведомости, 2016, № 1, с. 116 -119.
- Grant R.T. Observation on the anatomy of the Thebesian vessels of the Heart/R.T. Grant, L. Vico//Heart, 1929, v.25, № 1, p. 103 -123.
- Адыширин-Заде Э.А. Структурные основы циркуляторного гомеостаза/Э.А. Адыширин-Заде//В кн: Морфологические аспекты органной гемоциркуляции. Куйбышев, 1988, с. 5 -8
- Марков И.И. Роль экстраорганных артерий и микрососудистого русла органов в формировании гистогематических барьеров/И.И. Марков, А.И. Марков и др.//Морфологические ведомости, 2002, № 1 -2, с. 75 -78.
- Мчедлишвили Р.И. Приоткрывая покровы неизвестного в физиологии и патологии микроциркуляции крови/Р.И. Мчедлишвили//Пантол. физиол., эксперт. терапия, 1991, № 3, с. 3 -7
- Цымбалов Э.Е. Структурная организация микрососудистого русла слизистой оболочки полости рта/Э.Е. Цымбалов//Автореф. дис.. канд. мед. наук. Саранск, 2008, с. 26
- Морошкин В.С. Состояние экстра-интра-краниального кровотока у больных ишемической болезнью сердца/В.С. Морошкин, О.М. Моисеева//Артериальная гипертензия, 2012, № 2, с. 153 -157
- Абасов Б.Х. Различия во внешнем строении шейного отдела общей сонной артерии и ее ветвей и возможности замещения дефектов перемещением наружной сонной артерии/Б.Х. Абасов//Автореф. дис.. канд. мед.наук, Баку, 1960, с. 21
- Кошев В.И., Петров Е.С. Гидродинамический флаттер и антифлатерная стабилизация в сердечно-сосудистой системе//Самара, 2007, 407 с.
- Быков В.Л. Тканевые и клеточные защитные механизмы слизистой оболочки полости рта/В.Л. Быков/Морфология, 1996, № 6, с. 14 -19
- Марченко Я.В. Структурная организация микрососудистого русла лицевой области/Я.В. Марченко//Автореф. дис.. канд.мед. наук. Саранск, 2009, с.25
- Пермяков Н.К. Эндотоксин и система полиморфноядерного лейкоцита/Н.К. Пермяков, М.Ю. Яковлев, В.Н. Галанкин//Арх. патол. 1989, № 5, с.3-11
- Маянский А.Н., Маянскин Д.Н. Очерки о нейтрофиле и макрофаге//Новосибирск, 1983, 217 с.
- Пермяков Н.К. Иммунная оценка резервов связывания эндотоксина полиморфноядерными лейкоцитами // Н.К. Пермяков, И.А. Аниховская и др. // Арх. патол. 1995, № 2, с.4 - 7
- Лиходед В.Г., Аниховская И.А., Аполлонин А.В., Козлова Н.Н., Кудрявцев А.Е., Хабриев Р.У., Ющук Н.Д., Яковлев М.Ю. Fc -зависимое связывание эндотоксинов граммотрицательных бактерий полиморфно ядерными лимфоцитами крови человека/В.Г. Лиходед, И.А. Аниховская и др.//ЖМЭиИ, 1996, № 2, с. 76 -79
- Яковлев М.Ю. Системная эндотоксинемия в физиологии и патологии человека//Автореф. дис.. докт. мед.наук М. 1993, 55 с.
- Кошев В.И. Диапедезные кровотечения -основная причина развития стойких нарушений микроциркуляции при различных патологических процессах/В.И. Кошев, Е.С. Петров, И.И. Марков//Морфологические ведомости, 2009, № 1 -2, с. 23 -26
- Кошев В.И. Эндотелиальные механизмы развития постишемического развития феномена не восстановления микрогемо -илимфоциркуляции/В.И. Кошев, Е.С. Петров, И.И. Марков//Морфологические ведомости, 2009, № 1-2, с. 127 -129


