Роль астроцитов в нейровоспалении (обзор)
Автор: Мордовина А.И., Руденко Е.Е., Демура Т.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Патологическая физиология
Статья в выпуске: 1 т.19, 2023 года.
Бесплатный доступ
Цель: представить результаты исследований роли астроцитов в нейровоспалении, а также взаимодействий астроглиоцитов с другими глиальными клетками и нейронами в контексте нейровоспаления. Найдены 63 научные работы с использованием для поиска баз данных Cochrane Library, PubMed по запросам: «астроциты и нейровоспаление», «реактивные астроциты», «нейроглия и нейровоспаление». Для обзора отобрано 45 источников. Временной интервал анализируемой литературы: 2000-2020 гг. Сделан вывод о двойственности роли астроцитов в нейровоспалении. Эти клетки оказывают как защитный, так и разрушительный эффект. Важно понимать, что деятельность реактивных астроцитов зависит от их топографического расположения и микроокружения, а также медиаторов, которые выделяются клетками резидентами и нерезидентами центральной нервной системы (ЦНС). Знания о регуляции астроцитарных эффектов необходимы для реализации терапевтического потенциала астроглиоцитов.
Астроциты, нейровоспаление, нейроглия
Короткий адрес: https://sciup.org/149143900
IDR: 149143900 | УДК: 616.8-091.8+616.8-091.943 | DOI: 10.15275/ssmj1901089
Текст научной статьи Роль астроцитов в нейровоспалении (обзор)
EDN: JTXXQI
Corresponding author — Alina I. Mordovina
Тел.: +7 (966) 1389798
как с клетками-резидентами ЦНС, так и с кровеносными сосудами, участвуют в формировании и регуляции гематоэнцефалического барьера. Астроглиоциты — это иммунокомпетентные клетки, способные воспринимать и секретировать цитокины и хемоки-ны, модулируя иммунный ответ.
Цель — представить результаты исследований роли астроцитов в нейровоспалении, а также взаимодействий астроглиоцитов с другими глиальными клетками и нейронами в контексте нейровоспаления.
Найдены 63 научные работы с использованием для поиска баз данных Cochrane Library, PubMed по запросам: «астроциты и нейровоспаление»,
«реактивные астроциты», «нейроглия и нейровоспаление». Из выборки были исключены материалы конференций, главы книг и монографии. Для написания работы были использованы оригинальные исследования и обзорные статьи, опубликованные в рецензируемых научных изданиях в период с 2000 по 2020 г. на английском языке.
Реактивные астроциты. Активация астроцитов, или реактивный астроглиоз, — процесс, характеризующийся спектром молекулярных, клеточных и функциональных изменений, которые легли в основу изучения роли астроглии в нейровоспалении [1]. Первое современное описание активированных астроцитов появилось в 1970-е гг. после открытия глиального фибриллярного кислого белка (ГФКБ, glial fibrillary acid protein, GFAP), который был выделен из демиелинизированной бляшки рассеянного склероза (РС), став тогда одним из первых молекулярных признаков связи астроцитов и РС [2]. ГФКБ принято считать универсальным маркером астроглиоза, несмотря на то, что нейральные клетки-предшественницы экспрессируют его [3], взамен другим промежуточным филаментам, таким как виментин и нестин, содержание которых также повышается в астроцитах в процессе их активации.
Нейровоспаление и ишемия приводят к образованию двух популяций активированных астроцитов, которые принято называть «А1» и «А2». Терминология пересекается с номенклатурой «М1» и «М2» макрофагов, которая также применима по отношению к микроглиоцитам ЦНС. Микроглия довольно гетерогенна. Ее функциональные фенотипы колеблются от провоспалительных «М1-подобных» микроглиоцитов, которые выделяют большое количество провоспалительных медиаторов, таких как фактор некроза опухоли (ФНО, tumor necrosis factor, TNF), интерлейкин-1β (ИЛ-1β, interleukin-1в, IL-ie), а также активные формы кислорода [4], до иммуносупрессивной «М2-подобной» микроглии, которая характеризуется экспрессией хитиназа-3-подобного белка (Chitinase-like 3, Chil3), рецептора завитого белка 1 (Frizzled class receptor 1, Fzd1), аргиназы 1 (Arginase 1, Arg1) [5]. Важно заметить, что эта номенклатура не является исчерпывающей, так как микроглия может находиться в более чем двух полярных состояниях [6], и точно не понятно, может ли «М2-подобная» микроглия активироваться в ответ на инфильтрацию вещества мозга макрофагами. Астроциты также могут иметь более чем два активированных состояния [7].
Транскриптомный анализ активированных астроцитов показывает, что «А1» воспалительно активные астроциты повышенно экспрессируют гены, которые разрушительно действуют на синапсы, что наталкивает на мысли о том, что «А1»-астроглия может функционировать разрушительно, с одной стороны. С другой стороны, активируемые при ишемии «А2» астроциты продуцируют множество нейротрофических факторов, содействующих выживаемости и росту нейронов, а также вещества, ответственные за восстановление синапсов. Таким образом, «А2»-астроциты, должно быть, несут защитную и регенеративную функции.
Реактивные астроциты, образующиеся в процессе альтерации ЦНС, продуцируют и секретируют большое количество разных медиаторов, факторов роста и нейротропинов, которые могут как уменьшить, так и увеличить проявления нейровоспаления. Мышиная модель экспериментального аутоиммунного энцефаломиелита (ЭАЭ) проявила себя как лучшая модель для исследования поведения астроцитов в контексте нейровоспаления [8].
Регуляция реактивных астроцитов. Сигнальные пути реактивных астроцитов сходятся на довольно распространенных транскриптомных регуляторах воспаления (рис. 1) [9].
Нуклеарная транслокация ядерного фактора «каппа-би» (Nuclear factor kappa-light-chain-enhancer of activated B cells, NFkB) — центральное звено активации астроцитов, запуска нейровоспаления и ней-родегенеративных процессов. Селективная блокада астроцитарного NFκB в таких мышиных моделях нейровоспаления и повреждения ЦНС, как ЭАЭ, спинальная травма и оптический неврит, улучшает клинические исходы и ассоциируется со снижением уровня цитокинов и окислительного стресса [10]. Это говорит о том, что NFκB астроцитов играет одну из важнейших ролей в нейровоспалении.
Ядерная транслокация NFkB регулируется несколькими путями, среди которых можно выделить активаторы и супрессоры.
К активаторам нуклеарной транслокации NFκB астроцитов относятся такие провоспалительные стимуляторы, как ФНО-α, ИЛ-1β, ИЛ-17, реактивные формы кислорода, фагоцитированный миелин, толл-подобный рецептор (Toll-like receptor, TLR) [11]. Вдобавок сфингозин-1-фосфат (sphingosine-1-phosphate, S1P) также запускает NFκB и влияет на развитие ЭАЭ и РС [12]. S1P — это биологически активный фосфолипид, контролирующий пролиферацию некоторых типов клеток, а также миграцию лейкоцитов из лимфоидной ткани в циркулирующую кровь [13]. Реактивные астроциты повышено экспрессируют сфинголипидный рецептор S1PR1, и выборочное удаление у астроцитов S1PR1 оборачивается облегчением течения ЭАЭ и увеличением выживаемости нейронов [14].
LacCer — медиатор липидной природы, запускающий нейровоспаление и астроглиоз [15]. Он синтезируется B4GALT5 (бета-1,4-галактозилтрансфераза 5) и B4GALT6, относящимися к семейству бета-галакто-зилтрансфераз. Их активность контролируется NFκB [16], и оба этих фермента повышено регулируются в астроцитах в ЭАЭ и РС [12]. Интересно, что выключение именно B4GALT6 интрацереброваскуляр-ной инъекцией короткошпилечной РНК лентивируса под контролем промотора ГФКБ снижает концентрацию LacCer в прогрессирующей фазе ЭАЭ, подавляет развитие болезни и уменьшает макрофагальную инфильтрацию ЦНС [15]. Эксперименты in vitro показывают то, что LacCer приводит к активации факторов транскрипции NFkB и инсулиноподобного фактора роста 1 (ИФР-1, Insulin-like growth factor-1, IGF-1), последний из которых присоединяется к промоторам хемокиновых лигандов Ccl2, Csf2 и Nos2 астроцитов, что, соответственно, запускает синтез цитокинов, активацию микроглии и миграцию провоспалительных моноцитов в ЦНС [11].
Основываясь на доказательствах разрушительного эффекта активации NFκB в астроцитах, логично предположить, что существует несколько механизмов, ограничивающих его запуск. Одним из таких механизмов является лиганд-активируемый фактор транскрипции АГР, чья активность модулируется, например, метаболитами клеток и сопутствующей микрофлоры [17]. Метаболизм триптофана кишечной микробиотой — важный источник агонистов АГР [18]. АГР может лимитировать NFκB-сигнальный путь
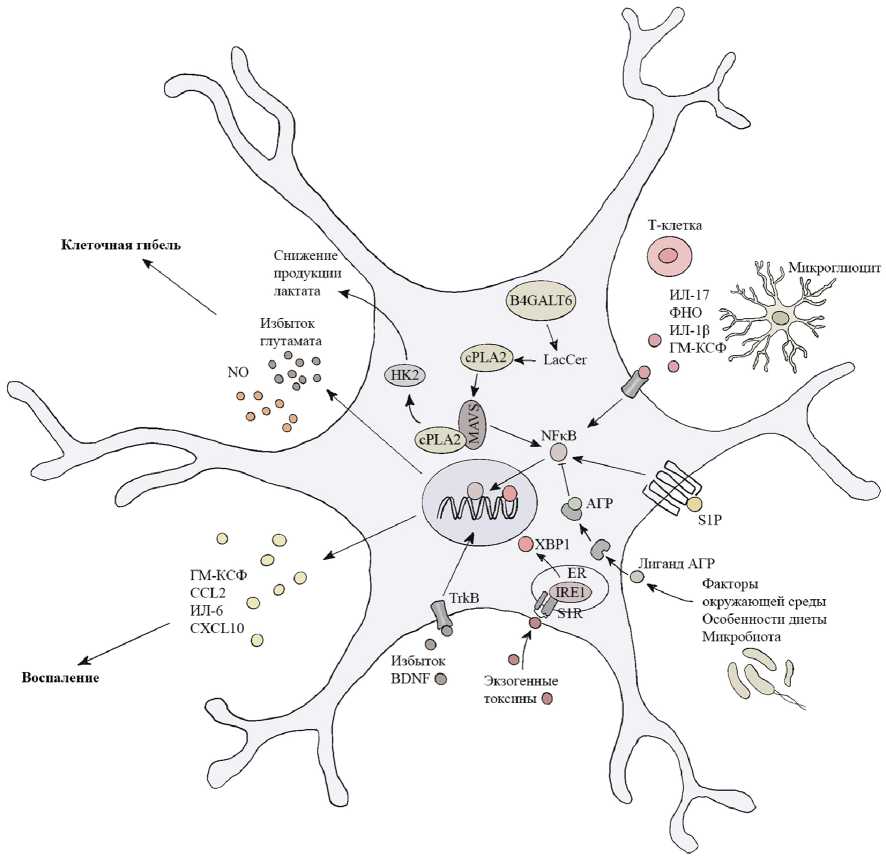
Рис. 1. Регуляция реактивных астроцитов: NO — оксид азота; ГМ-КСФ — гранулоцитарно-макрофагальный колониестимулирующий фактор, granulocyte-macrophage colony-stimulating factor, GM-SCF; CCL, CXCL — лиганды хемокинового рецептора; ИЛ — интерлейкин, interleukin, IL; B4GALT6 — бета-1,4-галактозилтрансфераза 6; cPLA2 — cytosolic phospholipase A2, цитозольная фосфолипаза А2; MAVS — mitochondrial antiviral-signaling protein, митохондриальный противовирусный сигнальный белок; HK2 — hexokinase 2, гексокиназа 2; TrkB — tropomyosin receptor kinase B, тропомиозиновый киназный рецептор B; BDNF — brain derived neurotrophic factor, нейротропный фактор мозга: LacCer — lactosylceramide, лактозилцерамид; XBP1 — X-box binding protein, X-box-связывающий белок 1; ER — estrogen receptor, эстрогеновый рецептор; IRE1 — inositol-requiring transmembrane kinase 1, инозитол-зависимый трансмембранный фермент 1; S1R — sigma-1 receptor, сигма-рецептор 1; АГР — арил-гидрокарбон рецептор, aryl hydrocarbon receptor, AHR
несколькими механизмами, включая те, в которые входит супрессор цитокиновой сигнализации 2 (suppressor of cytokine signalling 2, SOCS2) [19], а также димеризация АГР с продуктами распада NFκB [18]. Таким образом, продукты метаболизма триптофана снижают активацию NFκB в астроцитах и лимитируют воспаление в ЦНС через АГР [19]. Специфическое выключение АГР в астроцитах ухудшает течение ЭАЭ и выражается увеличением концентрации провоспалительных цитокинов, хемокинов и других молекул, ассоциируемых с активацией астроцитов (ГФКБ и виментин).
Некоторые кишечные бактерии-симбионты, которые продуцируют агонисты АГР, чувствительны к ампициллину [20]; уничтожение их ампициллином на поздних стадиях ЭАЭ ухудшает течение болезни. Отягощение болезни и возрастающая концентрация провоспалительных медиаторов обратима при применении индоксил-3-сульфата — агониста АГР, концентрация которого в крови регулируется кишечной микрофлорой [19]. Это показывает, как АГР участвует в регуляции воспаления через систему связей «кишечник — ЦНС».
Астроциты могут выступать мишенью для нейротропинов — факторов роста, ответственных за выживание нейронов и рост аксонов [21]. Будучи иногда экспрессируемым на астроцитах в контрольном белом веществе, TrkB-рецептор к BDNF очень ярко выражен у глиальных клеток в ЭАЭ и РС [22]. Мыши с выключенными TrkB-рецепторами ГФКБ-позитивных клеток показывают снижение восприимчивости к ЭАЭ и более легкое течение болезни. Исследования in vivo и in vitro доказывают, что TrkB-сигнальный путь регулирует выделение оксида азота астроцитами [22]. Таким образом, активация астроцитов через TrkB поддерживает нейровоспаление, несмотря на то, что лиганды этого рецептора чаще всего несут нейротрофическую функцию.
Взаимодействия астро- и микроглиоцитов в нейровоспалении. Взаимодействие астро- и микроглиоцитов модулирует воспаление в ЦНС через секрецию этими клетками цитокинов и других медиаторов воспаления (рис. 2А). Например, липополи-сахарид-активированные микроглиоциты запускают активацию астроглии по «А1» — нейротоксическому фенотипу [23]. Точнее, в ходе исследований удалось обнаружить, что секретируемые микроглиоцитами ИЛ-1α, ФНО-α и фактор комплемента С1q запускают в астроцитах транскрипцию еще неизвестного фактора, экспрессия которого приводит к снижению фагоцитоза и подавлению выделения нейротрофических факторов астроцитами. Если судить по секреции фактора комплемента С3, то вещества, которые принято считать маркером таких астроцитов, удалось обнаружить в нескольких нейродегенеративных заболеваниях, таких как болезни Гентингтона, Альцгеймера и РС [23]. АГР-сигнальный путь микроглии также модулирует выделение микроглиоцитами ФРСЭ (VEGF), регулируя таким образом экспрессию про-воспалительных генов астроцитов через индукцию ядерной транслокации NFκB в этих клетках [23].
Важно поговорить и о взаимном влиянии астроцитов на микроглиоциты. ГМ-КСФ — известный регулятор активации микроглии, участвующий во множестве процессов, важных для развития ЭАЭ [24]. Как выяснилось, ГМ-КСФ продуцируется астроцитами [25]. Исследователи продемонстрировали то, как B4GALT6/LacCer-зависимый сигнальный путь реактивных астроцитов модулирует транскрипцию микроглии и инфильтрирующих ЦНС моноцитов, продуцируя ГМ-КСФ [15].
Похожие замечания были сделаны и в отношении ИЛ-6 — медиатора нейровоспаления, играющего важную роль в патогенезе ЭАЭ [26]. В настоящее время ИЛ-6 в контексте нейровоспаления уделено не так много внимания, но некоторые исследования показывают то, что выключение ИЛ-6 в астроцитах облегчает течение ЭАЭ [27]. Этот эффект в определенной степени зависит от снижения активации микроглии, так как исследования об общем влиянии ИЛ-6 доказывают: при снижении его концентрации также уменьшается экспрессия главного комплекса гистосовместимости и провоспалительных генов [28].
Информация о том, что астроциты запускают провоспалительные функции микроглии через секрецию ИЛ-6, ГМ-КСФ и других сигнальных факторов, также подтверждается результатами исследований о вкладе факторов микроокружения астроглиоцитов в их патологическую активность в процессе воспаления [29]. Удалось идентифицировать новый сигнальный путь, который реализуется через S1R и IRE1α и приводит к активации фактора транскрипции XBP1, активирующего воспаление в ЦНС и координирующего ответ моноцитов и микроглии в ЭАЭ. Генноинженерная инактивация S1R и рецептора, который кодирует IRE1α, в астроцитах снижает экспрессию провоспалительных генов в микроглио- и моноцитах, давая основания полагать, что S1R-IRE1a-XBP1-сигнальный путь модулирует взаимодействия между астро- и микроглиоцитами [29].
Сложность взаимокоммуникации между микроглией и астроцитами в нейровоспалении также подтверждается исследованием эффектов ИЛ-10/ФНО—в— сигнальных путей при воспалении в ЦНС [30].
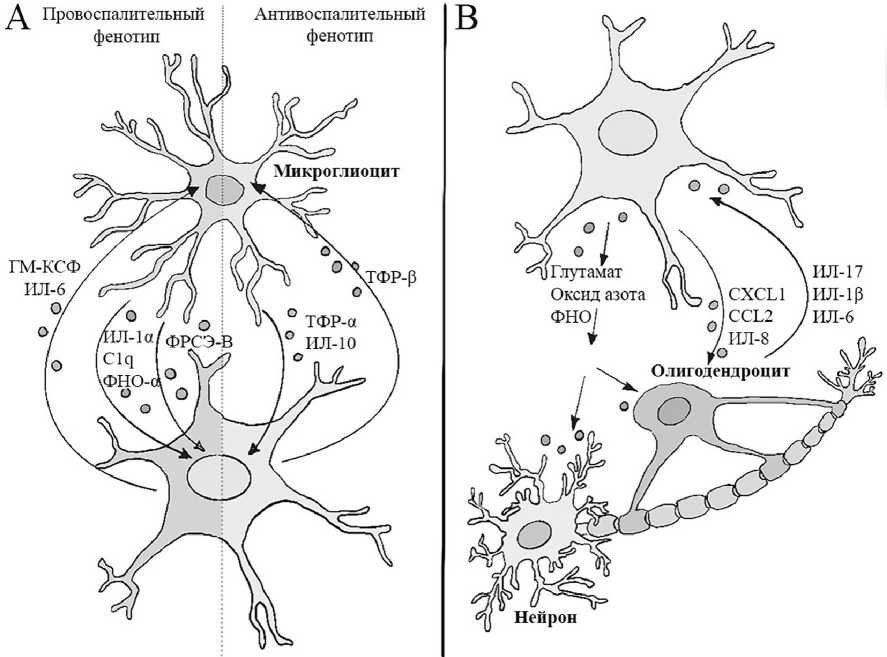
Рис. 2. Взаимодействия астроцитов с микроглиоцитами ( А ), олигодендроцитами и нейронами ( В ) в контексте нейровоспаления: C1q — субкомпонент системы комплемента; ФРСЭ — фактор роста сосудистого эндотелия, vascular endothelial cell growth factor, VEGF; ТФР — трансформирующий фактор роста, transforming growth factors, TGF
В контексте ЭАЭ в ответ на ИЛ-10, выделяемый микроглиоцитами, астроциты продуцируют ФНО-β, который влияет на микроглию, заставляя ее ограничивать экспрессию провоспалительных генов, в то же время увеличивая секрецию антивоспалительных медиаторов [30]. Таким образом, астроциты модулируют транскрипционную активность микроглии и через этот механизм воздействуют на состояние всех клеток — резидентов ЦНС.
Взаимодействия астро- и олигодендроцитов в нейровоспалении. Традиционно олигодендроциты рассматривались как инертные наблюдатели за процессом нейровоспаления [31]. Однако эта идея в настоящее время оспаривается некоторыми исследованиями, которые демонстрируют, что олигодендроглия принимает довольно активное участие в процессе воспаления в ЦНС [32]. Взаимная коммуникация между астроцитами и олигодендроцитами играет в этом важную роль (см. рис. 2В), так как олигодендроглия содержит большое количество рецепторов, которые отвечают на воспалительные медиаторы астроцитов [33], в то время как астроциты экспрессируют множество рецепторов к медиаторам, выделяемым олигодендроглией [33]. Точные механизмы, лежащие в основе этих процессов, еще не открыты, но многие исследования моделей нейровоспаления in vivo и in vitro показывают то, что функции этих клеток довольно сильно связаны.
Например, доказано, что реактивные астроциты запускают апоптоз олигодендроцитов через ФНО, лиганд рецептора Fas (FasL) и секрецию глутамата, что приводит к снижению ремиелинизации, удалению миелина и разрушению нейронов [34]. Этот процесс, скорее всего, усиливает и, возможно, даже запускает аутоиммунный ответ в ЦНС. Эти данные могут привести к возрождению теории об эндогенном происхождении воспаления в ЦНС [35]. Астроциты также влияют и на нейропротектив-ные функции олигодендроцитов, рекрутируя клетки-предшественницы олигодендроцитов на места воспаления через секрецию лигандов хемокинового рецептора CXCL1, CCL2 и ИЛ-8 [33]. Вместе с продукцией цилиарного нейротрофического фактора такие действия астроцитов модулируют дифференцировку клеток-предшественниц в зрелые миелинизирующие клетки, что увеличивает площадь ремиелинизации в областях воспалительного процесса в ЦНС и помогает таким образом восстановить процесс проведения возбуждения [36].
Другие исследования предполагают то, что олигодендроциты вносят вклад в развитие нейровоспаления через механизмы, выходящие за рамки их взаимодействия с миелином. Например, олигодендроглия участвует в фагоцитозе, презентации антигенов и активации эффектов CD4 Т-клеток, связанных с иммунологической памятью [32]. Кроме того, олигодендроциты выделяют провоспалительные медиаторы ИЛ-1β, -6, -17 и CCL2, которые запускают NFκB-сигнальный путь и провоспалительные функции в астроцитах [33]. Олигодендроциты также влияют на нейровоспаление, нарушая интеграцию гематоэнцефалического барьера, по крайней мере, косвенно, через конкуренцию с астроцитами за присоединение отростков к кровеносным сосудам, что приводит к снижению интеграции через плотные контакты [37].
Взаимодействия астроцитов и нейронов в нейровоспалении. Взаимодействия нейронов и астроцитов широко влияют на патогенез многих заболеваний, а токсические функции «А1» — реактивных астроцитов бурно обсуждаются в данный момент [8, 32], хотя основная часть нейротоксических факторов астроцитов еще не открыта.
Многие исследования показали то, что активация NFκB-сигнального пути в астроцитах во время воспаления в ЦНС запускает образование NO (рис. 2В) [29, 38], при переизбытке которого проявляется его разрушительное действие на нейроны [39]. В то время как BDNF и NO стимулируют выживаемость нейронов в здоровой ЦНС, увеличение концентрации BDNF в веществе мозга и его TrkB-рецепторов на реактивных астроцитах оборачивается повышением синтеза NO in vitro , что приводит к NO-нейротоксичности [22]. Точнее, выключение TrkB астроцитов облегчает течение ЭАЭ и снижает нейродегенерацию. В добавок к NO-опосредованной нейротоксичности реактивные астроциты могут привести к разрушению нейронов через снижение контроля над выведением и обратным захватом нейромедиаторов. Этот эффект частично реализуется посредством излишней секреции глутамата, которая приводит к гибели нейронов [40].
Помимо повышенной секреции цитотоксических веществ и нарушений в регуляции метаболизма нейромедиаторов, изменения в трофических взаимоотношениях нейронов и астроцитов также вносят вклад в патогенез РС и других болезней. Исследования продемонстрировали то, что LacCer-опосредованная активация цитозольной фосфолипазы А2 и ее взаимодействия с MAVS изменяет астроцитарный метаболизм, повреждая трофическую поддержку нейронов посредством лактат-челночного механизма [41]. Так, LacCer-опосредованное присоединение фосфолипазы А2 к MAVS разрушает комплекс MAVS и гек-сокиназы-2, замедляя гликолиз и продукцию лактата. В условиях функционирования здоровой ЦНС лактат, образуемый астроцитами, удовлетворяет трофические потребности нейронов [42]. Таким образом, снижение продукции лактата приводит к нейродегенерации. Похожие наблюдения в отношении метаболического взаимодействия нейронов и астроцитов были сделаны при болезнях Альцгеймера и Паркинсона [43, 44].
Хотя бóльшая часть этих данных получены в исследованиях in vitro , такие открытия доказывают, что астроциты могут вызывать гибель нейронов несколькими механизмами, среди которых — экзито-токсичность и метаболические нарушения. Такая астроцит-опосредованная нейротоксичность вкупе с нарушениями в регуляции астроцитарной деятельности может также влиять и на ухудшение неврологической инвалидизации [45].
Заключение. Астроциты играют важнейшую роль в нейровоспалении. Эти клетки оказывают как защитный, так и разрушительный эффект. С одной стороны, они продуцируют нейротрофические факторы, которые запускают регенерацию. С другой стороны, они вызывают нейродегенерацию посредством активации микроглии и благодаря собственной нейротоксической активности. Важно понимать, что деятельность реактивных астроцитов зависит от их топографического расположения и микроокружения, а также медиаторов, которые выделяются клетками-резидентами и нерезидентами ЦНС. Знания о регуляции астроцитарных эффектов необходимы для реализации терапевтического потенциала астроглиоцитов.
Список литературы Роль астроцитов в нейровоспалении (обзор)
- Khakh BS, Deneen В. The emerging nature of astro-cyte diversity. Annu Rev Neurosci. 2019; (42): 187-207. DOI: 10.1146/annurev-neuro-070918-050443.
- Eng LF, Ghirnikar RS, Lee YL. Glial fibrillary acidic protein: GFAP-thirty-one years (1969-2000). Neurochem Res. 2000; (25): 1439-51. DOI: 10.1023/A:1007677003387.
- Malatesta P, Hack MA, Hartfuss E, et al. Neuronal or glial progeny: regional differences in radial glia fate. Neuron. 2003; 37 (5): 751-64. DOI: 10.1016/s0896-6273(03)00116-8.
- Block ML, Zecca L, Hong JS. Microglia-mediated neuro-toxicity: uncovering the molecular mechanisms. Nat Rev Neurosci. 2007; 8 (1): 57-69. DOI: 10.1038/nrn2038.
- Boche D, Perry VH, Nicoll JA. Review: activation patterns of microglia and their identification in the human brain. Neuropathol Appl Neurobiol. 2013; 39 (1): 3-18. DOI: 10.1111/nan. 12011.
- Martinez FO, Gordon S. The M1 and M2 paradigm of macrophage activation: time for reassessment. F1000Prime Rep. 2014; (6): 13. DOI: 10.12703/P6-13.
- Liddelow SA, Barres BA. Reactive astrocytes: production, function, and therapeutic potential. Immunity. 2017; 46 (6): 957-67. DOI: 10.1016/j.immuni.2017.06.006.
- Colombo E, Farina О Astrocytes: Key regulators of neu-roinflammation. Trends Immunol. 2016; 37 (9): 608-20. DOI: 10.1016/j.it.2016.06.006.
- Linnerbauer M, Wheeler MA, Quintana FJ. Astrocyte crosstalk in CNS inflammation. Neuron. 2020; 108 (4): 608-22. DOI: 10.1016/j.neuron.2020.08.012.
- Brambilla R, Morton PD, Ashbaugh JJ, et al. Astrocytes play a key role in EAE pathophysiology by orchestrating in the CNS the inflammatory response of resident and peripheral immune cells and by suppressing remyelination. Glia. 2014; 62 (3): 452-67. DOI: 10.1002/glia.22616.
- Ponath G, Ramanan S, Mubarak M, et al. Myelin phagocytosis by astrocytes after myelin damage promotes lesion pathology. Brain. 2017; 140 (2): 399-413. DOI: 10.1093/brain/aww298.
- Rothhammer V, Kenison JE, Tjon E, et al. Sphingosine 1-phosphate receptor modulation suppresses pathogenic astrocyte activation and chronic progressive CNS inflammation. Proc Natl Acad Sci USA. 2017; 114 (8): 2012-7. DOI: 10.1073/pnas. 1615413114.
- Rivera J, Proia RL, Olivera A. The alliance of sphingo-sine-1-phosphate and its receptors in immunity. Nat Rev Immunol. 2008; 8 (10): 753-63. DOI: 10.1038/nri2400.
- Choi JW, Gardell SE, Herr DR, et al. FTY720 (fingoli-mod) efficacy in an animal model of multiple sclerosis requires astrocyte sphingosine 1-phosphate receptor 1 (S1P1) modulation. Proc Natl Acad Sci USA. 2011; 108 (2): 751-6. DOI: 10.1073/pnas.1014154108.
- Mayo L, Trauger SA, Blain M, et al. Regulation of astrocyte activation by glycolipids drives chronic CNS inflammation. Nat Med. 2014; 20 (10): 1147-56. DOI: 10.1038/nm.3681.
- Chatterjee S, Kolmakova A, Rajesh M. Regulation of lactosylceramide synthase (glucosylceramide beta-1,4-galacto-syltransferase); implication as a drug target. Curr Drug Targets. 2008; 9 (4): 272-81. DOI: 10.2174/138945008783954952.
- Gutierrez-Vazquez C, Quintana FJ. Regulation of the immune response by the aryl hydrocarbon receptor. Immunity. 2018; 48 (1): 19-33. DOI: 10.1016/j.immuni.2017.12.012.
- Rothhammer V, Quintana FJ. The aryl hydrocarbon receptor: an environmental sensor integrating immune responses in health and disease. Nat Rev Immunol. 2019; 19 (3): 184-97. DOI: 10.1038/S41577-019-0125-8.
- Rothhammer V, Mascanfroni ID, Bunse L, et al. Type I interferons and microbial metabolites of tryptophan modulate astrocyte activity and central nervous system inflammation via the aryl hydrocarbon receptor. Nat Med. 2016; 22 (6): 586-97. DOI: 10.1038/nm.4106.
- Zelante T, lannitti RG, Cunha C, et al. Tryptophan ca-tabolites from microbiota engage aryl hydrocarbon receptor and balance mucosal reactivity via interleukin-22. Immunity. 2013; 39 (2): 372-85. DOI: 10.1016/j.immuni.2013.08.003.
- Arevalo JC, Wu SH. Neurotrophin signaling: many exciting surprises! Cell Mol Life Sci. 2006; 63 (13): 1523-37. DOI: 10.1007/S00018-006-6010-1.
- Colombo E, Cordiglieri C, Melli G, et al. Stimulation of the neurotrophin receptor TrkB on astrocytes drives nitric oxide production and neurodegeneration. J Exp Med. 2012; 209 (3): 521-35. DOI: 10.1084/jem.20110698.
- Liddelow SA, Guttenplan KA, Clarke LE, et al. Neurotox-ic reactive astrocytes are induced by activated microglia. Nature. 2017; 541 (7638): 481-7. DOI: 10.1038/nature21029.
- Wheeler MA, Clark 1С, Tjon EC, et al. MAFG-driven astrocytes promote CNS inflammation. Nature. 2020; 578 (7796): 593-9. DOI: 10.1038/s41586-020-1999-0.
- Komuczki J, Tuzlak S, Friebel E, et al. Fate-mapping of GM-CSF expression identifies a discrete subset of inflammation-driving T helper cells regulated by cytokines IL-23 and IL-1 p. Immunity. 2019; 50 (5): 1289-304. e6. DOI: 10.1016/j.immuni. 2019.04.006.
- Heink S, Yogev N, Garbers C, et al. Trans-presentation of IL-6 by dendritic cells is required for the priming of pathogenic TH17 cells. Nat Immunol. 2017; 18 (1): 74-85. DOI: 10.1038/ni. 3632.
- Sanchis P, Fernandez-Gayol O, Comes G, et al. Inter-leukin-6 derived from the central nervous system may influence the pathogenesis of experimental autoimmune encephalomyelitis in a cell-dependent manner. Cells. 2020; 9 (2): 330. DOI: 10.3390/cells9020330.
- Savarin C, Hinton DR, Valentin-Torres A, et al. Astrocyte response to IFN-y limits IL-6-mediated microglia activation and progressive autoimmune encephalomyelitis. J Neuroinflamma-tion. 2015; (12): 79. DOI: 10.1186/s12974-015-0293-9.
- Wheeler MA, Jaronen M, Covacu R, et al. Environmental control of astrocyte pathogenic activities in CNS inflammation. Cell. 2019; 176 (3): 581-96. e18. DOI: 10.1016/j.cell. 2018.12.012.
- Norden DM, Fenn AM, Dugan A, Godbout JP TGFp produced by IL-10 redirected astrocytes attenuates microglial activation. Glia. 2014; 62 (6): 881-95. DOI: 10.1002/glia.22647.
- ZeisT, Enz L, Schaeren-Wemers N. The immunomodulatory oligodendrocyte. Brain Res. 2016; 1641 (Pt A): 139-48. DOI: 10.1016/j.brainres.2015.09.021.
- Jakel S, Agirre E, Mendanha Falcao A, et al. Altered human oligodendrocyte heterogeneity in multiple sclerosis. Nature. 2019; 566 (7745): 543-7. DOI: 10.1038/s41586-019-0903-2.
- Moyon S, Dubessy AL, Aigrot MS, et al. Demyelination causes adult CNS progenitors to revert to an immature state and express immune cues that support their migration. J Neurosci. 2015; 35 (1): 4-20. DOI: 10.1523/JNEUROSCI.0849-14.2015.
- Valentin-Torres A, Savarin C, Barnett J, Bergmann CO Blockade of sustained tumor necrosis factor in a transgenic model of progressive autoimmune encephalomyelitis limits oligodendrocyte apoptosis and promotes oligodendrocyte maturation. J Neuroinflammation. 2018; 15 (1): 121. DOI: 10.1186/sl 2974-018-1164-y.
- Locatelli G, Wortge S, Buch T, et al. Primary oligodendrocyte death does not elicit anti-CNS immunity. Nat Neurosci. 2012; 15 (4): 543-50. DOI: 10.1038/nn.3062.
- Domingues HS, Portugal CC, Socodato R, Relvas JB. Oligodendrocyte, astrocyte, and microglia crosstalk in myelin development, damage, and repair. Front Cell Dev Biol. 2016; (4): 71. DOI: 10.3389/fcell.2016.00071.
- Niu J, Tsai HH, Hoi KK, et al. Aberrant oligodendroglial-vascular interactions disrupt the blood-brain barrier, triggering CNS inflammation. Nat Neurosci. 2019; 22 (5): 709-18. DOI: 10.1038/S41593-019-0369-4.
- Locatelli G, Theodorou D, Kendirli A, et al. Mononuclear phagocytes locally specify and adapt their phenotype in a multiple sclerosis model. Nat Neurosci. 2018; 21 (9): 1196-208. DOI: 10.1038/S41593-018-0212-3.
- Calabrese V, Mancuso C, Calvani M, et al. Nitric oxide in the central nervous system: neuroprotection versus neurotoxicity Nat Rev Neurosci. 2007; 8 (10): 766-75. DOI: 10.1038/nrn2214.
- Bezzi P, Domercq M, Brambilla L, et al. CXCR4-activated astrocyte glutamate release via TNFalpha: amplification by microglia triggers neurotoxicity. Nat Neurosci. 2001; 4 (7): 702-10. DOI: 10.1038/89490.
- Chao CC, Gutierrez-Vazquez C, Rothhammer V, et al. Metabolic control of astrocyte pathogenic activity via CPLA2-MA-VS. Cell. 2019; 179 (7): 1483-98. e22. DOI: 10.1016/j.cell. 2019.11.016.
- Magistretti PJ, Allaman I. Lactate in the brain: from metabolic end-product to signalling molecule. Nat Rev Neurosci. 2018; 19 (4): 235-49. DOI: 10.1038/nrn.2018.19.
- Merlini M, Meyer ЕР, Ulmann-Schuler A, Nitsch RM. Vascular p-amyloid and early astrocyte alterations impair cere-brovascular function and cerebral metabolism in transgenic arcAp mice. Acta Neuropathol. 2011; 122 (3): 293-311. DOI: 10.1007/S00401 -011 -0834-y.
- Ohman A, Forsgren L. NMR metabonomics of cere-brospinal fluid distinguishes between Parkinson's disease and controls. Neurosci Lett. 2015; (594): 36-9. DOI: 10.1016/j.neulet. 2015.03.051.
- Nagai J, Rajbhandari AK, Gangwani MR, etal. Hyperactivity with disrupted attention by activation of an astrocyte synaptogenic cue. Cell. 2019; 177 (5): 1280-92. e20. DOI: 10.1016/j. cell.2019.03.019.


