Роль биопрепаратов в повышении симбиоза и продуктивности фасоли
Автор: Парахин Н.В., Наумкина Т.С., Осин А.А., Осина В.С.
Журнал: Вестник аграрной науки @vestnikogau
Рубрика: Растениеводство
Статья в выпуске: 4 (13), 2008 года.
Бесплатный доступ
Совместная инокуляция фасоли биопрепаратами клубеньковых бактерий и эндомикоризными грибами повышала симбиотическую и фотосинтетическую деятельность посевов. Двойная инокуляция увеличила общее потребление азота в 1,5 раза, а симбиотически фиксированного - в 2,1 раза, при этом повысилась урожайность и белковистость семян.
Короткий адрес: https://sciup.org/147123323
IDR: 147123323 | УДК: 635.652.2:631.524.84:631.847.21
Текст научной статьи Роль биопрепаратов в повышении симбиоза и продуктивности фасоли
Интенсификация сельскохозяйственного производства, предусматривающая массированное применение удобрений и пестицидов, за последние полвека позволила увеличить прирост сельскохозяйственной продукции на 70–90%. Но повышение урожайности сопровождается значительными вложениями капитала и энергоресурсов [1].
В мировой практике наблюдается тенденция снижения доз применяемых минеральных удобрений , и возрастает роль их интегрированного использования ( по экономическим и экологическим соображениям ) с агротехническими приемами , направленными на поддержание естественного плодородия почв , мероприятиями по повышению биоразнообразия полезной почвенной микрофлоры . Без принятия срочных мер по сохранению и повышению плодородия почв оно уже в ближайшем будущем может быть необратимо утрачено на обширных земледельческих территориях . Наиболее эффективное и экологически безопасное применение минеральных удобрений возможно только при удовлетворении потребности растений в широком спектре других компонентов , обеспечивающих развитие растений без ущерба для плодородия почв . Одним из них является инокуляция (" заражение ") комплексом полезных почвенных микроорганизмов [2, 3].
Бобово - ризобиальный и арбускулярный микоризный (AM) симбиозы являются системами огромного практического значения . Инокуляция бобовых культур клубеньковыми бактериями способствует повышению урожая за счет дополнительного фиксированного азота воздуха . Исследования Е . Н . Мишустина , В . К . Ш ильниковой (1973), Г . С . Посыпанова (1983, 1995), Н . В . Парахина , С . Н . Петровой (2006) показали , что при благоприятных условиях симбиоза зерновые бобовые культуры могут фиксировать до 200–300 кг / га азота воздуха [4, 5, 6, 7].
Микоризация бобовых растений способствует улучшению роста растений и фосфорного питания . Азотфиксирующий и AM симбиозы имеют экологическое значение , предохраняя почвы от истощения и поддерживая биологическое разнообразие растительных сообществ .
Имеются многочисленные структурные сходства , общие гены в системах , контролирующие эти типы симбиозов , которые указывают на общие механизмы взаимодействия между макро - и микросимбионтом . Это заставляет рассматривать генетическую систему бобовых растений , контролирующую их симбиотические свойства , как единую для развития 2
тройного симбиоза – бобовое растение + эндомикоризные грибы + клубеньковые бактерии [8, 9].
В природных экосистемах бобовые формируют ассоциации с грибами арбускулярной микоризы и ризобиями . Такие взаимодействия получили название тройного симбиоза . Исследованиями отечественных и зарубежных ученых , проведенных в полевых условиях , установлено положительное влияние двойной инокуляции на продуктивность бобовых растений .
Полевые исследования Н . М . Лабутовой и др . (2004), проведенные в институте масличных культур УААН ( г . Запорожье ), показали , что двойная инокуляция растений сои клубеньковыми бактериями и эндомикоризными грибами значительно повышала урожайность и содержание белка в семенах , чем их моноинокуляция каждым препаратом отдельно [10].
При инокуляции сои ризобиумом совместно с грибами АМ в опытах Y. Kawai и Y. Yamamoto (1986) установлено , что растения лучше поглощают P, Ca, Mg. Двойная инокуляция повышала количество клубеньков , их сухую массу , нитрогеназную активность [11].
Повышение продуктивности гороха посевного при совместной инокуляции препаратами клубеньковых бактерий и грибами АМ отмечено в работах Т . С . Наумкиной и др . (2003) и А . Ю . Борисова и др . (2004) [9, 12].
Несмотря на активные исследования , потенциал бобово - ризобиального и АМ симбиозов изучены недостаточно для применения в сельскохозяйственном производстве .
Целью нашей работы явилось изучить влияние и роль биопрепаратов ризоторфина и гломуса на формирование симбиотической системы , фотосинтетических показателей , уровень симбиотической азотфиксации , урожайность и качество семян фасоли .
М етодика
Исследования были проведены в ГНУ ВНИИЗБК в севообороте лаборатории генетики и микробиологии в 2004–2007 гг . Объектом исследований была фасоль ( сорт Оран ).
Почва опытных участков – темно - серая лесная ; среднесуглинистая ; с мощностью гумусового слоя 30– 35 см . Плотность пахотного слоя – 1,30–1,35 г / см 3. Гигроскопическая влажность в пахотном слое – 7,5% от сухой массы почвы . Наименьшая влагоемкость – 32,2–34,8%. Влажность устойчивого завядания – 9,7% от объема почвы . Содержание гумуса составило 4,4– 5,5%; легкогидролизуемого азота по Кононовой –7,8– 9,5 мг /100 г почвы ; подвижного фосфора ( Р 2 О 5) по Кирсанову – 9,2–11,3 мг /100 г почвы ; калия ( К 2 О ) по Масловой – 7,5–8,3 мг /100 г почвы ; гидролитическая кислотность – 4,2–4,6 мг - экв .; сумма поглощенных оснований – 21,6–26,5 мг - экв ./100 г почвы ; степень насыщенности основаниями – 78–94%; рН солевой вытяжки – 5,6–6,3.
Для инокуляции растений использовали биопрепарат ризоторфин на основе клубеньковых бактерий Rhizobium Phaseoli (штамм 653а) и биопрепарат на основе эндомикоризного гриба Glomus intraradices (штамм 8), представляющий смесь субстрата с микоризированными корнями растения-хозяина (ВНИИСХМ). Ризоторфином обрабатывали семена перед посевом, эндомикоризный гриб в количестве 300 кг/га вносили в почву при посеве. Схема полевого опыта включала следующие варианты :
-
1. Контроль ( без удобрений и без обработок Rhizobium и Glomus) – вариант абсолютного контроля необходим для выявления эффективности биопрепаратов ;
-
2. Инокуляция Glomus;
-
3. Инокуляция Rhizobium.
-
4. Инокуляция Rhizobium + Glomus.
Второй – четвертые варианты необходимы для выявления эффективности моноинокуляции ризоторфином , микоризации гломусом и эффективности тройного симбиоза ( бобовое растение + ризобиум + гломус ) без внесения удобрений на естественном плодородии почвы .
Общепринятая для условий зоны агротехника фасоли . Норма высева 0,6 млн . всхожих семян на 1 га . Учетная площадь делянки 15 м 2, повторность четырехкратная .
В ходе исследований изучали динамику формирования симбиотического аппарата фасоли , нитрогеназную активность клубеньков , активный симбиотический потенциал ( АСП ) [13], динамику формирования площади листьев , фотосинтетического потенциала ( ФП ), чистой продуктивности фотосинтеза ( ЧПФ ), накопление абсолютного сухого вещества [14], содержание белка (N x 6,25) и урожайность семян фасоли .
Результаты исследований и их обсуждение
Наши исследования показали , что моноинокуляция гломусом повысила все показатели формирования симбиотического аппарата фасоли . Так , при внесении гломуса число клубеньков и их масса возросли соответственно в 1,5 и 1,9 раза по сравнению с абсолютным контролем , при этом нодуляция растений достигла 43,2% против 30,5%. Применение ризоторфина обеспечило дальнейшее повышение всех показателей симбиотической системы фасоли ( табл . 1).
Таблица 1 – Влияние биопрепаратов на развитие симбиотической системы фасоли (в среднем за 2004–2007 гг.)
|
Показатели |
Варианты |
|||
|
1 |
2 |
3 |
4 |
|
|
Нодуляция растений , % |
30,5 |
43,2 |
81,7 |
94,8 |
|
Количество клубеньков , млн шт ./ га |
2,25±0,09 |
3,39±0,09 |
4,35±0,10 |
4,98±0,10 |
|
Масса клубеньков , кг / га |
22,2±3,7 |
42,3±4,0 |
69,8±6,1 |
83,9±6,7 |
|
АСП , кг дней / га |
1658 |
3172 |
5228 |
6292 |
|
Активность нитрогеназы , N2 мкг / раст ./ час |
95,2 |
107,4 |
208,5 |
337,2 |
Инокуляция растений азотфиксирующими и фосфатмобилизирующими микроорганизмами одновременно оказалась более эффективной, чем каждым препаратом отдельно. В среднем за 4 года полевых опытов число клубеньков в этом варианте составило 4,98 млн. шт./га, что в 2,2 раза больше, чем на контроле без инокуляции, нодуляция растений достигла 94,8%, а активность нитрогеназы была максимальной – 337,2 N2 мкг /раст./час. АСП был на 1064 кг дней/га выше, чем в варианте с ризоторфином и в 3,8 раза больше, чем на абсолютном контроле.
Симбиотическая деятельность посевов фасоли оказала положительное влияние на формирование всех фотосинтетических показателей деятельности посевов фасоли ( табл . 2).
Таблица 2 – Значение фотосинтетических показателей деятельности посевов фасоли в зависимости от варианта опыта (в среднем за 2004–2007 гг.)
|
Показатели |
Варианты |
|||
|
1 |
2 |
3 |
4 |
|
|
Площадь листьев , |
23,2± |
24,8± |
26,1± |
28,4± |
|
тыс . м 2/ га |
1,11 |
1,20 |
1,15 |
1,22 |
|
ФП , млн . м 2 дн ./ га |
1,74± 0,04 |
1,81± 0,04 |
2,00± 0,05 |
2,06± 0,06 |
|
ЧПФ , г / м 2 дн . |
3,75± 0,22 |
3,93± 0,23 |
4,00± 0,25 |
4,17± 0,26 |
|
Накопление АСВ , |
6,50± |
7,12± |
7,99± |
8,54± |
|
т / га |
0,38 |
0,42 |
0,41 |
0,43 |
При формировании фотосинтетических показателей прослеживается аналогичная закономерность . Моноинокуляция гломусом и ризоторфином обеспечивала увеличение площади листьев , фотосинтетического потенциала ( ФП ), чистой продуктивности фотосинтеза ( ЧПФ ) и накопление абсолютно сухого вещества . Двойная инокуляция была также более эффективной . При совместном применении гломуса и ризоторфина была образована максимальная площадь листьев .
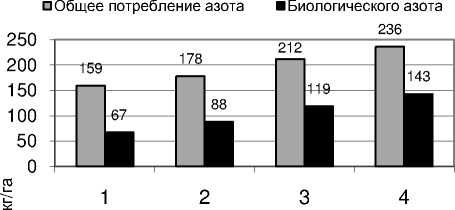
варианты
-
1. Контроль ( без инокуляции );
-
2. Инокуляция Glomus;
-
3. Инокуляция Rhizobium.
-
4. Инокуляция Rhizobium + Glomus.
Рисунок – Влияние биопрепаратов на потребление общего и биологического азота растениями фасоли ( в среднем за 2004–2007 гг .)
В среднем за 4 года она составила 28,4 тыс . м 2/ га , что на 5,2 тыс . м 2/ га больше , чем на абсолютном контроле . ФП возрос на 0,32 млн . м 2 дн ./ га , а ЧПФ – на
0,42 г / м 2 дн . Накопление сухого вещества превысило контрольный вариант на 2,04 т / га .
Биопрепараты оказали положительное влияние на общее потребление азота и , особенно , на интенсивность симбиотической азотфиксации растениями фасоли ( рис .).
Раздельное внесение биопрепаратов повысило как общее потребление , так и биологического азота фасолью . В варианте с ризоторфином общий вынос азота был на 53 кг / га , а симбиотического – на 42 кг / га больше , чем на абсолютном контроле . Доля биологического азота возросла с 42,1 до 56,1%.
Двойная инокуляция гломусом и ризоторфином увеличила общее потребление азота в 1,5 раза , а симбиотически фиксированного – в 2,1 раза . Доля биологического азота в его общем потреблении возросла до 60,6%.
Степень развития и активность фотосинтетического и симбиотического аппарата оказали существенное влияние на урожайность и качество семян фасоли . Наши исследования показали , что более высокий урожай семян был получен в варианте с одновременным применением гломуса и ризоторфина . В среднем за 4 года он составил 33,6 ц / га ( табл . 3).
Таблица 3 – Влияние биопрепаратов на урожайность и качество семян фасоли ( в среднем за 2004–2007 гг .)
|
Показатели |
Варианты |
|||
|
1 |
2 |
3 |
4 |
|
|
Урожайность , ц / га |
26,6± 1,25 |
28,9± 1,29 |
31,1± 1,39 |
33,6± 1,43 |
|
Содержание белка , % |
24,3 |
24,8 |
25,4 |
25,9 |
|
Сбор белка , кг / га |
646± 19 |
717± 21 |
790± 23 |
870± 23 |
Раздельная обработка растений фасоли гломусом и ризоторфином увеличила урожайность фасоли на 2,3– 4,5 ц / га соответственно , а содержание белка в семенах повысилось на 0,5–1,2%. Самый высокий выход белка с 1 га посева был в варианте двойной инокуляции – 870 кг / га , что на 224 кг / га больше , чем на абсолютном контроле и на 80–153 кг / га выше , чем в вариантах с обработкой растений ризоторфином и гломусом .
Заключение
Таким образом , исследования , проведенные в течение 4- х лет , показали , что тройная симбиотическая система , включающая в себя бобовую культуру ( фасоль ) – клубеньковые бактерии и грибы арбускулярной микоризы , наиболее эффективна .
В условиях Среднерусской лесостепи можно рекомендовать использование биопрепаратов на основе азотфиксирующих и фосфатмобилизирующих микроорганизмов . Это не требует высоких затрат , позволяет повысить продуктивность растений , что является актуальным в экологически ориентированном сельскохозяйственном производстве .
Список литературы Роль биопрепаратов в повышении симбиоза и продуктивности фасоли
- Gold M.V. Sustainable Agriculture: Definitions And Terms. 1999. Available At The USDA National Agriculture Library; http://www.nal.usda.gov/afsic/AFSIC> pubs/srb 9902/htm.
- Food, Agriculture, Convervation And Trade Act Of 1990 (FACTA)//Public Law. 1990. Govenment Printing Office. Washington, DC. P. 101-624.
- Vance C.P. Symbiotic nitrogen fixation and phosphorus acquisition. Plant nutrition in a world of declining renewable resources//Plant Physiology, 2001, vol. 127.-P. 390-397.
- Мишустин, Е.Н. Клубеньковые бактерии и инокуляционный процесс/Е.Н. Мишустин, В.К. Шильникова.-М.: Наука, 1973.-288с.
- Посыпанов, Г.С. Биологический азот -проблемы экологии и растительного белка/Г.С. Посыпанов.-М.: МСХА, 1993.-268с.
- Посыпанов, Г.С. Энергетическая оценка технологии возделывания полевых культур/Г.С. Посыпанов, В.Е. Долгодворов.-М.: МСХА, 1995.-36с.
- Парахин, Н.В. Сельскохозяйственные аспекты симбиотической азотфиксации/Н.В. Парахин, С.Н. Петрова.-М.: КолосС, 2006.-149с.
- Тихонович, И.А. Создание высокоэффективных микрорастительных систем/И.А. Тихонович//С.-х. биология.-2000.-№1.-С.28-33.
- Наумкина, Т.С. Инокуляция гороха посевного грибами арбускулярной микоризы и клубеньковыми бактериями для повышения продуктивности растений/Т.С. Наумкина, А.Ю. Борисов, О.Ю. Штарк//Сб. науч.-практ. конференции "Пути повышения устойчивости сельскохозяйственного производства в современных условиях.-Орел:ОрелГАУ, 2003.-С.124-131.
- Лабутова, Н.М. Влияние инокуляции растений клубеньковыми бактериями и эндомикоризным грибом на урожай различных сортов сои и содержание белка и масла в семенах/Н.М. Лабутова, А.И. Поляков, В.А. Лях, В.Л. Гордон//Доклады РАСХН.-№2.-2004.-С.10-12.
- Kawai, Y., Yamamoto Y. Increase in the Formation and Nitrogen Fixation of Soybean Nodules by Vesicurar-Arbuscular Mycorhiza/Y. Kawai, Y. Yamamoto//Plant Cell Physiol., 1986, vol. 27(3).-P. 399-405.
- Борисов, А.Ю. Эффективность использования совместной инокуляции гороха посевного грибами арбускулярной микоризы и клубеньковыми бактериями/А.Ю. Борисов, Т.С. Наумкина, О.Ю. Штарк и др.//Доклады РАСХН.-№2.-2004.-С.12-14.
- Посыпанов, Г.С. Методы изучения биологической фиксации азота воздуха/Г.С. Посыпанов. -М.: Агропромиздат, 1991.-300 с.
- Ничипорович, А.А. Фотосинтетическая деятельность растений в посевах/А.А. Ничипорович, Л.Е Строгонова, С.Н. Чмора, М.П. Власова. -М.: Агропромиздат, 1961.-180 с.


