Роль чувствительных С-волокон в развитии кардиопротекторного эффекта дистантного ишемического прекондиционирования
Автор: Барсукевич Вероника Чеславовна, Басалай Марина Васильевна, Булгак Александр Григорьевич, Мрочек Александр Геннадьевич
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 1, 2012 года.
Бесплатный доступ
Цель исследования: оценить роль чувствительных С-волокон в механизмах развития противоишемического эффекта дистантного ишемического прекондиционирования (ДИПК) при ишемии и реперфузии миокарда. Материалы и методы: эксперименты проведены на 80 наркотизированных нелинейных крысах-самцах (массой 250-350гр), разделенных на два экспериментальных протокола. Протокол 1. Было набрано 30 новорожденных крысят, которые были разделены на контрольные и опытные группы. В опытных группах животным с целью дегенерации чувствительных С-волокон в неонатальном периоде вводили капсаицин (п=15). По достижении массы 250 гр, животные подвергались 30-минутной ишемии и 120-минутной реперфузии миокарда (группы Контроль-ОИМ, п=7, Капсаицин-ОИМ, п=6) или двухсторонней 15-минутной окклюзии бедренных артерий, предшествующей ишемии и реперфузии миокарда (Контроль-ДИПК, п=8, Капсаицин-ДИПК, п=9). Протокол 2. Крысы первой группы подвергались 30-минутной ишемии миокарда с последующей 120-минутной реперфузией (группа Контроль, п=10). Животным второй и третьей групп за 25 минут до начала ишемии (группа ДИПК, п=10) и на 25-й минуте ишемии (группа ДИПК25', п=10) выполнялась двухсторонняя 15-минутная окклюзия бедренных артерий. Животным четвертой и пятой групп осуществляли подкожное введение капсаицина за 25 минут до начала ишемии и на 25-й минуте ишемии (группы Капсаицин, п=10 и Капсаицин25', п=10). Результаты: Протокол 1. В группах животных, которым выполнялась 30-минутная ишемия, сопровождающаяся 120-минутной реперфузией, размеры некроза миокарда были сопоставимы и составили 45±4% и 43±1% (группы Контроль-ОИМ и Капсаицин-ОИМ соответственно). В группе Капсаицин-ДИПК не наблюдалось уменьшения размера некроза по сравнению с группой Капсаицин-ОИМ (р>0,05). Протокол 2. Размер некроза в контрольной группе составил 42±1%. Отмечалось значимое уменьшение размера зоны некроза в группах, в которых окклюзия бедренных артерий выполнялась за 25 минут до начала острой ишемии и начиная с 25 минуты ишемии, а также у животных, которым за 25 минут до начала коронарной окклюзии вводился капсаицин по сравнению с контрольной группой (19±1%, 18±2% и 25±1%, соответственно, р0,05 в сравнении с группой Контроль). Заключение: полученные результаты свидетельствуют о том, что чувствительные С-волокна участвуют в развитии противоишемического эффекта ДИПК, осуществляемого до начала острой ишемии миокарда, однако, не играют роли ключевого звена в развитии кардиопротекторного эффекта ДИПК, воспроизводимого с 25-й минуты ишемии по 10-ю минуту реперфузии.
Дистантное ишемическое прекондиционирование, ишемическое и реперфузионное повреждение миокарда, капсаицин, с-волокна
Короткий адрес: https://sciup.org/14342704
IDR: 14342704
Текст научной статьи Роль чувствительных С-волокон в развитии кардиопротекторного эффекта дистантного ишемического прекондиционирования
Ишемическая болезнь сердца по-прежнему занимает лидирующее место среди причин смертности населения большинства экономически развитых стран мира, в том числе и в странах СНГ. Многочисленные экспериментальные и клинические исследования последних лет существенно расширили представления о патогенезе ИБС. В клиническую терминологию прочно вошли такие новые феномены как оглушенный, гиберниру-ющий миокард, а также феномен ишемического прекондиционирования. Прекондиционирование миокарда - один из наиболее эффективных механизмов эндогенной кардиопротекции. Под ишемическим прекондиционированием понимают повышение устойчивости миокарда к продолжительной ишемии, возникающее после кратковременных эпизодов локальной ишемии -реперфузии [1,2,3]. Однако применение данного феномена в клинической практике ограничено ввиду невозможности прогнозирования и предупреждения приступа ишемии. В последние годы было также показано, что устойчивость миокарда к ишемии повышается не только после кратковременных эпизодов ишемии - реперфузии самого миокарда, но и после ишемии - реперфузии анатомически отдаленных органов, таких, например, как тонкий кишечник, почки, скелетная мускулатура. Этот феномен получил название дистантного ишемического прекондиционирования (ДИПК). В многочисленных исследованиях была показана высокая эффективность ДИПК в ограничении размера некроза миокарда [4]. Понимание механизмов, лежащих в основе ДИПК, важно для скорейшего внедрения возможностей данного феномена в клиническую практику. Согласно современным представлениям, существуют 2 пути передачи ишемического сигнала от анатомически удаленного органа к сердцу - гуморальный [4-8] и нейрогенный [4,5,9-11]. Нейрогенный путь предполагает участие чувствительных немиели-низированных С-волокон [12]. Если эта гипотеза верна, то активация афферентных С-волокон конечностей неишемическим стимулом может оказывать кардиопротекторное действие. В экспериментальных исследованиях было показано, что введение капсаицина в неонатальном периоде в высоких дозах вызывает дегенерацию чувствительных нервных волокон. В тоже время капсаицин вызывает стимуляцию этих же волокон при воздействии в малых концентрациях [12,13]. Эксперименты, проведенные Ren X. et al. [14], продемонстрировали наличие кардиопротектор-ного эффекта неишемического стимула: надреза передней брюшной стенки, названного травматическим дистантным прекондиционированием. Было также показано, что кардиопротекторный эффект травматического прекондиционирования обусловлен раздражением чувствительных рецепторов, расположенных в коже, и требует вовлечения кардиальных симпатических нервов [9].
Целью настоящего исследования было изучение участия чувствительных С-волокон в механизмах развития противоишемического эффекта дистантного ишемического прекондиционирования (ДИПК) при ишемии и реперфузии миокарда.
МАТЕРИАЛЫ И МЕТОДЫ
Все исследования были проведены на модели острой коронарной недостаточности. В качестве наркоза использовался этаминал натрия в дозе 50 мг/кг внутрибрюшинно с последующим введением поддерживающей дозы 10 мг/кг/час внутривенно. Животных посредством трахеотомии переводили на искусственное дыхание атмосферным воздухом с помощью аппарата ИВЛ. Для измерения системного артериального давления (АД) крысам канюлировали правую общую сонную артерию. ЭКГ регистрировали при помощи игольчатых электродов. Температуру измеряли в прямой кишке с помощью температурного датчика. Регистрацию ЭКГ, АД осуществляли с помощью компьютерной программы Spike 4. Грудную клетку вскрывали в четвертом межреберном промежутке. Регионарная ишемия достигалась путем наложения лигатуры на переднюю нисходящую коронарную артерию (ПИКА). Окклюзия артерии подтверждалась цианозом ишемизированной области, снижением АД (на 10-20 мм рт. ст.) и подъемом сегмента ST на ЭКГ. Реперфузия миокарда достигалась простым удалением фишки и подтверждалась исчезновением цианоза и снижением сегмента ST и составляла 120 минут. Изучались следующие показатели гемодинамики: среднее АД (АД ср.), частота сердечных сокращений (ЧСС), двойное произведение (ДП). Показатели гемодинамики регистрировались непрерывно в течение эксперимента и оценивались в конце 15-минутной стабилизации после вскрытия грудной клетки, в начале 30-минутной окклюзии ПИКА, в начале реперфузии, а также, каждые 30 минут в течение реперфузии.
В конце реперфузии производили повторную окклюзию ПИКА. Внутривенно в левую общую яремную вену вводили 0.5 мл 5% раствора синьки Эванса, определяя, таким образом, зону риска, как не окрашенную в синий цвет. Затем сердце извлекали и отделяли правый желудочек. После за- мораживания при температуре -20 С левый желудочек разрезали на б поперечных срезов. Срезы сканировали при помощи сканера с обеих сторон, после чего их помещали в раствор трифенилте-тразолия хлорида на 15 минут при температуре 37 С для идентификации зоны некроза. Жизнеспособный миокард (клетки, сохранившие деги-дрогеназную активность) окрашивался в кирпично-красный цвет, некротизированная ткань была белесой. После 24-часовой инкубации срезов в 10% растворе формалина срезы сканировали повторно для определения соотношения площадей зоны риска и зоны некроза. Размеры зон риска и некроза определяли при помощи компьютерной планиметрии с использованием программы Adobe Photoshop 6.0.
Животные были разделены на два экспериментальных протокола.
Протокол 1. Для изучения участия чувствительных С-волокон в развитии кардиопротектор-ного эффекта ДИПК были набраны 30 новорожденных крысят в возрасте 1-2 суток. Животные были разделены на опытную и контрольную группы. С целью дегенерации чувствительных нервов, преимущественно немиелинизированных С-волокон, новорожденным крысам опытных групп (п=15) под 4% ингаляционным галотановым наркозом подкожно в область спины вводили раствор, содержащий капсаицин (50 мг/кг массы), этанол (1/10), Твин-80 (1/10) и дистиллированную воду (8/10). Крысам контрольных групп (п=15) вводили раствор такого же состава, но не содержащий капсаицина. При достижении массы крыс 200-250гр животные обеих групп были дополнительно рандомизированы на 2 подгруппы. Одним животным выполнялась только 30-минутная окклюзия ПИКА, сопровождающаяся 120-минутной реперфузией (группы контроль - ОИМ, п=7, и капсаицин - ОИМ, п=б), другим - за 25 минут до начала коронарной окклюзии выполнялось 15-минутное пережатие обеих бедренных артерий (группы контроль - ДИПК, п=8, и капсаицин - ДИПК, п=9). С целью подтверждения эффективности воздействия капсаицина на чувствительные С-волокна всем крысам измеряли массу мочевого пузыря, поскольку известно, что при потере чувствительной иннервации наблюдается его выраженная гипертрофия [13].
Протокол 2. Для изучения участия чувствительных С-волокон в ограничении зоны некроза миокарда, вызванной его ишемией и реперфузией, мы проводили стимуляцию С-волокон путем подкожного введения капсаицина крысам опытных групп. Исследование проводилось на 50 белых нелинейных крысах-самцах массой 250-
ЗООгр, разделенных на пять групп. В контрольной группе крыс после периода 15-минутной стабилизации выполняли 30-минутную окклюзию ПИКА, сопровождающуюся 120-минутной реперфузией (п=10). Во второй группе крысам за 25 минут до начала окклюзии ПИКА выполнялось 15-минутное пережатие обеих бедренных артерий (группа ДИПК, п=10). В третьей группе окклюзия бедренных артерий выполнялась с 25-й минуты ишемии по 10-ю минуту реперфузии (группа ДИПК25', п=10). В четвертой группе крысам подкожно билатерально в область задних конечностей за 25 минут до начала 30-минутной ишемии миокарда вводился капсаицин в дозе 3 мкг (группа Капсаицин, п=10). Животным пятой группы капсаицин вводился на 25-й минуте ишемии миокарда (группа Капсаицин25', п=10).
Статистическая значимость различий изучаемых показателей между группами оценивалась при помощи теста множественных сравнений Бонферрони. Все данные представлены в формате среднее ± стандартная ошибка среднего.
РЕЗУЛЬТАТЫ
Показатели гемодинамики в течение всего эксперимента во всех группах крыс представлены в табл. 1, 2. В ходе экспериментов не отмечалось значимых различий показателей гемодинамики (АД ср., ЧСС) в опытных группах по сравнению с контрольными.
Протокол 1. Размеры зон риска были сопоставимы во всех экспериментальных группах. На рис. 1 представлены зоны некроза в миокарде левого желудочка крыс, подвергшихся введению больших доз капсаицина в возрасте 1 - 2 суток, а также в группах крыс, которым вводился раствор такого же состава, но не содержащий капсаицин. Размеры зон некроза в группах животных, которым выполнялась 30-минутная ишемия миокарда с последующей 120-минутной реперфузией, были сопоставимы и составили 45±4 и 43±3% (группы Контроль-ОИМ и Капсаицин-ОИМ, соответственно, р>0,05). В группе Контроль-ДИПК отмечалось уменьшение размера некроза на 44% в сравнении с группой Контроль-ОИМ (р<0,01). У животных, которым в неонатальном периоде с целью дегенерации чувствительных С-волокон вводился капсаицин (группа Капсаицин-ДИПК), окклюзия бедренных артерий не сопровождалась развитием кардиопротекторного эффекта (р>0,05 в сравнении с группой Капсаицин-ОИМ).
Протокол 2. На рис. 2 представлены размеры зон некроза в миокарде левого желудочка крыс, которым проводилась стимуляция чувствитель- ных С-волокон посредством подкожного введения низких доз капсаицина. В контрольной группе крыс зона некроза составила 42±1%. В группе, в которой выполнялась двухсторонняя окклюзия бедренных артерий за 25 минут до начала острой ишемии миокарда (группа ДИПК), отмечалось ограничение зоны некроза на 54% в сравнении с контрольной группой (р<0,001). В группе животных, в которой окклюзия бедренных артерий производилась с 25-й минуты ишемии по 10-ю минуту реперфузии (группа ДИПК25'), также было получено значительное уменьшение зоны некроза в сравнении с контрольной группой (р<0,001).
У крыс, которым до начала острой коронарной окклюзии подкожно вводился капсаицин (группа Капсаицин), наблюдалось значительное ограничение размера некроза по сравнению с животными контрольной группы (р<0,001). При этом, кардиопротекторный эффект введения низких доз капсаицина был сопоставим с эффектом ДИПК (р>0,05). При введении капсаицина на 25-й минуте ишемии противоишемический эффект отсутствовал (р>0,05 в сравнении с группой Контроль), в то время как двухсторонняя окклюзия бедренных артерий, выполняемая с 25 минуты острой коронарной окклюзии, приводила к ограничению повреждения миокарда (р<0,001 в сравнении с группой Капсаицин25').
ОБСУЖДЕНИЕ
Основное преимущество ДИПК заключается в малой инвазивности и технической простоте воспроизведения, что делает его использование в клинической практике перспективным. Многообещающие результаты некоторых недавних клинических исследований [15] могут способствовать скорейшему внедрению ДИПК в практическую медицину. Это обусловливает важность изучения механизмов, лежащих в основе развития эффектов этого феномена.
В настоящее время известно, что в формирование окончательного размера некроза миокарда вносит вклад как ишемическое, так и реперфузионное повреждение [16,17,18,19], развивающиеся независимо друг от друга и, возможно, посредством различных механизмов. Существование реперфузионного повреждения подтверждается уменьшением размера инфаркта при использовании лечебных вмешательств, осуществляемых в первые минуты восстановления коронарного кровотока [18,19,20]. В проведенном нами ранее исследовании [20] было продемонстрировано ограничение зоны некроза миокарда у крыс, подвергавшихся двухсторонней окклюзии бе- дренных артерий с 25-й минуты ишемии по 10-ю минуту реперфузии при воспроизведении у них модели острой коронарной недостаточности. Это свидетельствует о более значимом вкладе реперфузионного повреждения в формирование окончательного размера зоны необратимого повреждения миокарда, чем предполагалось ранее.
Учитывая факт существования ишемического и реперфузионного повреждения, нам показалось важным и актуальным изучить роль нервных механизмов в реализации противоишемического эффекта ДИПК на этапах ишемии и реперфузии.
При дегенерации чувствительных С-волокон введением высоких доз капсаицина новорожденным крысам противоишемический эффект ДИПК не проявлялся. Этот факт является прямым доказательством непосредственного участия С-волокон в механизмах развития данного феномена. Введение крысам подкожно низких доз капсаицина, селективно стимулирующего С-волокна [12], до начала 30-минутной коронарной окклюзии сопровождалось ограничением зоны некроза, сравнимым по выраженности с противоишемиче-ским эффектом ДИПК (р>0,05), что согласуется с имеющимися в литературе данными [9]. Вместе с тем, стимуляция С-волокон низкими дозами капсаицина на 25-й минуте ишемии не оказывала кар-диопротекторного действия (р>0,05 в сравнении с группой Контроль). Эти данные могут свидетельствовать о существовании иных, вероятно, гуморальных механизмов ДИПК, осуществляемого с 25-й минуты ишемии по 10-ю минуту реперфузии.
ВЫВОДЫ
-
1. При дегенерации капсаицин-чувствительных афферентов у новорожденных крыс противоишемический эффект дистантного ишемического прекондиционирования не проявлялся, что свидетельствует о непосредственном участии чувствительных С-волокон в механизмах развития данного феномена.
-
2. Стимуляция С-волокон до начала острой ишемии способствует ограничению зоны некроза в миокарде и сопоставима по противоишемиче-ской эффективности с дистантным ишемическим прекондиционированием.
-
3. Стимуляция С-волокон во время ишемии миокарда не оказывает противоишемического эффекта, что может свидетельствовать об участии других, вероятно, гуморальных механизмов, лежащих в основе развития кардиопротекторно-го эффекта дистантного прекондиционирования, осуществляемого с 25-й минуты ишемии по 10-ю минуту реперфузии миокарда.
Табл.1.
Показатели гемодинамики в ходе эксперимента у животных, подвергшихся введению капсаицина или растворителя в неонатальном периоде: животные подвергались только 30-минутной ишемии и 120-минутной реперфузии миокарда (Контроль-ОИМ, Капсаицин-ОИМ) или двухсторонней 15-минутной окклюзии бедренных артерий с последующей окклюзией и реперфузией коронарной артерии (Контроль-ДИПК, Капсаицин-ДИПК).
|
Группа |
Контроль-ОИМ |
Капсаицин-ОИМ |
Контроль-ДИПК |
Капсаицин-ДИПК |
|
|
До начала ОИМ |
АД ср. |
74±3 |
77±3 |
80±6 |
72±3 |
|
ЧСС |
381±9 |
382±25 |
369±20 |
380±15 |
|
|
Начало ОИМ |
АД ср. |
81 ±4 |
75±5 |
90±б |
73±5 |
|
ЧСС |
400±12 |
398±23 |
394±17 |
425±9 |
|
|
Начало реперфузии |
АД ср. |
74±2 |
74±4 |
75±4 |
70±3 |
|
ЧСС |
416±8 |
402±21 |
399±17 |
410±11 |
|
|
30'реперфузии |
АД ср. |
7б±3 |
82±5 |
80±4 |
73±2 |
|
ЧСС |
39б±17 |
403±21 |
40б±19 |
40б±12 |
|
|
60'реперфузии |
АД ср. |
75±1 |
83±4 |
80±4 |
75±3 |
|
ЧСС |
383±10 |
408±24 |
425±16 |
421 ±11 |
|
|
90'реперфузии |
АД ср. |
77±3 |
82±5 |
83±4 |
73±4 |
|
ЧСС |
390±16 |
420±24 |
425±16 |
433±7 |
|
|
120'реперфузии |
АД ср. |
79±4 |
83±5 |
81 ±3 |
73±3 |
|
ЧСС |
407±17 |
432±24 |
425±16 |
438±12 |
|
Табл.2
Показатели гемодинамики в ходе эксперимента у животных, подвергшихся 30-минутной ишемии (Контроль) и 120-минутной реперфузии миокарда. Животным опытных групп за 25 минут до начала 30-минутной ишемии (ДИПК) и с 25-й минуты ишемии (ДИПК25') проводили двухстороннее 15-минутное пережатие бедренных артерий, либо подкожное введение капсаицина до ОИМ (Капсаицин) и на 25-й минуте острой коронарной окклюзии (Капсаицин25').
|
Группа |
Контроль |
ДИПК |
ДИПК25' |
Капсаицин |
Капсаицин25' |
|
|
До начала ОИМ |
АД ср. |
79±4 |
82±б |
93±7 |
73±3 |
85±5 |
|
ЧСС |
428±9 |
421±10 |
390±16 |
382±13 |
407±14 |
|
|
Начало ОИМ |
АД ср. |
7б±5 |
82±б |
88±6 |
81 ±4 |
78±4 |
|
ЧСС |
442±7 |
432±14 |
390±16 |
407±13 |
421±13 |
|
|
Начало реперфузии |
АД ср. |
73±2 |
81 ±6 |
87±5 |
78±4 |
73±3 |
|
ЧСС |
435±12 |
443±13 |
417±15 |
420±14 |
415±11 |
|
|
30'реперфузии |
АД ср. |
81 ±3 |
8б±б |
92±5 |
78±3 |
72±3 |
|
ЧСС |
434±16 |
428±14 |
398±16 |
405±15 |
409±12 |
|
|
60'реперфузии |
АД ср. |
87±3 |
90±б |
95±5 |
90±7 |
72±3 |
|
ЧСС |
435±16 |
428±14 |
395±16 |
422±18 |
432±12 |
|
|
90'реперфузии |
АД ср. |
84±4 |
87±7 |
92±5 |
88±6 |
74±2 |
|
ЧСС |
434±17 |
428±15 |
411±14 |
427±17 |
426±11 |
|
|
120'реперфузии |
АД ср. |
85±5 |
88±5 |
91±5 |
8б±5 |
74±3 |
|
ЧСС |
438±14 |
423±11 |
419±13 |
425±16 |
433±11 |
|
Данные представлены в формате: среднее ± стандартная ошибка среднего.
Рис. 1. Зоны некроза в миокарде левого желудочка у животных, подвергшихся введению капсаицина или растворителя в неонатальном периоде. Животным групп Контроль-ОИМ и Капсаицин-ОИМ выполняли только 30-минутную ишемию и 120-минутную реперфузию миокарда, крысам групп Контроль-ДИПК и Капсаицин-ДИПК до начала острой коронарной окклюзии проводили двухстороннее 15-минутное пережатие бедренных артерий.
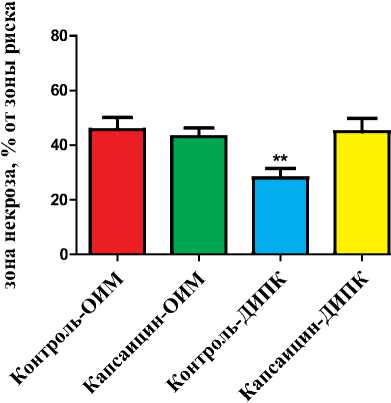
**- р<0,01 - значимое уменьшение зоны некроза в группе Контроль-ДИПК в сравнении с группой Контроль-ОИМ.
Рис. 2. Зоны некроза в миокарде левого желудочка у животных, подвергшихся 30-минутной ишемии и 120-минутной реперфузии миокарда. Животным опытных групп за 25 минут до начала 30-минутной ишемии (ДИПК) и с 25-й минуты ишемии (ДИПК25') проводили двухстороннее 15-минутное пережатие бедренных артерий, либо подкожное введение капсаицина до ОИМ (Капсаицин) и на 25-й минуте острой коронарной окклюзии (Капсаи-цин25').
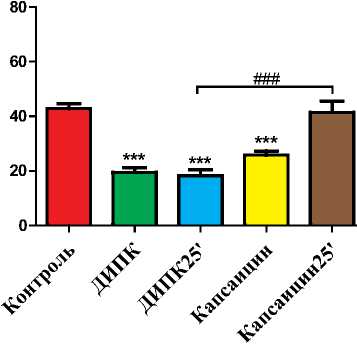
*** - р<0,001 - значимое уменьшение зоны некроза в группах ДИПК, ДИПК25' и Капсаицин в сравнении с контрольной группой,
-
### - р<0,001 - значимое уменьшение зоны некроза.
-
<0,001 - значимое уменьшение зоны некроза
Список литературы Роль чувствительных С-волокон в развитии кардиопротекторного эффекта дистантного ишемического прекондиционирования
- MagiII P., Murphy Т., Bouchier-Hayes D. J., Mulhall К. J. Preconditioning and its clinical potential. IrJ Med Sci. 2009; 178 (2): 129-134.
- Ludman A. J., Yellon D. М., Hausenloy D. J. Cardiac preconditioning for ischaemia: lost in translation. Dis Model Mech. 2010; 3(1-2):35-38.
- Walsh S. R., Tang T. Y., Kullar P. et al. Ischaemic preconditioning during cardiac surgery: systematic review and meta-analysis of perioperative outcomes in randomised clinical trials. Eur J Cardiothorac Surg. 2008; 34(5): 985-994.
- Hausenloy D. J., Yellon D. M. Remote ischaemic preconditioning: underlying mechanisms and clinical application. Cardiovasc Res. 2008; 79; 377-386.
- Lim S.Y., Yellon D.M., Hausenloy D.J. The neural and humoral pathways in remote limb ischemic preconditioning. Basic Res Cardiol. 2010(105):651-655.
- Shimizu М., Tropak М., Diaz R. J. et al. Transient limb ischaemia remotely preconditions through a humoral mechanism acting directly on the myocardium: evidence suggesting cross-species protection. Clin Sci. 2009(117): 191-200.
- King та J. G., Jr. Simard D., Voisine P., Rouleau J. R. Role of the autonomic nervous system in cardioprotection by remote preconditioning in isoflurane-anaesthetized dogs. Cardiovasc Res. 2011; 89 (2): 384-391.
- Konstantinov I. E., Li J., Cheung М. М., et al. Remote ischemic preconditioning of the recipient reduces myocardial ischemia-reperfusion injury of the denervated donor heart via a KATP channel-dependent mechanism. Transplantation 2005 (79):1691-1695.
- Jones W. K., Fan G. C., Liao S. et al. Peripheral nociception associated with surgical incision elicits remote nonischemic cardioprotection via neurogenic activation of protein kinase С signaling. Circulation 2009; 120(11):S1-S9.
- Loukogeorgakis S. P., Panagiotidou A. Т., Broad head M. W. et al. Remote ischemic preconditioning provides early and late protection against endothelial ischemia-reperfusion injury in humans: role of the autonomic nervous system. J Am Coll Cardiol. 2005; 46(3):450-456.
- Steensrud Т., Li J., Dai X. et al. Pretreatment with the nitric oxide donor SNAP or nerve transection blocks humoral preconditioning by remote limb ischemia or intra-arterial adenosine. Am J Physiol Heart Circ Physiol. 2010(299):H 1598-H1603.
- Holzer P. Capsaicin: cellular targets, mechanisms of action, and selectivity for thin sensory neurons. Pharmacol Rev. 1991; 43(2):143-201.
- Gourin A. V., Rudolph K., Korsak A. S. et al. Role of capsaicin-sensitive afferents in fever and cytokine responses during systemic and local inflammation in rats. Neuroimmunomodulation 2001; 9(1): 13-22.
- Ren X., Wang Y., Jones W. K. TNF-alpha is required for late ischemic preconditioning but not for remote preconditioning of trauma. J Surg Res. 2004; 121(1): 120-129.
- Botker H. E., Kharbanda R., Schmidt M. R. et al. Remote ischaemic conditioning before hospital admission, as a complement to angioplasty, and effect on myocardial salvage in patients with acute myocardial infarction: a randomized trial. Lancet 2010; 375(9716):727-734.
- Braunwald E., Kloner R.A. Myocardial reperfusion: a double-edged sword? J Clin Invest. 1985;76(5): 1713-1719.
- Piper H. М., Garcia-Dorado D., Ovize M. A fresh look at reperfusion injury. Cardiovasc Res. 1998; 38(2):291-300.
- OvizeM., Baxter G. F.,DiLisa F. etal. Postconditioning and protection from reperfusion injury: where do we stand? Cardiovasc Res. 2010; 87(3):406-423.
- Tsang A., Hausenloy D. J., Yellon D. M. Myocardial postconditioning: reperfusion injury revisited. Am J Physiol Heart Circ Physiol. 2005; 289(1):H2-H7.
- Басалай М. В., Барсукевич В. Ч., Мрочек А. Г. и соавт. Кардиопротекторный эффект дистантного ишемического прекондиционирования на реперфузионные повреждения миокарда на модели острой коронарной недостаточности. Кардиология в Беларуси 2011; 2:37-44.


