Роль дезорганизации соединительной ткани и базальной мембраны эпителия почечных канальцев в патогенезе мочекаменной болезни
Автор: Зубарев Вадим Александрович, Забродская Юлия Михайловна, Архангельский Анатолий Иванович, Топузов Марлен Эскендерович, Довжанский Илья Васильевич
Журнал: Морфологические ведомости @morpholetter
Рубрика: Краткие сообщения
Статья в выпуске: 2 т.28, 2020 года.
Бесплатный доступ
Патологические изменения структур почечного сосочка, по мнению ряда исследователей играют ключевую роль в патогенезе мочекаменной болезни. Согласно результатам существующих исследований, деструктивные процессы в коллагене характеризуются изменением длины, толщины волокон и их ориентацией в пространстве. Дезорганизация коллагена имеет ферментативные и не ферментативные механизмы. Цель исследования - исследование частоты и особенностей локализации бляшек Рэндалла и морфологическое исследование состояния соединительной ткани и базальной мембраны эпителия почечных канальцев разного уровня при мочекаменной болезни. Микроскопически исследованы препараты 29 биопсий почечной ткани, полученные от пациентов при фибро-уретеро-пиелоскопии (11), чрезкожной нефролитолапаксии (18) и препараты, полученные при 20 аутопсиях в случаях без видимой почечной патологии. Гистологические препараты окрашивались гематоксилином и эозином, для определения состояния волокон соединительной ткани методами Ван-Гизон, Маллори, Шифф-реактивом, альциановым синим, по Косу на кальцинаты. Результаты исследования показывают, что морфологические признаки мукоидного набухания соединительной ткани и базальной мембраны эпителия почечных канальцев разного уровня в сочетании с образованием микрокальцинатов требуют дальнейшего изучения возможной роли дезорганизации соединительной ткани почечной стромы в инициации камнеобразования в почках.
Патоморфология почки, мочекаменная болезнь, дезорганизация коллагена, бляшки рэндалла
Короткий адрес: https://sciup.org/143177444
IDR: 143177444 | DOI: 10.20340/mv-mn.2020.28(2)78-81
Текст краткого сообщения Роль дезорганизации соединительной ткани и базальной мембраны эпителия почечных канальцев в патогенезе мочекаменной болезни
Зубарев В.А., Забродская Ю.М., Архангельский А.И., Топузов М.Э., Довжанский И.В. Роль дезорганизации соединительной ткани и базальной мембраны эпителия почечных канальцев в патогенезе мочекаменной болезни// Морфологические ведомости.- 2020. - Том 28.- № 2.- С. 78-81. (2):78-81
Zubarev VA, Zabrodskaya YuM, Arkhangel'skiy AI, Topuzov ME, Dovzhanskiy IV. The role of disorganization of connective tissue and basement membrane of renal tubular epithelium in the pathogenesis of urolithiasis. Morfologicheskie Vedomosti – Morphological Newsletter. 2020;28(2):78-81. (2):78-81
Введение. Почки и мочевыводящие пути представляют собой сложную биологическую систему, компоненты которой находятся в тесной анатомо- функциональной связи. Слаженная работа органов имеет целью образование и экскрецию мочи. Заболевание одной части мочевых путей влечет за собой заболевание и других ее частей [1]. Форникальный аппарат почки, представленный проксимальным отделом каждой чашечки, ее форникса и соответствующего сосочка с прилегающей к ним нервной, сосудистой и лимфатической системами, имеет особое значение в гармоничной деятельности верхних мочевых путей.
Цель исследования: изучение морфологических и функциональных особенностей форникального аппарата почки, которая дает возможность приблизиться к пониманию этиологии и патогенеза многих урологических заболеваний и делает актуальным настоящее исследование.
Материалы и методы исследования. Исследование включало выявление частоты и расположения бляшек Рандаля при эндоскопических операциях на верхних мочевыводящих путях по поводу мочекаменной болезни и морфологическое исследование материала, полученного при аутопсиях. В исследуемую группу вошли 29 пациентов, которым выполнялась фибро-уретеро-пиелоскопия (11 человек), чрезкожная нефролитолапаксия (18 человек). В независимости от клинического исследования, проводилось морфологическое исследование материала, полученного при 20 аутопсиях лиц молодого и среднего возрастов (22-35 лет) без видимой почечной патологии. Изготавливались гистологические препараты из проксимальных отделов чашечки в области сосочков. Использовалась стандартная проводка по спиртам и заливкой в парафин. Срезы окрашивались гематоксилином и эозином, для определения состояния волокон соединительной ткани методами по Ван-Гизон, Маллори, Шифф-реактивом, альциановым синим, по Косу на кальцинаты. Препараты изучены в условиях поляризованного света на современном исследовательском оптическом микроскопе с микронным разрешением.
Результаты исследования и обсуждение. При э ндоскопических операциях папиллярные бляшки Рэндалла были найдены у 11 пациентов (38% случаев). Папиллярные бляшки были найдены равномерно по всей чашечке и, чаще, диффузно рассеяны по поверхности сосочка. Корреляции между возрастом или полом пациентов и наличием бляшек выявлено не было. При гистологическом исследовании зоны сосочка в 5 случаях выявлены единичные микрокальцинаты, располагающиеся под эпителием канальцев в соединительнотканной строме почки (рис. 1-2). В свою очередь строма отечна, отмечалось умеренное диффузное разряжение волокон, а также нежное окрашивание альциановым синим, указывающее на наличие мукоидного набухания, то есть начальных этапов дезорганизации соединительной ткани (рис. 3). Грубых проявлений повреждения стромы выявлено не было.
Патологические изменения структур почечного сосочка, по мнению ряда исследователей, играют ключевую роль в патогенезе мочекаменной болезни. Согласно ряду исследований деструктивные процессы в коллагене характеризуются изменением длины, толщины волокон, и их ориентацией в пространстве [2-3]. Дезорганизация коллагена имеет ферментативные и не ферментативные механизмы. Ферментативные механизмы осуществляются взаимодействием деполимеризующих коллагеназ и их ингибиторов, обеспечивающих регуляцию интенсивности катаболических процессов. Не ферментативные механизмы связаны с образованием дополнительных межмолекулярных связей под действием конечных продуктов гликирования (Advanced Glycation End products или AGE), ультрафиолетового облучения или механического давления (отек), а также в результате канцерогенеза.
Различные регуляторные пути и механизмы деградации пересекаются друг с другом на разных этапах, а не действуют независимо друг от друга [4]. Основным механизмом повреждения структуры коллагена является не ферментативное гликирование [5]. Stoller и соавторы (2004) предположили, что фактором, инициирующим патогенез камнеобразования, может быть повреждение vasa recta в области почечного сосочка [6]. Восстановление поврежденной стенки сосуда может протекать по типу формирования атеросклеротической бляшки.
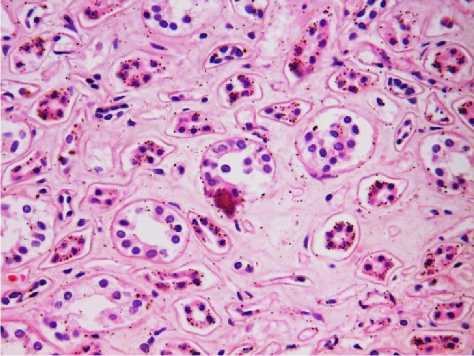
Рис. 1. Микрофото гистологического препарата почки. Субэпителиальные
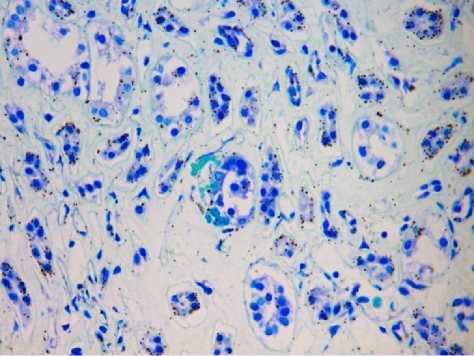
Рис. 2. Микрофото гистологического препарата почки. Субэпителиальные
отложения. Окр.: гематоксилином-эозином.
отложения. Окр.: альциановым синим.
Ув.: х400.
Ув.: х400.
Evan и соавторы (2003) представили альтернативный взгляд на патогенез камнеобразования на основе тщательного изучения папиллярных бляшек, полученных при
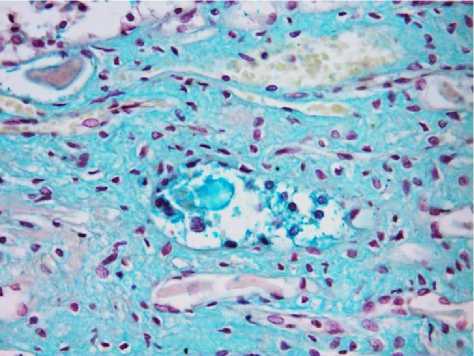
Рис. 3. Микрофото гистологического препарата почки. Слизистый отек. Окр.: альциановым синим. Ув.: х400.
биопсии в ходе перкутанной нефролитотомии у пациентов с идиопатическим оксалат-кальциевым нефролитиазом [7-8]. Очаги зарождения бляшки локализовались в базальной мембране уротелия тонкого конца петли Генле затем, проходя через медуллярный интерстиций, занимали субэпителиальное местоположение.
Заключение . Таким образом, наличие папиллярных бляшек, вероятнее всего, является этапом патогенеза мочекаменной болезни. Обнаруженные признаки мукоидного набухания в сочетании с образованием микрокальцина-тов требуют дальнейшего изучения возможной роли дезорганизации соединительной ткани почечной стромы в инициации камнеобразования в почках.
каких-либо конфликтов интересов при планировании, выполнении, финансировании и использовании результатов настоящего исследования.
Список литературы Роль дезорганизации соединительной ткани и базальной мембраны эпителия почечных канальцев в патогенезе мочекаменной болезни
- Pytel AYa. Lokhanochno-pochechnye reflyuksy i ikh klinicheskoe znachenie. Moskva: Medgiz, 1959. S. 274.
- Kistenev YuV. Issledovanie prostranstvennoy struktury kollagena s primeneniem metodov mnogofotonnoy mikroskopii i mashinnogo obucheniya. Uspekhi biologicheskoy khimii. 2019;59:219-252.
- Mostago-Guidolin LB, Ko AC-T, Wang F, Xiang B, Hewko M, Tian G, Major A, Shiomi M, Sowa MG. Collagen morphology and texture analysis: from statistics to classification. Sci Rep. 2013;3:2190.
- Aziz J, Shezali Ha, Radzi Z, Yahya NA, Abu Kassim NH, Czernuszka J, Rahmanv MT. Molecular Mechanisms of Stress-Responsive Changes in Collagen and Elastin Networks in Skin. Skin Pharmacol Physiol. 2016;29:190-203; DOl:. DOI: 10.1159/000447017
- Said G, Guilbert M, MillerotSerrurot E, Van Gulick L, Terryn Ch, Garnotel R, Jeannesson P. Impact of carbamylation and glycation of collagen type I on migration of HT1080 human fibrosarcoma cells. Int J Oncol. 2012;40:1797-1804.
- Stoller ML, Meng MV, Abrahams HM, Kane JP. The primary stone event: A new hypothesis involving a vascular etiology. J Urol. 2004;171:1920-1924.
- Evan AP, Coe FL, Rittling SR. Apatite plaque particles in inner medulla of kidneys of calcium oxalate stone formers. Osteopontin localization. Kidney Int. 2005;68:145-154.
- Evan AP, Lingeman JE, Coe FL. Randall's plaque of patients with nephrolithiasis begins in basement membranes of thin loops of Henle. J Clin Invest. 2003;111:607-616.


