Роль фактора роста эндотелия сосудов в патогенезе красного плоского лишая и псориаза
Автор: Артемина Е.М., Штода Ю.М., Слесаренко Н.А., Бакулев А.Л., Утц С.Р.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Кожные болезни
Статья в выпуске: 3 т.10, 2014 года.
Бесплатный доступ
Цель: оценить процесс ангиогенеза путем определения уровня фактора роста эндотелия сосудов (ФРЭС) в сыворотке крови больных красным плоским лишаем (КПП) и псориазом. Материал и методы. Обследованы 50 больных КПП, 62 пациента с псориазом и (контрольная группа) 36 практически здоровых лиц. У всех участников исследования определено содержание ФРЭС в сыворотке крови до лечения. Результаты. У больных красным плоским лишаем отмечалось повышение уровня ФРЭС в сыворотке крови до 1992 пг/мл, у пациентов с псориазом — до 1748,8 пг/мл. Уровень ФРЭС здоровых лиц колебался в пределах от 37 до 475 пг/мл. Заключение. При КПП и псориазе наблюдается избыточный ангиогенез, что подтверждается повышенным уровнем ФРЭС в сыворотке крови таких больных. Возможно, нормализация сосудистого звена патогенеза псориаза и КПП приведет к стойкой ремиссии данных дерматозов.
Красный плоский лишай, псориаз, фактор роста эндотелия сосудов
Короткий адрес: https://sciup.org/14918002
IDR: 14918002
Текст научной статьи Роль фактора роста эндотелия сосудов в патогенезе красного плоского лишая и псориаза
1 Введение. Микроциркуляторные изменения лежат в основе многих патогенетических механизмов различных заболеваний. Образование новых кровеносных сосудов — ангиогенез, впервые описанный Hunter в 1787 г., — является комплексным процессом, включающим следующие стадии: протеолитическое разрушение базальной мембраны сосудов и межклеточного матрикса, миграцию и прикрепление эндотелиальных клеток, их пролиферацию и формирование тубулярных структур [1–3].
К проангиогенным факторам относят: фактор роста эндотелия сосудов (VEGF), факторы роста фибробластов (aFGF, bFGF), трансформирующий фактор роста (TGF-α,β), фактор роста гепатоцитов (HGF), тромбоцитарный фактор роста (PDGF), эпидермальный фактор роста (EGF), фактор некроза опухоли-α (TNF-α), ангиогенин, интерлейкин-8, анги-опоэтин-1, — 2. Ингибиторами ангиогенеза являются: тромбоспондин (TSP), ангиостатин, эндостатин, вазостатин, пролактин, гормон роста (IFN-α). Ключевую роль в стимуляции ангиогенеза играет фактор роста эндотелия сосудов (ФРЭС, VEGF-A) [4].
ФРЭС — это специфический митоген эндотелиальных клеток, впервые описанный в 1989 г. как гепаринсвязывающий ангиогенный фактор роста, способствующий созданию как новой сосудистой системы, так и васкуляризации ранее существующей [5]. ФРЭС с молекулярным весом 45 KDa представлен пятью изоформами (VEGF 121, VEGF 145, VEGF 165- доминирующая изоформа, VEGF 189, VEGF 206), ген VEGF находится в хромосоме 6p21. Связывание VEGFА с тирозинкиназными рецепторами (рецептором-1 VEGF и рецептором-2 VEGF) запускает сигнальный каскад, который в конечном итоге стимулирует рост эндотелиальных клеток сосуда, их выживание и пролиферацию . Биологическая роль ФРЭС заключается в регуляции ангиогенеза, иммунного ответа, лимфангиогенеза и увеличении сосудистой проницаемости (в 1000 раз сильнее гистамина) [6].
В дерматологической практике нарушения микроциркуляции характерны для таких заболеваний, как псориаз, красный плоский лишай (КПЛ), аллергодерматозы, папилломы, келоидные рубцы, пиогенная гранулема, саркома Капоши и др. [7, 8].
Неизвестно, является ли локальное усиление ангиогенеза, наблюдаемое при КПЛ и псориазе, причиной возникновения дерматозов или встречается как результат развития патологических процессов при них. В результате вазодилатации и формирования новых сосудов в очагах поражения усиливается эритема, ее застойный характер, возникают пролиферативные элементы [9, 10].
По современным представлениям, в очагах КПЛ на слизистых оболочках полости рта микроциркуля-торные изменения приводят к трофическим расстройствам, понижению резистентности, нарушению окислительно-восстановительных реакций, что способствует развитию гипоксии в пораженных тканях. На ангиогенез при КПЛ слизистой оболочки полости рта указывает увеличение плотности, диаметра ка-
пилляров, наличие извилистых, разветвленных сосудов, обнаруженных при видеокапилляроскопии слизистой щек. Рассматривается связь между изменениями васкуляризации и выраженностью воспалительного процесса в коже при КПЛ. Для этого дерматоза характерно развитие вазодилатации за счет высвобождения медиаторов воспаления, в дальнейшем с преобладанием вазоконстрикции с нарушением проницаемости стенок сосудов, что, в свою очередь, усугубляет микроциркуляторные расстройства и способствует прогрессированию процесса. По сравнению с нормальной кожей количество и плотность микрососудов в очагах поражения было увеличено в эпидермодермальной зоне (ниже трещин Макс-Джозефа) [9, 11, 13].
При псориазе ангиогенез может не только быть кофактором, но и индуцировать развитие дерматоза. В псориатических бляшках наблюдается повышение уровня проангиогенных медиаторов, таких, как фактор некроза опухоли, VEGF, гипоксия-инду-цированный фактор, интерлейкины и ангиопоэтины, обнаружены рецепторы VEGF 1 и 2, функционирующие в кератиноцитах [14]. Секреция VEGF А может способствовать гиперпролиферации кератиноцитов при псориазе аутокринным образом, что, возможно, объясняет феномен Кебнера у данных больных [15]. Нарушение эндотелиальной функции при псориазе проявляется дилатацией кровеносных сосудов, повышением коагуляции крови, ремоделированием сосудов кожи. В очагах поражения формируются извитые и удлиненные поверхностные капилляры, проходящие в дермальных сосочках с несколькими сосудистыми сегментами в верхушках сосочков. Анализ иммуногистохимических исследований биопсии псориатической бляшки показал четырехкратное увеличение эндотелия сосудов поверхностного сосудистого сплетения. При псориазе наблюдается избыточная пролиферация эндотелиальных клеток, которая в свою очередь может запускаться ускоренной и нарушенной кератинизацией эпидермиса [16].
Цель: оценить процесс ангиогенеза путем определения уровня ФРЭС в сыворотке крови больных КПЛ и псориазом до начала лечения.
Материал и методы. Исследование проводилось на базе клиники кожных и венерических болезней ГБОУ ВПО «Саратовский ГМУ им. В. И. Разумовского» Минздрава России. Под нашим наблюдением находились 50 больных КПЛ, среди них 14 (28%) мужчин и 36 (72%) женщин. Средний возраст больных составил 40,5±1,3 года. У больных КПЛ диагностирована диссеминированная типичная форма, поражение слизистой оболочки полости рта выявлено у 32 пациентов. Также в исследование включены 62 больных псориазом в возрасте старше 40 лет, из которых 27 женщин (43,5%) и 35 мужчин (56,5%). Средний возраст больных составил 55,6 + 4,7 года. У 54 пациентов диагностирована экссудативная форма псориаза, у 8 человек — вульгарная. У всех больных псориаз был в стадии прогрессирования. Индекс PASI в среднем составил 39,5 + 3,2. В контрольную группу для сравнения лабораторных показателей были включены 36 практически здоровых лиц в возрасте от 30 до 48 лет.
Всем больным до начала лечения в сыворотке крови определяли ФРЭС с использованием набо-
Результаты исследования содержания ФРЭС в сыворотке крови пациентов
|
Группы обследованных больных |
Медиана ФРЭС (пг/мл) |
Диапазон значений ФРЭС (пг/мл) |
|
|
Мин-макс |
Q 25;75 |
||
|
КПЛ |
303,5* |
94,5–1992,1 |
172,8; 617,2 |
|
Псориаз |
631,3** |
118,2–1748,8 |
383,1;1231,5 |
|
Контрольная группа |
111,3*/** |
37,6–475,5 |
96,4; 289,1 |
П р и м еч а н и е : различия достоверны между контрольной группой и группой больных КПЛ *– Р ≤0,05; между контрольной группой и группой больных псориазом **– Р ≤0,01; Q — квартиль.
ра реагентов VEGF-ИФА-БЕСТ производства ЗАО «Вектор-Бест», Россия, кат. № А-8784. Принцип определения — твердофазный «сэндвич»-вариант иммуноферментного анализа с применением моно-и поликлональных антител к VEGF человека. Учет результатов реакции проводили на микропланшет-ном фотометре Anthos 2020. Обработку данных и вычисление концентраций исследуемых показателей проводили с использованием программы ADAPPlus (прибор и программа производства Labtec Instruments Gmbh, Австрия).
Для статистического анализа полученных результатов использовались пакеты компьютерных программ Statistica 6.0 (Stat Soft Inc.), SPSS 13.0 for Windows (SPSS Inc.), Microsoft Office Excel 2007. Изменения уровня ФРЭС сыворотки крови устанавливали методами описательной статистики, непараметрической статистики с расчетом медианы, среднего значения, верхних и нижних квартилей, уровней достоверности различия между группами по критерию Манна — Уитни.
Результаты. У больных псориазом уровень содержания ФРЭС в сыворотке крови до лечения колебался от 118,2 до 1748,8 пг/мл, медиана и квартильный диапазон составили 631,3 (383,1; 1231,5) пг/ мл. У больных КПЛ медиана и квартильный диапазон составили 303,5 (172,8; 617,2) пг/мл. Результаты исследования содержания ФРЭС в сыворотке крови у пациентов с КПЛ и псориазом по сравнению с контрольной группой здоровых обследуемых представлены в таблице и на рисунке.
Обсуждение. Иммунопатологические процессы в коже сложны и многообразны. Известно, что в патогенезе таких хронических дерматозов, как псориаз и КПЛ, лежат изменения иммунной регуляции с элементами агрессии и защиты. Возникают нарушения иммунного статуса с нарушениями в системе про- и противовоспалительных цитокинов (ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-12, ИЛ-23, ИЛ-17, ФНО-α и др.), которые регулируют процессы пролиферации и дифференцировки иммунокомпетентных клеток, а также кера-тиноцитов. Только в случае псориаза эти изменения
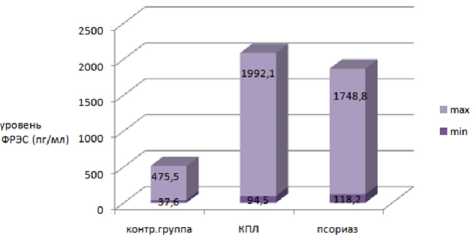
Содержание ФРЭС в сыворотке крови больных псориазом и КПЛ (пг/мл)
приводят к гиперпролиферации кератиноцитов, а при красном плоском лишае запускается процесс апоптоза. В свою очередь, усиление ангиогенеза может происходить через вовлечение цитокинов ФНО-α и ИЛ-1, которые индуцируют продукцию ФРЭС керати-ноцитами [12].
Научные исследования подтвердили, что ФРЭС относится к стресс-индуцированным белкам [13]. В неврогенной теории как псориаза, так и КПЛ рассматривается роль психических травм и нервного перенапряжения, т.е. стресс-индуцированного начала или обострения заболеваний. При этом стресс может приводить к выделению многочисленных нейропептидов, найденных в кожных нервных окончаниях, которые демонстрируют вазоактивные и провоспа-лительные свойства и могут запускать избыточную секрецию ФРЭС [14].
Заключение. Результаты исследования содержания ФРЭС у больных псориазом и КПЛ подтверждают его роль в сосудистом звене патогенеза данных заболеваний. Повышение его уровня свидетельствует об избыточном ангиогенезе и, как следствие, нарушении функции эндотелиальных клеток. Иммунные нарушения могут поддерживаться и усугубляться расстройствами микроциркуляции, что приводит к утяжелению и хронизации патологического процесса. Таким образом, нормализация показателей ангиогенеза, а именно уровня ФРЭС, возможно, приведет к стойкой и длительной ремиссии рассмотренных дерматозов.
Список литературы Роль фактора роста эндотелия сосудов в патогенезе красного плоского лишая и псориаза
- Folkman J. Is angiogenesisan organizing principle in biology and medicine? J Pediatric Surgery 2007; (42): 1-11
- Шестенко О.П., Никонова С.Д., Мертвецов Н.П. Ангиогенин и его роль в ангиогенезе. Молекулярная биология 2001; 35 (3): 349-371
- Folkman J. The role of angiogenesis in tumor growth. Se-min. Cancer Biol 1992; 3: 65-71
- Madeddy P. Therapeutic angiogenesis and vasculogene-sis for tissue regeneration. Experimental hysiology 2004; 90 (3): 315-326
- Ferrara N, Henzel JH. Pituitary follicular cells secrete a novel heparin-binding growth factor specific for vascular endo-thelial cells. Biochemical and Biophysical Research Communication 1989; (161): 851-858
- Ferrara N, Gerber HP, LeCouter J. The biology of VEGF and its receptors. Nat Med 2003; (9): 669-676
- Gerber HP, Ferrara N. The role of VEGF in normal and neoplastic hematopoiesis. J of Molecular Medicine 2003; (81): 20-31
- Carmeliet P. Angiogenesis in health and disease. Nat Med 2003; 9 (6): 653-660
- Петрова Л.В., Кушлинский Н.Е., Ильина Л.В. Фактор роста эндотелия сосудов как показатель гипоксии тканей, его возможная роль в патогенезе плоского лишая слизистой оболочки рта. Вестн. дерматол. и венерол. 2004; (5): 7-10
- Creamer D, Sullivan D, Bicknell R, Barker J. Angiogene-sis in psoriasis. Angiogenesis 2002; 5 (1): 231-236
- Алиев M.M. Клинико-морфологические и иммунологические аспекты красного плоского лишая: автореф. дис... канд. мед. наук. М., 1986; 22 с/
- Шахнович А.А., Круглова Л.С. Изменение экспрессии гена HBD-2 и TLR2 в коже больных красным плоским лишаем под влиянием ультрафиолетовой фототерапии. Вопросы курортологии, физиотерапии и лечебной физкультуры 2011; (3): 34-36
- Goldberg-Cohen I, Levy NS, Levy АР. Regulation of vascular endothelial growth factor by hypoxia. Gene Ther Mol Biol 2003;7:69-73
- Павлова О.В. Психосоматические аспекты патогенеза хронических кожных заболеваний. Психологич. журн. 2003; 24 (5): 88-94
- Man XY, Yang ХН, Cai SQ, Yao YG, Zheng M. Immuno-localization and expression of vascular endothelial growth factor receptors (VEGFRs) and neuropilins (NRPs) on keratinocytes in human epidermis. Mol Med 2006; (12): 127-136
- Canavese M, Altruda F, Ruzicka T, Schauber J. Vascular endothelial growth factor (VEGF) in the pathogenesis of psoriasis: A possible target for novel therapies? J of dermatological science 2010; (58): 171-176.


