Роль феномена эпителиально-мезенхимальной трансформации при развитии остеопластической формы пневмокониоза
Автор: Разумов В.В., Бондарев О.И.
Журнал: Академический журнал Западной Сибири @ajws
Рубрика: Терапия
Статья в выпуске: 5 (54) т.10, 2014 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/140221487
IDR: 140221487
Текст статьи Роль феномена эпителиально-мезенхимальной трансформации при развитии остеопластической формы пневмокониоза
Хорошо известно, что вся полнота взаимодействий, свойственная функциональным системам и позволяющая раскрыть сущность процесса, проявляется только в экстремальных условиях существования организма, возникающих при заболеваниях или создающихся экспериментально.
Противоречия в понимании природы пневмокониоза [4, 13] и недостаточная его гистологическая изученность побуждают к обоюдному изучению и конио-тического пневмосклероза, и остающимися неясными по сей день бронхо-лёгочных патологий, таких, как кальцификация лёгких, торокальный микролитиаз, остеохондропластическая трахеобронхопатия. К редким состояния относится и остеопластическая пневмопатия (ОП) [7, 10, 11, 16]. Попутно необходимо отметить существование смежной с проблемой кониотиче-ского пневмофиброза проблему патогенеза идиопатического лёгочного фиброза [6, 23].
Остеопластическая пульмопатия, при которой кость образуется интерстициально и/или внутриаль-веолярно без или с очагами миелопоэза, является крайне редким заболеванием, относящемуся к гетеротопической оссификации. Количество опубликованных случаев ОП в мировой литературе составляет по разным авторам от 140 до 200 наблюдений. Мы собрали 122 публикации по лёгочной оссификации, не включая в них случаи остеохондропластической трахеобронхо-патии, торокального (микро)литиаза и лёгочной каль-фицикации без гистологических доказательств наличия в ней костной ткани. В отечественной литературе за последние десятилетия были опубликованы описания 5-ти случаев авторских наблюдений ОП [1, 7, 10, 11, 12] и три обзора по проблеме лёгочных кальци- и ос-сификаций [5, 7, 14].
Редкость случаев этой патологии объясняет многочисленность терминологии для её обозначения: дендриформная лёгочная оссификация [17, 20, 30, 40, 43]; диффузная лёгочная оссификация [12, 17, 21, 29, 33]; идиопатическая диссеминированная лёгочная ос-сификация [15, 40]; гетеротопическая лёгочная осси-фикация [41]; диссеминированные оссифицированные узлы в лёгких, гетеротопические костные образования в лёгких в публикациях минувших 50-70-ых годов. В каждой публикации описывается обычно по 1-2 случая ОП, что не мешает авторам, тем не менее, приходит к определенным заключениям.
Раритетность, практическая казуистичность случаев развития ОП исключает как будто её из круга проблем пылевой патологии органов дыхания, тем более, что она редко встречается у лиц, подвергавшихся воздействию повышенной запылённости окружающей среды. Мы нашли в зарубежной литературе описания
2-х случаев ОП, в которых по мнению авторов можно было предполагать повышенную запылённость рабочих мест пациентов, тем не менее не ставившуюся ими в причинную связь с её развитием. В одном случае ОП была диагностирована у 83-летнего мужчины со спонтанным пневмотораксом, который нéкогда работал дантистом и периодически находился в зубопротезной мастерской, в которой для полировки зубных протезов использовалась мелкий песок [20]. Гистологическое исследование лёгочной ткани из зоны затемнения, полученной при торокоскопии, выявило дендриформную оссификацию лёгких и отсутствие признаков пневмокониоза. Во второй публикации говорится о случайном рентгенологическом выявлении дендриформной лёгочной оссификации у 77-летнего мужчины с карциномой мочевого пузыря и сопутствующими ишемической болезнью сердца, инсультом, гипертонией и гиперхолестеринемией [18]. Во время работы пациент подвергался воздействию асбеста. Однако авторы, не прибегая к биопсии, на основании клиникорентгенологических данных исключили у больного асбестоз. Ещё в одной публикации сообщено о сочетание ОП с асбестозом [19], но лапидарность изложения резюме статьи и её недоступность мешают восприятию этой информации как заслуживающей внимания. И только в двух статьях приведены аргументированные доказательства сочетания интерстициальной формы пневмокониоза от воздействия редкоземельных металлов с дендриформной оссификацией лёгких, верифицированной гистологически [1, 43].
В одном случае у 38-летнего мужчины компьютерная томография высокого разрешения выявляла диффузные крошечные округлые или чёткообразные уплотнения костной плотности с ветвистой архитектоникой, расположенные в интерлобулярных перегородках [43]. Аналитическая трансмиссионная электронная микроскопия лёгочной ткани обнаружила в ней наночастицы оксида церия, фосфатов церия и лантана, а также кварца, каолина, талька и оксида титана, с которыми пациент в возрасте 20-23 лет имел контакт, работая полировщиком изделий.
Несмотря на единичность наблюдения, авторы статьи приходят к предположению о более частом, чем это принято считать, развитии ОП, которая может протекать под видом интерстициальной пневмонии или идиопатического лёгочного фиброза. К таким состояниям они относят и пневмокониоз. Основанием к такому предположению авторов служит накопившиеся наблюдения о метапластическом образовании костной ткани в зонах воспаления и фиброза. Первыми предположение об ОП как редком осложнении или особом проявлении хронического фиброзирующего интерстициального воспаления лёгких высказали K.M. Müller et al. [30], правильность которого подтверждена последующими многочисленными наблюдениями [15, 40]. Поскольку пневмокониоз относится группе интерстициальных заболеваний лёгких, авторы анализированной статьи сочли возможным рассматривать ОП как осложнение или проявление пневмокониоза.
В другой, отечественной публикации по сочетанию ОП с пневмокониозом [1] последний диагностировался только гистологически по наличию в интер- стиции клеточно-фиброзных пылевых узелков из ко-ниофагов с пылью черного цвета. В составе пыли по-ляризационно обнаруживалось значительное количество анизотропных крупных кристаллов (пациент работал с редкоземельными металлами, ураном, скандием, рением, золотом и серебром).
Констатация сочетания фиброза и кальцификации, в общем понятная с позиций гистогенетической общности соединительной и костной тканей на уровне мезенхимальных предшественников, сменилась с конца минувших 90-ых годов выявлением биохимических и молекулярных звеньев патогенеза фиброзирующих и оссифицирующих заболеваний в целом [21, 34, 39], в том числе и системы органов дыхания [9, 17, 24, 32, 33, 42], а также и таких клинически значимых заболеваний, как гетеротопическая оссификация у обездвиженных пациентов с ожогами, обширными травмами скелета, черепно-мозговыми или спинальными травмами [31, 35, 37] и прогрессирующая оссифицирущая фибродисплазия [22, 25-28, 36]. Патогенетический каскад пневмосклероза стал включать про- и противовоспалительные, миграционные, ростовые факторы и рецепторы к ним, молекулы адгезии, молекулы сигнальной трансдукции, регуляторы трансляции (активирующие и ингибирующие). Выяснились пути, посредством которых лежащие на поверхности "причины" – нозологии и различные состояния (воспаление, гипоксия, оксидативный стресс, травмы, излучения и проч.) – получают доступ к геному, репрессируя одни и экспрессируя другие его участки, тем самым приводя к изменению фенотипа клеток, путей их дифференцировки и степени специализации.
Новые факты привели к кардинальному пересмотру представлений о трансдифференцировке тканей и метаплазии. До недавнего времени считалось, что "… даже в пределах обширной, сборной группы эпителиальных тканей у позвоночных не бывает взаимопревращений кожного и кишечного эпителиев или кишечного и целомического эпителиев, то есть взаимопревращений тканей. Тем более следует считать окончательно ушедшими в область прошлого представления о превращениях эпителиев в соединительную ткань и обратно, ведущее начало ещё от Вирхова" [8].
В настоящее время доказано, что дифференцировка является обратимым процессом, генетическая программа любой клетки любого уровня дифференцировки и специализации доступна перепрограммированию. Нобелевская премия 2012 года по физиологии или медицине была вручена Д. Гёрдону и С. Яманаке за "открытие возможности перепрограммирования дифференцированных клеток в плюрипотентные".
Частным случаем такой дедифференцировки клеток является эпителиально-мезенхимальная трансформация (ЭМТ), при которой эпителиальные или эндотелиальные клетки, оказавшись под воздействием механизмов патогенетического каскада, реверсируют в фенотип клеток своих гистогенетических предшественников, то есть в фенотип мезенхимальных клеток, ближайшими из которых являются фибробласты и миофибробласты [3, 17, 21, 24, 26, 29, 33, 34, 38, 39]. ЭМТ может быть отслежена при обычной световой микроскопии не только по исчезновению полярности клеток, изменению их внешнего вида, затрудняющих отличие их от фибробластов, но и по выявлению появившейся у них миграционной способности. Иммуногистохимически и иммуноферментативно у реверсируемых эпителиальных клеток начинают обнаруживаться маркёры, свойственные мезенхимальным клеткам. При ЭМТ исчезают многие специфичные для эпителиев белки кератиновой группы, из которых построены промежуточные филаменты, типичные для всех эпите-лиев. Эти кератины заменяются виментином – белком промежуточных филаментов, типичным для всех клеток мезенхимального происхождения. Мезенхимальные и мезенхиподобные клетки начинают экспрессировать, помимо виментина, другие свои маркёры: немышечный актин, десмин, α-гладкомышечный актин (α-SMA), фибронектин, а также начинают синтезировать коллаген III типа и кислые мукополисахариды (гликозаминогликаны), указывающих на менее зрелый характер соединительной ткани. Полнота ЭМТ (полная или неполная) ЭМТ зависит, скорее всего, от глубины дерепрессии генома.
Таким образом, к продукции коллагена, развитию фиброза, мышц, хряща или костной ткани в очагах гетеротопической оссификации в любом месте, в том числе и при ПО, могут оказаться причастными клетки трёх линий – 1) мезенхимальные резидентные стволовые клетки, 2) пришлые из костного мозга мезенхимальные стромальные клетки и 3) образовавшиеся на месте при ЭМТ клетки фибропластической ориентации.
Однако изучение интимных механизмов лёгочного фиброза находится ещё в стадии накопления фактов и представление о роли ЭМТ в её генезе считается недостаточно аргументированным [6]. Морфофункциональная гетерогенность фибробластов, объясняемая существованием нескольких гистогенетических линий, объединенных общим термином "популяция фибробластов" [2], расширяет круг претендентов на промежуточные и конечные клетки эпителиальной или эндотелиальной трансдифференцировок [26, 28] вплоть до мезензимальным клеток. Гистогенетической потенцией последних является способность образовывать диффероны фибробластической, миофибробла-стической, остеогенной, хондрогенной и адипоцитор-ной направленности.
Поэтому когда мы столкнулись со случаем ОП у шахтёра, мы использовали его для изучения роли ЭМТ в развитии лёгочного фиброза и ОП.
Мужчина, 1950 г.р., в 1971-2005 годах работал в подземных условиях в разных профессиях (горнорабочий очистного забоя, подземный электрослесарем, горный мастер). Проходил профосмотры, признавался годным к работе. На предмет профессиональной патологии органов дыхания не обследовался. С 2005 года воздействию повышенной запылённости уже не подвергался. В анамнезе – редкие обострения язвенной болезни двенадцатиперстной кишки.
С осени 2011 года госпитализирован в терапевтическое отделение в связи с болями в голеностопных и коленных суставах, оказавшимся связанными с деформирующем остеоартрозом. Тогда рентгенологически выявлялись снижение пневматизации лёгочной ткани в верхних и средних отдела лёгких за счёт резко усилен- ного лёгочного рисунка с нечёткими контурами, местами сливающимися; деформация лёгочного рисунка по смешанному типу; малоструктурность корней; определялись буллёзные вздутия. По СКТ органов грудной клетки с болюсным контрастированием: в лёгких диффузно, практически симметрично обнаруживались участки уплотнения лёгочной ткани по типу "матового стекла", чередующиеся с немногочисленными небольшими участками альвеолярной консолидации, на фоне которых отчётливо были видны просветы бронхов; интерстиций был изменён в виде утолщения междольковых перегородок; наибольшая выраженность изменений приходилась на средние отделы; в средостении выявлялись отдельные увеличенные лимфоузлы с максимальным их размером до 14×15 мм. Выявленные изменения в лёгких протекали клинически бессимптомно. Характер лёгочного процесса оставался по 2013 год не ясным. Предпологался ревматоидный артрит с синдромом Каплана, недифференцированное заболевание соединительной ткани с поражением суставов и лёгких. Рабочим диагнозом одно время был саркоидоз лимфатических узлов и лёгких, в связи с чем проводилась стероидная терапия. СКТ органов грудной клетки в апреле 2013 года – практически без существенной динамики. В связи с неэффективностью стероидной терапии выполнена диагностическая торакотомия слева с краевой резекцией лёгкого.
Макроскопически во время операции выявлялись участки уплотнения ткани лёгкого; в резецированном участке размером 4×2×2 см определялась зона уплотнения ткани грязно серого цвета, с отложениями угольной пыли, местами каменистой плотности: на разрезе зона уплотнения была частично кальцинированной. При световой микроскопии в лёгочной ткани из зоны уплотнения диффузно обнаруживались многочисленные костные балки в виде одиночных структур или их скоплений (рис. 1). Последние располагались среди зон перибронхиального или периваскулярного склероза, а также между участками бронхиальнореспираторной ткани лёгких с её сдавлением, а также и внутриальвеолярно. Костные балки содержали элементы клеточного костного мозга или жировую ткань. Наличие в них клеток хондроидного типа свидетельствовало о несовершенном остеогенезе. Таким образом, выявленные изменения не оставляли сомнение в принадлежности их ОП. Периоссально обнаруживались отложения угольной пыли.
Аргументациями в пользу феномена ЭМТ при световой микроскопии являлись, во-первых, фибробластноподобные клетки среди бронхиального эпителия, и, во-вторых, данные иммуногистохимического исследования, выполненного по методике мультимерной безбиотиновой системы детекции – REVEAL Biotin-Free Polyvalent DAB (Производитель – Spring Bioscience, США). Оно выявило антитела к виментину как у отдельных клеток бронхиального эпителия (рис. 2), так и у клеток, располагавшихся в зоне фиброза.
Результаты исследования однозначно указывали на процесс ЭМТ, который мы считаем причастным и к интерстициальному фиброзу, и к развитию ОП. Но и фиброз, и ОП мы трактуем как проявление пневмоко- ниотического процесса, исходя из современных представлений о гетеротопической оссификации как феномена трансформации прогениторных мезенхимальных клеток в остеобласты, и об ОП как частного его (феномена) случая, при котором клетки с мезенхимальной потенцией образуются путём ЭМТ.
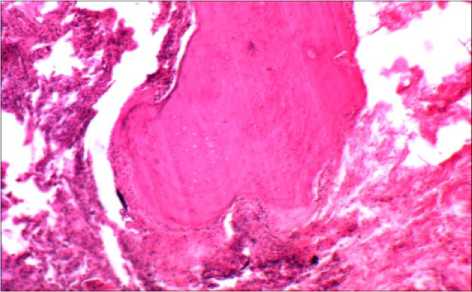
Рис. 1. Компактная кость с периоссальными отложениями угольной пыли в зоне фиброза (справа) и в респираторной структуре лёгкого (слева); в кости определяются хондороидные элементы (внизу) и очаг миелопоэза (вверху); х 100; окраска гематоксилином и эозином.
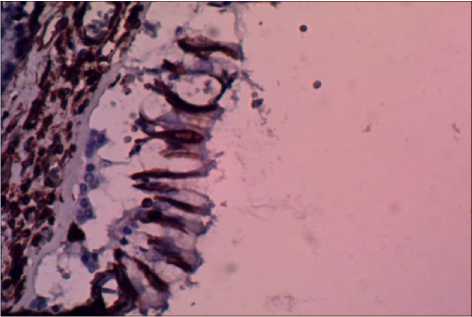
Рис. 2. Экспрессия виментина в эпителии бронха; х 400.
В представленном нами случае значительная запылённость лёгких угольно-породной пылью, содержащей двуокись кремния и облигатно запускающей макрофагальное воспаление, в свою очередь неизбежно являющего триггером для мезенхимальных клеток, а также локализация этой пыли в зонах оссификации позволяют говорить о причастности её к развитию и ЭМТ, и индуцированию развития мезенхимальных или мезенхимоподобных клеток в остеогенном направлении. Аргументацией пневмокониотической трактовки выявленной оссификации является, помимо её локализации в зонах, содержащих угольную пыль, морфологическая избыточность ответной реакции соединительной ткани. Для гетеротопических оссификаций, являющихся клинической проблемой, таких, как прогрессирующая оссифицирующая фибродисплазия, ос-сификация крупных суставов у ортопедически или неврологически обездвиженных больных, характерна, помимо их биологической неуместности, ещё и морфологическая неуёмность (избыточность) соединительнотканных разрастаний. Но избыточность образования коллагеновых волокон характерна и для пневмокониозов, особенно узелковых его форм, в которых она резко контрастирует со слабым развитием соединительной ткани в случаях запылённости лёгких интактной пылью.
Данные литературы и собственное наблюдение в сочетании с отсутствием специфических для ОП рентгенологических признаков и возможностью её клинически бессимптомного течения дают основание предполагать более широкую распространённость ОП, которая у работников пылевых профессий протекая под маской кальцификации лёгких, является, по сути дела, формой пневмокониоза.
Список литературы Роль феномена эпителиально-мезенхимальной трансформации при развитии остеопластической формы пневмокониоза
- Бердников Р.В., Филатов Е.А., Баженов А.В. и др. Клиническое наблюдение остеопластической пневмопатии//Уральский мед. журнал. -2013. -Том 107, № 2. -С. 114-115.
- Бозо И.Я., Деев Р.И., Пинаев Г.П. Фибробласт -специализированная клетка или функциональное состояние клеток мезенхимального происхождения?//Цитология. -2010. -Том 52, № 2. -С. 99-109.
- Васильев Ю.М. Перестройки молекулярной морфологии эпителиальных и соединительнотканных клеток в нормальных морфогенезах и при канцерогенезе//Биохимия. -2008. -Том 73, № 5. -С. 656-660.
- Величковский Б.Т. Патогенетическая классификация профессиональных заболеваний органов дыхания, вызванных воздействием фиброгенной пыли//Пульмонология. -2008. -№ 4. -С. 93-101.
- Гольдштейн В.Д. Остеопластическая пневмопатия//Болезни органов дыхания. Руководство для врачей, в 4-х томах. Том 4. Частная пульмонология/Под общей ред. Н.Р. Палеева. -М.: М, 1990. -С. 538-542.
- Дыгай А.М., Скурихи Е.Г., Першина О.В. и др. Стволовые и прогениторные клетки в Патогенезе пневмофиброза//Патогенез. -2013. -Том 11, № 1. -С. 36-51.
- Илькович И.И. Остеопластическая пневмопатия//Интерстициальные заболевания лёгких. Руководства для врачей/Под ред. И.И. Ильковича, А.Н. Кокосова. -СПб.: Нормизадат, 2005. -С. 465-469.
- Кнорре А.Г. Эмбриональный гистогенез (морфологические очерки). -Л.: М, 1971. -432 с.
- Моногарова Н.Е., Василенко И.В. Роль эпителиальномезенхимальной трансформации (ЭМТ) в патогенезе идиопатического фиброзирующего альвеолита (обычной интерстициальной пневмонии)//Патологiя (Украина). -2010. -Том 7, № 1. -С. 80-83.
- Непомнящая Е.М., Мороз М.С., Дюжиков А.А. Остеопластическая пневмопатия при митральном стенозе//Архив патологии. -1983. -Том 45, № 3. -С. 82-84.
- Новикова Л., Двораковская И., Сперанская А. Остеопластиче-ская пневмопатия. Клинический случай//Врач. -2010. -№ 7. -С. 66-68.
- Постникова Л.Б., Бащенко М.А., Коротаева Л.А. и др. Редкий случай диффузной оссификации лёгких//Пульмонология. -2014. -№ 1. -С. 116-119.
- Разумов В.В., Бондарев О.И. Методологические проблемы изучения пневмокониоза и пылевого бронхита: прошлое и настоящее. -Новокузнецк, 2012. -160 с.
- Самсонова М.В., Черняев А.Л., Бубнова Н.И. Кальцификация и оссификация лёгких//Архив патологии. -2011. -№ 5. -С. 16-18.
- Crisosto C.F. Diffuse pulmonary ossification associated with idiopathic pulmonary fibrosis//Archivos de Bronconeumol. -2004. -Vol. 40. -P. 595-598.
- D'Andrea E., Borghesi M.R., Forroni A. et al. A case of racemose osteoplastic pneumopathy//Radiol. Med. -1989. -Vol. 77, № 6. -P. 701-703.
- Hashimoto N., Phan S.H., Imaizumi K. et al. Endothelialmesenchymal transition in bleomycin-induced pulmonary fibrosis//Am. J. Respir. Cell. Mol. Biol. -2010. -Vol. 43. -P. 161-172.
- Jamjoom L., Meziane M., Renapurkar R.D. Dendriform pulmonary ossification: Report of two cases//Indian J. Radiol. Imaging. -2013. -Vol. 23, № 1. -P. 15-18.
- Joines R.W., Roggli V.L. Dendriform pulmonary ossification. Report of two cases with unique findings//Am. J. Clin. Pathol. -1989. -Vol. 91. -P. 398-402.
- Jungmann H., Godbert B., Wissler M.P. et al. Diffuse pulmonary ossification in a patient exposed to silica//Eur. Respir. Rev. -2013. -Vol. 22, № 128. -P. 189-90.
- Kalluri R., Neilson E.G. Epithelial-mesenchymal transition and its implications for fibrosis//J. Clin. Invest. -2003. -Vol. 112. -P. 1776-1784.
- Kaplan F.S., Shen Q., Lounev V. et al. Skeletal metamorphosis in fibrodysplasia ossificans progressiva (FOP)//J. Bone Miner. Metab. -2008. -Vol. 26. -P. 521-530.
- Kim D.S., Collard H.R., King T.E. Classification and natural history of the idiopathic interstitial pneumonias//Jr. Proc. Am. Thorac. Soc. -2006. -Vol. 3, № 4. -P. 285-292.
- Kim K.K., Kugler M.C., Wolters P.J. et al. Alveolar epithelial cell mesenchymal transition develops in vivo during pulmonary fibrosis and is regulated by the extracellular matrix//Proc. Natl. Acаd. Sci. BSA. -2006. -Vol. 103, № 35. -P. 13180-13185.
- Lounev V.Y., Ramachandran R., Wosczyna M.N. et al. Identification of progenitor cells that contribute to heterotopic skeletogenesis//J. Bone Joint. Surg. Am. -2009. -Vol. 91. -P. 652-663.
- Medici D., Kalluri R. Endothelial-mesenchymal transition and its contribution to the emergence of stem cell phenotype//Semin. Cancer Biol. -2012. -Vol. 22, № 5-6. -P. 379-384.
- Medici D., Olsen B.R. The role of endothelial-mesenchymal transition in heterotopic ossification//J. Bone Miner. Res. -2012. -Vol. 27, № 8. -Р. 1619-1622.
- Medici D., Shore E.M., Lounev V.Y. Conversion of vascular endothelial cells into multipotent stem-like cells//Nat. Med. -2010. -Vol. 16. -P. 1400-1406.
- Mizushina Y., Bando M., Hosono T. et al. A rare case of asymptomatic diffuse pulmonary ossification detected during a routine health examination//Intern Med. -2012. -Vol. 51. -20. -P. 2923-2927.
- Müller K.M., Friemann J., Stichnoth E. Dendriform pulmonary ossification//Pathol Res Pract. -1980. -Vol. 168. -P. 163-172.
- Nelson E.R., Wong V.W., Krebsbach P.H. et al. Heterotopic ossification following burn injury: the role of stem cells//J. Burn Care. Res. -2012. -Vol. 33, № 4. -P. 463-470.
- Paruchuri S., Yang J.H., Aikawa E. et al. Human pulmonary valve progenitor cells exhibit endothelial/mesenchymal plasticity in response to vascular endothelial growth factor-A and transforming growth factor-beta2//Circ. Res. -2006. -Vol. 99. -P. 861-869.
- Peros-Golubicic T., Tekavec-Trkanjec J. Diffuse pulmonary ossification: An unusual interstitial lung disease//Curr. Opin. Pulm. Med. -2008. -Vol. 14. -P. 488-492.
- Piera-Velazquez S. Li Z., Jimenez S.A. Role of endothelialmesenchymal transition (EndoMT) in the pathogenesis of fibrotic disorders//Am. J. Pathol. -2011. -Vol. 179, № 3. -P. 1074-1080.
- Reznik J.E., Biros E., Marshall R. et al. Prevalence and risk-factors of neurogenic heterotopic ossification in traumatic spinal cord and traumatic brain injured patients admitted to specialised units in Australia//Journal of musculoskeletal & neuronal interactions. -2014. -Vol. 14, № 1. -P. 19-28.
- Shore E.M., Xu M., Feldman G.J. et al. A recurrent mutation in the BMP type I receptor ACVR1 causes inherited and sporadic fibrodysplasia ossificans progressive//Nat Genet. -2006. -Vol. 38. -P. 525-527.
- Suda R.K., Billings P.C., Egan K.P. et al. Circulating osteogenic precursor cells in heterotopic bone formation//Stem Cells. -2009. -Vol. 27. -P. 2209-2219.
- Susienka M.J., Medici D. Vascular endothelium as a novel source of stem cells for bioengineering//Biomatter. -2013. -Vol. 3. -e24647-1-4.
- Thiery J.P., Acloque H., Huang R.Y., Nieto M.A. Epithelialmesenchymal transitions in development and disease//Cell. -2009. -Vol. 139. -P. 871-890.
- Trejo O., Xaubet A., Marin-Arguedas A. et al. Dendriform pulmonary ossification associated with idiopathic pulmonary fibrosis//Arch. Bronconeumol. -2002. -Vol. 38, № 8. -P. 399-400.
- Watson S.G., Walsh S.L. Heterotopic ossification encasing a plombage cavity//Thorax. -2012. -Vol. 67, № 2 12. -P. 1120-1121.
- Willis B.C., duBois R.M., Borok Z. Epithelial origin of myofibroblasts during fibrosis in the lung//Proc. Am. Thorac. Soc. -2006. -Vol. 3. -P. 377-382.
- Yoon H.K., Moon H.S., Park S.H. et al. Dendriform pulmonary ossification in patient with rare earth pneumoconiosis//Thorax. -2005. -Vol. 60, № 8. -P. 701-703.


