Роль фетоплацентарных белков в регуляции продукции интерлейкина-2 наивными Т-клетками и Т-клетками памяти
Автор: Заморина С.А., Литвинова Л.С., Юрова К.А., Дунец Н.А., Хазиахматова О.Г., Тимганова В.П., Бочкова М.С., Храмцов П.В., Раев М.Б.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Медико-биологические науки
Статья в выпуске: 1, 2017 года.
Бесплатный доступ
Изучено влияние физиологических концентраций фетоплацентарных белков - трофобластического β1-гликопротеина (ТБГ), хорионического гонадотропина (ХГ) и альфа-фетопротеина (АФП)) на продукцию интерлейкина-2 (ИЛ-2) изолированными CD45RA+ и CD45RO+- клетками в системе in vitro. Установлено, что на уровне наивных Т-клеток (CD45RA+) стимулирующий эффект на продукцию ИЛ-2 оказывал ХГ (10 и 100 МЕ/мл) и АФП (100 Ед/мл), но не ТБГ. В отношении примированных Т-клеток памяти (CD45RO+) показано, что стимулирующий эффект демонстрировали ХГ (10 и 100 МЕ/мл) и ТБГ (1 и 10 мкг/мл), но не АФП. Таким образом, фетоплацентарные белки оказывают преимущественно стимулирующее действие на продукцию ИЛ-2 Т-клетками памяти.
Хорионический гонадотропин, трофобластический β1-гликопротеин, альфа-фетопротеин, беременность, иммунная толерантность, т- клетки памяти, ил-2
Короткий адрес: https://sciup.org/147204805
IDR: 147204805 | УДК: 557.175.6
Текст научной статьи Роль фетоплацентарных белков в регуляции продукции интерлейкина-2 наивными Т-клетками и Т-клетками памяти
Известно, что физиологически протекающая беременность сопровождается изменениями, направленными на формирование иммунной толерантности к полуа логенному эмбриону. Одним из наиболее значимых механизмов формирования иммунной толерантности является супрессия Т-клеточной памяти в условиях постоянного воздей ствия антигенов эмбрионального происхождения [Кудряшова. Гасанова. 2011; Кадырова, 2014].
В последние годы было показано, что уровень функциональной активности Т-клеток определяется стадией их дифференцировки. характеризую-щейся различной экспрессией ряда функциональных и адгезионных молекул [Sallusto et aL 2004]. В литературе имеются единичные работы по дифференцировке Т-клеток памяти при неосложнен-
€> Заморина С. А, Литвинова Л. С . Юрова К А, Дунец Н. А, Хаумахмакеа О. ПТимганова В П, Бочкова М. С .Храмцзв П. В, Раев М. Б, 2017
ной беременности [Кадырова. 2014]. а данные о функциональной активности Т-клеток памяти под воздействием белков зоны беременности отсутствуют. В то же время, очевидно, что при неосложненной беременности в периферической крови действуют факторы, приводящие к снижению активности циркулирующего пула Т-клеток памяти, способных к осуществлению антиген-специфичес-ких цитотоксических реакций адаптивного иммунитета в отношении антигенов эмбрионального происхождени я.
В 2008 г. методами протеомики продемонстрировано, что лишь несколько молекул регулируют иммунную толерантность матери среди них - трофобластический pl-гликопротеин (ТЕГ), наряду с хорионическим гонадотропином (ХГ) и альфа-фстопро-теином (АФП) [Dong et al.. 2008]. Эти белки позиционируются как иммуносупрессоры, и ряд их эффектов в отношении актуальных клеточных субпопуляций, вовлеченных в формирование иммунной толерантности, активно изучается [Martinez et aL 2013; Заморила. Раев. 2015; Damen et al, 2016].
Исследование дифференцировки клеток памяти - методически довольно сложный процесс. Экспрессия различных изоформ молекулы CD45 позволяет разделить Т-лимфоциты на наивные Т-клстки и Т-клстки памяти. Молекула CD45 является трансмембранной тирозиновой протсинфосфа-тазой, а ее экспрессия на иммунокомпетентных клетках признана критическим регулятором сигнализации, опосредованной Т-клеточным рецептором (TCR) [Mustelin et al., 2003; McNeill et aL 2007].
Дифференцировка Т-клеток затрагивает состав внеклеточного домена CD45: в наивных клетках это полная комплектация (CD45RA, 220 кДа), по мере антигензависимой дифференцировки ряд доменов теряется, а продукт конечной модификации обозначают как CD45RO (180 кДа). Т-лимфоциты, экспрессирующие CD45RA+, позиционируются как наивные Т-клетки, а экспрессирующие CD45RO+ -как «примированные» Т-клетки памяти.
Наивные Т-клетки, экспрессирующие высокомолекулярные изоформы CD45, имеют высокую фосфата зную активность и поддерживают Т-клеточный рецептор (TCR) в примированном состоянии для распознавания антигена [McNeill et aL, 2007]. Процесс активации наивных клеток довольно сложен и требует вовлечения TCR и кости-мулирующих молекул (CD28 и др ). Переход к низкомолекулярным изоформам — CD45RO при активации Т-клеток снижает фосфатазную активность рецептора CD45 и. как полагают, способствует ослаблению Т-клеточной сигнализации [Holmes, 2006]. В свою очередь, быстрый и усиленный ответ CD45RO клеток памяти на специфический антиген является их важнейшим функциональным отличием от их «наивных» предшест венников [Elyaman el. al., 2008; Селедцов и др., 2010].
Известно, что активация Т-лимфоцитов тесно связана с аутокринной продукцией интсрлсйкина-2 (ИЛ-2), который, в свою очередь, является одним из ключевых цитокинов, запускающим пролиферацию Т-клеток и их дифференцировку,
В связи с вышесказанным, целью исследования является изучение роли ТБГ, ХГ и АФП в регуляции продукции ИЛ-2 изолированными CD45RA1 и CD45RO+- клетками в системе in vitro.
Материалы и методы
Объекты исследования. В работе использовали фракционированные мономуклеары периферической крови (МПК) практически здоровых доноров, которыми являлись небеременные женщины репродуктивного возраста (п=8). МПК получали центрифугированием в градиенте плотности фи-колл-верографина (1.077 г/см3) («Pharmacia», Швеция), после чего клетки отмывали и подвергали воздействию фетоплацентарных белков. В качестве контроля применяли пробу, где вместо белков добавляли ГШС.
Сепарирование CD45RA+ и CD45RO+-
клеток. Для получения монокультур наивных Т-клеток (CD45RA”) из суспензии МПК был использован метод иммуномагнитной сепарации, в основе которого лежит технология MACS® («Miltenyi Biotcc» Германия), основанная на использовании суперпарамагнитных биодеградируемых частиц MACS MicroBeads, конъюгированных с моноклональными антителами. Добавленные к взвеси клеток MicroBeads/CD45RA-4acn
Выделенные клетки с фенотипом CD45RA1 или CD45RO+ отмывали в среде RPMI-1640 («Sigma-Aldrich», США), затем оценивали их количество с помощью автоматического счётчика клеток (Countess™ Automated Cell Counter, «InVitrogen», США) с использованием красителя Tiypan blue 0.4% («InVitrogen». США). Жизнеспособность составляла не мснсс 95-98% от общего числа клеток. Отсутствие моноцитов (CD 14^) и В-лимфоцитов (CD19+) в культурах CD45RA+ и CD45RO+ Т-клеток до культивирования подтверждали с помощью анализа поверхностных маркеров на проточ- ном цитофлуориметре MACS Quant CMillenyi Biolec”, Германия). согласно протоколам производителей. В эксперименте использовали клеточные культуры, содержание CD3+CD45RA+CD14'CD19' и CD3”CD45RO+CD14'CD19' Т-клсток в которых составляло в среднем 98.5 ± 1.5%.
Культивирование CD45RA+ и CD45RO+-клеюк CD45RA+ или CD45RO^ клетки (1^10^ кл/мл) культивировали Б 48-луНОЧНЫХ планшетах в среде RPMI-1640 («Sigma-Aldrich», США). с добавлением 10%-ной эмбриональной телячьей сы-воротки - ЭТС («Sigma». США). 10 мМ Hepes («ICN Ph.», США), 2 мМ L-глутамина («ICN Ph.». США) в течение 48 ч. при 37°С во влажной атмосфере. содержащей 5% СО2.
В работе использовали физиологические концентрации фетоплапентарных белков, соответствующие нормальной беременности — для ТБГ (получен в ИЭГМ УрО РАН Патент РФ № 2367449) -1 и 10 мкг/мл [Посисеева. Назаров, Татаринов. 2004]. для ХГ (Московский эндокринный завод) 10 и 100 МЕ/мл [Со1е: 20121 ДЛЯ АФП («Биалекса», Россия) 10, 50, 150 Ед/мл [Gagnon et al., 2008].
В качество активатора Т-лимфоцитов использовали T-Cell Activation/Expansion Kit human (Ас/Exp) («MiltenyiBiotec», Германия) - антибио-тиновые частицы MACSiBead™ с биотинилированными антителами против CD2+, CD3+, CD28+ человека. Нагруженные антителами частицы MACSiBead™ имитируют присутствие антигенпрезентирующих клеток и активируют Т-клеткн. Реагент Ас/Exp добавляли в пробы в количестве 5
мкл, которые содержали - 0.5х106 нагруженных антителами MACSiBead™ частиц. Соотношение клеток и активирующих частиц составляло 1:2.
Оценка концентрации ИЛ-2. Содержание ИЛ-2 в культуральных супернатантах оценивали им му коферментным методом при помощи тест-систем «Вектор-Бест», Россия. Измерение оптической плотности производили на многоканальном спектрофотометре Biohit ВР 800 (Финляндия).
Статистическая обработка данных проводилась С помощью парного /-критерия Стьюдента. Данные на рисунках представлены в виде М±о.
Результаты и их обсуждение
Установлено, что через 48 ч. инкубации в интактных пробах CD45RA+ Т-лимфоцитов содержание ИЛ-2 в супернатантах клеточных культур было в 5.9 раз больше, чем в популяции CD45RO+-клеток (17.2±16.8 пг/мл; 2.88± 2.55 пг/мл, соответственно).
Добавление Т-клеточного активатора способствовало значительному увеличению концентрации ИЛ-2 в среде культивирования: в популяции CD45RA Т-лимфоцитов - в 21.17 раза (р()<0.05), а в культуре CD45RO" - в 86 раз (рЮ<0.05) (364.33±31.16 пг/мл; 286.4±52.55 пг/ мл, соответственно).
В целом, субпопуляции CD45RA+ и CD45RO” секретировали одинаковый уровень ИЛ-2, достоверных различий между субпопуляциями не было обнаружено (рисунок).
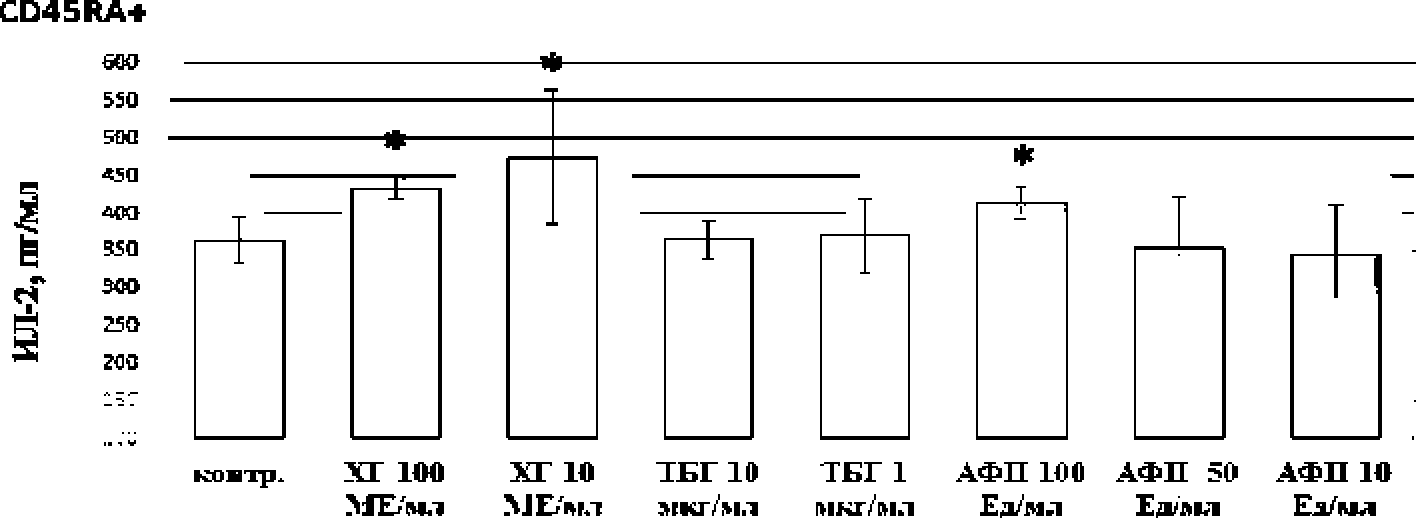
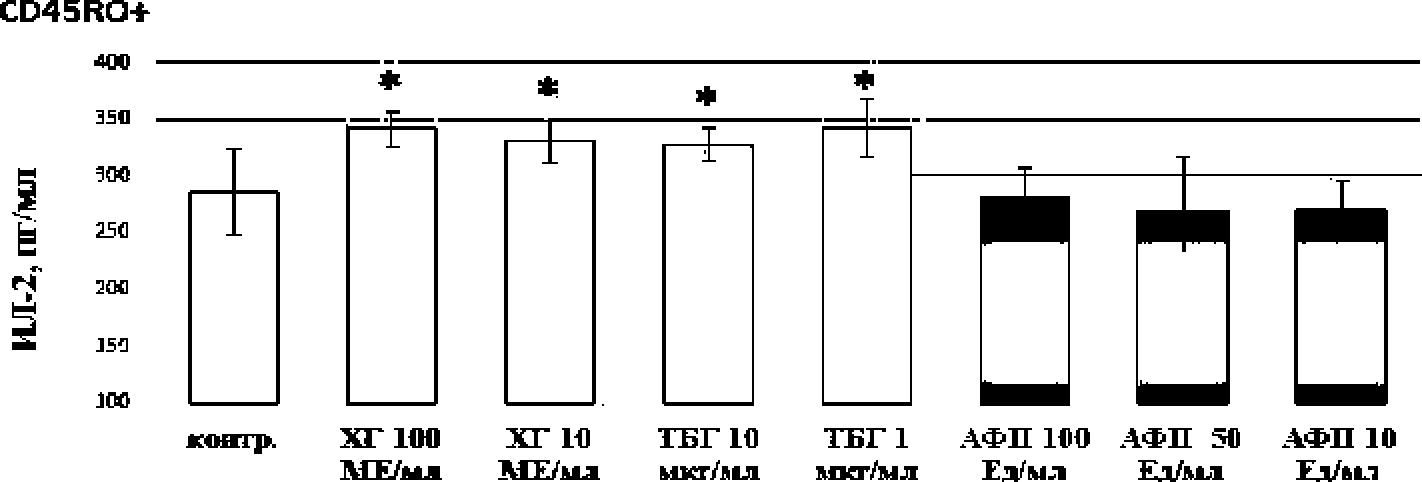
Влияние фетоплацентарных белков на продукцию ИЛ-2 изолированными CD45RA+ и CD45RO+-клетками (п=8)
Установлено, что на уровне наивных Т-клеток памяти (CD45RA4") стимулирующий эффект на продукцию ИЛ-2 оказывал ХГ (10 и 100 МЕ/мл) и АФП (100 Ед/мл), но не ТБГ. Известно, что ХГ, являясь плацентарным аналогом лютеотропного гормона, в физиологических условиях проецируется после оплодотворения клетками трофобласта. Гормон отличается широким спектром биологического действия, регулируя стероидогенез плаценты и плода, а также оказывая эффекты на уровне иммунной системы [Schumacher el al., 2009]. Максимальная концентрация ХГ в период гестации (—100 МЕ/мл) совпадает с экспрессией антигенов МНС I класса на клеточной поверхности эмбриона (I триместр). распознавание которых, как правило, приводит к процессам иммунного отторжения. В силу этого факта. ХГ считается одним из основных факторов. формирующих иммунную толерантность во время беременности. Известно, что ХГ контролирует дифференцировку Т-регуляторных лимфоцитов и ИЛ-17-продуцирущих лимфоцитов, а также активность NK-. NKT-клеток и фагоцитов [Замо-рина, 2013]. Тем не менее, роль ХГ в процессах дифференцировки Т-клеток памяти остается не исследованной. Тот факт, что ХГ повышает продукцию ИЛ-2 как наивными Т-клетками, так и при-мированными Т-клетками памяти, свидетельствует о том, ЧТО гормон активно участвует В регуляции активности этих субпопуляций.
АФП - это гликопротеин, синтезируемый в фетальной печени. В норме АФП может обнаруживаться в сыворотке эмбриона, начиная с 4-й недели беременности. Его концентрация достигает пика междуг 12 и 16-й неделями и затем постепенно снижается вплоть до рождения. Так как АФП проникает через плаценту, он может обнаруживаться в довольно высокой концентрации в сыворотке крови матери, достигая максимума между 32- и 36-й неделями беременности. Уровень АФП служит важным показателем при мониторинге антенатального периода. Экспериментальные исследования свидетельствуют об иммуносупрессорной активности этого белка [Черешнев и др., 2004]. В нашем исследовании показано, что АФП в высокой концентрации, соответствующей III триместру (100 Ед/мл), повышал продукцию ИЛ-2 только наивными Т-клетками памяти.
В отношении примированных Т-клеток памяти (CD45RO ) показано, что стимулирующий эффект демонстрировали ХГ (10 и 100 МЕ/мл) и ТБГ (1 и 10 мкг/мл), но не АФП (рисунок).
ТБГ - онкофета льный белок, продуцируемый клетками цито- и синцитиотрофобласта во время беременности. В динамике беременности уровень ТБГ постепенно растет и достигает значений 200-
400 мкг/мл к III триместру, и он становится доминантным белком в сыворотке беременных. В то же время в сыворотке крови плода его уровень не превышает 1-2 мг/л [Посисеева. Назаров. Татаринов, 2004].
ТБГ вносит существенный вклад в иммунные реакции матери, участвуя в формировании иммунологической толерантности к плоду7, однако этот аспект его действия в отношении Т-клеток иммунной памяти не изучен. В нашем исследовании продемонстрировано. что ТБГ в концентрациях, экстраполированных с I триместра беременности, повышает продукцию ИЛ-2 примированными Т-клетками памяти.
Ключевая функция ИЛ-2 на уровне исследуемых субпопуляций заключается в обеспечении перехода антиген-акгивированных CD4 и CD8 -лимфоцитов из G1 в S-фазу клеточного цикла, что, в конечном итоге, приводит к их пролиферации [Snares el al.. 2002; Литвинова и др.. 2014]. В целом, ИЛ-2 способствует переходу СВ45КА+-клеток в CD45RO -клетки, которые непосредственно реализуют иммунный ответ на специфический антиген. что и является их важнейшим функциональным отличием от их «наивных» предшественников. В то же время, очевидно, что активация клеток памяти в период беременности - явление неоднозначное, поскольку если эти клетки активируются на фетальные антигены, то это может привести к отторжению эмбриона. Можно предположить, что в сыворотке беременных женщин есть факторы, нивелирующие эту активацию. В частности, известно, что |3-эстрадиол в концентрациях, соответствующих III триместру беременности, снижает экспрессию генов G/M и hTERE а также и уровень ИЛ-2 в супернатантах [Хазиахматова, 2016]. По-видимому. физиологический смысл этих изменений, индуцированных p-эстрадиолом, подразумевает ограничение агрессивной иммунной реакции при вынашивании.
Кроме этого, при интерпретации данных необходимо учитывать фенотипическое разделение Т-клеток памяти на CD4 и CD 8 . Активация наивных CD8 Т-лимфоцитов завершается их трансформацией в цитотоксические Т-лимфоциты. Одновременно фенотип CD4+CD45RO+ объединяет в себе активированные Т-клетки памяти. Т-регуляторные лимфоциты и ИЛ-17-продуцирующие лимфоциты. Важно отметить что ИЛ-2 необходим для развития Т-регуляторных лимфоцитов, увеличение количества которых ассоциировано с успешной беременностью [Shumacher el aL 2009]. Таким образом, повышение уровня ИЛ-2, секретируемого таргетными суб- популяциями Т-клеток, имеет неоднозначное им-мунорегуляторное значение.
В ситуации in vivo уровень ИЛ-2 с наступлением беременности не изменяется в сравнении с небеременными, но повышается в случае спонтанного аборта [Vassiliadis et at, 1998]. Как известно, основными продуцентами ИЛ-2 являются CD4+ лимфоциты, которым в этой ситуации он необходим для дифференцировки в Т-регуляторные лимфоциты. Вероятно, с самых ранних сроков беременности, на системном уровне происходит активация СВ4+-клеток под действием фетальных антигенов. необходимая для формирования иммунной толерантности. В то же время, при патологии проницаемость плацентарного барьера усиливается и это приводит к увеличению количества фетальных антигенов в кровотоке матери и соответственно, ведет к повышению уровня ИЛ-2 у женщин с угрозой прерывания беременности.
Для понимания процессов формирования иммунной толерантности важно понять, какова роль фетоплацентарных белков в регуляции иммунной памяти? В данной работе продемонстрировано, что ХГ в концентрациях, соответствующих таковым при беременности, повышает продукцию ИЛ-2 как наивными Т-клетками, так и примированными Т-клетками памяти, АФП стимулирует продукцию ИЛ-2 только в концентрации, соответствующей III триместру беременности и только на уровне наивных Т-клеток, вероятно, способствуя их трансформации в активированные Т-клетки памяти, В то же время, ТБГ в концентрациях, соответствующих I триместру (1 и 10 мкг/мл), стимулировал продукцию ИЛ-2 активированными Т-оетками памяти. Вероятно, в данном случае, ТБГ преимущественно воздействует на CD4+-лимфоциты, которые под воздействием аутокринного ИЛ-2 дифференцируются в Т-регуляторные клетки. В целом, фето плацентарные белки оказывают преимущественно стимулирующее действие на продукцию ИЛ-2 наивными Т-клетками и Т-клетками памяти,
Исследование поддержано грантом РФФИ р_а 16-44-590049 и субсидией «Организация проведения научных исследований» (№ 603, БФУ им, И. Канта).
Список литературы Роль фетоплацентарных белков в регуляции продукции интерлейкина-2 наивными Т-клетками и Т-клетками памяти
- Заморина С.А. Механизмы иммуномодулирующей активности хорионического гонадотропина: дис.... д-ра биол. наук. Челябинск, 2013. 237 с
- Заморина С.А., Раев М.Б. Изучение иммуномодулирующих эффектов трофобластического β1гликопротеина человека//Физиология человека. 2015. Т. 41(1). С. 117-123
- Кадырова Л.В. Дифференцировка Т-лимфоцитов в динамике беременности: автореф. дис.... канд. мед. наук. М., 2014. 19 с
- Кудряшова А.В., Гасанова Д.Д. Дифференцировка клеток памяти в популяции Т-хелперов при вызванной беременностью гипертензии//Вестник Уральской медицинской академической науки. 2011. № 2-1(35). С. 40-41
- Литвинова Л.С. и др. Основные поверхностные маркеры функциональной активности Тлимфоцитов//Медицинская иммунология. 2014. Т. 6, № 1. С. 7-26
- Посисеева Л.В., Назаров С.Б., Татаринов Ю.С. Трофобласт-специфический бета-гликопротеин в акушерстве и гинекологии. Иваново: Изд-во Иваново, 2004. 240 с
- Раев М.Б. Способ выделения и очистки трофобластического β-1-гликопротеина: пат. Рос. Федерация № 2367449, заявл. 21.02.2008, опубл. 20.09.2009, Бюл. № 26
- Селедцов В.И. и др. Клеточные механизмы генерации иммунологической памяти//Цитокины и воспаление. 2010. Т. 4. С. 9-15
- Татаринов Ю.С., Масюкевич В.Н. Иммунохимическая идентификация нового β 1-глобулина в сыворотке крови беременных женщин//Бюл. эксперим. биол. и мед. 1970. Т. 69, № 6. С. 66-68
- Хазиахматова О.Г. Роль стероидных гормонов в дифференцировке Т-лимфоцитов: молекулярногенетический и иммуно-морфологический аспекты: дис. … канд. биол. наук. Томск, 2016. 142 с
- Черешнев В.А. и др. Альфа-фетопротеин. Екатеринбург, 2004. 376 с
- Cole L.A. HCG, the wonder of today's science//Reproductive Biology and Endocrinology. 2012. Vol. 10, № 24. P. 1-18
- Dauven D. et al. Immune modulatory effects of human chorionic gonadotropin on dendritic cells//Frontiers in Endocrinology. 2016. Vol. 7. P. 1-11
- Dong M. et al. The effect of trophoblasts on T lymphocytes: possible regulatory effector molecules-a proteomic analysis//Cell Physiol. Biochem. 2008. Vol. 21, № 5-6. P. 463-472
- Elyaman W. et al. Distinct functions of autoreactive memory and effector CD4+ T cells in experimental autoimmune encephalomyelitis//Am. J. Pathol. 2008. Vol. 173, № 2. P. 411-422
- Gagnon A. et al. Obstetrical complications associated with abnormal maternal serum markers analytes//J. Obstet. Gynaecol. Can. 2008. Vol. 30, № 10. P. 918-949
- Holmes N. CD45: all is not yet crystal clear//Immunology. 2006. Vоl. 117, № 2. P. 145-155
- Martinez F. et al. The role of pregnancy-specific glycoprotein 1a (PSG1a) in regulating the innate and adaptive immune response//Am. J. Reprod. Immunol. 2013. Vol. 69, № 4. P. 383-394
- McNeill L. et al. The differential regulation of Lck kinase phosphorylation sites by CD45 is critical for T cell receptor signaling responses//Immunity. 2007. Vol. 27, № 3. P. 425-437
- Mustelin T. et al. Positive and negative regulation of T-cell activation through kinases and phosphatases//Biochem. J. 2003. Vol. 371. P. 15-27
- Sallusto F. et al. Central memory and effector memory T cell subsets: function, generation, and maintenance//Annu. Rev. Immunol. 2004. Vol. 22. P. 745-763
- Schumacher A. et al. Human chorionic gonadotropin attracts regulatory T cells into the fetalmaternal interface during early human pregnancy//J. Immunol. 2009. Vol. 9. P. 5488-5497
- Suárez A. et al. Generation of CD4+CD45RA+ Effector T cells by stimulation in the presence of cyclic Adenosine 5′-Monophosphate-Elevating Agents//J. Immunol. 2002. Vol. 169. P. 1159-1167
- Vassiliadis S. et al. Serum levels of pro-and antiinflammatory cytokines in non-pregnant women, during pregnancy, labour and abortion//Mediators of Inflammation. 1998. Vol. 7, № 2. P. 69-72
- Кадырова Л.В., Сотникова Н.Ю. Сывороточный уровень IL-2 и IL-15 в динамике беременности//Мать и Дитя в Кузбассе. 2014. № 2. С. 46-48


