Роль фитогормонов в контроле развития симбиотических клубеньков у бобовых растений. Сообщение I. Цитокинины
Автор: Долгих Е.А., Кириенко А.Н., Леппянен И.В., Долгих А.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Обзоры
Статья в выпуске: 3 т.51, 2016 года.
Бесплатный доступ
В обзоре обсуждаются результаты исследований по влиянию цитокининов на развитие азотфиксирующих клубеньков у бобовых растений, а также молекулярные механизмы такого влияния и взаимодействия с компонентами сигнального каскада, активируемого индукторами клубенькообразования - бактериальными сигналами Nod-факторами. Позитивная роль цитокининов при клубенькообразовании была впервые показана в экспериментах с экзогенным 6-бензиламинопурином (6-БАП), добавление которого вызывало образование клубенькоподобных структур на корнях бобовых растений (K.R. Libbenga, P.A.A. Harkers, 1973). В пользу предположения об участии цитокининов в контроле клубенькообразования свидетельствовали и эксперименты по инокуляции бобовых растений бактериальными штаммами, дефектными по синтезу Nod-факторов, но выделяющими транс-зеатин (J.B. Cooper, S.R. Long, 1994). В результате у растений формировались клубенькоподобные структуры, в которых наблюдали индукцию экспрессии генов ранних нодулинов, специфичных для симбиоза. На современном этапе исследований выявление у бобовых растений мутантов по генам, кодирующим рецепторы к цитокининам, позволило подтвердить предположение о вовлечении цитокининов в контроль клубенькообразования. У мутантов Medicago truncatula с нарушением функции гена рецептора цитокинина CRE1 ( cytokinin response1 ) и Lotus japonicus с нарушением функции гена LHK1 ( Lotus histidine kinase1 ) наблюдалось подавление развития клубеньков (S. Gonzalez-Rizzo и соавт., 2006; J.D. Murray и соавт., 2007). При этом подавление восприимчивости растений к цитокининам влияло как на развитие инфекционных нитей, так и на формирование клубеньков. Напротив, усиление функции генов LHK1 и CRE1 у L. japonicus и M. truncatula c использованием генно-инженерных подходов, приводило к образованию клубенькоподобных структур (L. Tirichine и соавт., 2007; E. Ovchinnikova и соавт., 2011). В статье рассмотрены пути биосинтеза и активации цитокининов, а также особенности рецепции и распространения ответа. Накопление цитокининов при развитии симбиоза может происходить за счет индукции экспрессии генов, контролирующих биосинтез/акти-вацию этих гормонов, но молекулярные механизмы такой активации еще предстоит выяснить. Анализ показал, что цитокинины вовлекаются в передачу сигнала от Nod-фактора после стадии, контролируемой одним из ключевых регуляторов сигнального пути - кальций-кальмодулин-зависимой киназой. Имеющиеся данные свидетельствуют о том, что активация рецептора к цитокининам зависит от Nod-факторов. Экспрессия генов, кодирующих транскрипционные факторы NSP2, ERN1 и NIN, была значительно снижена у мутантов cre1 и lhk1. Это позволяет сделать вывод, что активация рецептора к цитокининам предшествует вовлечению этих транскрипционных факторов в передачу сигнала (L. Tirichine и соавт., 2007; J. Plet и соавт., 2011). Проведенный анализ показывает, что цитокинины участвуют в регуляции ранних стадий органогенеза и контроле инфекционного процесса, но они также могут быть вовлечены в контроль дифференцировки клубеньков. Помимо локального контроля клубенькообразования, цитокинины участвуют и в системном контроле - в авторегуляции клубенькообразования. Таким образом, цитокинины могут играть различную роль в клубенькообразовании, в зависимости от времени и места их активации.
Бобово-ризобиальный симбиоз, цитокинины, nod-факторы, органогенез клубеньков, ризобиальная инфекция
Короткий адрес: https://sciup.org/142213682
IDR: 142213682 | УДК: 633.31/.37:631.461.52:57.052 | DOI: 10.15389/agrobiology.2016.3.285rus
Текст обзорной статьи Роль фитогормонов в контроле развития симбиотических клубеньков у бобовых растений. Сообщение I. Цитокинины
Развитие симбиоза между бобовыми растениями и бактериями порядка Rhizobiales, ведущее к появлению азотфиксирующих клубеньков, — результат тонко регулируемых молекулярных и биохимических взаимодействий между симбионтами (1). Микро- и макросимбионты способны выделять во внешнюю среду разнообразные соединения, поэтому ранние исследования по поиску потенциальных кандидатов на роль «регуляторов» развития симбиоза были направлены на их идентификацию и анализ
Исследования поддержаны грантом РНФ (проект № 14-24-00135).
функциональной активности. Среди выделяемых ризобиями соединений были выявлены цитокинин-подобные вещества в концентрации, достаточной для инициации органогенеза (2, 3). Способность свободноживущих ризобий синтезировать ауксины через триптофан-зависимый и трипто-фан-независимый путь также определяла возможность участия этих гормонов в контроле клубенькообразования (4, 5). Цитокинины и ауксины представляют собой группы гормонов, которые играют существенную роль в регуляции роста и развития растений, в том числе контролируют процессы морфогенеза в ответ на стимулы окружающей среды (6-10). В связи с этим в ранних работах их рассматривали в качестве наиболее вероятных кандидатов на роль соединений, способных регулировать органогенез у бобовых растений (5, 11, 12).
Эти представления были пересмотрены, когда позже удалось идентифицировать другие соединения, выделяемые ризобиями, — Nod-факторы (англ. nodulation), представляющие собой липохитоолигосахариды (13). Добавление очищенных Nod-факторов к растению оказалось достаточным условием для активации целого комплекса ответных реакций, которые обычно развиваются при инициации симбиоза с ризобиями. Более того, у отдельных видов растений (у люцерны Medicago sativa и сои Glycine soja) при добавлении Nod-факторов образовывались клубеньки, которые имели черты структурного сходства с клубеньками, индуцируемыми ризобиями (14, 15). В дальнейшем были расшифрованы все стадии синтеза Nod-факторов и идентифицированы гены ризобий, контролирующие синтез и выделение этих молекул (16-19). Установлено, что на ранних этапах взаимодействия растения выделяют флавоноиды в ризосферу, что стимулирует синтез и продукцию ризобиальными бактериями Nod-факторов (20, 21). В свою очередь, Nod-факторы служат индукторами развития целого комплекса ответных реакций у растений, активация которых лежит в основе появления симбиотических клубеньков. Эти исследования стали основой для формирования доминирующей точки зрения о том, что только Nod-факторы необходимы и достаточны для контроля клубенькообразования.
Однако на современном этапе исследований, несмотря на то, что ключевая роль Nod-факторов в инициации и развитии симбиоза не вызывает сомнений, накоплены экспериментальные данные, подтверждающие, что изменение баланса фитогормонов цитокининов и ауксинов также необходимо для клубенькообразования.
В настоящем обзоре обсуждаются результаты классических и современных исследований по влиянию цитокининов на развитие азотфик-сирующих клубеньков у бобовых растений, а также молекулярные механизмы такого влияния и взаимодействия с компонентами сигнального каскада, активируемого Nod-факторами.
Основные этапы развития симбиоза между бобовыми растениями и клубеньковыми бактериями. Ключевое событие при индукции клубенькообразования в бобово-ризобиальном симбиозе — связывание Nod-факторов со специфичными рецепторами растений, которые представляют собой LysM-содержащие рецептор-подобные киназы (22-26). Последующий запуск сигнального каскада в клетках корня приводит к активации двух подпрограмм развития: инфекционного процесса и органогенеза клубеньков, что лежит в основе успешного формирования симбиоза (27).
Ранние реакции на действие Nod-факторов — деполяризация мембраны клеток корневых волосков, развитие «Са2+ волн» в ядре и около-ядерном пространстве (28-33), изменения в структуре цитоскелета и деформация кончиков корневых волосков (34-37), а также индукция экспрессии 286
симбиоз-специфичных генов ранних нодулинов (ENOD генов, англ. ear-lynodulins) (38). Эти реакции предшествуют скручиванию корневых волосков, формированию в них микроколоний бактерий и развитию инфекционных нитей — тубулярных структур, посредством которых бактерии доставляются в клетки растения. Одновременно с инфекционным процессом активируется сигнальный каскад в более глубоких слоях коры корня, что приводит к реактивации делений клеток коры и формированию примордия клубенька (1, 27, 36, 39-42). По мере развития у клубенька формируются проводящие ткани (43) и функциональная меристема, обеспечивающие его пролиферирующими клетками (27, 44-47).
У бобовых растений были выявлены несколько компонентов, участвующих в передаче сигнала от рецепторов. Это рецептор-подобная киназа с лейцин-богатыми повторами во внеклеточном домене (LjSYMRK/MtDMI2), основной фермент синтеза мевалоновой кислоты 3-гидрокси-3-метилглу-тарил-кофермент А редуктаза (MtHMGRl/LjHMGRl), катионные каналы (LjCASTOR, LjPOLLUX/MtDMIl), белки нуклеопорины (LjNUP85, LjNUP133 и LjNENA) и кальций-кальмодулин-зависимая киназа (LjCCaMK/MtDMI3) (48-50). Последняя выполняет важную роль в «декодировании» сигнала. Нарушение ее функции приводит к блокированию инфекционного процесса и органогенеза клубеньков. Распространение сигнала от Nod-факторов необходимо для активации транскрипции большинства генов, связанных с органогенезом клубеньков и развитием инфекции, которая контролируется транскрипционными факторами LjCYCLOPS/MtIPD3, LjNSPl/MtNSPl, LjNSP2/MtNSP2, LjNIN/MtNIN, MtERNl, LjNF-YAl/MtNF-YA1(HAP2), LjNF-YBl/MtNF-YBl, LjEFD/MtEFD (40, 5l-54).
Участие цитокининов в контроле клубенькообразован и я. Позитивная роль цитокининов при клубенькообразовании была впервые показана в экспериментах с экзогенным добавлением 6-бен-зиламинопурина (6-БАП), что привело к возникновению клубенькоподобных структур на корнях бобовых растений. Стимуляцию пролиферации кортикальных клеток при экзогенном добавлении 6-БАП наблюдали у люцерны посевной Medicago sativa, белого клевера Trifolium repens, гороха посевного Pisum sativum и лядвенца японского Lotus japonicus (55-60). Низкие концентрации цитокининов вызвали появление клубенькового примордия, например 6-БАП стимулировал клубенькообразование у гороха P sativum (59). Однако высокие концентрации оказывали противоположный эффект на клубенькообразование и подавляли развитие примордиев боковых корней. Авторы сделали вывод, что ингибирование органогенеза клубеньков и боковых корней высокими концентрациями цитокинина происходит из-за стимуляции продукции этилена (59).
В пользу предположения об участии цитокининов в контроле клу-бенькообразования свидетельствовали эксперименты по инокуляции растений люцерны M sativa бактериальными штаммами, дефектными по синтезу Nod-факторов, но содержащими гены биосинтеза транс-зеатина. В результате у растений формировались клубенькоподобные структуры, в которых наблюдали индукцию экспрессии генов ранних нодулинов MtENOD40 и MtENOD2 (57). То есть цитокинины индуцируют ответные реакции, очень сходные с теми, которые развиваются при инокуляции бактериальным симбионтом (38).
Добавление экзогенного цитокинина 6-БАП также стимулировало экспрессию генов ранних нодулинов MsENOD40 и MsENOD2 у люцерны M. sativa (6l). Эти гены индуцируются не только при развитии симбиоза люцерны с клубеньковыми бактериями, но и при симбиозе с грибами ар- бускулярной микоризы (61). Авторы предположили, что цитокинины действуют как триггеры индукции экспрессии ранних нодулинов и при бобово-ризобиальном, и при микоризном симбиозе. В микоризованных корнях люцерны было выявлено значительно более высокое содержание трансзеатина по сравнению с неинокулированными. Поскольку в основе развития бобово-ризобиального симбиоза лежат механизмы, которые сформировались на основе более древнего симбиоза с грибами арбускулярной микоризы, участие цитокининов в ответе растений на взаимодействие с симбиотическими микроорганизмами может быть эволюционно древним событием.
Эксперименты, направленные на снижение содержания цитокининов у растений, также свидетельствовали о стимулирующей роли этих гормонов в клубенькообразовании. У трансгенных растений L. japonicus, экспрессирующих гены ферментов катаболизма цитокининов Arabidopsis и Zea mays (AtCKX2 и ZmCKXl), формировалось значительно меньше корневых клубеньков (62).
Предположения о вовлечении цитокининов в контроль клубень-кообразования нашли окончательное подтверждение, когда у модельных бобовых растений Medicago truncatula и L. japonicus были идентифицированы рецепторы к цитокининам MtCREl и LjLHKl, контролирующие развитие симбиоза (63-66). Мутации, вызывающие конститутивную активацию рецептора к цитокининам MtCREl/LjLHKl (доминантно позитивная мутация в гене рецептора), приводили к развитию клубенько-подобных структур (спонтанных клубеньков) в отсутствии ризобий. В частности, у L. japonicus был изолирован мутант со спонтанно формируемыми клубеньками spontaneous nodule formation? (snf2). Клонирование показало наличие доминантной мутации в гене LHK1, который является гомологом AHK4/CRE1 у Arabidopsis (Arabidopsis HISTIDINE KINASE4/CYTOKININ RESPONSE1), при этом мутация оказалась локализована во внеклеточном CHASE домене рецептора к цитокининам (67-69). У snf2 мутанта формировались свободные от ризобий клубенькоподобные структуры, которые были похожи на клубеньки, образующиеся при бактериальной инокуляции (64). Сходным образом к появлению спонтанных клубеньков приводила трансформация растений Medicago генетической конструкцией для синтеза MtCREl с заменой в CHASE домене (L267F), что определяло конститутивную активацию рецептора (69).
Напротив, у мутантов по рецептору к цитокининам с выключением функции гена MtCREl/LjLHKl наблюдали значительное снижение количества формирующихся симбиотических клубеньков. Появление редких клубеньков у мутантов crel и Ihkl было сдвинуто по времени и контролировалось дополнительными рецепторами к цитокининам (у L. japonicus — LjLHKlA, LjLHK3) (70). У мутанта crel M. truncatula, а также у растений с подавленной в результате РНК-интерференции экспрессией гена рецептора к цитокининам MtCREl было нарушено формирование клубеньков и резко снижалось их количество (63, 7l). При этом подавление восприимчивости растений к цитокининам влияло как на развитие инфекционных нитей, так и на формирование клубеньков (63, 7l). Даже если развитие инфекционных нитей инициировалось, их рост останавливался в эпидермисе и наружных слоях коры. У редких клубеньков, появляющихся на мутанте crel, была нарушена зональность, что указывает на участие цитокининов не только в инициации органогенеза, но и контроле процессов дифференцировки клубеньков (7l).
У L. japonicus был обнаружен мутант hitl (hyperinfectedl), несущий мутацию в гене LjLHKl, который формировал пониженное число клу-288
беньков (65, 66). Он характеризовался повышенной восприимчивостью к ризобиальной инфекции (в отличие от мутантов crel у Medicago), но ее дальнейшее развитие было блокировано в эпидермисе и коре, что приводило к значительному снижению клубенькообразования (66). Авторы получили доказательства того, что LjLHKl непосредственно связывается с цитокининами, при этом мутантный белок не обладал такой способностью.
Таким образом, для двух модельных растений M. truncatula и L. japonicus показана ключевая роль цитокининов в инициации и развитии органогенеза клубеньков. При этом отсутствие чувствительности растений к цитокининам из-за нарушения работы рецептора неодинаково влияло на ризо-биальную инфекцию у M. trncatula и L japonicus, что может быть связано с разным типом клубенькообразования у двух видов бобовых (66, 71). Роль цитокининов не ограничена только регуляцией ранних стадий органогенеза, они могут быть вовлечены в контроль дифференцировки клубеньков.
В соответствии с предполагаемым участием цитокининов в регуляции органогенеза клубеньков и инфекционного процесса, рецептор LjLHKl и регуляторы цитокининового ответа локализованы в делящихся клетках наружной коры корня и клетках корневых волосков у L. japonicus (62, 70). В формирующемся клубеньке зона экспрессии этих генов значительно расширялась, а в зрелом была ограничена зоной меристемы и проводящими пучками (62, 70).
У M. trncatula локализация рецептора к цитокининам при инициации симбиоза была связана только с делящимися клетками перицикла и внутренней коры, затем с развивающимися примордиями клубеньков, а в зрелом клубеньке — с меристемой и зоной инвазии (72, 73). Однако в клетках корневых волосков у M. trncatula была выявлена активация регуляторов ответа на цитокинин, экспрессия которых возрастала при инокуляции и обработке Nod-факторами (73), что подтверждали данные транскриптомного анализа (74). Более того, с помощью транскриптомного анализа показано, что в клетках корневых волосков в ответ на инокуляцию возрастала экспрессия рецептора MtCREl (75). То есть у M. trncatula также происходит активация рецептора к цитокинину в клетках корневых волосков.
Эксперименты по обработке растений экзогенным цитокинином 6-БАП (10 - 8 моль/л) показали, что инициация процесса органогенеза клубеньков контролируется с помощью локальных механизмов, действующих в клетках коры корня (60). При добавлении цитокинина к растению стимуляцию экспрессии гена LjNIN, необходимого для органогенеза, наблюдали только в коре корня (60).
Известно, что развитие инфекции в эпидермисе корня четко скоординировано с развитием клубенькового примордия в коре корня при симбиозе (27, 76, 77). Существенную роль в такой координации могут играть цитокинины. Так, у двойного мутанта L. japonicus symrk14 lhk1 (SYMRK — компонент сигнального пути, активируемого Nod-факторами, LjLHKl — рецептор к цитокининам) дополнительная мутация symrk14 нарушала развитие инфекционных нитей в клетках корневых волосков и выход из них бактерий (70). Если при инокуляции одиночного мутанта lhk1 отдельные бактерии достигали клеток коры корня и там активировали формирование единичных клубеньков через дополнительные рецепторы к цитокининам (LjLHKlA, LjLHK3), то у двойного мутанта развитие клубеньков было полностью блокировано (70). Это свидетельствует о наличии связи между событиями в эпидермисе и активацией рецептора к цитокининам в коре корня. По мнению авторов, Nod-факторы, выделяемые ри-зобиями, стимулируют сигнальный каскад в клетках эпидермиса (показа- телем служит активация рецептора к цитокинину LjLHKl в этих клетках), что приводит к появлению сигнала, который перемещается в кору корня (70). Этот сигнал активирует в клетках коры корня рецептор к цитокининам LjLHKl и вспомогательные рецепторы LjLHKlA, LjLHK3, что способствует стимуляции делений клеток. Служит ли таким сигналом сам цитокинин или другой регулятор, влияющий на синтез/активацию цитокинов в коре корня, остается неясным. Под влиянием цитокининов может значительно увеличиваться синтез самих рецепторов (авторегуляция), что усиливает ответ растений на действие этих гормонов при дальнейшем развитии симбиоза (70).
Существуют доказательства, что цитокинины вовлекаются в передачу сигнала от Nod-фактора после стадии, контролируемой кальций-кальмодулин-зависимой киназой (CCaMK). Следовательно, активация рецептора к цитокининам зависит от Nod-факторов. Рецептор к цитокининам работает по принципу «фосфореле», то есть, будучи активированным, передает сигнал фосфопереносящему белку, который фосфорилирует и активирует транскрипционный фактор RR Б-типа (от англ. type-B Response Regulator). Транскрипционный фактор RR Б-типа связывается с промоторами цитокинин-регулируемых генов и активирует их экспрессию. Среди активируемых присутствуют гены первичного ответа A-типа (type-A Response Regulator, RR A-типа), которые негативно регулируют цитокининовый ответ (негативно влияют на транскрипционный фактор RR Б-типа).
Nod-фактор
NFR1/NFR5
HMGR1
МСА8
CASTOR. POLLUX
NUP85, NUP133, NENA
| CCaMK I |CYCLOPS|
| CCaMK I | CYCLOPS |
| NSP1 | NSP2 |
NIN
| LHK1 |
| NSP1 J NSP2 |
NIN |
Развитие инфекции
Органогенез клубеньков
Рис. 1. Схема взаимодействия цитокининов и компонентов сигнального пути, активируемых Nod-факторами, у бобового растения Lotus ja-ponicus (модифицировано по 76, 78) : NFR1, NFR5 — LysM-рецепторные киназы к Nod-факторам, SYMRK — рецептор-подобная киназа с богатыми лейцином повторами во внеклеточном домене, HMGR1 — 3-гидрокси-3-метилглутарил-кофермент A редуктаза, MCA8 — кальциевая АТФаза SERCA-типа, CASTOR, POL-LUX — катионные каналы, NUP85, NUP133, NENA — белки нуклеопорины, CCaMK — кальций-кальмодулин-зависимая киназа, CYCLOPS — транскрипционный фактор, LHK1 — рецептор к цитокинину, NSP1, NSP2, NIN — транскрипционные факторы.
Известно, что экспрессия генов первичного ответа А-типа (RR A-типа), активируемых цитокининами, значительно возрастает при инокуляции, то есть цитокининовый ответ — часть сигнального каскада, индуцируемого ризобиями (63, 7l, 73). Экспрессия цитокинин-регулируемых генов MtRRl и MtRR4 у M. truncatula при инокуляции Sinorhizobum meliloti оказалась существенно снижена в Nod -мутантах dmi1, dmi2, dmi3 и nsp2, дефектных по основным компонентам передачи сигнала от Nod-фактора (63). Для лядвенца (60, 77) было показано, что активация рецептора к цитокининам LjLHKl зависит от сигнальной трансдукции, связанной с рецепцией Nod-факторов. При обработке растений лядвенца дикого типа, а также мутантов symRK, nup133, nup85, castor, pollux, ccamk и cyclops низкими концентрациями цитокининов наблюдали стимуляцию деления клеток коры корня и формирование спонтанных клубеньков (рис. 1) (60, 77). Полученные результаты свидетель- ствовали о вовлечении цитокининов в контроль клубенькообразования уже после стадий, контролируемых этими компонентами сигнального пути (60). Однако у мутантов nsp1, nsp2 и nin (гены, кодирующие транскрипционные факторы и активирующиеся после CCaMK) обработка цитокининами не вызывала спонтанного клубенькообразования. Следовательно, активация рецептора к цитокинину происходит на стадии, которая предшествует вовлечению в передачу сигнала этих транскрипционных регуляторов при формировании клубеньков.
Сходные результаты были получены и при введении в мутантные растения symRK, nup133, nup85, castor, pollux, ccamk и cyclops, а также nsp2 и nin генетической конструкции для синтеза рецептора LjLHK1 с заменой L266F в CHASE домене (вызывает конститутивную активацию рецептора к цитокинину) (см. рис. 1) (78). У трансгенных растений symRK, nup133, nup85, castor, pollux, ccamk и cyclops, несущих конструкцию для синтеза LjLHKl L266F, формировались спонтанные клубеньки, однако такие клубеньки не появлялись у мутантов nsp2 и nin в ответ на обработку, что предполагает активацию NSP2 и NIN уже после активации рецептора к цитокинину .
Экзогенное добавление цитокининов активировало экспрессию генов, кодирующих основные транскрипционные регуляторы развития симбиоза, такие как NSP2, ERN1 и NIN (71). Более того, экспрессия генов транскрипционных факторов NSP2, ERN1 и NIN была значительно снижена у мутантов по рецептору к цитокининам cre1 и lhk1. Следовательно, активация рецептора к цитокининам предшествует вовлечению этих транскрипционных факторов в передачу сигнала (64, 71) . Наконец, в промоторе гена NSP2 была найдена последовательность, выявленная у всех других ци-токинин-регулируемых генов, с которой связывался транскрипционный регулятор MtRR1 (RR Б-типа), что подтверждает возможность регуляции экспрессии этого гена в ответ на активацию рецептора к цитокининам (79).
Особенности метаболизма цитокининов у бобовых растений. До настоящего времени оставалось неясным, что лежит в основе увеличения содержания цитокининов при симбиозе — выделение ризобиями цитокинин-подобных соединений или синтез/активация цитокининов в самом растении. Основные формы цитокининов у высших растений — транс-зеатин (tZ), N6-(A2-изопентенил)аденин (iP), цис-зеатин (cZ), дигидрозеатин (DZ), N6-бензиладенин (BA) (80). К синтезу цитокининов способны также бактерии (в том числе ризобии), у которых выявлены гены биосинтеза цитокининов, гомологичные таковым у растений (81). При исследовании метаболизма цитокининов у растений была идентифицирована серия генов, участвующих в этих процессах (рис. 2). Предшественниками биосинтеза цитокининов служат свободные АТФ и АДФ, а также тРНК. Первая стадия биосинтеза цитокининов — синтез изопенте-нил-нуклеотидов из АТФ или АДФ и диметилаллилпирофосфата (DMAPP), который катализируется ферментом изопентенилтрансферазой (IPT) (см. рис. 2). Кроме IPT, у растений выявлены ферменты тРНК-IPT, использующие в качестве субстрата тРНК и участвующие в синтезе цис-зеатина (82). На этом этап биосинтеза контролируется количество цитокининов в тканях растения, а изменение уровня экспрессии IPT наиболее значительно отражается на их содержании. В дальнейшем изопентенил-нуклеотиды могут превращаться в зеатин-нуклеотиды с помощью цитохром Р450-монооксигеназ CYP735A (83). Цитокининовые нуклеотиды обладают слабой физиологической активностью, поэтому их активация посредством отщепления рибозы и фосфатной группы — важный этап биосинтеза цитокининов. Эта последняя стадия получения активных цитокининов из цитокининовых нуклеотидов посредством дефосфорилирования и дерибо-зилирования катализируется ферментом 5'-монофосфат-фосфорибогидро-лазой, который кодируется генами из семейства LONELYGUY (LOG). LOG ферменты обладают фосфорибогидролазной активностью и превращают цитокининовые нуклеотиды iPRMP и tZRMP в свободные активные изопентениладенин и зеатин (84).
Недавно было показано, что экспрессия генов, вовлеченных в контроль биосинтеза цитокининов, растет в ответ на инокуляцию ризобиями и обработку Nod-факторами. У M. truncatula после обработки Nod-факторами в течение 1 ч значительно возрастала экспрессия гена MtIPT4, кодирующего изопентенилтрансферазу (85). Увеличение экспрессии MtIPT4 коррелировало с накоплением в корнях цитокининов (транс-зеатина и изопентени-ладенина) (85). Результаты этого эксперимента свидетельствовали об активации биосинтеза цитокининов в самих растениях, поскольку их инокуляция ризобиями не проводилась. Экспрессия других генов (MtIPT1, MtIPT3 у M. truncatula, а также их гомологов PsIPT4, PsIPT3 у P. sativum) существенно возрастала при клубенькообразовании с 7-х сут после инокуляции и увеличивалась при развитии клубеньков (86). Кроме того, экспрессия генов LONE-LYGUYs (LOGs), кодирующих активирующие цитокинин ферменты, значительно возрастала при инокуляции Medicago и гороха P. sativum (85-87).
cis-prenvl-tRNA
DMAPP tRNA
I tRNA-IPT| l prenyl-tRNA
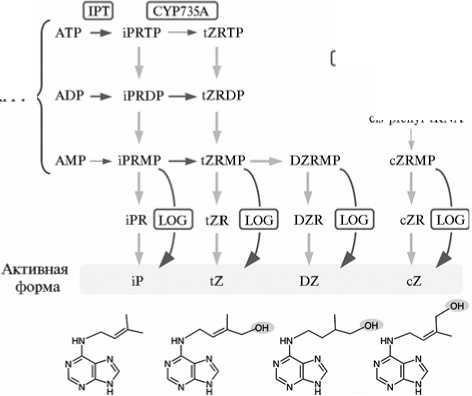
Рис. 2.
DMAPP нин, tZ
Основные этапы биосинтеза цитокининов (88): — диметилаллилпирофосфат, iP — изопентениладе-— транс-зеатин, DZ — дигидрозеатин, cZ — цис-
DMAPP+ <
зеатин, iPRMP — изопентениладенинрибозид-монофосфат, tZRMP — транс-зеатинрибозид-монофосфат, DZRMP — дигидрозеатинрибозид-монофосфат, cZRMP — цис-зеа-тинрибозид-монофосфат, iPR — изопентениладенинрибозид, tZR — транс-зеатинрибозид, DZR — дигидрозеатинрибозид, cZR — цис-зеатинрибозид, IPT — изопентенилтрансфераза, LOG — 5'-монофосфат-фосфорибогидролаза.
У L japonicus экспрессия гена LjIPT3, кодирующего изопентенил-трансферазу, индуцировалась в течение 3 ч после инокуляции ризобиями. Она возрастала в корнях, достигая максимального значения на более поздних этапах клу-бенькообразования, что может свидетельствовать о необходимости цитокининов для этого процесса (89). Более того, экспрессия другого гена LjIPTI существенно возрастала на 7-е сут после инокуляции и оставалась высокой в клубеньках (89). Подавление экспрессии LjIPT3 в результате РНК-интерференции приводило к существенному снижению числа клубеньков (89). Все эти данные подтверждают, что биосинтез цитокининов и их активация происходят в корнях бобовых растений в ответ на инокуляцию ризобиями, продуцирующими Nod-факторы. Ризобии могут синтезировать цитокинины, однако при исследовании продукции цитокининов у четырех разных штаммов ризобий, способных и не способных формировать клубеньки, не было найдено корреляции между типами и количеством синтезированных ими цитокининов и возможностью индуцировать развитие клубеньков (90).
Таким образом, увеличение содержания цитокининов при клубень-кообразовании, вероятно, связано с активацией синтеза этих гормонов в самом растении под влиянием сигнальных молекул ризобий Nod-факторов.
Участие цитокининов в контроле авторегуляции симбиоза. Цитокинины не только необходимы для инициации органогенеза клубеньков (локальный контроль), но также вовлечены в авторегуляцию процесса клубенькообразования (системный контроль) (91).
Показано, что активация рецептора к цитокининам MtCRE1/LjLHK1 необходима для индукции синтеза в корнях регуляторных пептидов MtCLE13 у Medicago, а также CLE-RS1 и CLE-RS2 у Lotus (92, 93).
В индукции экспрессии генов MtCLE13 и CLE-RS1, CLE-RS2 непосредственно участвует транскрипционный фактор NIN, активация которого зависит от рецептора MtCRE1/LjLHK1. Синтезированные пептиды перемещаются в побег и там связываются с рецепторами MtSUNN/LjHAR1/PsSYM29 и LjCLV2/PsSYM28, LjKLAVIER - гомологами CLAVATA1, CLAVATA2 и RPK2 (TOAD2) у Arabidopsis. При активации этих рецепторов в побеге генерируется сигнал неизвестной природы, который перемещается в корни и ингибирует дальнейшую закладку новых клубеньков. Таким сигналом может быть поступление цитокининов. У L. japonicus в ответ на инокуляцию во флоэме побега растения увеличивалась экспрессия гена LjIPT3 (91). При этом LjIPT3 активировался через компоненты системы авторегуляции симбиоза (рецепторы CLAVATA и регуляторные CLE-пептиды), а увеличение концентрации цитокининов негативно влияло на клубенькообразование (91). Следовательно, цитокинины могут играть двойную роль в клубенько-образовании в зависимости от времени и места их активации.
Итак, значительный интерес представляет изучение механизмов координированной регуляции развития клубеньков у растений при симбиозе с ризобиями, которая позволяет сигнальным молекулам этих бактерий (Nod-факторам) активировать эндогенные регуляторы самого растения — фитогормоны, прежде всего цитокинины и ауксины. Представленные в настоящей статье данные позволяют предложить модель, согласно которой активация Nod-факторами компонентов сигнального пути, прежде всего каль-ций-каль-модулин-зависимой киназы (CCaMK), приводит к локальному накоплению цитокининов, что, в свою очередь, влияет на деление клеток коры корня и формирование клубенькового примордия. Наличие мутантов по рецептору к цитокинину MtCRE1/LjLHK1, формирующих спонтанные клубеньки, позволяет сделать вывод о том, что программа развития клубеньков существует в самом растении-хозяине, но активируется сигнальными молекулами ризобий. При этом накопление цитокининов может происходить за счет индукции экспрессии генов, контролирующих биосин-тез/активацию этих гормонов, но молекулярные механизмы такой активации еще предстоит выяснить.
Список литературы Роль фитогормонов в контроле развития симбиотических клубеньков у бобовых растений. Сообщение I. Цитокинины
- Schultze M., Kondorosi A. Regulation of symbiotic root nodule development. Annu. Rev. Genet., 1998, 32: 33-57 ( ) DOI: 10.1146/annurev.genet.32.1.33
- Phillips D.A., Torrey J.G. Studies on cytokinin production by Rhizobium. Plant Physiol., 1972, 49: 11-15 ( ) DOI: 10.1104/pp.49.1.11
- Sturtevant D.B., Taller B.J. Cytokinin production by Bradyrhizobium japonicum. Plant Physiol., 1989, 89: 1247-1252 ( ) DOI: 10.1111/j.1399-3054.1970.tb08880.x
- Thimann K.V. On the physiology of the formation of nodules on legume roots. PNAS USA, 1936, 22: 511-514 ( ) DOI: 10.1073/pnas.22.8.511
- Morris R.O. Genes specifying auxin and cytokinin biosynthesis in prokaryotes. In: Plant hormones/P.J. Davies (ed.). KAP, Dordrecht, 1995, E20: 318-339 ( ) DOI: 10.1007/978-94-011-0473-9_15
- Sachs T., Thimann K. The role of auxins and cytokinins in the release of buds from dominance. Am. J. Bot., 1967, 54(1): 136-144 ( ) DOI: 10.2307/2440896
- Tanaka M., Takei K., Kojima M., Sakakibara H., Mori H. Auxin controls local cytokinin biosynthesis in the nodal stem in apical dominance. The Plant Journal, 2006, 45(6): 1028-1036 ( ) DOI: 10.1111/j.1365-313X.2006.02656.x
- Werner T., Motyka V., Strnad M., Schmülling T. Regulation of plant growth by cytokinin. PNAS USA, 2008, 98(18): 10487-10492 ( ) DOI: 10.1073/pnas.171304098
- Werner T., Köllmer I., Bartrina I., Holst K., Schmülling T. New insights into the biology of cytokinin degradation. Plant Biology, 2006, 8(3): 371-381 ( ) DOI: 10.1055/s-2006-923928
- Sakakibara H. Cytokinins: activity, biosynthesis, and translocation. Annu. Rev. Plant Biol., 2006, 57: 431-449 (doi: 10.1146/annurev.arplant.57.032905.105231).
- Syono K., Newcomb W., Torrey J.G. Cytokinin production in relation to the development of pea root nodules. Can. J. Bot., 1976, 54: 2155-2162 ( ) DOI: 10.1139/b76-232
- Newman J.D., Diebold R.J., Schultz B.W., Noel K.D. Infection of soybean and pea nodules by Rhizobium spp. purine auxotrophs in the presence of 5-aminoimidazole-4-carboxamide riboside. J. Bacteriol., 1994, 176: 3286-3294 (PMCID: PMC205499).
- Spaink H., Sheeley D.M., van Brussel A.A.N., Glushka J., York W.S., Tak T., Geiger O., Kennedy E., Reinhold N., Lugtenberg B.J.J. A novel highly unsaturated fatty acid moiety of lipooligosaccharide signals determines host specificity of Rhizobium. Nature, 1991, 354: 125-130 ( ) DOI: 10.1038/354125a0
- Truchet G., Roche P., Lerouge P., Vasse J., Camut S., Debilly F., Prome J.C., Denarie J. Sulphatedlipo-oligosaccharide signals of Rhizobium meliloti elicit root nodule organogenesis in alfalfa. Nature, 1991, 351: 670-673 ( ) DOI: 10.1038/351670a0
- Stokkermans T.J.W., Peters N.K. Bradyrhizobium elkanii lipo-oligosaccharide signals induce complete nodule structures on Glycine soja Siebold et. Zucc. Planta, 1994, 193: 413-420 ( ) DOI: 10.1007/BF00201821
- Cárdenas L., Domínguez J., Quinto C., López-Lara I.M., Lugtenberg B.J., Spaink H.P., Rademaker G.J., Haverkamp J., Thomas-Oates J.E. Isolation, chemical structures and biological activity of the lipo-chitin oligosaccharide nodulation signals from Rhizobium etli. Plant Mol. Biol., 1995, 29(3): 453-464 ( ) DOI: 10.1007/BF00020977
- Ritsema T., Lugtenberg B.J., Spaink H.P. Acyl-acyl carrier protein is a donor of fatty acids in the NodA-dependent step in biosynthesis of lipochitin oligosaccharides by rhizobia. J. Bacteriol., 1997, 179(12): 4053-4055 (PMCID: PMC179219).
- Corvera A., Promé D., Promé J.-C., Martínez-Romero E., Romero D. The nolL gene from Rhizobium etli determines nodulation efficiency by mediating the acetylation of the fucosyl residue in the Nodulation factor. Mol. Plant-Microbe Interact., 1999, 12(3): 236-246 ( ) DOI: 10.1094/MPMI.1999.12.3.236
- Perret X., Staehelin C., Broughton W.J. Molecular basis of symbiotic promiscuity. Microbiol. Mol. Biol. Res., 2000, 64(1): 180-201 ( ) DOI: 10.1128/MMBR.64.1.180-201.2000
- Denarie J., Debelle F., Prome J.C. Rhizobium lipo-chitooligosaccharide nodulation factors: signaling molecules mediating recognition and morphogenesis. Annu. Rev. Biochem., 1996, 65: 503-535 ( ) DOI: 10.1146/annurev.bi.65.070196.002443
- Long S.R. Rhizobium symbiosis: Nod factors in perspective. Plant Cell, 1996, 8: 1885-1898 ( ) DOI: 10.1105/tpc.8.10.1885
- Madsen E.B., Madsen L.H., Radutoiu S., Olbryt M., Rakwalska M., Szcyglowski K., Sato S., Kaneko T., Tabata S., Sandal N., Stougaard J. A receptor kinase gene of the LysM type is involved in legume perception of rhizobial signals. Nature, 2003, 425: 637-640 ( ) DOI: 10.1038/nature02045
- Radutoiu S., Madsen L.H., Madsen E.B., Felle H.H., Umehara Y., Gronlund M., Sato S., Nakamura Y., Tabata S., Sandal N., Stougaard J. Plant recognition of symbiotic bacteria requires two LysM receptor-like kinases. Nature, 2003, 425: 569-570 ( ) DOI: 10.1038/nature02039
- Ben Amor B., Shaw S.L., Oldroyd G.E.D., Maillet F., Penmetsa R., Cook D., Long S.R., Denarie J., Gough C. The NFP locus of Medicago truncatula controls an early step of Nod factor signal transduction upstream of a rapid calcium flux and root hair deformation. Plant J., 2003, 34: 1-12 ( ) DOI: 10.1046/j.1365-313X.2003.01743.x
- Arrighi J.-F., Barre A., ben Amor B., Bersoult A., Soriano L.C., Mirabells R., de Carvalho-Niebel F., Journet E.-P., Gherardi M., Huguet T., Geurts R., Denarie J., Rouge P., Gough C. The Medicago trancatula lysine motif-receptor-like kinase gene family includes NFP and new nodule-expressed genes. Plant Physiol., 2006, 142: 265-279 ( ) DOI: 10.1104/pp.106.084657
- Smit P., Limpens E., Geurts R., Fedorova E., Dolgikh E., Gough C., Bisseling T. Medicago LYK3 an entry receptor in rhizobial Nod factor signaling. Plant Physiol., 2007, 145(1): 183-191 ( ) DOI: 10.1104/pp.107.100495
- Oldroyd G.E.D., Downie J.A. Coordinating nodule morphogenesis with Rhizobial infection in legumes. Annu. Rev. Plant Biol., 2008, 59: 519-546 (doi: 10.1146/annurev.arplant.59.032607.092839).
- Ehrhardt D.W., Atkinson E.M., Long S.R. Depolarization of alfalfa root hair membrane potential by Rhizobium meliloti Nod factors. Science, 1992, 256(5059): 998-1000 ( ) DOI: 10.1126/science.10744524
- Ehrhardt D.W., Wais R., Long S.R. Calcium spiking in plant root hairs responding to Rhizobium nodulation signals. Cell, 1996, 85(5): 673-681 ( ) DOI: 10.1016/S0092-8674(00)81234-9
- Harris J.M., Wais R., Long S.R. Rhizobium-induced calcium spiking in Lotus japonicus. Mol. Plant-Microbe Interact., 2003, 16: 335-341 ( ) DOI: 10.1094/MPMI.2003.16.4.335
- Felle H.H., Kondorosi E., Kondorosi A., Schultze M. Nod factors modulate the concentration of cytosolic free calcium differently in growing and non-growing root hairs of Medicago sativa L. Planta, 1999, 209: 207-212 ( ) DOI: 10.1007/s004250050624
- Engstrom E.M., Ehrhardt D.W., Mitra R.M., Long S.R. Pharmacological analysis of Nod factor-induced calcium spiking in Medicago truncatula: evidence for the requirement of type IIA calcium pumps and phosphoinositide signaling. Plant Physiol., 2002, 128: 1390-1401 ( ) DOI: 10.1104/pp.010691
- Charron D., Pingret J.L., Chabaud M., Journet E.P., Barker D.G. Pharmacological evidence that multiple phospholipid signaling pathways link Rhizobium nodulation factor perception in Medicago truncatula root hairs to intracellular responses, including Ca2+ spiking and specific ENOD gene expression. Plant Physiol., 2004, 136: 3582-3593 ( ) DOI: 10.1104/pp.104.051110
- Van Brussel A.A.N., Bakhuizen R., Van Spronsen P.C., Spaink H.P., Tak T., Lugtenberg B.J.J., Kijne J.W. Induction of preinfection thread structures in the leguminous host plant by mitogeniclipooligosaccharides of Rhizobium. Science, 1992, 257: 70-72 ( ) DOI: 10.1126/science.257.5066.70
- de Ruijter N.C.A., Bisseling T., Emons A.M.C. Rhizobium Nod factors induce an increase in sub-apical fine bundles of actin filaments in Vicia sativa root hairs within minutes. Mol. Plant Microbe Interact., 1999, 12: 829-832 ( ) DOI: 10.1094/MPMI.1999.12.9.829
- Timmers A.C.J., Auriac M.-C., Truche G. Refined analysis of early symbiotic steps of the Rhizobium-Medicago interaction in relationship with microtubular cytoskeleton rearrangements. Development, 1999, 126: 3617-3628 (PMID: 10409507).
- Lerouge P., Roche P., Faucher C., Maillet F., Truchet G., Prome J.C., Denarie J. Symbiotic host-specificity of Rhizobium meliloti is determined by a sulphated and acylated glucosamine oligosaccharide signal. Nature, 1990, 19: 781-784 ( ) DOI: 10.1038/344781a0
- Horvath B., Heidstra R., Lados M., Moerman M., Spaink H.P., Prome J.-C., Van Kammen A., Bisseling T. Lipo-oligosaccharides of Rhizobium induce infection related early nodulin gene expression in pea root hairs. Plant J., 1993, 4: 727-733 ( ) DOI: 10.1046/j.1365-313X.1993.04040727.x
- Bauer P., Ratet P., Crespi M., Schultze M., Kondorosi A. Nod factors and cytokinins induce similar cortical cell division, amyloplast deposition and MsEnod12A expression patterns in alfalfa roots. Plant J., 1996, 10: 91-105 ( ) DOI: 10.1046/j.1365-313X.1996.10010091.x
- Downie J.A., Walker S.A. Plant responses to nodulation factors. Curr. Opin. Plant Biol., 1999, 2: 483-489 ( ) DOI: 10.1016/S1369-5266(99)00018-7
- Marsh J.F., Rakocevic A., Mitra R.M., Brocard L., Sun J., Eschstruth A., Long S.R., Schultze M., Pascal Ratet P., Oldroyd G.E.D. Medicago truncatula NIN is essential for rhizobial-independent nodule organogenesis induced by autoactive calcium/calmo-dulin-dependent protein kinase. Plant Physiol., 2007, 144: 324-335 ( ) DOI: 10.1104/pp.106.093021
- Schauser L., Wieloch W., Stougaard J. A plant regulator controlling development of symbiotic root nodules. Nature, 1999, 402: 191-195 ( ) DOI: 10.1038/46058
- de Billy F., Grosjean C., May S., Bennett M., Cullimore J. Expression studies on AUX1-like genes in Medicago truncatula suggest that auxin is required at two steps in early nodule development. Mol. Plant-Microbe Interact., 2001, 14(3): 267-277 ( ) DOI: 10.1094/MPMI.2001.14.3.267
- Pate J.S., Gunning B.E.S., Briarty L.G. Ultrastructure and functioning of the transport system of the leguminous root nodule. Planta, 1969, 85: 11-34 ( ) DOI: 10.1007/BF00387658
- Hirsch A.M., Bhuvaneswari J.G., Torrey J.G., Bisseling T. Early nodulin genes are induced in alfalfa root outgrowths elicited by auxin transport inhibitors. PNAS USA, 1989, 86: 1244-1248 ( ) DOI: 10.1073/pnas.86.4.1244
- Sprent J.I., Embrapa J.I. Root nodule anatomy, type of export product and evolutionary origin in some Leguminosae. Plant Cell Environ., 1979, 3: 35-43 ( ) DOI: 10.1111/1365-3040.ep11580516
- Crespi M., Frugier F. De novo organ formation from a differentiated cells: root nodule organogenesis. Sci. Signal., 2008, 1(49): re11 ( ) DOI: 10.1126/scisignal.149re11
- Endre G., Kereszt A., Kevei Z., Mihacea S., Kalo P., Kiss G.B. A receptor kinase gene regulating symbiotic nodule development. Nature, 2002, 417: 962-966 ( ) DOI: 10.1038/nature00842
- Ane J.-M., Kiss G.B., Riely B.K., Penmetsa R., Oldroyd G.E.D., Ayax C., Levy J., Debelle F., Baek J.-M., Kalo P., Rosenberg C., Roe B.A., Long S.R., Denarie J., Cook D.R. Medicago trancatula DMI1 required for bacterial and fungal symbioses in legumes. Science, 2004, 303: 1364-1367 ( ) DOI: 10.1126/science.1092986
- Oldroyd G.E., Downie J.A. Nuclear calcium changes at the core of symbiosis signalling. Curr. Opin. Plant Biol., 2006, 9: 351-357 ( ) DOI: 10.1016/j.pbi.2006.05.003
- Smit P., Raedts J., Portyanko V., Debelle F., Gough C., Bisseling T., Geurts R. NSP1 of the GRAS protein family is essential for rhizobial Nod factor-induced transcription. Science, 2005, 308: 1789-1790 ( ) DOI: 10.1126/science.1111025
- Yano K., Tansengco M.L., Hio T., Higashi K., Murooka Y., Imaizumi-Anraku H., Kawaguchi M., Hayashi M. New nodulation mutants responsible for infection thread development in Lotus japonicus. Mol. Plant-Microbe Interact., 2006, 19(7): 801-810 ( ) DOI: 10.1094/MPMI-19-0801
- Andriankaja A., Boisson-Dernie A., Frances L., Sauviac L., Jauneau A., Barker D.G., de Carvalho-Niebel F. AP2-ERF transcription factors mediate Nod factor dependent Mt ENOD11 activation in root hairs via a novel cis-regulatory motif. Plant Cell, 2007, 19: 2866-2885 ( ) DOI: 10.1105/tpc.107.052944
- Middleton P.H., Jakab J., Penmetsa R.V., Starker C.G., Doll J., Kaló P., Prabhu R., Marsh J.F., Mitra R.M., Kereszt A., Dudas B., Van den Bosch K., Long S.R., Cook D.R., Kiss G.B., Oldroyd G.E. An ERF transcription factor in Medicago truncatula that is essential for Nod factor signal transduction. Plant Cell, 2007, 19: 1221-1234 ( ) DOI: 10.1105/tpc.106.048264
- Libbenga K.R., Harkes P.A.A. Initial proliferation of cortical cells in the formation of root nodules in Pisum sativum L. Planta, 1973, 114: 17-28 ( ) DOI: 10.1007/BF00390281
- Fang Y., Hirsch A.M. Studying early nodulin gene ENOD40 expression and induction by nodulation factor and cytokinin in transgenic alfalfa. Plant Physiol., 1998, 116: 53-68 ( ) DOI: 10.1104/pp.116.1.53
- Cooper J.B., Long S.R. Morphogenetic rescue of Rhizobium meliloti nodulation mutants by trans-zeatin secretion. Plant Cell, 1994, 6: 215-225 ( ) DOI: 10.1105/tpc.6.2.215
- Mathesius U., Charon C., Rolfe B.G., Kondorosi A., Crespi M. Temporal and spatial order of events during the induction of cortical cell divisions in white clover by Rhizobium leguminosarum bv trifolii inoculation or localized cytokinin addition. Mol. Plant-Microbe Interact., 2000, 13: 617-628 ( ) DOI: 10.1094/MPMI.2000.13.6.617
- Lorteau M.-A., Ferguson B.J., Guinel F.C. Effects of cytokinin on ethylene production and nodulation in pea (Pisum sativum) cv. Sparkle. Physiologia Plantarum, 2001, 112: 421-428 ( ) DOI: 10.1034/j.1399-3054.2001.1120316.x
- Heckmann A.B., Sandal N., Bek A.S., Madsen L.H., Jurkiewicz A., Nielsen M.W., Tirichine L., Stougaard J. Cytokinin induction of root nodule primordia in Lotus japonicus is regulated by a mechanism operating in the root cortex. Mol. Plant-Microbe Interact., 2011, 24(11): 1385-1395 ( ) DOI: 10.1094/MPMI-05-11-0142
- van Rhijn P., Fang Y., Galili S., Shaul O., Atzmon N., Wininger S., Eshed Y., Lum M., Li Y., To V., Fujishig N., Kapulnik Y., Hirsch A.M. Expression of early nodulin genes in alfalfa mycorrhizae indicates that signal transduction pathways used in forming arbuscular mycorrhizae and Rhizobium-induced nodules may be conserved. PNAS USA, 1997, 94: 5467-5472 ( ) DOI: 10.1073/pnas.94.10.5467
- Lohar D.P., Schaff J.E., Laskey J.G., Kieber J.J., Bilyeu K.D., Bird D.M. Cytokinins play opposite roles in lateral root formation, and nematode and Rhizobial symbioses. Plant J., 2004, 38: 203-214 ( ) DOI: 10.1111/j.1365-313X.2004.02038.x
- Gonzalez-Rizzo S., Crespi M., Frugier F. The Medicago truncatula CRE1 cytokinin receptor regulates lateral root development and early symbiotic interaction with Sinorhizobium meliloti. Plant Cell, 2006, 18: 2680-2693 ( ) DOI: 10.1105/tpc.106.043778
- Tirichine L., Sandal N., Madsen L.H., Radutoiu S., Albrektsen A.S., Sato S., Asamizu E., Tabata S., Stougaard J. A gain-of-function mutation in a cytokinin receptor triggers spontaneous root nodule organogenesis. Science, 2007, 315: 104-107 ( ) DOI: 10.1126/science.1132397
- Murray J., Karas B., Ross L., Brachmann A., Wagg C., Geil R., Perry J., Nowakowski K., MacGillivary M., Held M., Stougaard J., Peterson L., Parniske M., Szczyglowski K. Genetic suppressors of the Lotus japonicus har1-1 hypernodulation phenotype. Mol. Plant-Microbe Interact., 2006, 19(10): 1082-1091 ( ) DOI: 10.1094/MPMI-19-1082
- Murray J.D., Karas B.J., Sato S., Tabata S., Amyot L., Szczyglowski K. A cytokinin perception mutant colonized by Rhizobium in the absence of nodule organogenesis. Science, 2007, 315: 101-104 ( ) DOI: 10.1126/science.1132514
- Inoue T., Higuchi M., Hashimoto Y., Seki M., Kobayashi M., Kato T., Tabata S., Shinozaki K., Kakimoto T. Identification of CRE1 as a cytokinin receptor from Arabidopsis. Nature, 2001, 409: 1060-1063 ( ) DOI: 10.1038/35059117
- Suzuki T., Miwa K., Ishikawa K., Yamada H., Aiba H., Mizuno T. The Arabidopsis sensor His-kinase, AHK4, can respond to cytokinins. Plant Cell Physiol., 2001, 42: 107-113 ( ) DOI: 10.1093/pcp/pce037
- Ovchinnikova E., Journet E.-P., Chabaud M., Cosson V., Ratet P., Duc G., Fedorova E., Wei Liu W., Rik Op den Camp R., Zhukov V., Tikhonovich I., Borisov A., Bisseling T., Limpens E. IPD3 controls the formation of nitrogen-fixing symbiosomes in pea and Medicago spp. Mol. Plant-Microbe Interact., 2011, 24(11): 1333-1344 ( ) DOI: 10.1094/MPMI-01-11-0013
- Held M., Hou H., Miri M., Huynh C., Ross L., Hossain M.S., Sato S., Tabata S., Perry J., Wang T.L., Szczyglowski K. Lotus japonicus cytokinin receptors work partially redundantly to mediate nodule formation. Plant Cell, 2014, 26: 678-694 ( ) DOI: 10.1105/tpc.113.119362
- Plet J., Wasson A., Ariel F., Le Signor C., Baker D., Mathesius U., Crespi M., Frugier F. MtCRE1-dependent cytokinin signaling integrates bacterial and plant cues to coordinate symbiotic nodule organogenesis in Medicago truncatula. Plant J., 2011, 65: 622-633 ( ) DOI: 10.1111/j.1365-313X.2010.04447.x
- Lohar D.P., Sharopova N., Endre G., Peñuela S., Samac D., Town C., Silverstein K.A., VandenBosch K.A. Transcript analysis of early nodulation events in Medicago truncatula. Plant Physiol., 2006, 140: 221-234 ( ) DOI: 10.1104/pp.105.070326
- Op den Camp R.H., De Mita S., Lillo A., Cao Q., Limpens E., Bisseling T., Geurts R. A phylogenetic strategy based on a legume-specific whole genome duplication yields symbiotic cytokinin type-A response regulators. Plant Physiol., 2011, 157: 2013-2022 ( ) DOI: 10.1104/pp.111.187526
- Larrainzar E., Riely B.K., Kim S.C., Carrasquilla-Garcia N., Yu H-Y., Hwang H.-J., Oh M., Kim G.B., Surendrarao A.K., Chasman D., Siahpirani A.F., Penmetsa R., Lee G.-S., Kim N., Roy S., Jeong-Hwan Mun L.-H., Cook D.R. Deep sequencing of the Medicago truncatula root transcriptome reveals a massive and early interaction between nodulation factor and ethylene signals. Plant Physiol., 2015, 169: 233-265 ( ) DOI: 10.1104/pp.15.00350
- Breakspear A., Liu C., Roy S., Stacey N., Rogers C., Trick M., Morieri G., Mysore K.S., Wen J., Oldroyd G.E.D., Downie J.A., Murray J.D. The root hair «infectome» of Medicago truncatula uncovers changes in cell cycle genes and reveals a requirement for Auxin signaling in rhizobial infection. Plant Cell, 2014, 26: 4680-4701 ( ) DOI: 10.1105/tpc.114.133496
- Genre A., Russo G. Does a common pathway transduce symbiotic signals in plant-microbe interactions? Front. Plant Sci., 2016, 7: A96 ( ) DOI: 10.3389/fpls.2016.00096
- Madsen L.H., Tirichine L., Jurkiewicz A., Sullivan J.T., Heckmann A.B., Bek A.S. The molecular network governing nodule organogenesis and infection in the model legume Lotus japonicus. Nat. Commun., 2010, 1: 1-10 ( ) DOI: 10.1038/ncomms1009
- Hayashi T., Banba M., Shimoda Y., Kouchi H., Hayashi M., Imaizumi-Anraku H. A dominant function of CCaMK in intracellular accommodation of bacterial and fungal endosymbionts. Plant J., 2010, 63: 141-154 ( ) DOI: 10.1111/j.1365-313X.2010.04228.x
- Ariel F., Brault-Hernandez M., Laffont C., Huault E., Brault M., Plet J., Moison M., Blanchet S., Ichanté J.L., Chabaud M., Carrere S., Crespi M., Chan R.L., Frugier F. Two direct targets of cytokinin signaling regulate symbiotic nodulation in Medicago truncatula. Plant Cell, 2012, 24: 3838-3852 ( ) DOI: 10.1105/tpc.112.103267
- Mok D.W., Mok M.C. Cytokinin metabolism and action. Annu. Rev. Plant Physiol. Plant Mol. Biol., 2001, 52: 89-118 ( ) DOI: 10.1146/annurev.arplant.52.1.89
- Costacurta A., Vanderleyden J. Synthesis of phytohormones by plant associated bacteria. Crit. Rev. Microbiol., 1995, 21: 1-18 ( ) DOI: 10.3109/10408419509113531
- Miyawaki K., Tarkowski P., Matsumoto-Kitano M., Kato T., Sato S., Tarkowska D., Tabata S., Sandberg G., Kakimoto T. Roles of Arabidopsis ATP/ADP isopentenyltransferases and tRNA isopentenyltransferases in cytokinin biosynthesis. PNAS USA, 2006, 103(44): 16598-16603 ( ) DOI: 10.1073/pnas.0603522103
- Takei K., Yamaya T., Sakakibara H. Arabidopsis CYP735A1 and CYP735A2 encode cytokinin hydroxylases that catalyze the biosynthesis of trans-zeatin. J. Biol. Chem., 2004, 279(40): 41866-41872 ( ) DOI: 10.1074/jbc.M406337200
- Kurakawa T., Ueda N., Maekawa M., Kobayashi K., Kojima M., Nagato Y., Sakakibara H., Kyozuka J. Direct control of shoot meristem activity by a cytokinin-activating enzyme. Nature, 2007, 445(7128): 652-655 ( ) DOI: 10.1038/nature05504
- van Zeijl1 A., Op den Camp R.H.M., Deinum E.E., Charnikhova T., Franssen H., Op den Camp H.J.M., Bouwmeester H., Kohlen W., Bisseling T., Geurts R. Rhizobium lipo-chitooligosaccharide signaling triggers accumulation of cytokinins in Medicago truncatula roots. Mol. Plant, 2015, 8(8): 1213-1226 ( ) DOI: 10.1016/j.molp.2015.03.010
- Azarakhsh M., Kirienko A.N., Zhukov V., Lebedeva M.A., Dolgikh E.A., Lutova L.A. KNOTTED1-LIKE HOMEOBOX 3: a new regulator of symbiotic nodule development. J. Exp. Bot., 2015, 66(22): 7181-7195 ( ) DOI: 10.1093/jxb/erv414
- Mortier V., Wasson A., Jaworek P., De Keyser A., Decroos M., Holsters M., Tarkowski P., Mathesius U., Goormachtig S. Role of LONELY GUY genes in indeterminate nodulation on Medicago truncatula. New Phytologist, 2014, 202(2): 582-593 ( ) DOI: 10.1111/nph.12681
- Hirose N., Takei K. Regulation of cytokinin biosynthesis, compartmentalization and translocation. J. Exp. Bot., 2008, 59(1): 75-83 ( ) DOI: 10.1093/jxb/erm157
- Chen Y., Chen W., Li X., Jiang H., Wu P., Xia K., Yang Y., Wu G. Knockdown of LjIPT3 influences nodule development in Lotus japonicus. Plant Cell Physiol., 2014, 55(1): 183-193 ( ) DOI: 10.1093/pcp/pct171
- Kisiala A., Laffont C., Emery J.R.N., Frugier F. Bioactive cytokinins are selectively secreted by Sinorhizobium meliloti nodulating and nonnodulating strains. Mol. Plant-Microbe Interact., 2013, 26: 1225-1231 ( ) DOI: 10.1094/MPMI-02-13-0054-R
- Sasaki T., Suzaki T., Soyano T., Kojima M., Sakakibara H., Kawaguchi M. Shoot-derived cytokinins systemically regulate root nodulation. Nature, 2014, 5: 4983 ( ) DOI: 10.1038/ncomms5983
- Mortier V., DeWever E., Vuylsteke M., Holsters M., Goormachtig S. Nodule numbers are governed by interaction between CLE peptides and cytokinin signaling. Plant J., 2012, 70: 367-376 ( ) DOI: 10.1111/j.1365-313X.2011.04881.x
- Soyano T., Hirakawa H., Sato S., Hayashi M., Kawaguchi M. Nodule inception creates a long-distance negative feedback loop involved in homeostatic regulation of nodule organ production. PNAS USA, 2014, 111: 14607-14612 ( ) DOI: 10.1073/pnas.1412716111


