Роль ГАМК А-рецепторов комплекса Бетцингера в регуляции дыхания у крыс
Автор: Маньшина Надежда Геннадьевна, Ведясова Ольга Александровна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Нормальная и патологическая физиология
Статья в выпуске: 1, 2014 года.
Бесплатный доступ
В острых опытах на наркотизированных половозрелых крысах изучены изменения паттерна внешнего дыхания и биоэлектрической активности инспираторных мышц при микроинъекциях растворов (10 -6 М) мусцимола и бикукуллина в комплекс Бетцингера (КБ). Установлено, что инъекции мусцимола в КБ укорачивают вдох и выдох, повышая частоту дыхания, при этом дыхательный объем и легочная вентиляция увеличиваются, что совпадает с изменениями частотно-амплитудных параметров электромиограмм инспираторных мышц. При введении бикукуллина в КБ частота дыхания снижается, а объемные параметры спирограмм закономерно не меняются. Наблюдаемые реакции свидетельствуют о различной роли ГАМК А-рецепторов области КБ в механизмах регуляции ритма и объемных параметров дыхания.
Комплекс бетцингера, паттерн дыхания, гамк а-рецепторы, gaba а-receptors, мусцимол, бикукуллин
Короткий адрес: https://sciup.org/14112956
IDR: 14112956 | УДК: 612.282:612.285
Текст научной статьи Роль ГАМК А-рецепторов комплекса Бетцингера в регуляции дыхания у крыс
Введение. Формирование дыхательного ритма и его регуляция обеспечиваются сложными межнейронными взаимодействиями с участием многих возбуждающих, а также тормозных нейромедиаторов [10, 16, 17, 19]. Важную роль как в формировании нормоп-ноэ, так и в возникновении патологических паттернов дыхания играет гамма-аминомасляная кислота (ГАМК), являющаяся тормозным нейропередатчиком, широко распространенным в центральной респираторной нейросети [1, 6, 24]. Свое действие в различных отделах дыхательного центра ГАМК реализует через две основные группы мембранных рецепторов: ионотропные рецепторы класса ГАМКА и метаботропные рецепторы класса ГАМКВ [20, 22, 23]. В настоящее время актуальными аспектами нейрохимии дыхания являются изучение значения ГАМКергической медиации и анализ роли разных классов ГАМК-рецепторов, представленных на уровне функционально специфических отделов дыхательного центра, в меха- низмах модуляции центральной инспираторной и экспираторной активности, регуляции паттерна дыхания [2, 4, 12]. В этом плане особый интерес представляет комплекс Бет-цингера (КБ), образованный популяциями экспираторных и инспираторных нейронов. Среди нейронов КБ в функциональном отношении наиболее значимы экспираторные нейроны типа Е2 [13, 15, 25], которые участвуют в процессах ГАМКергического торможения в пределах всей респираторной нейросети и тем самым вносят вклад в механизмы формирования дыхательной ритмики [5, 26]. Отдельные физиологи на основании результатов введения в КБ агонистов и антагонистов ГАМКА-рецепторов полагают, что этот класс рецепторов непосредственно участвует в респираторном ритмогенезе [9, 20, 21]. Авторы других экспериментальных исследований считают, что опосредованное ГАМКА-рецепторами торможение в пределах КБ у взрослых млекопитающих не имеет существенного значения для генерации нормального дыхательного ритма [22]. Таким образом, на сегодняшний день многие стороны вопроса о роли ГАМКА-рецепторов в регуляции ритма и паттерна дыхания остаются спорными и требуют дальнейшего экспериментального изучения.
Цель исследования. Анализ респираторных реакций при блокаде и стимуляции ГАМК А -рецепторов области комплекса Бет-цингера в условиях in vivo у половозрелых крыс.
Материалы и методы. Эксперименты поставлены на 20 беспородных крысах массой 250–300 г, наркотизированных внутрибрюшинным введением уретана (1,5 г/кг массы), при строгом соблюдении биоэтических правил. Операционная подготовка начиналась с трахеотомии и введения в трахею пластиковой трубки, после чего животных переворачивали спиной вверх, препарировали шейные мышцы и осуществляли доступ к дорсальной поверхности продолговатого мозга через атланто-окципитальное отверстие. Затем на правом боку животного делали разрез кожи от II–III межреберий до нижнего края грудной клетки с целью доступа к дыхательным мышцам. Прооперированных крыс фиксировали в стереотаксической установке СЭЖ-3 и закрепляли голову в положении вентрального сгибания. Тепловое состояние животных поддерживали с помощью электрогрелки.
Блокаду и стимуляцию ГАМК А -рецепто-ров КБ осуществляли путем локального воздействия растворов мусцимола и бикукуллина, которые инъецировали через стеклянную микроканюлю (диаметр кончика 20–25 мкм), укрепленную на игле микрошприца МШ-1 (цена деления 0,02 мкл). Растворы веществ в концентрации 10-6 М готовили ex tempore разведением в искусственной спинномозговой жидкости и вводили в КБ в объеме 0,2 мкл по стереотаксическим координатам [11]. Кончик микроканюли удерживали в мозге в течение всего времени регистрации респираторных эффектов во избежание распространения раствора вверх по треку.
Реакции внешнего дыхания оценивали по изменениям спирограммы, которую регистрировали через трахеотомическую трубку при помощи электронного спирографа с ма- нометрическим датчиком. Выходные сигналы от спирографа подавались на аналоговоцифровой преобразователь, а затем на компьютер, где записывались в виде пневмотахограмм с последующим преобразованием их в спирограммы с помощью программы PowerGraph 3.2 Professional (ООО «Интероптика-С»). Одновременно регистрировали суммарную и интегрированную биоэлектрическую активность диафрагмы и наружных межреберных мышц (НММ), которую отводили с помощью биполярных стальных игольчатых электродов (межэлектродное расстояние 3 мм), подсоединенных к миографическому усилителю. Запись спирограммы и электромиограммы (ЭМГ) осуществляли непрерывно, в т.ч. до начала воздействия фармакологических веществ и в течение 60 мин после их микроинъекции в КБ.
На спирограммах анализировали длительность вдоха и выдоха (с), дыхательный объем (ДО, мл). Расчетным путем определяли частоту дыхания (ЧД, мин-1) и минутный объем дыхания (МОД, мл/мин). На суммарных и интегрированных ЭМГ диафрагмы и НММ определяли длительность залпов инспираторной активности (ДЗ, мс), длительность межзалповых интервалов (МЗИ, мс) и амплитуду залповых разрядов (отн. ед.). Статистическую обработку результатов проводили в программе SigmaStat 3.5 при помощи однофакторного парного t-теста, теста ANOVA, тестов Dunnett’s и Tukey; достоверными считали различия при p<0,05.
Результаты и обсуждение. Характерной реакцией на микроинъекции в КБ раствора ГАМК А -агониста мусцимола было изменение фазовой структуры дыхательного цикла за счет уменьшения времени обеих фаз дыхания. Максимальное уменьшение длительности вдоха регистрировалось в период с 5-й по 50-ю мин после инъекции (рис. 1), при этом вдох укорачивался от 185,55±32,95 (исходный уровень) до 150,37±40,63 мс, или на 18,9 % (p<0,05; ANOVA, Dunnett’s-test). В изменениях длительности выдоха тенденция укорочения имела большую выраженность и достигала статистической значимости уже с 1-й мин после микроинъекции мусцимола, что может отражать особую роль
ГАМКА-рецепторов в модуляции активности экспираторных нейронов КБ. Как видно из рис. 1, наибольшее изменение фазы выдоха было приурочено к 35-50-й мин экспозиции, когда параметр снижался от 779,06±170,58 (исходное значение) до 597,97±145,98 мс, а наблюдаемый при этом эффект удерживался на уровне 23,2 % (p<0,05; ANOVA, Tukey-test). То есть вызываемые мусцимолом отклонения фазы выдоха характеризовались большей устойчивостью во времени, сохраняясь до конца регистрации.
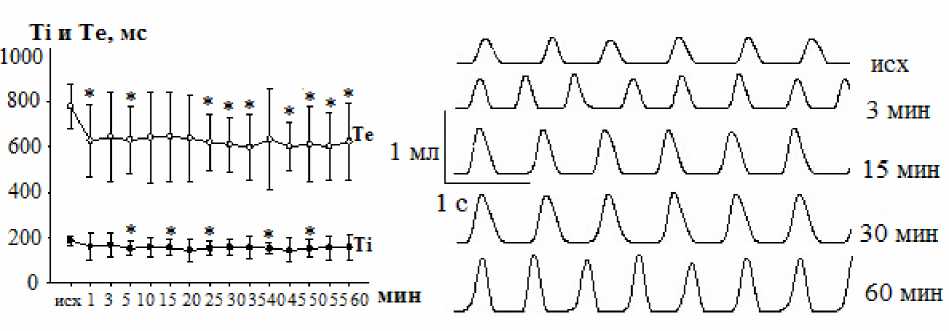
Рис. 1. Изменение длительности вдоха (Ti) и выдоха (Te) после микроинъекции 10-6 М раствора мусцимола в КБ крыс.
Справа – спирограммы.
Обозначения:
исх – исходный уровень; – достоверность отклонений от исходного уровня (p<0,05)
В результате уменьшения длительности вдоха и выдоха при инъекциях мусцимола в КБ был зарегистрирован некоторый рост ЧД. В целом ЧД увеличивалась от 71,10±5,24 (исходный фон) до 83,40±11,92 мин-1 (60-я мин экспозиции), что составляло 17,3 %. Динамика роста ЧД у животных в условиях активации ГАМК А -рецепторов области КБ мусцимолом наглядно представлена оригинальными спирограммами на рис. 1.
Анализ спирограмм показал, что микроинъекции мусцимола в КБ вызывали увеличение ДО. Исходное значение ДО равнялось 0,25±0,03 мл, на 1-й мин достигало 0,31±0,05 мл, что соответствовало приросту на 24,0 % (p<0,05; Dunnett’s-test; Tukey-test), в дальнейшем эффект мог увеличиваться. Сочетание увеличения ЧД и ДО определило направленность отклонений такого показателя, как МОД. До микроинъекции мусцимола в КБ величина МОД равнялась 17,65±4,63 мл/мин, на 1-й мин воздействия она возрастала до
23,45±7,65 мл/мин, а на 45-й мин – до 25,12±8,69 мл/мин. Выраженность эффекта при этом составляла соответственно 32,9 и 42,3 % (p<0,05; парный t-test, Dunnett’s-test).
В полном соответствии с увеличением глубины дыхания, начиная с 1-й мин воздействия ГАМК А -агониста на КБ, отмечалось повышение амплитуды активности инспираторных мышц. Причем на ЭМГ НММ амплитуда осцилляций увеличивалась на 25,4 % (p<0,05; ANOVA), что было почти в 2 раза сильнее, чем реакции диафрагмы. Изменения временных параметров ЭМГ совпадали с динамикой длительности фаз дыхания, т.е. при введении мусцимола в КБ происходило укорочение ДЗ (на 16,2 и 23,4 %; p<0,01) и МЗИ (на 27,6 и 28,1 %; p<0,01) на ЭМГ диафрагмы и НММ. Иллюстрацией наблюдаемых реакций инспираторных мышц служат оригинальные ЭМГ, зарегистрированные у крыс в исходном состоянии и в разные сроки после микроинъекции мусцимола в КБ (рис. 2).
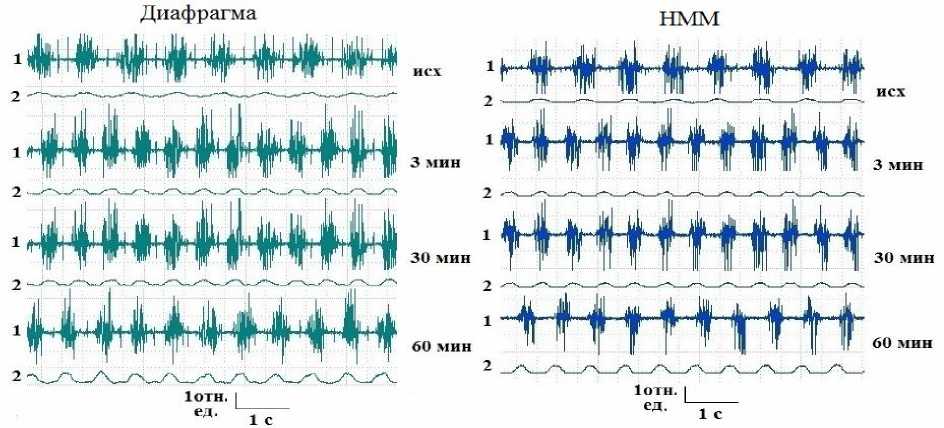
Рис. 2. Суммарные (1) и интегрированные (2) ЭМГ диафрагмы и НММ, зарегистрированные до и в разные сроки после микроинъекции 10-6 М раствора мусцимола в КБ крыс
При микроинъециях в КБ раствора ГАМК А -блокатора бикукуллина изменения большинства показателей паттерна дыхания, а также отдельных параметров ЭМГ инспираторных мышц имели характер, противоположный реакциям на введение ГАМК А -аго-ниста мусцимола. Главным отличием респираторных эффектов блокады ГАМК А -рецеп-торов КБ от эффектов их активации было пролонгирование инспираторной и экспираторной фаз дыхательного цикла.
Длительность вдоха достоверно увеличивалась с 1-й мин после микроинъекции бикукуллина, и этот эффект сохранялся в течение всего времени наблюдений. Именно на 1-й мин воздействия ГАМК А -блокатора отмечалась максимальная реакция, которая составляла 16,1 % (p<0,05; парный t-test) от исходного фона. В указанное время вдох увеличивался от 145,90±37,02 до 169,46±48,14 мс (рис. 3). Длительность выдоха после введения бикукуллина в КБ также увеличивалась, но этот эффект нарастал во времени. До введения бикукуллина длительность экспирации составляла 618,74±109,64 мс, на 30-й мин – 720,50±137,43 мс, а на 45-й мин достигала 774,44±133,48 мс, что соответствовало увеличению на 25,2 % (p<0,05; парный t-test) от исходного значения.
ЧД в ответ на инъекцию бикукуллина в КБ снижалась в среднем на 12,7 % (p<0,05; парный t-test) в интервале с 5-й по 30-ю мин (рис. 3). Отмечаемая реакция, как и в случае действия агониста, формировалась за счет преимущественного изменения длительности экспираторной фазы.
Изменения объемов дыхания на этом фоне имели бифазический характер. Так, в первые минуты после микроинъекции бикукуллина в КБ величины ДО и МОД отклонялись от исходных значений главным образом в сторону уменьшения (1–15-я мин), а в последующие сроки (20–60-я мин) эти параметры начинали меняться в сторону увеличения, причем наблюдаемые отклонения не достигали достоверного уровня. То есть выраженность изменений объемных параметров паттерна дыхания при блокаде ГАМК А -рецеп-торов КБ была заметно ниже, чем при их активации.
Амплитуда осцилляций на ЭМГ диафрагмы при инъекциях бикукуллина в КБ достоверно увеличивалась на 21,8 % (p<0,01; парный t-test). Что касается амплитуды ЭМГ НММ, то она, напротив, уменьшалась на 12,1 % (p<0,05; парный t-test). Также отсутствовало совпадение в характере изменений временных параметров ЭМГ диафрагмы и
НММ. Так, для ЭМГ диафрагмы было характерно нарастающее по мере действия ГАМКА-блокатора увеличение ДЗ и МЗИ, которые в начале наблюдений возрастали соответственно на 19,6 и 13,5 % (p<0,05; парный t-test). На ЭМГ межреберных мышц отмеча- лось укорочение ДЗ и МЗИ в среднем на 12,8 и 10,0 % (p<0,05; парный t-test), при этом изменения МЗИ сохранялись на достоверном уровне в течение всего времени действия ГАМКА-блокатора.
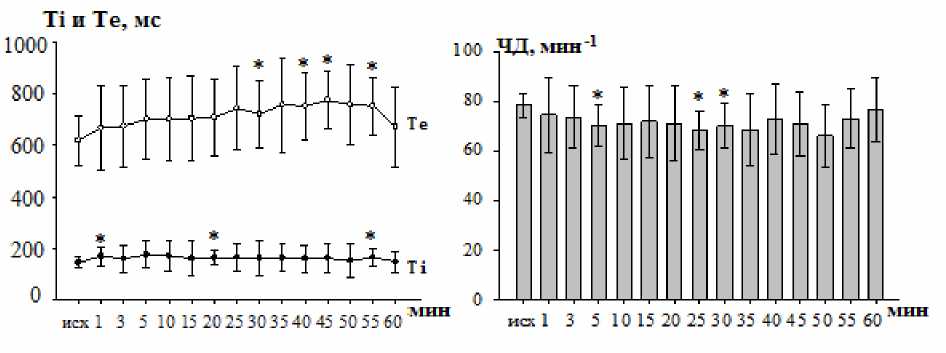
Рис. 3. Изменение длительности вдоха (Ti), выдоха (Te) и частоты дыхания после микроинъекции 10-6 М раствора бикукуллина в КБ крыс.
Обозначения: исх – исходный уровень; * – достоверность отклонений от исходного уровня (p<0,05)
Реакции внешнего дыхания и инспираторных мышц, наблюдаемые при активации и блокаде ГАМКА-рецепторов КБ, свидетельствуют об их участии на уровне указанного отдела дыхательного центра в опосредовании модулирующих влияний эндогенной ГАМК на частоту и глубину дыхания у половозрелых крыс. Обращает внимание, что отклонения большинства анализируемых параметров спирограмм и ЭМГ дыхательных мышц при изменении уровня активности ГАМКА-рецеп-торов КБ развивались с относительно короткими латентными периодами. Это, вероятно, объясняется принадлежностью ГАМКА-ре-цепторов к ионотропным мембранным сайтам, которые характеризуются высокой скоростью активации [3, 7, 8]. Также следует отметить, что ГАМКА-агонист мусцимол при инъекциях в КБ вызывал значительное укорочение фазы выдоха и коррелирующее с этим уменьшение межзалповых интервалов на ЭМГ инспираторных мышц. Это служит свидетельством важной роли ГАМКА-рецеп-торов КБ в регуляции ритмики дыхания посредством модуляции активности экспираторных нейронов, широко представленных в области КБ [15, 25, 26]. Тесная связь ГАМКА-рецепторов с регуляцией экспираторной фазы была ранее показана в условиях in vitro при регистрации инспираторной и экспираторной активности, отводимой от спинальных корешков у препаратов мозгового ствола – спинного мозга новорожденных крыс при воздействии бикукуллина и пикротоксина [18].
В плане конкретизации роли ГАМКА-рецепторов КБ в респираторном контроле представляют интерес результаты их блокады бикукуллином. Необходимо подчеркнуть, что выключение ГАМКА-рецепторов КБ не вызывало закономерных изменений объемных параметров паттерна внешнего дыхания, но в то же время приводило к достоверному изменению фаз дыхательного цикла. Этот эффект был противоположен действию мусцимола, т.е. проявлялся пролонгированием, причем особенно выраженно менялась фаза выдоха, что можно связывать с блокадой постсинаптических ГАМКА-рецепторов. Согласно литературными данным, у взрослых млекопитающих бикукуллин уменьшает величину тормозного постсинаптического потенциала во второй фазе экспирации (фазе Е2) у инспираторных и постинспираторных нейронов, во время всей экспирации – у поздних инспираторных нейронов, а во время инспирации – у экспираторных нейронов [17]. На- личие ГАМКА-рецепторов, чувствительных к бикукуллину и способных менять нейрональную возбудимость, было показано в опытах на препаратах мозгового ствола для экспираторных нейронов комплекса пре-Бетцин-гера [23].
На наш взгляд, наблюдаемое при инъекции бикукуллина в КБ увеличение длительности фаз вдоха и выдоха может быть обусловлено тем, что при блокаде ГАМК А -рецепторов меняется активность ритмогенерирующих респираторных нейросетей и интенсивность разрядов премоторных и моторных нейронов дыхательных мышц. Следует заметить, что другими исследователями факт участия ГАМК А -рецепторов в регуляции активности межреберных мышц у крыс был продемонстрирован в условиях in vitro [18]. В наших опытах это подтверждается снижением ЧД и характером отклонений амплитудных параметров ЭМГ диафрагмы и НММ. Надо подчеркнуть, что изменения амплитуды ЭМГ диафрагмы по направленности отклонений (увеличение) при действии бикукуллина на КБ совпадали с эффектом действия мусцимола, тогда как амплитуда ЭМГ НММ при введении бикукуллина и мусцимола менялась противоположным образом (уменьшалась и увеличивалась соответственно). В целом, полученные данные дают основание считать, что при блокаде ГАМК А -рецепторов КБ в большей степени меняется функциональное состояние бульбарных механизмов, управляющих активностью инспираторных межреберных мышц. Различный характер отклонений амплитуды залповых разрядов диафрагмы и НММ на фоне блокады ГАМК А -рецепторов может отчасти объяснить отсутствие закономерных реакций со стороны объемных параметров спирограмм.
Оценивая респираторные эффекты, вызываемые инъекциями мусцимола и бикукуллина, можно указать, что эффективность и результат их действия зависят как от состояния ионных каналов, в которых находятся ГАМКА-рецепторы [3], так и от набора субъединиц в рецепторах [8]. Субъединичный состав ГАМКА-рецепторов, а также их вне- и внутрисинаптическая локализация определяют физиологические свойства и кинетику мембранно-ионных процессов и, таким образом, конечный результат взаимодействия с агонистами и блокаторами [7, 14].
Заключение. На основании полученных данных можно заключить, что ГАМК А -ре-цепторы области КБ в большей степени включены в процессы формирования фазовой структуры дыхательного цикла и в меньшей степени – в механизмы регуляции глубины дыхания. С учетом того что при стимуляции и блокаде ГАМК А -рецепторов КБ какой-либо дезорганизации ритма дыхания у экспериментальных животных не наблюдалось, следует полагать, что у взрослых крыс действие лиганда через ионотропные ГАМК А -рецепто-ры КБ сводится не столько к формированию ритма, сколько к модуляции его частоты.
-
1. Александрова Н. П. Влияние гамма-аминомасляной кислоты на инспираторно-тормозящий рефлекс Геринга–Брейера / Н. П. Александрова, В. Г. Александров, Т. Г. Иванова // Рос. фи-зиол. журн. им. И. М. Сеченова. – 2008. – Т. 94, № 12. – С. 1356–1364.
-
2. Ведясова О. А. Реакции дыхания при микроинъекции ГАМК и пенициллина в различные отделы вентральной респираторной группы / О. А. Ведясова, А. М. Ковалев // Бюл. экспериментальной биологии и медицины. – 2012. – Т. 153, № 2. – С. 137–140.
-
3. Калуев А. В. Как организован хлорный ионофор ГАМК-А рецептора? / А. В. Калуев // Нейронауки. – 2006. – № 3 (5). – С. 31–43.
-
4. Реакции дыхания на введение агонистов ГАМКергических рецепторов / И. А. Тараканов [и др.] // Бюл. сибирской медицины. – 2005. – Т. 4 (прил. 1). – С. 47–48.
-
5. Alheid G. F. The chemical neuroanatomy of breathing / G. F. Alheid, D. R. McCrimmon // Respir. Physiol. Neurobiol. – 2008. – Vol. 164. – P. 3–11.
-
6. Association of GABA(B)R1 receptor gene polymorphism with obstructive sleep apnea syndrome / Y. A. Bayazit [et al.] // ORL. J. Otorhinolaryngol. Relat. Spec. – 2007. – Vol. 69, № 3. – Р. 190–197.
-
7. Banks M. I. Kinetic differences between synaptic and extrasynaptic GABA(A) receptors in CA1 pyramidal cells / M. I. Banks, R. A. Pearce // J. Neurosci. – 2000. – Vol. 20, № 3. – P. 937–948.
-
8. Bianchi M. T. Structural determinants of fast desensitization and desensitization-deactivation coupling in GABAa receptors / M. T. Bianchi, K. F. Haas, R. L Macdonald // J. Neurosci. – 2001. – Vol. 21, № 4. – P. 1127–1136.
-
9. Blockade of synaptic inhibition within the pre-Bötzinger complex in the cat suppresses respira-
tory rhythm generation in vivo / О. Pierrefiche [et al.] // J. Physiol (Lond.). – 1998. – Vol. 509. – Р. 245–254.
-
10. Bou-Flores C . Gap junctions and inhibitory synapses modulate inspiratory motoneuron synchronization / C. Bou-Flores, A. J. Berger // J. Neurophysiol. – 2001. – Vol. 85. – P. 1543–1551.
-
11. Chitravanshi V. C. Phrenic nerve responses to chemical stimulation of the subregions of ventral medullary neuronal group in the rat / V. C. Chitra-vanshi, H. N. Sapru // Brain Res. – 1999. – Vol. 821, № 2. – P. 443–446.
-
12. Differential ontogeny of GABA(B)-receptor-mediated pre- and postsynaptic modulation of GABA and glycine transmission in respiratory rhythmgenerating network in mouse / W. Zhang [et al.] // J. Physiol. – 2002. – Vol. 540. – P. 435–446.
-
13. Duffin J. Functional synaptic connections among respiratory neurons / J. Duffin, G.-F. Tian, J. N. Peever // Pespir. Physiol. – 2000. – Vol. 122. – P. 237–246.
-
14. Dynamic mobility of functional GABAA receptors at inhibitory synapses / P. Thomas [et al.] // Nat. Neurosci. – 2005. – Vol. 8. – P. 889–897.
-
15. Feldman J. L. Looking for inspiration: new perspectives on respiratory rhythm / J. L. Feldman, C. A. Del Negro // Nat. Rev. Neurosci. – 2006. – Vol. 7. – Р. 232–242.
-
16. Glycinergic pacemaker neurons in pre-Bötzinger complex of neonatal mouse / C. Morgado-Valle [et al.] // J. Neurosci. – 2010. – Vol. 30. – P. 3634–3639.
-
17. Haji A. Neuropharmacology of control of respiratory rhythm and pattern in mature mammals / A. Haji, R. Takeda, M. Okazaki // Pharmacol. Ther. – 2000. – Vol. 86. – P. 277– 304.
-
18. Iizuka M. GABAA and glycine receptors in regulation of intercostal and abdominal expiratory activity in vitro in neonatal rat / M. Iizuka
// J. Physiol. – 2003. – Vol. 551, № 2. – Р. 617–633.
-
19. Respiratory responses evoked by blockades of ionotropic glutamate receptors within the Bötzinger complex and the pre-Bötzinger complex of the rabbit / D. Mutolo [et al.] // Eur. J. Neurosci. – 2005. – Vol. 21. – Р. 122–134.
-
20. Respiratory responses induced by blockades of GABA and glycine receptors within the Bötzinger complex and the pre-Bötzinger complex of the rabbit / F. Bongianni [et al.] // Brain Res. – 2010. – Vol. 1344. – P. 134–147.
-
21. Ritter B. Early postnatal maturation of GABAA-mediated inhibition in the brainstem respiratory rhythm-generating network of the mouse / B. Ritter, W. Zhang // Eur. J. Neurosci. – 2000. – Vol. 12. – P. 2975–2984.
-
22. Role of inhibition in respiratory pattern generation / W. A. Janczewski [et al.] // J. Neurosci. – 2013. – Vol. 33, № 13. – P. 5454–5465.
-
23. Shao X. M. Respriatory rhythm generation and synaptic inhibition of expiratory neurons in pre-Botzinger complex: differential roles of glycinergic and GABАergic neural transmission / X. M. Shao, J. L. Feldman // J. Neurophysiol. – 1997. – Vol. 77. – P. 1853–1860.
-
24. St-Jacques R. Transient, reversible apnoea following ablation of the pre-Botzinger complex in rats / R. St-Jacques, W. M. St-John // J. Physiol. – 1999. – Vol. 520, № 1. – P. 303–314.
-
25. Sun Q. Firing patterns of pre-Botzinger and Botzinger neurons during hypocapnia in the adult rat / Q. Sun, A. K. Goodchild, P. M. Pilowsky // Brain Res. – 2001. – Vol. 903. – P. 198–206.
-
26. Tian G.-F. Botzinger-complex, bulbospinal expiratory neurons monosynaptically inhibit ventral-group respiratory neurones in the decerebrate rat / G.-F. Tian, J. H. Peever, J. Duffin // Exp. Brain. Res. – 1999. – Vol. 124. – P. 173–180.
ROLE OF THE BETZINGER COMPLEX GABAA-RECEPTORS IN RESPIRATORY CONTROL IN RATS
N.G. Manshina, O.A. Vedyasova
Samara State University
Список литературы Роль ГАМК А-рецепторов комплекса Бетцингера в регуляции дыхания у крыс
- Александрова Н. П. Влияние гамма-аминомасляной кислоты на инспираторно-тормозящий рефлекс Геринга-Брейера/Н. П. Александрова, В. Г. Александров, Т. Г. Иванова//Рос. физиол. журн. им. И. М. Сеченова. -2008. -Т. 94, № 12. -С. 1356-1364.
- Ведясова О. А. Реакции дыхания при микроинъекции ГАМК и пенициллина в различные отделы вентральной респираторной группы/О. А. Ведясова, А. М. Ковалев//Бюл. экспериментальной биологии и медицины. -2012. -Т. 153, № 2. -С. 137-140.
- Калуев А. В. Как организован хлорный ионофор ГАМК-А рецептора?/А. В. Калуев//Нейронауки. -2006. -№ 3 (5). -С. 31-43.
- Реакции дыхания на введение агонистов ГАМКергических рецепторов/И. А. Тараканов [и др.]//Бюл. сибирской медицины. -2005. -Т. 4 (прил. 1). -С. 47-48.
- Alheid G. F. The chemical neuroanatomy of breathing/G. F. Alheid, D. R. McCrimmon//Respir. Physiol. Neurobiol. -2008. -Vol. 164. -P. 3-11.
- Association of GABA(B)R1 receptor gene polymorphism with obstructive sleep apnea syndrome/Y. A. Bayazit [et al.]//ORL. J. Otorhinolaryngol. Relat. Spec. -2007. -Vol. 69, № 3. -Р. 190-197.
- Banks M. I. Kinetic differences between synaptic and extrasynaptic GABA(A) receptors in CA1 pyramidal cells/M. I. Banks, R. A. Pearce//J. Neurosci. -2000. -Vol. 20, № 3. -P. 937-948.
- Bianchi M. T. Structural determinants of fast desensitization and desensitization-deactivation coupling in GABAa receptors/M. T. Bianchi, K. F. Haas, R. L Macdonald//J. Neurosci. -2001. -Vol. 21, № 4. -P. 1127-1136.
- Blockade of synaptic inhibition within the pre-Bötzinger complex in the cat suppresses respiratory rhythm generation in vivo/О. Pierrefiche [et al.]//J. Physiol (Lond.). -1998. -Vol. 509. -Р. 245-254.
- Bou-Flores C. Gap junctions and inhibitory synapses modulate inspiratory motoneuron synchronization/C. Bou-Flores, A. J. Berger//J. Neurophysiol. -2001. -Vol. 85. -P. 1543-1551.
- Chitravanshi V. C. Phrenic nerve responses to chemical stimulation of the subregions of ventral medullary neuronal group in the rat/V. C. Chitravanshi, H. N. Sapru//Brain Res. -1999. -Vol. 821, № 2. -P. 443-446.
- Differential ontogeny of GABA(B)-receptor-mediated pre-and postsynaptic modulation of GABA and glycine transmission in respiratory rhythm-generating network in mouse/W. Zhang [et al.]//J. Physiol. -2002. -Vol. 540. -P. 435-446.
- Duffin J. Functional synaptic connections among respiratory neurons/J. Duffin, G.-F. Tian, J. N. Peever//Pespir. Physiol. -2000. -Vol. 122. -P. 237-246.
- Dynamic mobility of functional GABAA receptors at inhibitory synapses/P. Thomas [et al.]//Nat. Neurosci. -2005. -Vol. 8. -P. 889-897.
- Feldman J. L. Looking for inspiration: new perspectives on respiratory rhythm/J. L. Feldman, C. A. Del Negro//Nat. Rev. Neurosci. -2006. -Vol. 7. -Р. 232-242.
- Glycinergic pacemaker neurons in pre-Bötzinger complex of neonatal mouse/C. Morgado-Valle [et al.]//J. Neurosci. -2010. -Vol. 30. -P. 3634-3639.
- Haji A. Neuropharmacology of control of respiratory rhythm and pattern in mature mammals/A. Haji, R. Takeda, M. Okazaki//Pharmacol. Ther. -2000. -Vol. 86. -P. 277-304.
- Iizuka M. GABAA and glycine receptors in regulation of intercostal and abdominal expiratory activity in vitro in neonatal rat/M. Iizuka//J. Physiol. -2003. -Vol. 551, № 2. -Р. 617-633.
- Respiratory responses evoked by blockades of ionotropic glutamate receptors within the Bötzinger complex and the pre-Bötzinger complex of the rabbit/D. Mutolo [et al.]//Eur. J. Neurosci. -2005. -Vol. 21. -Р. 122-134.
- Respiratory responses induced by blockades of GABA and glycine receptors within the Bötzinger complex and the pre-Bötzinger complex of the rabbit/F. Bongianni [et al.]//Brain Res. -2010. -Vol. 1344. -P. 134-147.
- Ritter B. Early postnatal maturation of GABAA-mediated inhibition in the brainstem respiratory rhythm-generating network of the mouse/B. Ritter, W. Zhang//Eur. J. Neurosci. -2000. -Vol. 12. -P. 2975-2984.
- Role of inhibition in respiratory pattern generation/W. A. Janczewski [et al.]//J. Neurosci. -2013. -Vol. 33, № 13. -P. 5454-5465.
- Shao X. M. Respriatory rhythm generation and synaptic inhibition of expiratory neurons in pre-Botzinger complex: differential roles of glycinergic and GABАergic neural transmission/X. M. Shao, J. L. Feldman//J. Neurophysiol. -1997. -Vol. 77. -P. 1853-1860.
- St-Jacques R. Transient, reversible apnoea following ablation of the pre-Botzinger complex in rats/R. St-Jacques, W. M. St-John//J. Physiol. -1999. -Vol. 520, № 1. -P. 303-314.
- Sun Q. Firing patterns of pre-Botzinger and Botzinger neurons during hypocapnia in the adult rat/Q. Sun, A. K. Goodchild, P. M. Pilowsky//Brain Res. -2001. -Vol. 903. -P. 198-206.
- Tian G.-F. Botzinger-complex, bulbospinal expiratory neurons monosynaptically inhibit ventral-group respiratory neurones in the decerebrate rat/G.-F. Tian, J. H. Peever, J. Duffin//Exp. Brain. Res. -1999. -Vol. 124. -P. 173-180.


