Роль грибов в этиологии массовых кожных поражений у соболя Martes zibellina L. 1758 в Томской области
Автор: Овчинников Р.С., Жигалин А.В., Гайнуллина А.Г., Южаков А.Г., Тютеньков О.Ю., Савинов В.А., Москвитина Н.С., Капустин А.В., Лаишевцев А.И., Гулюкин А.М.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Соболь - природная популяция и разведение
Статья в выпуске: 4 т.58, 2023 года.
Бесплатный доступ
Массовые кожные заболевания у промысловых соболей (Martes zibellina L. 1758) на территории Сибири известны с XVIII века, однако их этиология до сих пор недостаточно изучена. Заболевание поражает до 62 % промысловых соболей, вызывая повреждения кожного покрова, и наносит серьезный экономический ущерб. В настоящей работе впервые установлено, что в этиологии кожного заболевания соболей участвуют кератинофильные грибы-дерматофиты различных видов, часть из которых впервые обнаружена на территории Российской Федерации. Целью работы было выявление и идентификация клинически значимых микроскопических грибов у соболей с проявлениями кожных заболеваний. Патологический материал (волосы, корочки), отбирали с пораженных участков шкур диких соболей ( Martes zibellina ), добытых при пушном промысле сезона 2018-2019 годов в разных районах Томской области. Всего было изучено 28 образцов патологического материала. Микологическое исследование включало тест с лампой Вуда, прямую микроскопию патологического материала, посев на микологические среды с последующей идентификацией выделенных культур грибов. Посев проводили на дифференциально-диагностическую среду для дерматофитов ДТМ-Эксперт (ФНЦ ВИЭВ РАН, Россия) и на среду Сабуро с хлорамфениколом («HiMedia Laboratories Pvt. Ltd.», Индия). Посевы инкубировали в аэробных условиях при 26-28 °С, срок инкубирования - до 21 сут. Для изучения культурально-морфологических признаков делали пересев культур уколом на агар Сабуро в чашках Петри, инкубировали 10-14 сут. Для молекулярно-генетической идентификации отбирали изолированные колонии грибов, выращенных на среде Сабуро в течение 10 сут при 26-28 °С. ДНК выделяли с помощью набора GeneJET Plant Genomic DNA Purification Kit («Thermo Fisher Scientific», США) в соответствии с инструкцией изготовителя. Полученную ДНК использовали для проведения полимеразной цепной реакции (ПЦР). Секвенировали участки внутреннего транскрибируемого спейсера гена рибосомальной РНК (ITS). Филогенетический анализ полученных нуклеотидных последовательностей проводили с помощью приложения SeqMan (DNASTAR Lasergene v.7.1.0, https://www.dnastar.com/software/lasergene/). Выравнивание последовательностей с имеющимися в базе данных GenBank выполняли с использованием пакета программ Standard Nucleotide BLAST (http://www.ncbi.nlm.nih.gov/BLAST/). Нуклеотидные последовательности, представляющие особый интерес, депонированы в базе данных GenBank NCBI. При осмотре шкур соболей были обнаружены кожные поражения, которые локализовались в основном в области спины, поясницы, боков и характеризовались выпадением остевых волос, алопециями, образованием корочек и струпьев. Часто в области поражений со стороны мездры имелись темные пятна. Поражения наблюдали как у самцов, так и у самок, преимущественно у молодняка. Образцы патологического материала представляли собой слипшиеся пучки волос (пуховые, реже остевые) с засохшими корочками и чешуйками у основания. Результат люминесцентного теста с лампой Вуда во всех образцах был отрицательным. При микроскопии наблюдали пучки слипшихся пуховых волос и большое количество гнойного дебриса, затрудняющего обнаружение грибных элементов. В результате культурального микологического анализа была выделена 51 культура, идентифицировано 18 таксонов (видов и родов) грибов. При этом из 12 % образцов были изолированы кератинофильные грибы-дерматофиты ( Arthroderma cuniculi , Chryso-sporium carmichaelii , Chrysosporium spp.), вероятно, выступающие в качестве этиологических агентов дерматоза. Рост дерматофитов наблюдался только на селективной дифференциально-диагностической среде ДТМ-Эксперт, на обычных средах росли быстрорастущие недерматофитные грибы. Также были изолированы недерматофитные грибы с кератинолитическим свойствами - Scopulariopsis brevicaulis (16 %), Acremonium spp. (14 %), Aspergillus spp. (36 %), которые могут выступать в качестве вторичных оппортунистических патогенов.
Патогенные грибы, микозы животных, дерматомикозы, дерматофиты, arthroderma, chrysosporium, соболь, martes zibellina
Короткий адрес: https://sciup.org/142239849
IDR: 142239849 | УДК: 636.934.55:591.2 | DOI: 10.15389/agrobiology.2023.4.745rus
Текст научной статьи Роль грибов в этиологии массовых кожных поражений у соболя Martes zibellina L. 1758 в Томской области
В последние десятилетия среди домашних и диких животных отмечают резкий всплеск заболеваемости оппортунистическими микозами. Некоторые микозы высококонтагиозны, способны вызывать летальный исход и поражать значительные популяции в природе (1). Характерные примеры — хитридиомикоз амфибий, синдром белого носа (white nose syndrome, WNS) у рукокрылых, грибковая болезнь змей (snake fungal disease, SFD) (2-4). Ми-когенные инфекции наносят значительный ущерб биоразнообразию природных экосистем. При поражении промысловых животных микозы также приводят к существенным экономическим потерям.
В этой связи важное значение приобретает детальное изучение микобиоты диких животных, которая может быть представлена как контами-нантами и сапробионтами, так и потенциально патогенными видами грибов (патобионтами). При исследовании микробиома человека и животных акцент делается на прокариотах, в то время как грибы изучены в гораздо меньшей степени (5). Видовой состав микобиоты диких животных в Российской Федерации и за рубежом изучен недостаточно (6).
Некоторые представители микобиоты животных могут быть опасны для человека, то есть имеют эпидемиологическое значение. Так, возбудители адиаспиромикоза способны вызывать респираторные микозы (7). В 2015 году обнаружен новый вид Emmonsia spp., вызывающий не только респираторные, но и диссеминированные микозы, при этом отмечен резкий рост заболеваемости (8). В 2018 году в Бразилии было предпринято одно из первых эколого-эпидемиологических исследований по детекции грибных патогенов у диких животных. Грибы обнаружили в 102 из 1063 образцов, в том числе патогенные виды — в 89 образцах (9).
В России важное промысловое значение имеют представители семейства Куньи ( Mustelidae ), куда входят виды с ценным мехом, включая соболя ( Martes zibellina L. 1758).
Первые упоминания о кожном заболевании вольных соболей в Сибири встречались еще в XVIII веке, однако его этиология долгие годы оставалась невыясненной. Заболевание регистрируют по всему ареалу вида. Ми-когенным инфекциям диких соболей посвящена единственная отечественная работа Н.Д. Степаненко, написанная в конце 1960-х годах, длительное время закрытая для читателей и переизданная только в 2007 году (10). В ней описана массовая грибная инфекция соболей, протекающая в форме хронических кожных поражений и наносящая огромный экономический ущерб пушному промыслу. Н.Д. Степаненко с коллегами впервые провели микологическое исследование пораженных шкур. В большинстве образцов были выделены грибы рода Cephalosporium (syn. Acremonium ), которые названы в качестве возбудителей заболевания.
В 1960-е годы кожные дефекты, известные как «оспины», поражали до 70 % промысловых сибирских соболей (10). В настоящее время кожные поражения по-прежнему носят массовый характер. О.Ю. Тютеньков с соавт. (11) провели осмотр более 2 тыс. шкурок соболей в заготовительных организациях, а также анкетный опрос охотников. В объединенной выборке была выявлена значительная доля пораженных шкурок — 53,5±1,1 % (11). По мнению авторов, массовые кожные поражения соболей вызваны грибами, однако надлежащие микологические диагностические исследования до сих пор не проводились.
В настоящей работе впервые установлено, что в этиологии кожного заболевания соболей участвуют кератинофильные грибы-дерматофиты различных видов, часть из которых впервые обнаружена на территории РФ.
Целью работы было выявление и идентификация клинически зна- чимых микроскопических грибов у соболей с проявлениями кожных заболеваний.
Методика. Патологический материал (волосы, корочки) отбирали с пораженных участков шкур диких соболей ( Martes zibellina ), добытых при пушном промысле сезона 2018-2019 годов в различных районах Томской области: Колпашевский район — 3 пробы, Бакчарский район — 19 проб, южные районы (Томский, Кожевниковский и Шегарский) — 6 проб. Всего было изучено 28 образцов патологического материала.
Микологическое исследование включало тест с лампой Вуда, прямую микроскопию патологического материала, посев на микологические среды с последующей идентификацией выделенных культур грибов. Посев проводили на дифференциально-диагностическую среду для дерматофитов ДТМ-Эксперт (ФНЦ ВИЭВ РАН, Россия) и на среду Сабуро с хлорамфениколом («HiMedia Laboratories Pvt. Ltd.», Индия).
Посевы инкубировали в аэробных условиях при 26-28 ° С, срок инкубирования — до 21 сут. Для изучения культурально-морфологических признаков делали пересев культур уколом на агар Сабуро в чашках Петри, инкубировали 10-14 сут. Готовили препараты культур грибов (раздавленная капля) и микроскопировали в сухой системе микроскопа Microoptix MX 100 («West Medica», Австрия) при увеличении ½100 и ½400.
Видовую фенотипическую идентификацию грибов проводили в соответствии с определителем (12).
Для прямой микроскопии готовили препараты патологического материала в 15 % растворе гидроксида калия (КОН) и микроскопировали при ½100 и ½400.
Для молекулярно-генетической идентификации отбирали изолированные колонии грибов, выращенных на среде Сабуро в течение 10 сут при 26-28 ° С. ДНК выделяли с помощью набора GeneJET Plant Genomic DNA Purification Kit («Thermo Fisher Scientific», США) в соответствии с инструкцией изготовителя. Полученную ДНК использовали для проведения полимеразной цепной реакции (ПЦР).
Для апмлификации внутреннего транскрибируемого спейсера рибосомальной РНК (ITS) использовали праймеры (5' ^ 3'): ITSlFwfun TTGGT-CATTTAGAGGAAGTAAAAGTC; ITS1Rvfun CTGCGTTCTTCATCGATGC. Амплификацию (амплификатор DTprime 5, ООО «ДНК-Технологии», Россия) проводили в следующем температурном режиме: 5 мин при 94 ° С; 15 мин при 94 ° С; 20 с при 50 ° С; 20 c при 72 ° С (35 циклов); 5 мин при 72 ° С.
Секвенировали участки внутреннего транскрибируемого спейсера гена рибосомальной РНК (ITS) с теми же праймерами. Секвенирование проводили с помощью набора для секвенирования ДНК Big Dye Terminator v.3.1 Cycle Sequencing Kit («Applied Biosystems», США).
Для секвенирования по двум цепям использовали те же праймеры, что и для ПЦР. Определение нуклеотидной последовательности проводили на автоматическом секвенаторе ABI Prism 3100 («Applied Biosystems», США) по инструкции производителя.
Филогенетический анализ полученных нуклеотидных последовательностей выполняли с помощью приложения SeqMan (DNASTAR Lasergene v.7.1.0, . Для выравнивания последовательностей с имеющимися в базе данных GenBank использовали пакет программ Standard Nucleotide BLAST . Нуклеотидные последовательности, представляющие особый интерес, депонировали в базе данных GenBank NCBI .
Результаты. При осмотре шкур соболей были обнаружены кожные поражения, которые локализовались в основном в области спины, поясницы, боков. Они характеризовались выпадением остевых волос, алопециями, образованием корочек и струпьев. Волосяной покров неравномерной длины, волосы выдергивались пучками. Часто в области поражений со стороны мездры наблюдали темные пятна. Часть поражений была скрыта подшерстком и обнаруживалась при пальпации (бугорки, корочки). Поражения наблюдали как у самцов, так и у самок, преимущественно у молодняка.
При визуальном исследовании образцы патологического материала представляли собой слипшиеся пучки волос (пуховые, реже остевые) с засохшими корочками и чешуйками у основания. Результат люминесцентного теста с лампой Вуда во всех образцах был отрицательный.
При микроскопии наблюдали пучки слипшихся пуховых волос и большое количество гнойного дебриса, затрудняющего обнаружение грибных элементов, из-за чего споры и мицелий грибов в образцах обнаружить не удалось.
В результате культурального микологического анализа 28 образцов патологического материала из 25 проб (89,2 %) были выделены грибы. Всего выделена 51 культура, идентифицировано 18 таксонов (видов и родов) грибов (рис. 1).
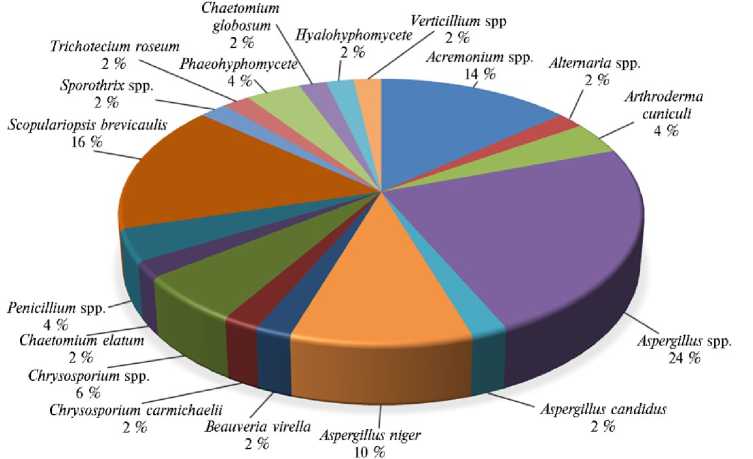
Рис. 1. Таксономический состав и процентное соотношение грибов, выделенных из проб патологического материала с пораженных участков шкур диких соболей ( Martes zibellina L. 1758) (Томская обл., 2018-2019 годы) .
В микобиоте кожных поражений соболей доминировали грибы рода Aspergillus — их доля составила 36 % ( Aspergillus spp. — 24 %, A. niger — 10 %, A. candidus — 2 %). Среди наиболее распространенных видов были также представлены Scopulariopsis brevicaulis (16 %) и Acremonium spp. (14 %). Помимо этого, выделили несколько видов кератинофильных грибов-дерматофитов — Arthroderma cuniculi (4 %), Chrysosporium carmichaelii (2 %), Chryso-sporium spp. (6 %). В общей сложности доля кератинофильных грибов составила 12 %. Доля остальных таксонов грибов — 2-4 % ( Alternaria spp., Beau-veria virella , Chaetomium elatum , Chaetomium globosum , Penicillum spp., Sporothrix spp., Trichotecium roseum , Verticillium spp., Phaehyphomycete , Hyalohyphomycete ).
Встречаемость грибов составляла от 0 до 4 видов в одном образце. Из большинства проб выделили по два вида. Особый интерес представляют два изолята грибов-дерматофитов (изоляты ¹ 1.1-19 и ¹ 3.11-19), изна чально идентифицированных по морфологическим признакам как Trichophyton spp. Оба изолята были выделены от соболей из Бакчарского района. На 7-9-е сут роста оба изолята вызывали покраснение среды ДТМ-Эксперт, формировали белые бархатисто-порошистые колонии, присущие грибам- дерматофитам (рис. 2).
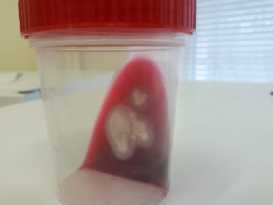
Рис. 2. Рост дерматофита Trichophyton spp. ¹ 3.11-19, выделенного из проб патологического материала с пораженных участков шкур диких соболей ( Martes zibell-ina L. 1758), на селективной среде ДТМ-Эксперт.
При пересеве уколом на агар Сабуро наблюдали белые бархатисто-шерстистые колонии, слегка выпуклые, края реснитчатые, гиалиновые. Обратная сторона колоний светло-коричневого цвета. Диаметр колоний составлял 30-40 мм на 14-е сут роста. При микроскопии наблюдали гиалиновый ветвящийся мицелий и многочисленные одноклеточные микроконидии овальной и каплевидной формы. Многоклеточные споры (макроконидии) не встречались. При длительном инкубировании культур наблюдали образование спирально-извитых гиф.
Для уточнения видовой принадлежности провели молекулярно-генетическую идентификация изолятов Trichophyton spp. ¹ 1.1-19 и
¹ 3.11-19 методом секвенирования ITS-региона (табл.).
По результатам ITS-секвенирования, оба изолята Trichophyton spp. (¹ 1.1-19 и ¹ 3.11-19 проявили наибольшую гомологию (соответственно 100 и 97,7 %) со штаммом Trichophyton spp. IFM 41172, выделенным от барсука. Значительное сходство изоляты проявили со штаммом Trichophyton spp. NWHC 44736-43-02-01B, выделенным от гоферовой змеи. Третьим ближайшим гомологом оказался штамм Arthroderma cuniculi CBS 492.71, выделенный от человека (см. табл.). Таким образом, ближайший идентифицированный до вида гомолог для обоих изолятов — Arthroderma cuniculi .
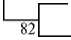
Как видно из дендрограммы, построенной по результатам секвенирования ITS-регионов изолятов A. cuniculi ¹ 1.1-19 и A. cuniculi ¹ 3.11-19 (рис. 3), они образуют отдельный кластер вместе со штаммом Trichophyton spp. IFM 41172, рядом с кластерами трех штаммов A. cuniculi и двух штаммов A. tuberculatum .
Еще один изолят (¹ 3.5-19), предположительно относящийся к дерматофитам, был фенотипически идентифицирован как Chrysosporium spp. При росте на агаре Сабуро наблюдали белые равномерно окрашенные колонии, бархатисто-пушистые, выпуклые, с радиальной складчатостью. Края ровные. Обратная сторона колоний от желтого до светло-коричневого, с радиальными бороздами. Диаметр колоний на 14-е сут роста — 30-40 мм. Культура образовывала многочисленные овальные и округлые микроконидии, присущие роду Chrysosporium. При секвенировании ITS-региона изолят Chrysosporium spp. ¹ 3.5-19 проявил 100 % гомологии со штаммом Chryso-sporium carmichaelii E00083342, выделенным из ногтя человека (GenBank: KC923439.1, .
Кроме трех указанных культур, еще три были идентифицированы на основании морфологических признаков как Chrysosporium spp., однако их видовая принадлежность требует дальнейшего уточнения молекулярными методами.
Результаты BLAST-анализа ITS-сиквенсов изолятов Trichophyton spp. ¹ 1.1-19 и ¹ 3.11-19, выделенных из проб патологического материала с пораженных участков шкур диких соболей ( Martes zibellina L. 1758) (Томская обл., 2018-2019 годы)
Ближайший по гомологии штамм Степень гомологии, % Номер в GenBank, ссылка Источник выделения штамма изолят ¹ 1.1-19 изолят ¹ 3.11-19 Trichophyton sp. IFM 41172. 100,00 97,73 AB458161.1 Барсук (Meles meles) Trichophyton sp. NWHC 44736-43-02-01B 93,24 92,56 KX148667.1 Береговая гоферовая змея (Pituophis catenifer) Arthroderma cuniculi CBS 492.71 90,59 90,94 NR_077138.1 Человек, кожные поражения
991 .4/Z/irot/ermo_ret/effit_strain_23489-01_18S_ribosomal_RNA_gene
991 । Arthroderma redeliii strain CBS 134554 18S ribosomal RNA gene
| I Trichophyton iezv-aOrf strain ШЕМ 2671) i-olatc ISTlAM-ITS ID
____________I /lrZ/iz-ui7c'rma_unanBZtim_slrain_ATCC_28454_18S ribosonial_RNA_gene
100*- Arthroderma_uncinanim_CRS_3 15.65 ITS region from TYPE material
। Arthroderma eboreum sttain DE 1 I I l_0932_18S_ribosomal_RNA_gene __ Arthroderma olidum ITS1 strain NCPF 5088
Arthroderma olidum ITS1 strain NCPF 5069
70 .4',г/|гог/е/7,.'й o//r/Mto ITS1 strain NCPF 5087
- Arthroderma olidum TTS1 strain NCPF 5081
99i Arthroderma thuringiensis CBS 417.71 ITS region from TYPE .МП ’/nr-Nip/nsw zNwn^/e^ nurial 188 rRNA gene ITS 1 5 88 rllNA
Ж
I Arthroderma multifidum stTain CHS 420.7 I smail subunit ribosomal Ar/irotlerffla_mulZl^t/™_ITSl_strain_NCPF_5075
I v4rt/irocIiz™a_muti/M™_ITSl_strain_IMI_125889
991 • Arthroderma cuniadi strain VMZ Sobl.1-19 small subunit ribosomal
■ • v4rZlzro(7erma_cunzculz_strain_VMZ_Sob3.11- 19_small_subunit_ribosomal
100r Arthroderma tuberculatum strain CBS 312.65 small subunit ribosomal
I— ,4rr/irot7erma_ZuZ>e;eutoZ»m_genoniic_DNA_sequence_contains_ITSl_5.8S
Trichophyton sp. NWHC 44736-43-02-01B 18S ribosomal RNA gene
Ж
0,02
r v4rZ/:rot7<,rmti_a/niaz/i_CBS_492.71_ITS_region_from_TYPE_material
] Arthroderma cuniculi 1TS1 strain NCPF 5085
' ^z/zroA™a_cnnjcn/j_ITSl_strain_NCPF_5073
Рис. 3. Филогенетическая дендрограмма, построенная на основе секвенирования ITS-регионов изолятов Arthroderma cuniculi ¹ 1.1-19 и A. cuniculi ¹ 3.11-19 (отмечены кружками) , выделенных из проб патологического материала с пораженных участков шкур диких соболей ( Martes zib-ellina L. 1758) (Томская обл., 2018-2019 годы).
ITS-последовательности трех изолятов дерматофитов, идентифицированных методом секвенирования, были депонированы в международном репозитории GenBank NCBI под номерами MN534766.1 ( A. cuniculi 1.1-19), MN653980.1 ( A. cuniculi 3.11-19), MT556012.1 ( C. carmichaelii 3.5-19).
Клиническая картина кожных поражений соболей в настоящем исследовании во многом схожа с описанием, сделанным ранее другими авторами. Поражения характеризовались как «оспины», «плешины», «коросты», «стриженый и свалявшийся волос», выпадение волос пучками (10). Такие описания характерны для хронического воспалительного процесса. Прямая микроскопия патологического материала была неинформативной из-за большого количества гнойного дебриса. Культуральный метод микологического анализа показал значительное видовое разнообразие грибов, составляющих микобиоту кожных поражений диких соболей. Подавляющее большинство изученных образцов (89,2 %) содержали от 1 до 4 видов грибов.
При этом 88 % выделенных грибов оказались недерматофитными плесневыми грибами. Очевидно, они играют роль контаминантов кожного покрова соболей. Часто встречался вид Scopulariopsis brevicaulis (16 %). Этот вид, хотя и не относится к дерматофитам, обладает кератинолитической активностью (13) и способен вызывать поверхностные микозы человека (14) и животных (15). Выделение от соболей может свидетельствовать об его определенной этиологической значимости в качестве оппортунистического патогена.
Особого внимания заслуживает выделение представителей рода Acre-monium , чья доля составила 14 %. Пробы от некоторых животных содержали по два морфотипа Acremonium spp. (белые и желтые морфотипы). Их видовая принадлежность требует уточнения. Грибы рода Acremonium также обладают кератинолитической активностью (16) и вызывают заболевания человека (17) и животных (15).
В исследовании Н.Д. Степаненко (10) именно грибы рода Acremo-nium (по старой номенклатуре Verticillium) были выделены из большинства образцов и признаны главным этиологическим фактором заболевания. На наш взгляд, этот таксон может играть определенную роль в патогенезе заболевания, но не служит основным (первичным) возбудителем.
Наиболее вероятные возбудители, приводящие к кожным поражениям, — кератинофильные грибы-дерматофиты (пор. Onygenales ), чья доля в микобиоте составила 12 %. Были выделены два изолята Arthroderma cunic-uli , составляющие отдельный кластер наряду со штаммом Trichophyton sp. IFM 41172, полученным от барсука. Молекулярно-генетические особенности выделенных нами штаммов A. cuniculi и их таксономическое положение требуют дальнейшего изучения.
Род Arthroderma (сем. Arthrodermataceae) — наиболее крупный род грибов-дерматофитов, который включает 27 видов (18). Вид A. cuniculi плохо изучен, и пока не вполне ясна его экологическая ниша и клиническая значимость. Он был выделен и впервые описан в 1963 году (19). Его выделяли в единичных случаях как с шерсти, так и из почвы в местах обитания животных, в частности зайцев . Филогенетически близкие изоляты были выделены из кожных поражений змей и дерматофитозного поражения человека , что указывает на патогенный потенциал A. cuniculi. На наш взгляд, этот вид вполне может быть основным этиологическим фактором кожных инфекций соболей. Мы впервые обнаружили A. cuniculi на территории России, также впервые он был выделен от соболей. Возможно, A. cuniculi является зооан-тропофильным и представляет опасность для людей, как и многие другие виды дерматофитов, поражающие животных (20).
Кроме того, от соболей выделили кератинофильные грибы рода Chrysosporium. Один изолят был определен до вида с помощью секвенирования — Chrysosporium carmichaelii. Видовая принадлежность трех других изо-лятов Chrysosporium spp. требует уточнения. Экология вида C. carmichaelii изучена недостаточно. Он был выделен из почвы и пыли (21), от летучих мышей, из человеческого ногтя , что свидетельствует об его патогенном потенциале. Грибы рода Chrysosporium известны как возбудители поверхностных и глубоких микозов человека и животных (22) и могут рассматриваться в качестве возможных возбудителей кожных инфекций у соболей. На территории Российской Федерации вид C. carmichaelii, судя по доступной литературе, выделен впервые.
Важно отметить, что кератинофильные грибы-дерматофиты, такие как A. cuniculi и Chrysosporium spp., прихотливы и медленно растут в культуре, их рост легко подавляют быстрорастущие плесневые грибы. Культуры A. cuniculi удалось получить только на селективной среде для дерматофитов ДТМ-Эксперт, недавно разработанной в ФНЦ ВИЭВ РАН (Москва) (23). Большинство изолятов Chrysosporium spp. также были выделены на среде ДТМ-Эксперт, в то время как на стандартной среде Сабуро их рост, очевидно, ингибировали быстрорастущие плесени.
Мы предполагаем, что из-за отсутствия селективной среды для дерматофитов в исследованиях Н.Д. Степаненко (10) от соболей не удалось выделить грибы-дерматофиты, а были выделены только недерматофитные грибы с преобладанием рода Acremonium, которые приняли за возбудителей инфекции. Хотя в нашей работе доля грибов-дерматофитов составила 12 %, в действительности их распространенность у соболей может быть выше, но далеко не во всех случаях такие грибы удается изолировать из клинического материала. Истинное распространение патогенных грибов может быть изучено в дальнейшем с помощью современных высокочувствительных диагностических техник, в частности метагеномного секвенирования (24).
Существуют лишь единичные публикации, посвященные изучению микобиоты куньих в аспекте различных заболеваний. В Чехословакии среди куньих была диагностирована высокая (от 30 до 73 %) распространенность адиаспиромикоза — респираторного заболевания, вызываемого видами рода Emmonsia (прежде относились к роду Chrysosporium ). Основной возбудитель Emmonsia parva — типичный сапротроф, обитающий в почве, на растительных остатках (25). В Великобритании адиаспиромикоз в дикой природе был диагностирован почти у трети (28 %) обследованных животных разных видов. Основной обнаруженный возбудитель — Emmonsia crescens , способный также поражать человека (26). Нельзя исключать, что виды рода Emmonsia , морфологически близкие к роду Chrysosporium , также циркулируют в популяции сибирских соболей, что может быть выявлено в дальнейших исследованиях.
Следует отметить, что в зарубежной литературе инфекционные болезни соболей освещены очень скудно, поскольку в природе этот вид обитает только на территории России, Казахстана, Монголии, Китая, Кореи и Японии.
Таким образом, от соболей с кожными поражениями, добытых в Томской области, были выделены представители 18 различных таксонов грибов, в том числе кератинофильные грибы-дерматофиты ( Arthroderma cu-niculi, Chrysosporium carmichaelii , Chrysosporium spp.), вероятно, выступающие в качестве этиологических агентов массового дерматоза. Виды A. cuniculi и C. carmichaelii не были диагностированы ранее на территории Российской Федерации, также это первое сообщение об их встречаемости у соболей. Недерматофитные грибы с кератинолитическим свойствами ( Scopulariopsis brevicaulis , Acremonium spp., Aspergillus spp.) могут играть роль вторичных оппортунистических патогенов при этом заболевании. Проведенные исследования продемонстрировали присутствие в дикой природе грибов-дерматофитов, что указывает на необходимость дальнейшего изучения распространенности клинически значимых грибов среди диких животных. Целесообразна разработка комплекса мер борьбы с грибными инфекциями промысловых животных, наносящими значительный экономический ущерб.
Список литературы Роль грибов в этиологии массовых кожных поражений у соболя Martes zibellina L. 1758 в Томской области
- Seyedmousavi S., Bosco S.D.M., De Hoog S., Ebel F., Elad D., Gomes R.R., Jacobsen I.D., Jensen H.E., Martel A., Mignon B., Pasmans F., Piecková E., Rodrigues A.M., Singh K., Vi-cente V.A., Wibbelt G., Wiederhold N.P., Guillot J. Fungal infections in animals: a patchwork of different situations. Medical Mycology, 2018, 56(suppl_1): S165-S187 (doi: 10.1093/mmy/myx104).
- James T.Y., Toledo L.F., Rödder D., da Silva Leite D., Belasen A.M., Betancourt-Román C.M., Jenkinson T.S., Soto-Azat C., Lambertini C., Longo A.V., Ruggeri J., Collins J.P., Burrowes P.A., Lips K.R., Zamudio K.R., Longcore J.E. Disentangling host, pathogen, and environmental deter-minants of a recently emerged wildlife disease: lessons from the first 15 years of amphibian chytridi-omycosis research. Ecology and Evolution, 2015, 5(18): 4079-4097 (doi: 10.1002/ece3.1672).
- Hoyt J.R., Kilpatrick A.M., Langwig K.E. Ecology and impacts of white-nose syndrome on bats. Nature Reviews Microbiology, 2021, 19(3): 196-210 (doi: 10.1038/s41579-020-00493-5).
- Davy C.M., Shirose L., Campbell D., Dillon R, McKenzie C., Nemeth N., Braithwaite T., Cai H., Degazio T., Dobbie T., Egan S., Fotherby H., Litzgus J. D., Manorome P., Marks S., Paterson J. E., Sigler L., Slavic D., Slavik E., Urquhart J., Jardine C. Revisiting ophidiomycosis (snake fungal disease) after a decade of targeted research. Frontiers in Veterinary Science, 2021, 8: 665805 (doi: 10.3389/fvets.2021.665805).
- Ross A.A., Rodrigues Hoffmann A., Neufeld J.D. The skin microbiome of vertebrates. Microbi-ome, 2019, 7: 79 (doi: 10.1186/s40168-019-0694-6).
- Williams C.L., Caraballo-Rodríguez A.M., Allaband C., Zarrinpar A., Knight R., Gauglitz J.M. Wildlife-microbiome interactions and disease: exploring opportunities for disease mitigation across ecological scales. Drug Discovery Today: Disease Models, 2018, 28: 105-115 (doi: 10.1016/j.ddmod.2019.08.012).
- Anstead G.M., Sutton D.A., Graybill J.R. Adiaspiromycosis causing respiratory failure and a review of human infections due to Emmonsia and Chrysosporium spp. Journal of Clinical Microbiology, 2012, 50(4): 1346-1354 (doi: 10.1128/JCM.00226-11).
- Schwartz I.S., Kenyon C., Feng P., Govender N.P., Dukik K., Sigler L., Jiang Y., Stielow J.B., Muñoz J.F., Cuomo C.A., Botha A., Stchigel A.M., de Hoog G.S. 50 years of emmonsia disease in humans: the dramatic emergence of a cluster of novel fungal pathogens. PLoS Pathogens, 2015, 11(11): e1005198 (doi: 10.1371/journal.ppat.1005198).
- Losnak D.O., Rocha F.R., Almeida B.S., Batista K.Z.S., Althoff S.L., Haupt J., Ruiz L.S., Anversa L., Lucheis S.B., Paiz L.M., Donalisio M.R., Richini Pereira V.B. Molecular detection of fungi of public health importance in wild animals from Southern Brazil. Mycoses, 2018, 61(7): 455-463 (doi: 10.1111/myc.12767).
- Степаненко Н.Д. Кожное заболевание соболей в природных условиях. Киров, 2007.
- Тютеньков О.Ю., Соколова Н.М., Трифонова М.Г. Дерматомикоз соболя (Martes zibellina) Томского Приобья. Териофауна России и сопредельных территорий: международное совещание: Х съезд Териологического общества при РАН. М., 2016: 433.
- de Hoog G.S., Guarro J., Gené J., Figueras M.J. Atlas of clinical fungi. CBS, Utrecht, 2000.
- Anbu P., Gopinath S.C.B., Hilda A., Mathivanan N., Annadurai G. Secretion of keratinolytic enzymes and keratinolysis by Scopulariopsis brevicaulis and Trichophyton mentagrophytes: regression analysis. Canadian Journal of Microbiology, 2006, 52(11): 1060-1069 (doi: 10.1139/W06-067).
- Tosti A., Piraccini B., Stinchi C., Lorenzi S. Onychomycosis due to Scopulariopsis brevicaulis: clinical features and response to systemic antifungals. The British Journal of Dermatology, 1996, 135(5): 799-802 (doi: 10.1111/J.1365-2133.1996.TB03895.X).
- Маноян М.Г., Овчинников Р.С. Микобиота кожных поражений животных. Тез. докл. «Современная микология в России: Первый съезд микологов России». М., 2002: 414-415.
- Rodrigues Marcondes N., Ledesma Taira C., Cirena Vandresen D., Estivalet Svidzinski T.I., Kadowaki M.K., Peralta R.M. New feather-degrading filamentous fungi. Microbial Ecology, 2008, 56(1): 13-17 (doi: 10.1007/s00248-007-9319-x).
- Perdomo H., Sutton D.A. García D., Fothergill A.W., Cano J., Gené J., Summerbell R.C., Rinaldi M.G., Guarro J. Spectrum of clinically relevant Acremonium species in the United States. Journal of Clinical Microbiology, 2011, 49(1): 243-256 (doi: 10.1128/JCM.00793-10).
- Hainsworth S., Kučerová I., Sharma R., Cañete-Gibas C.F., Hubka V. Three-gene phylogeny of the genus Arthroderma: basis for future taxonomic studies. Medical Mycology, 2021, 59(4): 355-365. (doi: 10.1093/mmy/myaa057).
- Dawson C.O. Two new species of Arthroderma isolated from soil from rabbit burrows. Sabouraudia, 1963, 2(3): 185-191 (doi: 10.1080/00362176385190301).
- Baumbach C.M., Müller S., Reuschel M., Uhrlaß S., Nenoff P., Baums C.G., Schrödl W. Iden-tification of zoophilic dermatophytes using MALDI-TOF mass spectrometry. Frontiers in Cellular and Infection Microbiology, 2021, 11: 631681 (doi: 10.3389/fcimb.2021.631681).
- Zaki S.M., Mikami Y., El-Din A.A.K., Youssef Y.A. Keratinophilic fungi recovered from muddy soil in Cairo Vicinities, Egypt. Mycopathologia, 2005, 160(3): 245-251 (doi: 10.1007/S11046-005-0143-X).
- Ovchinnikov R.S., Vasyliev D.B. Pathogenic chrysosporium-related fungi in reptiles and other animals. In: Recent trends in human and animal mycology /K. Singh, N. Srivastava (eds.). Springer, Singapore, 2019: 47-80 (doi: 10.1007/978-981-13-9435-5_3).
- Savinov V.A., Ovchinnikov R.S., Kapustin A.V., Laishevtcev A.I., Gulykin A.M. Development of a differential diagnostic nutrient medium for the express diagnosis of animal dermatophytosis In: IOP Conference Series: Earth and Environmental Science. V. 315. IOP Publishing, 2019, 315(2): 022071 (doi: 10.1088/1755-1315/315/2/022071).
- Dekker J.P. Metagenomics for clinical infectious disease diagnostics steps closer to reality. Journal of Clinical Microbiology, 2018, 56(9): e00850-18 (doi: 10.1128/JCM.00850-18).
- Křivanec K., Otčenášek M. Importance of free living mustelid carnivores in circulation of adiaspiromycosis. Mycopathologia, 1977, 60(3): 139-144.
- Borman A.M., Simpson V.R., Palmer M.D., Linton C.J., Johnson E.M. Adiaspiromycosis due to Emmonsia crescens is widespread in native British mammals. Mycopathologia, 2019, 168(4): 153-163 (doi: 10.1007/s11046-009-9216-6).


