Роль химиолучевой терапии в лечении нейроэндокринного рака прямой кишки: серия клинических наблюдений
Автор: Гордеев С.С., Сейдинович А., Нагуслаева А.А., Поликарпова С.Б., Мамедли З.З.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 4 т.21, 2022 года.
Бесплатный доступ
Цель исследования - оценка эффективности предоперационной лучевой терапии (ЛТ) у пациентов НЭО прямой кишки g2-g3. Материал и методы. Ретроспективное изучение историй болезней пациентов, проходивших лечение в НМИЦ онкологии им. Н.Н. Блохина в период с 2000 по 2020 г. с запросом МКБ-Х: МКБ-0 1.4.1 8249/3, 82401, 8240/1, 8240/3.1, 8240/3, 82403, 82443, 8045/3.2, 8013/3, 80123, 85103, 8510/3, 8041/3.3, 80413, 8041/3, 8246/3, 8240/3.2 и МКБ-Х С20, С21.1. Критерии включения больных в исследование: гистологически верифицированные нейроэндокринные опухоли прямой кишки и анального канала g2 и g3 степени злокачественности (Ki67>3 %), которым проведена предоперационная лучевая (ЛТ) или химиолучевая терапия (ХЛТ). Из исследования исключали пациентов, которым проводили ЛТ/ХЛТ с паллиативной целью, а также больных с первично-множественными синхронными или метахронными опухолями, пациентов с нерезектабельными метастазами в печени. Стадирование осуществляли на основании данных МРТ малого таза, КТ грудной клетки и брюшной полости с внутривенным контрастированием. Основным анализируемым параметром была частота ответа на лечение по критериям Recist, дополнительными - частота лечебного патоморфоза по dWoRaK, общая и безрецидивная выживаемость. Статистический анализ проводили с использованием пакета программ iBm spss (версия 25). Результаты. Медиана наблюдения составила 24 мес. Пациент с полным клиническим ответом нейроэндокринного рака g3 на лечение наблюдается в течение 64 мес без признаков прогрессирования. Пятилетняя ОВ и БРВ пациентов с НЭО прямой кишки g2-g3 составили 64,3 и 53,6 % соответственно. Заключение. Удалось добиться долгосрочной выживаемости без прогрессирования опухолевого процесса у 2 из 3 пациентов с нейроэндокринным раком g3 (у 1 из них - со стойким полным клиническим ответом на лечение) и у 3 из 4 пациентов с нейроэндокринными опухолями g2.
Нейроэндокринный рак прямой кишки, лучевая терапия, химиолучевая терапия
Короткий адрес: https://sciup.org/140295373
IDR: 140295373 | УДК: 616.351-006.6-08:615.28+615.849.1 | DOI: 10.21294/1814-4861-2022-21-4-90-97
Текст научной статьи Роль химиолучевой терапии в лечении нейроэндокринного рака прямой кишки: серия клинических наблюдений
Нейроэндокринные опухоли (НЭО) прямой кишки G2 и G3 – редкие злокачественные новообразования. В научной литературе описано небольшое число серий клинических наблюдений. Основной метод лечения – хирургический, однако из-за отсутствия уверенности в выполнимости резекции R0 часто встает вопрос о предоперационном лечении. При этом эффективность неоадъювантной терапии при нейроэндокринных опухолях прямой кишки G2-G3 не изучена. Существует небольшое число статей, отражающих влияние лучевой терапии (ЛТ) и химиолучевой терапии (ХЛТ) нейроэндокринного рака прямой кишки в составе комплексной терапии.
Целью исследования явилась оценка эффективности предоперационной химиолучевой терапии у пациентов с нейроэндокринными опухолями прямой кишки G2-G3.
Материал и методы
Исследование основано на ретроспективном изучении историй болезни пациентов, проходивших лечение в НМИЦ онкологии им. Н.Н. Блохина в период с 2000 по 2020 г. По кодам МКБ-0 1.4.1 8249/3, 82401, 8240/1, 8240/3.1, 8240/3, 82403, 82443, 8045/3.2, 8013/3, 80123, 85103, 8510/3, 8041/3.3, 80413, 8041/3, 8246/3, 8240/3.2 и МКБ-Х С20, С21.1 был отправлен запрос в архив на отбор историй болезни пациентов за период 2000–20 гг. Критериями включения в исследуемую группу были: гистологически верифицированные нейроэндокринные опухоли прямой кишки и анального канала с G2 и G3 степенями злокачественности (Ki67>3 %), по поводу которых проведена предоперационная ЛТ или ХЛТ. Из исследования исключали пациентов, которым проводили ЛТ/ХЛТ с паллиативной целью, пациентов с первично-множественными синхронными или метахронными опухолями, а также пациентов с нерезектабельными метастазами в печени. Ста-дирование осуществляли на основании данных МРТ малого таза, КТ грудной клетки и брюшной полости с внутривенным контрастированием.
Лучевую терапию проводили с использованием технологий трехмерной конформной лучевой терапии (3D-CRT, до 2010 г.) или ЛТ с модуляцией интенсивности (IMRT, после 2010 г.). Объем об- лучения включал прямую кишку с мезоректальной клетчаткой и регионарные, тазовые лимфатические узлы. РОД составляла 2 Гр, СОД 44 Гр на зону регионарного метастазирования, СОД 50–52 Гр ‒ на первичную опухоль. На фоне ЛТ проводили химиотерапию капецитабином 825 мг/м2 2 раза в сутки per os в дни ЛТ. Эффект ЛТ оценивали по результатам МРТ малого таза через 8–14 нед после завершения ЛТ/ХЛТ.
Основным анализируемым параметром была частота ответа на лечение по критериям RECIST, дополнительными – частота лечебного патоморфоза по DWORAK, общая и безрецидив-ная выживаемость. Все данные о выживаемости были рассчитаны с момента постановки диагноза до смерти (общая выживаемость) или смерти/ прогрессирования (безрецидивная выживаемость, в зависимости от того, какое событие наступит раньше). Сравнение показателей выживаемости между пациентами проводилось с использованием лог-рангового теста методом Каплана–Мейера. Статистический анализ проводили с использованием пакета программ IBM SPSS (версия 25).
Результаты
Всего по запросу в архиве было идентифицировано 312 историй болезни. После удаления дублирующихся записей (повторное взятие биопсии у одного и того же пациента) осталось 277 историй болезни. В дальнейшем 189 из них было исключено по следующим причинам: 136 – нейроэндокринные опухоли G1, 39 – отсутствие историй болезни в архиве (потерянные истории болезни и пациенты, обратившиеся только для получения второго мнения), 14 – диагноз НЭО опровергнут после повторного взятия биопсии или проведения хирургического вмешательства. Данные оставшихся 88 пациентов были внесены в реестр редких заболеваний Российского общества специалистов по колоректальному раку (РОСКР). Из этих 88 пациентов у 39 опухоль локализовалась в прямой кишке, у 30 исходно была неметастатическая форма заболевания или исходно резектабельные метастазы в печени, и только 7 больных получали предоперационную ЛТ или ХЛТ.
В итоге в исследование включено 7 пациентов. У 2 (28,6 %) пациентов выявлена II стадия забо-
Таблица 1/Table 1
Характеристика исследуемой группы Features of the study group
|
Характеристика/Features |
Число больных/Number of patients (n=7) |
|
Возраст (медиана, мин-макс), лет/Age, (median, min-max), years |
59 (33–66) |
|
Пол/Sex |
|
|
Мужчины/Men |
3 (43 %) |
|
Женщины/Female |
4 (57 %) |
|
Локализация/Localization |
|
|
Верхнеампулярный отдел/Upper ampullar department |
1 (14 %) |
|
Среднеампулярный отдел/Middle ampullar department |
2 (29 %) |
|
Нижнеампулярный отдел/Lower ampullar department |
3 (43 %) |
|
Анальный канал/Anal canal |
1 (14 %) |
|
Стадия опухолевого процесса/Stage of the tumor process |
|
|
IIA |
1 (14 %) |
|
IIB |
1 (14 %) |
|
IIIB |
4 (58 %) |
|
IV |
1 (14 %) |
|
Стадия опухоли по критерию Т/Stage of the tumor according to the criterion T |
|
|
T2 |
1 (14 %) |
|
T3 |
4 (57 %) |
|
T4 |
2 (29 %) |
Стадия опухоли по критерию N/Stage of the tumor according to the criterion N
|
N0 |
2 (29 %) |
|
N1 |
5 (71 %) |
|
Ki67 |
|
|
G2 |
4 (57 %) |
|
G3 |
3 (42 %) |
|
Медиана прослеженности, мес/Median follow-up, months |
57,1 (9–104,1) |
При оценке эффективности лечения частота ответа по RECIST составила (табл. 2): полный ответ – у 1 (14 %), частичный ответ – у 3 (43 %), стабилизация – у 2 (29 %), прогрессирование – у 1 (14 %) больного. У 3 пациентов в группе нейроэндокринного рака G3, получавших лучевую терапию, наблюдалась стабилизация (n=1), частичный ответ (n=1) и полный ответ (n=1). В группе химиотерапии частичный ответ был у 1 пациента. Частичный или полный ответ достигнут у 3 (75 %) из 4 пациентов с нейроэндокринной опухолью G2 и у 2 (67 %) из 3 пациентов с нейроэндокринной опухолью G3. Прогрессирование отмечалось у пациента с опухолью G2.
Трем пациентам не было проведено хирургическое лечение: у 1 пациента отмечен полный клинический ответ на лечение, принято решение о продолжении наблюдения в рамках протокола «наблюдения и ожидания»; у 2-го пациента в связи с диссеминацией опухолевого процесса в период ожидания реализации эффекта ХЛТ (при этом исходно отмечались метастазы в печени, которые перешли в нерезектабельное состояние, по первичной опухоли ‒ положительная динамика); у 3-го пациента в сентябре 2018 г. отмечено прогрессирование заболевания в виде метастазов в шейных и шейно-надключичных лимфатических узлах слева. По первичной опухоли положительная динамика. С 20.09.18 по 24.09.18 проведена химиотерапия по схеме: иринотекан в дозе 60 мг/м2 (разовая доза – 120 мг) в 1-й, 8-й дни + цисплатин в дозе 60 мг/м2 (разовая доза – 120 мг) в 1-й день. Таким образом, хирургическое вмешательство выполнено 4 (57 %) из 7 пациентов. Во всех случаях резекция кишки выполнена в объеме R0. В связи с этим лечебный патоморфоз (ЛП) оценен у 4 пациентов: ЛП I степени наблюдался в 3 (43 %), 0 степени – в 1 (14 %) случае.
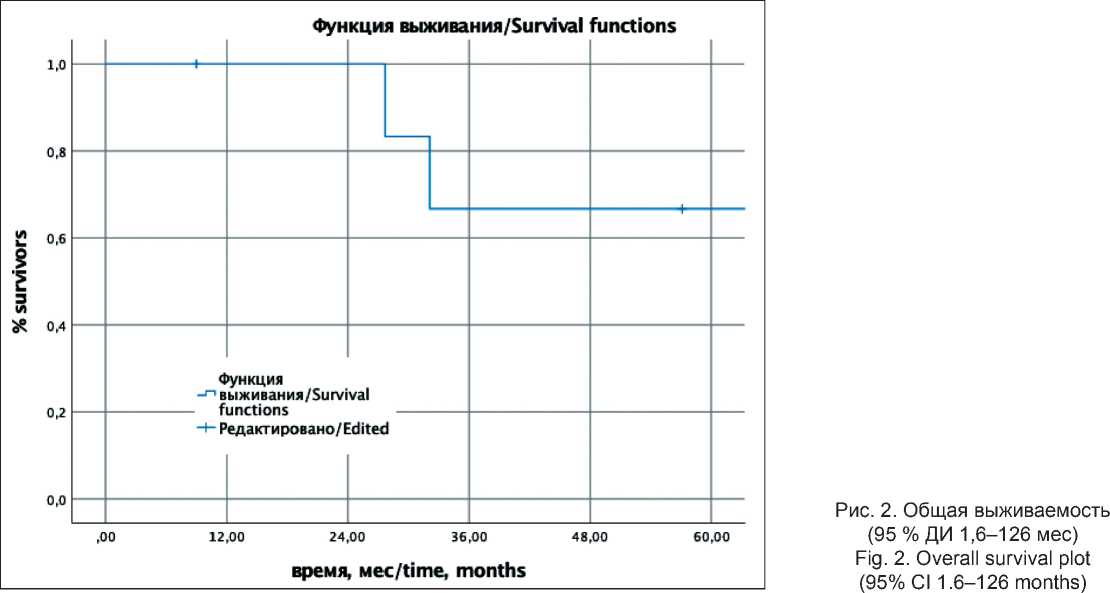
Медиана наблюдения составила 24 мес. Пациент с полным клиническим ответом нейроэндокринного рака G3 на лечение наблюдается в течение 64 мес без признаков прогрессирования. Из 4 пациентов, которым выполнены операции в объеме R0, 3 живы без признаков рецидива заболевания с периодом наблюдения – 32, 90 и 104 мес после завершения лечения, 1 больной погиб через 57 мес после завершения лечения от причин, не связанных с опухолевым процессом. Из 2 пациентов с диссеминацией опухолевого процесса на фоне ХЛТ 1 – с нейроэндокринным раком G3 ‒ погиб от прогрессирования через 6 мес от момента начала лечения, 1 – с нейроэндокринной опухолью G2 ‒ потерян для наблюдения через 12 мес с признаками прогрессирования заболевания на фоне II линии химиотерапии. В итоге, 5-летняя общая (ОВ) и безрецидивная выживаемость (БВР) составили 64,3 ± 21 % и 53,6 ± 20,1 % соответственно (рис. 1, 2). Таким образом, удалось добиться долгосрочной выживаемости без прогрессирования опухолевого процесса у 2 из 3 пациентов с нейроэндокринным раком G3 (из них у 1 ‒ со стойким полным клиническим ответом) и у 3 из 4 пациентов с нейроэндокринными опухолями G2.
Обсуждение
В связи с тем, что ХЛТ не входит в стандарты лечения нейроэндокринных опухолей прямой кишки, нам удалось выявить только 7 пациентов, которые получали данное лечение, при глубине поиска в архиве 20 лет. Тем не менее отсутствие уверенности в локорегионарном контроле и близость опухоли к мезоректальной фасции всегда будут поводом к обсуждению данной тактики на мультидисциплинарных консилиумах. Несмотря на то, что ни у одного из 4 прооперированных пациентов в представленном исследовании не отмечено признаков клинически значимого лечебного патоморфоза, у 3 из 7 пациентов наблюдался частичный или полный ответ на ХЛТ, что напрямую может влиять на оценку резектабельности опухоли хирургом.
В исследовании B. Conte et al. на выборке из 100 человек с нейроэндокринным колоректальным раком (из них у 40 % опухоль локализовалась в прямой кишке) установлено, что для локализованной
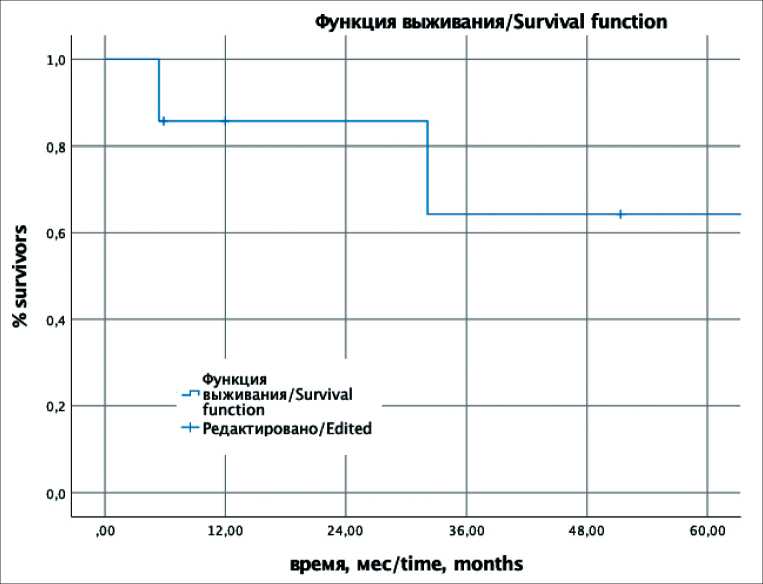
Рис. 1. Безрецидивная выживаемость (95 % ДИ 15,4–112,3 мес)
Fig. 1. PFS plot
(95% CI 15.4–112.3 months)
формы заболевания мультимодальный подход к лечению, по-видимому, связан с лучшими результатами, в то время как системная химиотерапия является основой лечения распространенного заболевания. Действительно, 64 % пациентов лечение начинали с химиотерапии в связи с наличием метастазов (у 59 пациентов была поражена печень). Лучевая терапия (СОД 50 Гр) была применена у 10 пациентов с аноректальной локализацией нейроэндокринного рака (НЭР). Показатель ло-корегионарного контроля составил 70 %, медиана ОВ – 17,4 мес [1]. В нашем исследовании медиана ОВ не достигнута, что может быть связано с факторами селекции пациентов, которые невозможно проследить в рамках ретроспективной работы. Были достигнуты высокие показатели отдаленных результатов даже в подгруппе пациентов с G3
НЭР, традиционно ассоциирующимся с крайне негативным прогнозом. В нашем исследовании так же, как и в работе B. Conte et al., подтверждается длительный локорегионарный ответ на ХЛТ в неоадъювантном режиме с последующим оперативным вмешательством.
Несмотря на то, что ни у одного из оперированных пациентов в нашем исследовании не отмечено клинически значимых проявлений лечебного па-томорфоза (III–IV степени), выявленный случай стойкого полного клинического ответа говорит об актуальности ХЛТ как метода лечения НЭР. Случаи полного клинического ответа НЭР на ХЛТ ранее описаны и другими авторами, в частности, T. Yoshida et al. приводят результаты лечения 59 случаев нейроэндокринного рака и смешанного адено-НЭР, из которых у 2 пациентов достигнут полный клинический ответ на ХЛТ (причем у 1 из них были нерезектабельные метастазы, что ограничивало хирургические возможности, у 2-го пациента проведена операция, но заболевание прогрессировало) [2]. S. Semrau et al. представили клиническое наблюдение, в котором описан случай полного клинического ответа НЭР G3 на ХЛТ, что позволило обойтись без хирургического лечения и, таким образом, избежать калечащей операции [3].
B. Brieau et al. проводилось сравнение ХЛТ с хирургическим лечением при неметастатическом нейроэндокринном раке прямой кишки и анального канала [4]. В группе ХЛТ полный ответ, частичный ответ и стабилизация были достигнуты в 40, 40 и 13 % случаев соответственно. В нашем исследовании аналогичные показатели были ниже и составили 14, 29 и 43 % соответственно. Контроль заболевания составил 93 %, медиана ВБП и ОВ – 13,2 и 39,2 мес соответственно. По сравнению с нашим исследованием более высокие показатели ответа на лечение, представленные в указанной статье, можно объяснить включением пациентов с неметастатическим НЭР. Несмотря на это, отдаленные результаты лечения в нашей работе были выше. Однако и авторы данной статьи пришли к выводу, что ввиду высоких показателей Ki67, обусловливающих агрессивное поведение опухоли, необходимо назначение предоперационной ХЛТ [4].
В работе K.R. Voong et al. в период с 1 января 2000 г. по 17 февраля 2013 г. у 10 пациентов был подтвержден НЭР прямой кишки или анального канала, им проведена химиолучевая терапия органов малого таза. Проводилась оценка общей выживаемости, локорегионарного контроля, выживаемости без прогрессирования. У 8 больных был низкодифференцированный НЭР, у 2 – низкодифференцированный НЭР с компонентом аденокарциномы. Медиана наблюдения составила 15 мес
(3–128 мес). Средняя доза ЛТ – 50,4 Гр (45–60 Гр). Все пациенты получали химиотерапию до или после химиолучевой терапии. У 7 больных достигнут стойкий локорегионарный контроль; у 2 было подозрение на рецидив и у 1 – подтвержденный рецидив опухоли в малом тазу. У обоих пациентов, которым проводилась предоперационная химиолу-чевая терапия, во время операции имелся только микроскопический очаг остаточной карциномы. В 7 случаях наблюдалось прогрессирование заболевания, у всех в виде отдаленного метастазирования в печень, легкие, кости и абдоминальные лимфатические узлы. Двухлетняя БРВ и ОВ составили 30 и 46 %. Более низкие показатели можно объяснить большей распространенностью первичной опухоли (TxN0M0 – 1, II стадия – 1, III стадия – 4, IV – 4 пациента). Однако авторами также был сделан вывод о необходимости ХЛТ у пациентов с данной патологией [5].
Недостатками нашего исследования являются его ретроспективный характер, малое количество пациентов. Эти ограничения, к сожалению, ожидаемы, учитывая редкость заболевания и отсутствие больших и надежных баз данных. Также к недостаткам работы можно отнести то, что в рамках одной исследуемой группы мы рассматривали НЭО как G2, так и G3. Однако показания и принципы ХЛТ при данных типах опухолей схожи. В будущем усилия должны быть направлены на создание национальной базы данных и/или сети врачей и учреждений, занимающихся лечением пациентов с данной патологией. Одним из путей решения этой проблемы является более активное многоцентровое сотрудничество в рамках работы реестра редких заболеваний РОСКР . Соответственно, в случае, если необходимость такого лечения возникает, нужно приоритетно рассматривать вопрос о проведении предоперационной лучевой терапии, учитывая полученные случаи частичного и полного ответа.
Список литературы Роль химиолучевой терапии в лечении нейроэндокринного рака прямой кишки: серия клинических наблюдений
- Conte B., George B., Overman M., Estrella J., Jiang Z.Q., Mehrvarz Sarshekeh A., Ferrarotto R., Hoff P.M., Rashid A., Yao J.C., Kopetz S., Dasari A. High-Grade Neuroendocrine Colorectal Carcinomas: A Retrospective Study of 100 Patients. Clin Colorectal Cancer. 2016; 15(2): e1-7.
- Yoshida T., Kamimura K., Hosaka K., Doumori K., Oka H., Sato A., Fukuhara Y., Watanabe S., Sato T., Yoshikawa A., Tomidokoro T., Terai S. Colorectal neuroendocrine carcinoma: A case report and review of the literature. World J Clin Cases. 2019; 7(14): 1865-75. 10.12998/ wjcc.v7.i14.1865.
- Semrau S., Agaimy A., Pavel M., Lubgan D., Schmidt D., Cavallaro A., Golcher H., Grützmann R., Fietkau R. Long-term control with chemoradiation of initially metastatic mixed adenoneuroendocrine carcinoma of the rectum: a case report. J Med Case Rep. 2019; 13(1): 82. 10.1186/ s13256-019-1995-x.
- Brieau B., Lepère C., Walter T., Lecomte T., Guimbaud R., Manfredi S., Tougeron D., Desseigne F., Lourenco N., Afchain P., El Hajbi F., Terris B., Rougier P., Coriat R. Radiochemotherapy Versus Surgery in Nonmetastatic Anorectal Neuroendocrine Carcinoma: A Multicenter Study by the Association des Gastro-Entérologues Oncologues. Medicine (Baltimore). 2015; 94(42): e1864.
- Voong K.R., Rashid A., Crane C.H., Minsky B.D., Krishnan S., Yao J.C., Wolff R.A., Skibber J.M., Feig B.W., Chang G.J., Das P. Chemoradiation for High-grade Neuroendocrine Carcinoma of the Rectum and Anal Canal. Am J Clin Oncol. 2017; 40(6): 555-60. 10.1097/ COC.0000000000000211.


