Роль хирургического метода в лечении мелкоклеточного рака легкого
Автор: Аксарин Алексей Александрович, Тер-Ованесов Михаил Дмитриевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 2 (74), 2016 года.
Бесплатный доступ
Представлены результаты хирургического лечения 41 больного мелкоклеточным раком лёгкого (МРЛ), из них лобэктомия была выполнена 26 (63,4 %), пневмонэктомия - 15 (36,6 %) пациентам. При I стадии пятилетняя выживаемость составила 66 %; при II стадии - 29 %; при III стадии - 21 %. Уровень пятилетней выживаемости при систематической лимфодиссекции составил 61 %, что значимо превосходило отдаленные результаты при иных вмешательствах на лимфатическом коллекторе легких. Мелкоклеточный рак лёгкого I и II стадии является показанием к радикальному вмешательству, которое должно выполняться в объёме лоб- или пневмонэктомии с систематической медиастинальной лимфодиссекцией и адъювантной химиотерапией.
Мелкоклеточный рак лёгкого, хирургическое и комбинированное лечение, отдаленные результаты
Короткий адрес: https://sciup.org/14056673
IDR: 14056673 | УДК: 616.24-006.6-089 | DOI: 10.21294/1814-4861-2016-15-2-63-68
Текст научной статьи Роль хирургического метода в лечении мелкоклеточного рака легкого
Рак лёгкого – наиболее распространённое злокачественное новообразование как в мире, так и в России, и в Ханты-Мансийском автономном округе – Югре [2]. В мире ежегодно диагностируется более 1 600 000 новых случаев рака лёгкого и 1 200 000 смертей от этого злокачественного заболевания. В России в 2013 г. диагностировано 45 076 первичных случаев (стандартизованный показатель – 23,54 на 100 тыс. населения). В 2013 г. в Югре зарегистрировано 440 новых случаев рака лёгкого (30,42 на 100 тыс. населения) [6]. Из них 61 (13,9 %) случай мелкоклеточного рака лёгкого (МРЛ).
Отличительными чертами МРЛ являются скрытое течение; быстрое развитие заболевания (удвоение объёма опухоли составляет в среднем 33 дня); раннее лимфогенное метастазирование; высокая чувствительность к цитостатическим препаратам [3, 7, 10, 17]. Применение только противоопухолевой терапии не позволяет достичь удовлетворительных результатов, пятилетняя выживаемость отмечена лишь у 2,3–5,0 % больных [5, 9, 19], что определило проведение настоящего исследования.
Цель исследования – определить место хирургического лечения мелкоклеточного рака лёгкого.
Материал и методы
В исследование включен 41 больной мелкоклеточным раком лёгкого, которым в Югре были выполнены радикальные операции в период с
1999 по 2011 г. Среди пациентов преобладали мужчины – 34 (82,9 %), женщин – 7 (17,1 %), соотношение 4,9:1 (табл. 1). Средний возраст составлял 53,2 года.
В 23 (56,1 %) случаях опухоли локализовались в правом, в 18 (43,9 %) – в левом лёгком. Независимо от стороны поражения пациенты чаще всего оперировались по поводу МРЛ I стадии (табл. 2). В 19 (46,3 %) случаях наблюдался центральный рак, в 22 (53,7 %) – периферический. У женщин превалировала периферическая форма опухоли – 71,4 %. При центральной локализации правое лёгкое было поражено – в 11 (57,9%) случаях, левое – в 8 (42,1 %). При этом в нижней доле опухоль располагалась в 8 (19,5 %) случаях, в верхней доле – в 7 (17,0 %), в средней доле и главном бронхе – по 2 (4,9 %) наблюдения. При периферическом раке правое лёгкое было поражено – в 12 (54,5 %) случаях, левое – в 10 (45,5 %). При этом опухоль располагалась в верхней доле – в 16 (72,7 %), в нижней – в 4 (9,8 %), в средней – в 2 (4,9 %) наблюдениях.
До операции правильный гистологический диагноз – мелкоклеточный рак лёгкого – был установлен лишь у 9 (21,9 %) пациентов. В 3 (7,3 %) случаях гистологически процесс трактовался как плоскоклеточный рак. В остальных наблюдениях верификации до операции не было, что связано с периферическим расположением опухоли или не-информативностью однократного цитологического и гистологического исследования.
распределение больных по полу и возрасту таблица 1
|
Пол |
Из них в возрастных группах: |
|
|
41–60 лет |
61–70 лет |
|
|
Мужской (n=34) |
29 |
5 |
|
Женский (n=18) |
5 |
2 |
|
Всего (n=41) |
34 (82,9 %) |
7 (17,1 %) |
Зависимость распространённости процесса от стороны поражения таблица 2
|
Стадия МРЛ |
Правое лёгкое (n=23) |
Левое лёгкое (n=18) |
|
IА |
3 (13,1 %) |
1 (5,6 %) |
|
IВ |
5 (21,7 %) |
7 (38,9 %) |
|
IIA |
2 (8,7 %) |
1 (5,6 %) |
|
IIB |
5 (21,7 %) |
4 (22,2 %) |
|
IIIA |
8 (34,8 %) |
5 (27,7 %) |
Методы лечения больных МрЛ в зависимости от стадии опухоли таблица 3
|
Стадия заболевания |
Операция |
Метод лечения Операция + химиотерапия |
Операция + химиотерапия + ЛТ |
|
IА |
2 (4,9 %) |
1 (2,4 %) |
1 (2,4 %) |
|
IВ |
6 (14,6 %) |
4 (9,8 %) |
2 (4,9 %) |
|
IIА |
- |
2 (4,9 %) |
1 (2,4 %) |
|
IIВ |
2 (4,9 %) |
6 (14,6 %) |
1 (2,4 %) |
|
IIIA |
4 (9,8 %) |
6 (14,6 %) |
3 (7,3 %) |
|
Итого |
14 (34,1 %) |
19 (46,3 %) |
8 (19,5 %) |
Распределение больных по объёму хирургического лечения: пневмонэктомии – 15 (36,6 %) операций, лобэктомии - 26 (63,4 %). Систематическая медиастинальная лимфодиссекция выполнена у 27 (65,9 %) пациентов, системная биопсия медиастинальных лимфоузлов – у 5 (12,2 %). В 9 (21,9 %) случаях лимфодиссекции не было, выполнялась биопсия лимфоузлов, подозрительных на метастатическое поражение.
Комбинированное лечение (операция с адъювантной полихимиотерапией) проводилось 27 (65,9 %) больным МРЛ, 8 (19,5 %) пациентам помимо хирургического лечения дополнительно была назначена лучевая терапия (ЛТ). В 14 (34,1 %) случаях осуществлено хирургическое лечение в монорежиме.
При МРЛ IA и IB стадий у 8 (19,5 %) пациентов использован хирургический метод лечения. При IIA стадии все пациенты получили адъювантную полихимиотерапию (ПХТ). При IIB и IIIA стадии преобладал комбинированный метод лечения – 7 (17,0 %) и 9 (21,9 %) пациентов. Четверо больных МРЛ IIIA стадии получили только хирургическое лечение, поскольку двое из них отказались от продолжения специального лечения, 1 пациент умер в раннем послеоперационном периоде, у 1 – развился бронхоплевральный свищ с эмпиемой плевры.
Сведения о больных систематизированы в базе данных Microsoft Excel. Полученные данные подвергались статистической обработке. Выживаемость была рассчитана методом Каплана – Мейера. Статистическая значимость различий выживаемости определялась по лог-ранговому критерию. Статистическая обработка данных выполнена в программе SPSS Statistics 17.0.
Результаты и обсуждение
Продолжительность жизни пациентов определялась состоянием региональных внутригрудных лимфоузлов и методом лечения, что соответствует литературным данным [1, 14]. Общая пятилетняя выживаемость составила 43,9 %, медиана выживаемости - 49 мес, при анализе полученных результатов очевидно преимущество комбинированного лечения с использованием АПХТ по сравнению с хирургическим вмешательством. Пятилетняя выживаемость при оперативном вмешательстве с АПХТ составила 47,5 %, при хирургическом лечения - 35,0 %, что согласуется с данными литературы [4, 9, 14, 15, 21].
При I стадии удалось достичь удовлетворительных результатов, одногодичная выживаемость – 100 %, трёхлетняя – 75 %, пятилетняя – 66 % (р<0,05, log rank test), медиана выживаемости не была до- стигнута (рис. 1). В этой группе только половине пациентов проведена адъювантная полихимиотерапия. Наши данные подтверждаются и международными исследованиями [11, 13]. При более распространённом процессе (II стадия) показатели выживаемости были значимо хуже, одногодичная выживаемость составила 73 %, трёхлетняя – 54 %, пятилетняя - 29 %. Медиана выживаемости – 46 мес. Десяти из 12 пациентов проведена АПХТ, 2 – лучевая терапия. Неудовлетворительные результаты получены при III стадии, одногодичная выживаемость составила 41 %, трех- и пятилетняя выживаемость – 21 %. Медиана выживаемости – 11 мес, несмотря на то, что 9 из 13 пациентов была назначена АПХТ, 2 – лучевая терапия.
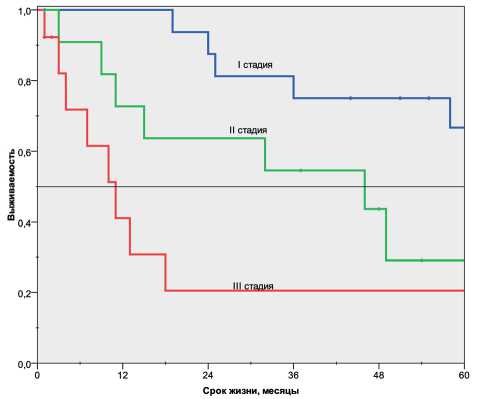
Рис. 1. Отдалённые результаты лечения больных мелкоклеточным раком лёгкого в зависимости от стадии
Полученные результаты согласуются с данными литературы. Так, в одноцентровом исследовании C.D. Jones et al. [12] пятилетняя выживаемость после резекции лёгкого и лимфодиссекции при II–IIIA стадии МРЛ составила 52 %. Во второй фазе исследования, проведённого W. Eberhardt et al. (1999) [9], включающего химиолучевую терапию и хирургическое лечение при резекции R0 при МРЛ IB–IIIB стадиях, пятилетняя выживаемость достигла 63 %, медиана выживаемости – 68 мес.
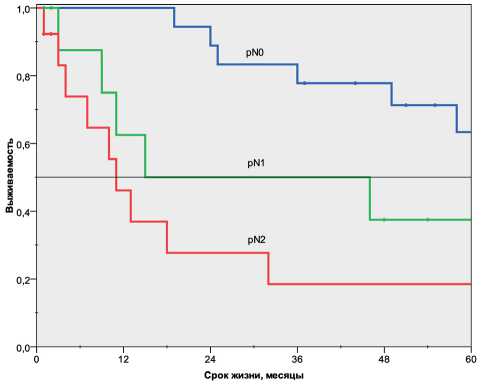
Рис. 2. Отдалённые результаты лечения больных мелкоклеточным раком лёгкого в зависимости от состояния внутри-грудных лимфоузлов
Удовлетворительные показатели выживаемости были получены только у пациентов без метастатического поражения лимфоузлов pN0 (р<0,025, log rank test). Одногодичная выживаемость составила 100 %, трёхлетняя - 77 %, пятилетняя - 63 %. Медиана не была достигнута. При pN 1 более одного года прожили 62 % пациентов, трёхлетняя выживаемость составила 50 %, пятилетняя - 37 %. Медиана - 15 мес. При pN2 более одного года прожили 46 % пациентов, тогда как трёхлетняя и пятилетняя выживаемость составила 18 %. Медиана – 11 мес (рис. 2). Полученные данные согласуются с современными мировыми тенденциями [14–16]. Кроме символа pN, на прогноз заболевания значительное влияние оказывает наличие VEGF и MVC [16].
Выживаемость после лобэктомий была значимо выше, чем после пневмонэктомий (р<0,05, log rank test). При лобэктомии однолетняя, трёхлетняя и пятилетняя выживаемость составила 84, 63 и 53 % соответственно, при пневмонэктомии – 59, 34 и 19 % соответственно. Медиана выживаемости при лобэктомии не была достигнута, при пневмонэктомии она равнялась 19 мес (рис. 3). Наши результаты соответствуют данным, полученным D. Schreiber et al., медиана выживаемости после сублобарной резекции составила 23 мес, после лобэктомии – 40 мес, после пневмонэктомии – 20 мес. Пятилетняя выживаемость после лобэктомии составила 52,6 %, после сублобарной резекции или пневмонэктомии – 31,8 % [18]. О преимуществе лобэктомии свидетельствуют и данные M. Brock et al. [8]. В этом исследовании пятилетняя выживаемость после лобэктомии при МРЛ составила 50 %, тогда как после сублобарных
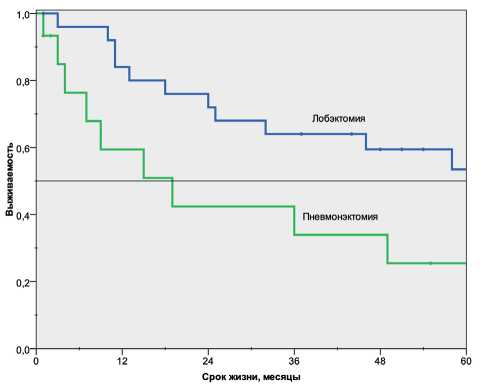
Рис. 3. Отдалённые результаты лечения больных мелкоклеточным раком лёгкого в зависимости от объёма выполненной операции
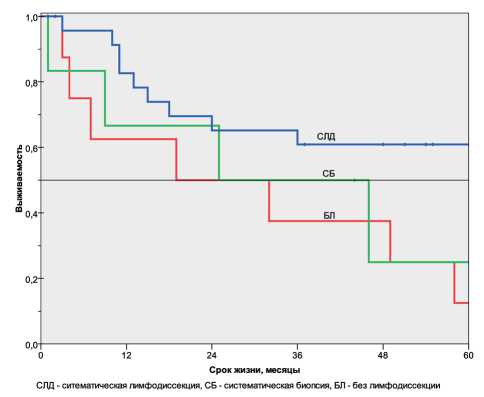
Рис. 4. Отдалённые результаты лечения больных мелкоклеточным раком лёгкого в зависимости от объёма лимфодис-секции резекций – 20 %. Лучшие результаты при выполнении лобэктомии по сравнению с пневмонэктомией получены Y. Xu et al. Пятилетняя выживаемость после лобэктомии при МРЛ была 33 %, а при пневмонэктомии – 13 % [21]. Однако есть противоположные данные, полученные J. Yuequan et al. [20]. Общая выживаемость и медиана были лучше после пневмонэктомии, чем после лобэктомии, – 24,0 % и 28 мес против 11,1 % и 20 мес соответственно.
Выживаемость при МРЛ после выполнения систематической лимфодиссекции была значимо выше (р<0,05, log rank test). Трёхлетняя выживаемость при систематической лимфодиссекции составила 61 %, при системной биопсии – 50 %, без лимфодиссекции – 37 %. Пятилетняя – 61, 24 и 14 % соответственно. Медиана выживаемости при систематической лимфодиссекции не была достигнута, при системной биопсии она равнялась 25 мес, без лимфодиссекции – 19 мес (рис. 4).
Локальные внутригрудные рецидивы были выявлены у 8 (19,5 %) больных. При этом у 5 из них лимфодиссекция не выполнялась, а у 3 выполнена системная биопсия. В группе больных с систематической медиастинальной лимфодиссекцией локорегионарных рецидивов не было. Метастазирование в отдалённые органы наблюдалось у 18 (43,9 %) пациентов. Чаще всего поражался головной мозг, что обнаруживалось в ближайшие два года после операции. Для снижения риска развития церебральных метастазов может быть использовано профилактическое облучение головного мозга в СОД 25 или 30 Гр.
Заключение
Таким образом, поражение лимфоузлов любого уровня является неблагоприятным прогностическим признаком при мелкоклеточном раке лёгкого. Однако полный отказ от хирургического лечения при МРЛ также не оправдан. Мелкоклеточный рак лёгкого I и II стадии является показанием к радикальному вмешательству, которое должно выполняться в объёме лоб- или пневмонэктомии с систематической медиастинальной лимфодиссек-цией, и обязательной адъювантной полихимиотерапией, и профилактической лучевой терапией на головной мозг. При наличии противопоказаний к операции может быть проведена лучевая терапия или химиолучевая терапия. При мелкоклеточном раке III стадии хирургическое лечение показано только при развитии жизнеугрожающих осложнений. В этом случае основным методом лечения является химио- или химиолучевая терапия.
Список литературы Роль хирургического метода в лечении мелкоклеточного рака легкого
- Бычков М.Б., Дгебуадзе Э.Н., Большакова С.А. Мелкоклеточный рак легкого//Практическая онкология. 2005. Т. 6, № 4 (24). С. 213-219.
- Давыдов М.И., Ганцев Ш.Х., Липатов О.Н., Поляков Б.И., Рахматулина И.Р., Ханов А.М. Атлас по онкологии. М., 2008. 416 с.
- Моисеев П.И. Комбинированное лечение больных мелкоклеточным раком легкого с использованием послеоперационной химиотерапии и профилактического облучения головного мозга//Онкологический журнал. 2009. Т. 3, № 1 (9). С. 21-25.
- Моисеев П.И., Жарков В.В. Роль хирургии в комбинированном лечении больных мелкоклеточным раком легкого: собственный опыт//Онкологический журнал. 2007. Т. 1, № 1 (1). С. 59-75.
- Скрипчак Ю.В., Кононова Г.В., Асахин С.М., Левит М.Л., Пушкарева И.К., Вальков М.Ю. Лучевая терапия при мелкоклеточном раке легкого: эволюция, современное состояние, перспективы//Сибирский онкологический журнал. 2011. № 6. С. 74-82.
- Состояние онкологической помощи населению ХантыМансийского автономного округа в 2013 году. Ханты-Мансийск, 2014. С. 2.
- Трахтенберг А.Х., Чиссов В.И. Рак легкого: руководство, атлас. М., 2009. 655 с.
- Brock M.V., Hooker C.M., Syphard J.E., Westra W., Xu L., Al-berg A.J., Mason D., Baylin S.B., Herman J.G., Yung R.C., Brahmer J., Rudin C.M., Ettinger D.S., Yang S.C. Surgical resection of limited disease small cell lung cancer in the new era of platinum chemotherapy: its time has come//J. Thorac. Cardiovasc. Surg. 2005. Vol. 129 (1). P. 64-72.
- Eberhardt W., Stamatis G., Stuschke M., Wilke H., Müller M.R., Kolks S., Flasshove M., Schütte J., Stahl M., Schlenger L., Budach V., Greschuchna D., Stüben G., Teschler H., Sack H., Seeber S. Prognostically orientated multimodality treatment including surgery for selected patients of small-cell lung cancer patients stages IB to IIIB: long-term results of a phase II trial//Br. J. Cancer. 1999. Vol. 81 (7). P. 1206-1212.
- Hann C.L., Rudin C.M. Management of Small-Cell Lung Cancer: Incremental Changes but Hope for the Future//Oncology (Williston Park). 2008. Vol. 22 (13). P. 1486-1492.
- Isaka M., Nakagawa K., Ohde Y., Okumura T., Watanabe R., Ito I., Nakajima T., Kondo H. A clinicopathological study of peripheral, small-sized high-grade neuroendocrine tumours of the lung: differences between small-cell lung carcinoma and large-cell neuroendocrine carcinoma//Eur. J. Cardiothorac. Surg. 2012. Vol. 41 (4). P. 841-846 DOI: 10.1093/ejcts/ezr132
- Jones C.D., Cummings I.G., Shipolini A.R., McCormack D.J. Does surgery improve prognosis in patients with small-cell lung carcinoma?//Interact. J. Thorac. Cardiovasc. Surg. 2013. Vol. 16 (3). P. 375-380 DOI: 10.1093/icvts/ivs475
- Ju M.H., Kim H.R., Kim J.B., Kim Y.H., Kim D.K., Park S.I. Surgical outcomes in small cell lung cancer//Korean J. Thorac. Cardiovasc Surg. 2012. Vol. 45 (1). P. 40-44 DOI: 10.5090/kjtcs.2012.45.1.40
- Leuzzi G., Alessandrini G., Sperduti I., Spaggiari L., Venuta F., Rendina E., Granone P., Lococo F., Rapicetta C., Sgarbi G., Zannini P., Di Rienzo G., Nicolosi M., Facciolo F. Prognostic impact of node-spreading pattern in surgically-treated small-cell lung cancer: a multicentre analysis//Interact. J. Thorac. Cardiovasc. Surg. 2015. Vol. 21 (suppl. 1). P. S2-S3 DOI: 10.1093/icvts/ivv204.06
- Lewiński T., Zulawski M., Turskil C., Pietraszek A. Small cell lung cancer I-IIIA: cytoreductive chemotherapy followed by resection with continuation of chemotherapy//Eur. J. Cardiothorac. Surg. 2001. Vol. 20 (2). P. 391-398.
- Lucchi M., Mussi A., Fontanini G., Faviana P., Ribechini A., Angeletti C.A. Small cell lung carcinoma (SCLC): the angiogenic phenomenon//Eur. J. Cardiothorac. Surg. 2002. Vol. 21 (6). P. 1105-1110.
- Rudin C.M., Ismaila N., Hann C.L., Malhotra N., Movsas B., Norris K., Pietanza M.C., Ramalingam S.S., Turrisi A.T., Giaccone G. Treatment of Small-Cell Lung Cancer: American Society of Clinical Oncology Endorsement of the American College of Chest Physicians Guideline//J. Clin. Oncol. 2015. Vol. 33 (34). P. 4106-4111. doi:10.1200/jco.2015.63.7918.
- Schreiber D., Rineer J., Weedon J., Vongtama D., Wortham A., Kim A., Han P., Choi K., Rotman M. Survival outcomes with the use of surgery in limited-stage small cell lung Cancer: should its role be re-evaluated?//Cancer. 2010. Vol. 116 (5). P. 1350-1357. doi: 10.1002/cncr.24853.
- Yokouchi H., Ishida T., Yamazaki S., Kikuchi H., Oizumi S., Uramoto H., Tanaka F., Harada M., Akie K., Sugaya F., Fujita Y., Fukuhara T., Takamura K., Kojima T., Harada T., Higuchi M., Matsuura Y., Honjo O., Minami Y., Watanabe N., Nishihara H., Suzuki H., Dosaka-Akita H., Isobe H., Nishimura M., Munakata M. Prognostic impact of clinical variables on surgically resected small-cell Lung Cancer: Results of a retrospective multicenter analysis (FIGHT002A and HOT1301A).//Lung Cancer. 2015. Vol. 90 (3). P. 548-553 DOI: 10.1016/j.lungcan.2015.10.010
- Yuequan J., Zhi Z., Chenmin X. Surgical Resection for Small Cell Lung Cancer: Pneumonectomy versus Lobectomy//ISRN Surg. 2012. Vol. 2012: 101024 DOI: 10.5402/2012/101024
- Xu Y., Zheng H., Gao W., Jiang G., Xie H., Chen C., Fei K. Is neoadjuvant chemotherapy mandatory for limited-disease small-cell lung cancer?//Interact. J. Cardiovasc. Thorac. Surg. 2014. Vol. 19 (6). P. 887-893 DOI: 10.1093/icvts/ivu262


